尿激酶原对冠脉结扎大鼠心肌缺血再灌注损伤的保护作用
刘江波,张金盈,刘志远,仇瑞莉,张松雨,梅艳阳,赵晓宁,李 纲(.南阳市中心医院心血管内科,南阳 473009;2.郑州大学第一附属医院心血管内科,郑州 450052)
心肌缺血再灌注损伤(MIRI)是指中断的心肌组织血流恢复正常灌注后,心肌损伤进行性加重的病理过程[1-2]。缺血期可引起心肌超微结构、能量代谢、氧化应激、心肌损伤及线粒体凋亡等一系列损伤性变化,严重者会因心律失常而导致猝死[3]。治疗MIRI的药物较多,其中尿激酶原(PRO)属于第二代溶栓药,是尿激酶的前体物质,具有纤维蛋白特异性[4]。高海英等[5]研究表明,PRO可明显改善急性心肌梗死患者的心肌功能,但目前关于其治疗MIRI的作用机制尚不完全统一。本文旨在探究PRO对冠脉结扎大鼠心肌缺血血流动力学和MIRI的影响,以期了解PRO对MIRI患者的治疗作用机制。
1 仪器与材料
1.1仪器 电子天平,北京赛多利斯仪器有限公司;低温离心机,湖南恒诺离心机有限公司;DW-T6型彩色多普勒超声仪,江苏大为医疗有限公司;小动物Medlab生物信号采集系统,南京美易公司;UV-240型紫外分光光度计,日本Shimadzu公司;Bx50F4型光学显微镜,日本Olympus公司;全自动生化分析仪,日本 Furuno Electric公司;蛋白电泳及转膜仪,美国Bio-Rad公司;凝胶成像系统,以色列DNR公司;流式细胞仪,赛默飞世尔科技有限公司;LD-66型实验室切片机,长沙益广制药机械公司。
1.2试药 肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)试剂盒以及苏木素、伊红,均购自武汉博士德生物工程有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、活性氧(ROS)检测试剂盒,均购自上海恒远生物科技有限公司;戊巴比妥钠,中国医药集团上海化学试剂公司;FITC标记Annexin V凋亡检测试剂盒,购自四季青生物工程材料有限公司;Bcl-2相关X蛋白(Bax)、B淋巴细胞瘤-2(Bcl-2)单克隆抗体,购于美国Santa Cruz公司;HRP羊抗兔IgG等二抗,购自美国Thermo公司。
1.3动物 SPF级3周龄SD大鼠60只,购自广东医学院实验动物中心,粤监证字 2015A029。本实验经动物伦理委员会批准。
2 方法
2.1分组及建立模型 将60只大鼠适用性喂养 1 周,随机选15只作为对照组,其余45只大鼠采用冠脉结扎手术制备MIRI模型[6]。给造模大鼠腹腔注射戊巴比妥钠溶液50 mg·kg-1麻醉,切开左胸第 2~5肋之间的皮肤,分离皮下组织及前锯肌和胸大肌后切开第 2~3 肋间肌暴露心脏,结扎,使得心肌细胞缺血,缺血时间为15 min,后灌注10 min,1 h后再次缺血15 min,后灌注10 min,消毒,缝合。动脉结扎后使用心电图检测,结果显示,ST段明显抬高、T波高耸,持续30 min后打开结扎线,恢复血流灌注,心电图显示结扎后ST段逐渐下降、T波逐步恢复视为造模成功。将造模成功的45只大鼠均分为模型组和PRO高、低剂量组(分别静脉注射2,1 mg·kg-1PRO),对照组和模型组分别注射等量生理盐水,每日1次,持续7 d。
2.2检测项目
2.2.1大鼠血流动力学检测 完成药物干预后24 h,采用DW-T6型彩色多普勒超声仪检测各组大鼠平均动脉压(MAP)、左室收缩压(LVSP)和左心室舒张末压(LVEDP)水平。
2.2.2大鼠血清炎性因子及氧化应激物质检测 完成大鼠血流动力学检测后从颈总动脉插管接取0.5 mL大鼠血液,严格按照MDA、SOD、ROS、IL-6、IL-1β和TNF-α试剂盒说明书操作,检测各成分水平。
2.2.3HE染色观察大鼠心肌损伤 处死大鼠后,取大鼠心肌组织,用二甲苯浸泡后再用酒精梯度脱水,苏木精浸泡后用盐酸酒精分化、氨水冲洗,用伊红染色,酒精浸泡脱水,中性树胶封片,在400倍镜下观察大鼠的心肌细胞状态。
2.2.4流式细胞仪检测大鼠心肌细胞凋亡 将各组大鼠心肌组织剪碎后用胰酶消化制成细胞悬液,离心机在4 ℃恒温下以3 000 r·min-1离心 5 min,加入Binding Buffer和Annexin V-FITC混匀,室温避光孵育并加入Binding Buffer后用流式细胞仪检测。
2.2.5Western Blot法检测蛋白表达水平 取大鼠心肌组织,用胰蛋白酶消化,提取总蛋白,转移蛋白到PVDF膜,室温封闭2 h后加入对应抗体,孵育2 h,以β-actin作为内参蛋白,对比条带颜色,计算各蛋白的表达水平。

3 结果
3.1大鼠血流动力学检测结果 见表1。由表1可知,与对照组比较,模型组大鼠MAP和LVSP水平显著降低,LVEDP显著升高(P<0.01);与模型组比较,PRO低剂量组大鼠MAP和LVSP水平显著升高,LVEDP水平显著降低(P<0.01);与PRO低剂量组比较,PRO高剂量组大鼠MAP和LVSP水平显著升高,LVEDP水平显著降低(P<0.01)。
3.2大鼠血清炎性因子检测结果 见表2。由表2可知,与对照组比较,模型组大鼠血清IL-6、IL-1β和TNF-α水平均显著升高(P<0.01);与模型组比较,PRO低剂量组大鼠血清IL-6、IL-1β和TNF-α水平均显著降低(P<0.01);与PRO低剂量组比较,PRO高剂量组大鼠血清IL-6、IL-1β和TNF-α水平显著降低(P<0.01)。

表1 大鼠血流动力学检测结果

表2 大鼠血清炎性因子检测结果
3.3大鼠氧化应激水平检测结果 见表3。由表3可知,与对照组比较,模型组大鼠血清MDA和ROS水平显著升高,SOD水平显著降低(P<0.01);与模型组比较,PRO低剂量组大鼠血清MDA和ROS水平显著降低,SOD水平显著升高(P<0.01);与PRO低剂量组比较,PRO高剂量组大鼠血清MDA和ROS水平显著降低,SOD水平显著升高(P<0.01)。

表3 大鼠氧化应激水平检测结果
3.4大鼠心肌损伤HE染色观察结果 见图1。由图1可知,对照组大鼠心肌组织、肌外膜、心肌纤维均正常且完整;模型组大鼠心肌纤维弯曲,肌红蛋白溶解,同时心肌细胞核固缩、溶解,肌束膜破裂;PRO高、低剂量组心肌组织少量肌纤维断裂溶解弯曲。
3.5大鼠心肌细胞凋亡检测结果 见表4和图2。由表4和图2可知,与对照组比较,模型组大鼠心肌细胞凋亡率显著升高(P<0.01);与模型组比较,PRO低剂量组大鼠心肌细胞凋亡率显著降低(P<0.01);与PRO低剂量组比较,PRO高剂量组大鼠心肌细胞凋亡率显著降低(P<0.01)。

表4 各组大鼠心肌细胞凋亡率比较
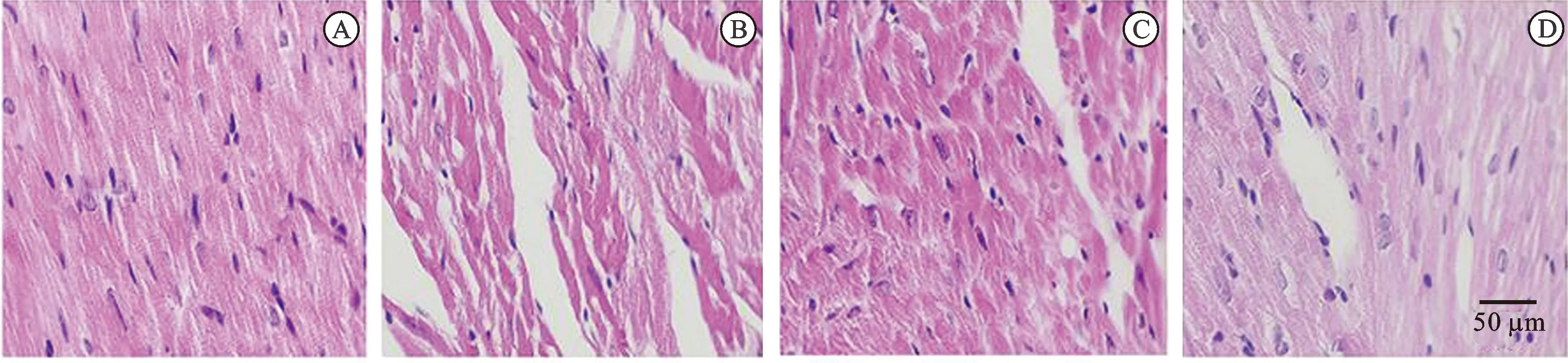
图1 大鼠心肌损伤HE染色观察结果(×400)

图2 大鼠心肌细胞凋亡检测结果
3.6大鼠凋亡蛋白及c-Jun氨基末端激酶(JNK)信号通路蛋白检测结果 见图3和表5。由图3和表5可知,与对照组比较,模型组大鼠心肌组织Bax和磷酸化c-Jun氨基末端激酶 (P-JNK) 蛋白表达水平显著升高,Bcl-2蛋白表达水平显著降低(P<0.01);与模型组比较,PRO低剂量组大鼠心肌组织Bax和P-JNK蛋白表达水平显著降低,Bcl-2蛋白表达水平显著升高(P<0.01);与PRO低剂量组比较,PRO高剂量组大鼠心肌组织Bax和P-JNK蛋白表达水平显著降低,Bcl-2蛋白表达水平显著升高(P<0.01)。

图3 大鼠凋亡蛋白及JNK信号通路蛋白检测结果

表5 大鼠凋亡蛋白及JNK信号通路蛋白检测结果
4 讨论
MIRI会导致心律失常,影响血流动力学[7]。本研究发现,与模型组相比,PRO低剂量组大鼠MAP和LVSP水平显著升高,LVEDP显著降低,说明PRO可有效改善大鼠MIRI后的血流动力学。这可能是因为PRO含有纤溶酶原激活剂抑制剂的作用位点,可有效抑制缺血后的心脏出现血栓,同时可较好地溶解血凝块从而改善血流动力学。同时PRO可以通过缓解心脏的损伤,改善心肌的供血能力,从而改善血流动力学。温且木·阿布都拉等[8]研究表明,PRO可有效缓解大鼠MIRI,改善血流动力学,与本研究结论一致。
MIRI后会发生一系列免疫反应[9],促炎性细胞因子主要包括TNF-α、IL-1β、IL-6 和白细胞介素-8(IL-8)。其中IL-6和TNF-α由单核细胞、巨噬细胞和非免疫细胞等分泌,是主要的促炎症因子[10-11]。由本研究结果可知,与模型组比较,使用PRO处理后大鼠血清中IL-6、IL-1β和TNF-α水平均显著降低,说明PRO可有效抑制大鼠体内的炎症反应。这可能是因为PRO可以作用JAK2/STAT3信号通路,通过调节该信号通路调节其下游炎症因子的分泌,有效缓解大鼠心肌细胞缺血后的炎症反应。王晓亚[12]研究表明,PRO可有效缓解心肌梗死患者炎症反应,与本研究结论类似。
心肌细胞缺血后会产生大量的ROS,使得机体发生氧化应激[13]。发生氧化应激后,细胞膜的通透性会改变并使得细胞内酶MDA和ROS大量释放到血液中[14]。本研究发现,与模型组比较,使用PRO处理后MDA和ROS水平显著降低。这可能是由于PRO具有抗氧化性,可有效抑制ROS对细胞膜的损伤,防止细胞内酶MDA和ROS大量释放到血液中。刘志远等[15]研究表明,PRO可有效缓解大鼠MIRI和氧化应激反应,与本研究结论相一致。
细胞凋亡是MIRI中常见的现象之一,Bcl-2家族是常见的凋亡控制基因[16]。该家族主要包括Bcl-2基因和Bax基因,Bcl-2为抑凋亡基因,Bax为促凋亡基因[17]。研究发现,使用PRO处理后Bcl-2蛋白表达水平显著升高、Bax蛋白表达水平显著降低,说明使用PRO处理后大鼠缺血后心肌细胞的凋亡得到缓解。这可能是因为PRO能有效抑制凋亡基因的表达,并促进抗凋亡基因的表达,防止MIRI后的心肌细胞凋亡。罗敏等[18]研究表明,降低MIRI后细胞的凋亡可有效缓解MIRI,与本研究结论类似。
JNK 信号通路调控炎症反应在MIRI病理过程中起重要的作用[19-20]。研究表明,激活JNK信号通路后会促进白细胞介素-1 (IL-1)和转化生长因子-β(TGF-β)的表达,激活 TGF-β激酶 1和 Toll 样受体,使得转化生长因子激酶(TAK1)被激活,最终反作用于JNK 通路,使之激活。本研究发现,使用PRO处理后,大鼠心肌组织P-JNK蛋白表达水平显著降低。说明PRO可有效抑制JNK信号通路,并通过JNK信号通路抑制下游的炎症反应及氧化应激反应。张国明[21]研究表明,缓解MIRI可通过抑制JNK信号通路的活化、降低炎症反应得以实现,与本研究结论一致。
综上所述,PRO可抑制JNK信号通路的活化,从而缓解大鼠MIRI。但本实验涉及到的样本量较少,在后续的实验中还需扩大样本量进行实验。

