氨基酸转化三七花中稀有人参皂苷及提取液对脂多糖诱导的RAW264.7细胞活性的影响
邵紫君,李志满,于鹏程,陈建波,李珊珊,孙印石*
1.吉林农业大学中药材学院,吉林 长春 130033
2.中国农业科学院特产研究所,吉林 长春 130112
三七Panax notoginseng(Burk.) F.H.Chen 为五加科人参属植物,已有600年以上的药用历史,是我国名贵中药材。由于疗效确切、效果显著,近些年来三七的应用越来越广泛,受到不少重视养生、健身人士的追捧。但遗憾的是三七一直未能进入“药食同源”目录,三七产业发展遭遇了政策瓶颈。《中国药典》规定三七的药用部位为根和根茎[1],三七花(Panax notoginsengflower)作为三七的副产物,一直未能得到有效的开发与利用。可喜的是在2016年云南省卫生和计划生育委员会正式批准三七花可以按照当地特有的食品原料进行管理,标志着三七花正式进入食品行业[2]。三七花中含有人参皂苷、维生素、氨基酸等多种营养成分,其中人参皂苷是三七花中的主要有效成分[3-6]。根据结构不同,人参皂苷可分为达玛烷型和齐墩果酸型。其中,达玛烷型中四环三萜类人参皂苷分为原人参二醇型皂苷[如人参皂苷Rb1、Rb2、Rc、Rd(Rb1、Rb2、Rc、Rd)]和原人参三醇型皂苷[如人参皂苷Re、Rg1(Re、Rg1)][7]。此外,还有一些次级人参皂苷,它们在原材料中含量很低,如人参皂苷20(S)-Rg3、20(R)-Rg3、Rk1、Rg5[20(S)-Rg3、20(R)-Rg3、Rk1、Rg5]等这些人参皂苷可以经过一定的加工获得,它们被称为稀有人参皂苷[8]。现有研究表明,稀有人参皂苷对一些疾病有显著的疗效,如对抑郁症、糖尿病和炎症疾病具有良好的药理作用[9],对肝癌、肺癌、胃癌等癌细胞的凋亡有显著的影响[10]。随着科学研究的深入,市场对稀有人参皂苷的需求正在增加,所以探寻一种高效绿色的稀有人参皂苷富集方法至关重要。
稀有人参皂苷可以通过蒸煮[11]、酸水解[12]、微生物降解和金属离子催化[13-15]等手段来进行富集。但这些方法既复杂又耗时,并对外源添加物的专属性和反应条件要求较高,容易造成环境污染。据报道,天冬氨酸可通过降解原人参二醇组总皂苷来获得稀有人参皂苷[16]。但这种转化技术对原材料要求较高,转化方法复杂、成本高,不适用于工业化生产。而三七花中皂苷含量丰富,位居三七各部位首位[17-18],但关于三七花中稀有人参皂苷的转化未见报道。本实验研究了氨基酸种类、氨基酸浓度、反应温度、反应时间和液固比对三七花中稀有人参皂苷转化的影响。并进一步比较了转化前、后三七花提取物对脂多糖(LPS)诱导的RAW264.7 细胞抗炎活性的影响,以期为三七花的开发利用提供新的思路。
1 材料
1.1 材料和试剂
三七花,购自云南省文山市三七药业批发行,经吉林农业大学李伟教授鉴定为五加科人参属植物三七P.notoginseng(Burk.) F.H.Chen 的干燥花(4年生);RAW264.7 小鼠巨噬细胞,由中国医学科学院细胞中心提供;对照品精氨酸(Arg,批号1008J033)、组氨酸(His,批号816L031)、天冬氨酸(Asp,批号1784M052)、谷氨酸(Glu,批号1005L047)和赖氨酸(Lys,批号2395H145),北京索莱宝科技有限公司;对照品人参皂苷20(S)-Rg3(批号Z15D8X50607 )、 20(R)-Rg3(批号YA0417YA14)、Rk1(批号P20N6F6254)、Rg5(批号P26N7F25707)、Rg1(批号Z13O8L45576)、Re(批号H15M6X1)、Rb1(批号Z16J9X52719)、Rb2(批号P25D8F51140)、Rc(批号Z10J6B1)、Rd(批号Z13O8L45576)、LPS(批号S18A9168132),质量分数均≥98%,上海源叶生物科技有限公司;乙腈和甲醇,色谱纯,美国Fisher 公司;DMEM 培养基、胎牛血清和PBS,Gibco 公司;CCK-8,日本同仁有限公司;NO 试剂盒,碧云天试剂公司;IL-6 ELISA 试剂盒,爱博泰克生物科技有限公司。
1.2 仪器与设备
BioTek Epoch2 酶标仪,美国伯腾仪器有限公司;Acquity UPLC H-Class 超高效液相色谱仪,PDA检测器,英国Waters 公司;EX125D2H 电子天平,奥豪斯仪器(常州)有限公司;GZX-9140 MBE 数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;C18Sep-Pak®SPE 液相色谱柱,爱尔兰赛分科技公司;Milli-Q Advantage A1 超纯水机,美国密理博公司;0.22 μm 有机系针头式过滤器,天津市津腾实验设备有限公司;LDZM-40KCS-II 立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-2FD 超净工作台,苏净安泰空气技术有限公司;CO2培养箱,赛默飞世尔科技(中国)有限公司;7A07015 显微镜,奥林巴斯(中国)有限公司;TGL-16G 医用离心机,湖南湘仪实验室仪器开发有限公司;Alpha 1-4LD plus 冻干机,德国Christ 公司。
2 方法与结果
2.1 原材料处理
取三七花60 ℃烘干、粉碎过60 目不锈钢筛网获得原药材粉末,放于阴凉干燥处,备用。
2.2 人参皂苷的测定
2.2.1 对照品溶液的制备 准确称取20(S)-Rg3、20(R)-Rg3、Rk1、Rg5各5 mg 于5 mL 量瓶中,甲醇溶解并定容;配制成混合对照品母液。准确吸取0.1、0.2、0.4、0.8、1.6 mL 于5 mL 量瓶中,定容,-20 ℃条件下储存。
2.2.2 供试品溶液的制备 取各反应后的上清液,用0.22 μm 微孔滤膜滤过,收集滤液,作为供试品溶液,待上机分析。
2.2.3 色谱条件 色谱柱为Acquity UPLC®BEH C18柱(50 mm×2.1 mm,1.7 μm);流动相为水-乙腈,梯度洗脱程序:0~5.8 min,13%~22%乙腈;5.8~18.75 min,22%~38%乙腈;18.75~22.05 min,38%~40%乙腈;22.05~23.55 min,40%~45%乙腈;23.55~24.25 min,45%~58%乙腈;24.25~30.00 min,58%~62%乙腈;30.00~30.75 min,62%~80%乙腈;30.75~37.75 min,80%~100%乙腈;37.75~40 min,0%~87%水;柱温35 ℃;体积流量0.4 mL/min;进样量3 μL;检测波长203 nm。
2.2.4 线性关系考察 精密吸取“2.2.1”项下的混合对照品储备液,按“2.2.3”项下色谱条件进行测定,以色谱峰峰面积为纵坐标(Y)、对照品质量浓度为横坐标(X),绘制标准曲线,进行线性回归,得回归方程、相关系数(R2)和线性范围分别为20(S)-Rg3Y=3.31×106X-2.18×104,R2=0.999 4,线性范围20.2~323.2 μg/mL;20(R)-Rg3Y=2.26×106X-1.30×104,R2=0.999 4,线性范围20.6~329.6 μg/mL;Rk1Y=4.72×106X-114,R2=0.999 3,线性范围20.8~332.8 μg/mL;Rg5Y=8.66×106X-4.82×104,R2=0.999 3,线性范围20.6~329.6 μg/mL。
2.2.5 精密度试验 精密吸取同一质量浓度的混合对照品溶液3 μL,按“2.2.3”项下色谱条件进行分析,连续进样9 次,测定20(S)-Rg3、20(R)-Rg3、Rk1、Rg5峰面积的RSD 分别为1.88%、2.33%、1.67%、2.67%,表明仪器精密度良好。
2.2.6 重复性试验 精密吸取同一转化后三七花提取液样品6 份,精密吸取6 份供试品溶液3 μL,按“2.2.3”项下色谱条件进行分析,测定20(S)-Rg3、20(R)-Rg3、Rk1、Rg5的峰面积,通过回归方程计算转化后三七花样品中20(S)-Rg3、20(R)-Rg3、Rk1、Rg5的含量及RSD。结果表明20(S)-Rg3、20(R)-Rg3、Rk1、Rg5质量浓度的RSD 分别为1.64%、1.33%、2.68%、1.44%,表明本实验重复性良好。
2.2.7 稳定性试验 精密吸取转化后三七花提取液样品3 μL,分别在0、2、4、8、16、24 h 按“2.2.3”项下色谱条件进行分析,测定20(S)-Rg3、20(R)-Rg3、Rk1、Rg5峰面积的RSD 值分别为2.68%、1.73%、2.47%、2.39%。
2.2.8 加样回收率试验 精密吸取转化后三七花提取液样品6 份,加入适量的20(S)-Rg3、20(R)-Rg3、Rk1、Rg5对照品,按照“2.2.2”项下方法操作,按“2.2.3”项下色谱条件进行分析,测定得到4 种人参皂苷的平均加样回收率分别为99.74%、99.83%、98.35%、99.64%,RSD 分别为3.25%、2.87%、2.31%、3.89%,表明加样回收率良好。
2.3 数据处理
用GraphPad Prism 5 软件分析数据,所有数据均采用±s表示,组间比较采用t检验和单因素方差分析,P<0.05 为显著性差异具有统计学意义。
2.4 氨基酸种类对稀有人参皂苷转化含量的影响
选择5 种氨基酸分别与三七花粉末进行反应。反应条件参考文献报道[19],即氨基酸浓度为5%,反应时间为1 h,液固比为20 mL/g,反应温度为120 ℃。使用UPLC 测定20(S)-Rg3、20(R)-Rg3、Rk1、Rg5的含量,所有样品重复3 次。2 种酸性氨基酸和3 种碱性氨基酸对4 种稀有人参皂苷转化的影响如表1 所示,Asp、Glu、His、Lys 和Arg 对稀有人参皂苷的转化含量依次减弱,其中,酸性氨基酸对稀有人参皂苷群的转化含量显著高于碱性氨基酸(P<0.05)。Asp 和Glu 对4 种稀有人参皂苷的总转化含量分别为(28.90±0.45)mg/g 和(27.56±0.48)mg/g。这与夏娟[15]的研究结果一致。与孙成鹏等[13]报道的柠檬酸转化稀有人参皂苷转化含量相比,可提高1.28 倍,因此最终选定Asp 作为最佳催化剂。
2.5 反应条件优化
考察了反应温度(80、90、100、110、120 ℃)、Asp 浓度(1%、3%、5%、10%、20%)、液固比(10、20、30、40、50 mL/g)和反应时间(0.5、1.0、1.5、2.0、2.5、3.0 h)对稀有人参皂苷20(S)-Rg3、20(R)-Rg3、Rk1、Rg5转化含量的影响。根据上述单因素试验的结果,设计了4 因素3 水平的正交试验对提取工艺进一步优化,所有样品重复3 次。
表1 不同氨基酸种类对稀有人参皂苷转化的影响 ( = 3)Table 1 Effects of different amino acids on conversion of rare ginsenosides ( = 3)

表1 不同氨基酸种类对稀有人参皂苷转化的影响 ( = 3)Table 1 Effects of different amino acids on conversion of rare ginsenosides ( = 3)
上标含相同字母表示无显著性差异,否则表示有显著性差异(P<0.05)The superscript containing the same letter means that there is no significant difference,otherwise it means that there is a significant difference (P < 0.05)
氨基酸 质量分数/(mg·g-1)20(S)-Rg3 20(R)-Rg3 Rk1 Rg5 总量His 1.68±0.12 1.35±0.11 2.80±0.06 0.54±0.02 6.37±0.08c Lys 1.06±0.04 0.70±0.04 1.49±0.15 0.22±0.04 3.47±0.07d Glu 10.40±0.77 3.87±0.33 6.12±0.42 7.17±0.47 27.56±0.48b Asp 10.71±0.77 3.34±0.32 6.27±0.45 8.58±0.26 28.90±0.45a Arg 0.95±0.09 0.67±0.07 1.40±0.04 0.20±0.02 3.22±0.08d
2.5.1 反应温度对稀有人参皂苷转化含量的影响研究表明,鲜人参加工为红参的过程中,稀有人参皂苷的含量会明显增加,表明温度是影响稀有人参皂苷形成的重要因素。本实验研究结果(表2)表明,随着温度的升高,4 种稀有人参皂苷的转化含量呈现逐渐升高又下降的趋势。在110 ℃时,4 种稀有人参皂苷20(S)-Rg3、20(R)-Rg3、Rk1、Rg5的转化含量最高,分别为(11.08±0.88)、(3.63±0.60)、(6.63±0.52)、(8.06±0.38)mg/g,与其他组比较有显著性差异(P<0.05)。因此,最终选定110 ℃作为最优的反应温度。
2.5.2 Asp 浓度对稀有人参皂苷转化含量的影响本实验研究结果表明(表3),随氨基酸浓度的增加(1%~5%),稀有人参皂苷的转化含量随Asp 浓度增加而增加。在5%时稀有人参皂苷的转化含量达到最高,20(S)-Rg3、20(R)-Rg3、Rk1、Rg5分别为(15.49±1.15)、(3.77±0.57)、(9.51±0.98)、(11.17±0.52)mg/g,并与其他组比较有显著性差异(P<0.05)。当氨基酸浓度超过5%时,稀有人参皂苷的转化含量逐渐减少。因此,最终选定Asp 最适宜的浓度为5%。
表2 不同温度对稀有人参皂苷转化的影响 ( = 3)Table 2 Effects of different temperatures on transformation of rare ginsenosides ( = 3)

表2 不同温度对稀有人参皂苷转化的影响 ( = 3)Table 2 Effects of different temperatures on transformation of rare ginsenosides ( = 3)
上标含不同字母表示有显著性差异(P<0.05)The superscript containing the different letter means that there is a significant difference (P < 0.05)
温度/℃ 质量分数/(mg·g-1)20(S)-Rg3 20(R)-Rg3 Rk1 Rg5 总量80 0.46±0.02 0.36±0.01 0.23±0.01 0.23±0.01 1.29±0.01e 90 1.12±0.20 1.12±0.06 0.72±0.04 0.77±0.04 3.73±0.08d 100 2.60±0.07 2.27±0.05 1.41±0.16 2.17±0.01 8.50±0.70c 110 11.08±0.88 3.63±0.60 6.63±0.52 8.06±0.38 29.41±0.59a 120 5.95±3.20 2.72±0.53 3.50±1.94 4.16±2.27 16.33±2.08b
表3 不同Asp 浓度对稀有人参皂苷转化的影响 ( = 3)Table 3 Effect of different Asp addition on conversion of rare ginsenosides ( = 3)

表3 不同Asp 浓度对稀有人参皂苷转化的影响 ( = 3)Table 3 Effect of different Asp addition on conversion of rare ginsenosides ( = 3)
上标含不同字母表示有显著性差异(P<0.05)The superscript containing the different letter means that there is a significant difference (P < 0.05)
ASP 浓度/% 质量分数/(mg·g-1)20(S)-Rg3 20(R)-Rg3 Rk1 Rg5 总量1 6.39±0.11 4.00±0.06 3.83±0.09 4.09±0.19 18.31±0.11e 3 11.08±0.88 3.63±0.60 6.62±0.52 8.06±0.38 29.41±0.59c 5 15.49±1.15 3.77±0.57 9.51±0.98 11.17±0.52 39.95±0.80a 10 12.61±0.64 2.32±0.01 7.78±0.29 7.78±0.29 30.49±0.31b 20 8.53±0.24 1.47±0.50 5.51±0.70 6.75±0.26 22.27±0.16d
2.5.3 液固比对稀有人参皂苷转化含量的影响液固比对稀有人参皂苷群转化的影响如表4 所示,随着液固比的增加,稀有人参皂苷的转化含量呈现先增加后降低的趋势,在20 mL/g 时转化含量达到最高,20(S)-Rg3、20(R)-Rg3、Rk1、Rg5分别为(15.48±1.15)、(3.77±0.57)、(9.51±0.98)、(11.17±0.52)mg/g,且显著高于其他组的转化含量(P<0.05)。最终选定最适宜的液固比为20 mL/g。
2.5.4 反应时间对稀有人参皂苷转化含量的影响反应时间对稀有人参皂苷的影响如表5 所示。稀有人参皂苷的含量随反应时间的增加而逐渐增加。当反应2.0 h 时,4 种稀有人参皂苷的转化含量达到最高,20(S)-Rg3、20(R)-Rg3、Rk1、Rg5分别为(15.49±0.64)、(3.77±0.57)、(9.51±0.98)、(11.17±0.52)mg/g,且显著高于其他组(P<0.05)。当反应时间超过2.0 h 后,稀有人参皂苷的总量没有继续增长。这可能是因为随着反应时间的增加,底物被不断消耗,并且有效成分在达到最大值后有效碰撞减少,含量变化趋于平坦。考虑未来规模化生产,低能耗高产率的原则,最终选定2.0 h 为最佳反应时间。
表4 不同液固比对稀有人参皂苷转化的影响 ( = 3)Table 4 Effect of different liquid-solid ratios on transformation of rare ginsenosides ( = 3)

表4 不同液固比对稀有人参皂苷转化的影响 ( = 3)Table 4 Effect of different liquid-solid ratios on transformation of rare ginsenosides ( = 3)
上标含不同字母表示有显著性差异(P<0.05)The superscript containing the different letter means that there is a significant difference (P < 0.05)
液固比/(mL·g-1) 质量分数/(mg·g-1)20(S)-Rg3 20(R)-Rg3 Rk1 Rg5 总量10 10.43±0.09 3.26±0.15 6.87±0.19 9.36±0.14 29.92±0.14e 20 15.48±1.15 3.77±0.57 9.51±0.98 11.17±0.52 39.94±0.80a 30 14.93±0.38 3.85±0.26 8.45±0.02 10.80±0.20 38.04±0.22b 40 14.36±0.58 3.94±0.08 8.22±0.15 10.54±0.23 37.06±0.25c 50 14.08±0.51 2.88±0.15 7.75±0.15 10.47±0.13 35.18±0.23d
表5 不同反应时间对稀有人参皂苷转化的影响 ( = 3)Table 5 Effects of different time on conversion of rare ginsenosides ( = 3)
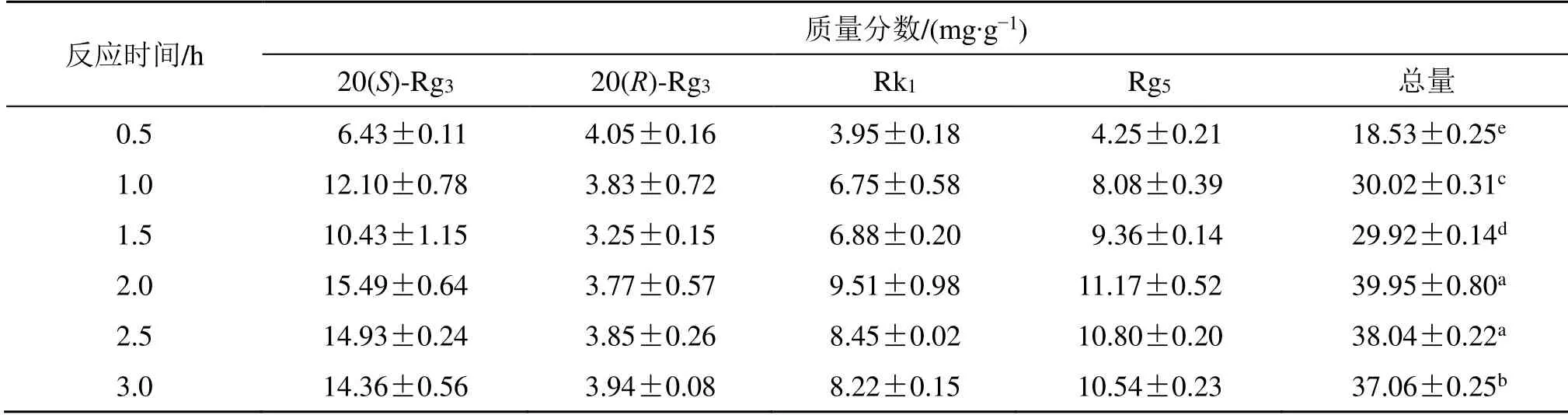
表5 不同反应时间对稀有人参皂苷转化的影响 ( = 3)Table 5 Effects of different time on conversion of rare ginsenosides ( = 3)
上标含相同字母表示无显著性差异,否则表示有显著性差异(P<0.05)The superscript containing the same letter means that there is no significant difference,otherwise it means that there is a significant difference (P < 0.05)
反应时间/h 质量分数/(mg·g-1)20(S)-Rg3 20(R)-Rg3 Rk1 Rg5 总量0.5 6.43±0.11 4.05±0.16 3.95±0.18 4.25±0.21 18.53±0.25e 1.0 12.10±0.78 3.83±0.72 6.75±0.58 8.08±0.39 30.02±0.31c 1.5 10.43±1.15 3.25±0.15 6.88±0.20 9.36±0.14 29.92±0.14d 2.0 15.49±0.64 3.77±0.57 9.51±0.98 11.17±0.52 39.95±0.80a 2.5 14.93±0.24 3.85±0.26 8.45±0.02 10.80±0.20 38.04±0.22a 3.0 14.36±0.56 3.94±0.08 8.22±0.15 10.54±0.23 37.06±0.25b
2.5.5 正交试验结果 由于多个因素对稀有人参皂苷的转化都存在一定的影响,优化提取工艺是稀有人参皂苷转化的重要步骤。通过前期单因素试验结果,以反应温度(A)、Asp 浓度(B)、液固比(C)、反应时间(D)为考察因素,每个因素设置3 个水平,进行采用L9(34)正交试验,正交试验设计与结果见表6,方差分析见表7。由表6 可见,对稀有人参皂苷转化总转化含量的影响因素大小排列为A>C>D>B,最佳转化条件是A3B2C3D2。由方差分析可知,温度对转化含量影响显著,Asp 浓度、液固比、时间对转化含量影响不显著。因此最佳的转化条件是温度为120 ℃、Asp 浓度为5%、液固比为30 mL/g 和反应时间为2.0 h。

表6 三七花中稀有人参皂苷转化L9(34)正交试验结果Table 6 L9(34) orthogonal test results of conversion of rare ginsenosides from PNF

表7 正交试验方差分析Table 7 ANOVA of orthogonal test
2.6 结果验证
按照正交试验筛选出的最优条件A3B2C3D2进行验证,重复5 次,结果显示,转化后4 种稀有人参皂苷20(S)-Rg3、20(R)-Rg3、Rk1、Rg5的转化含量分别为(17.80±0.43)、(5.40±0.64)、(10.62±0.68)、(13.10±0.22)mg/g,平均的总转化含量为(47.12±0.52)mg/g,表明本实验确定的稀有人参皂苷的转化方法稳定且转化效率高。三七花皂苷转化前后对比图如图1 所示。
2.7 转化前后三七花提取物对 LPS 刺激RAW264.7 细胞活力的影响
据现有文献报道,三七花对耳廓炎症、渗出性炎症以及小鼠或大鼠踝关节肿胀、足肿胀等均有抑制作用[19-21]。并能显著抗5-羟色胺、组胺及缓激肽所致大鼠皮肤毛细血管通透性增加,还可减少炎症渗出物中的PGE 含量[22-23]。说明三七花具有良好的消肿抗炎功效。而稀有人参皂苷20(S)-Rg3、20(R)-Rg3、Rk1、Rg5对于炎症反应也有显著抑制[24-25]。因此,对比转化前后三七花提取物对LPS 刺激RAW264.7 细胞的炎症反应。

图1 三七花转化前 (a)、后 (b) 人参皂苷UPLC 对比图Fig.1 UPLC comparison of PNF before (a) and after (b)ginsenoside transformation
RAW264.7 小鼠巨噬细胞用DMEM 培养基(含10%胎牛血清,链霉素和青霉素总含量为1%的双抗)培养传代,培养箱设置条件为37 ℃、5% CO2。将RAW264.7 细胞以2×104/孔的密度接种于96 孔板上,培养24 h 后进行分组处理,正常组:不做任何处理,正常培养12 h,炎症模型组:1 μg/mL LPS持续刺激细胞12 h,转化前后三七花提取液处理组:1 μg/mL LPS 和提取液(1.562、3.125、6.250、12.500、25.000、50.000、100.000、200.000 μg/mL)共同处理细胞12 h。12 h 后每孔加入10 μL CCK-8,孵育2 h,酶标仪检测450 nm 波长处的吸光度(A)值,计算增殖指数。
增殖指数=A处理/A对照
由图2 可知,与对照组相比,LPS 显著促进巨噬细胞的增殖(P<0.05),与LPS 组相比,转化后三七花提取物在质量浓度为1.56~200 μg/mL,对LPS 诱导的RAW264.7 的增殖具有显著抑制作用(P<0.05)。在质量浓度≥6.250 μg/mL 时,与三七花提取物相比,转化后三七花提取物更能显著抑制LPS 引起RAW264.7 细胞的增殖(P<0.05)。
2.8 转化前后三七花提取物对RAW264.7 细胞NO分泌的影响

图2 三七花提取物转化前后对LPS 刺激RAW264.7 细胞吞噬活性的影响 ( = 3)Fig.2 Effect of PNF extract on phagocytic activity of RAW264.7 cells stimulated by LPS ( = 3)
NO 在炎症反应过程中大量表达,是炎症发病机制中的重要信使[26]。RAW264.7 细胞以8×104/孔的密度接种于96 孔板,培养24 h,1 μg/mL LPS 刺激细胞2 h,1 μg/mL LPS 和提取液(1.56、3.125、6.25、12.5、25、50、100、200 μg/mL)共同处理细胞12 h,收集细胞上清液,按NO 试剂盒说明操作,测定细胞上清液中NO 的含量。
由图3 可知,与对照组相比,模型组RAW264.7细胞NO 分泌水平显著升高(P<0.05)。转化前三七花提取物对LPS 诱导的RAW264.7 细胞中NO 具有显著抑制作用的最低质量浓度为3.125 μg/mL,而转化后三七花提取物具有显著抑制作用的最低质量浓度为1.562 μg/mL。并且在相同质量浓度中,转化后三七花提取物更能显著抑制 LPS 引起RAW264.7 细胞中NO 的分泌(P<0.05)。

图3 三七花提取物对LPS 刺激RAW264.7 细胞NO 释放量的影响 ( = 3)Fig.3 Effect of extract from PNF on release of NO from RAW264.7 cells stimulated by LPS ( = 3)
2.9 转化前后三七花提取物对RAW264.7 细胞白细胞介素-6 (IL-6) 分泌的影响
小鼠巨噬细胞RAW264.7 在LPS 的诱导下会释放出大量的促炎因子IL-6,细胞中促炎因子分泌的增加可加速炎症的发展[27]。RAW264.7 细胞以8×104个/孔的密度接种于96 孔板,培养24 h,1 μg/mL LPS 刺激细胞2 h,1 μg/mL LPS 和提取液(1.56、3.125、6.25、12.5、25、50、100、200 μg/mL)共同处理细胞12 h,收集细胞上清液,按IL-6 ELISA试剂盒说明操作,测定细胞上清液中IL-6 的含量。
从如图4 可以看出,模型组IL-6 的分泌显著高于对照组(P<0.05)。与模型组相比,转化前三七花提取物在质量浓度大于3.125 μg/mL 时,可显著抑制IL-6 的释放(P<0.05),而转化后三七花提取物在质量浓度大于1.56 μg/mL 时,就可以显著抑制促炎因子IL-6 的释放(P<0.05)。在相同质量浓度中,转化后三七花提取物对IL-6 抑制率显著高于转化前三七花提取物(P<0.05)。

图4 三七花提取物对LPS 刺激RAW264.7 细胞IL-6 释放量的影响 ( = 3)Fig.4 Effect of PNF extract on release of IL-6 from RAW264.7 cells stimulated by LPS ( = 3)
3 讨论
本研究添加食品级氨基酸,通过单因素实验和正交试验探索了一种安全高效绿色的将三七花中原有人参皂苷转化为稀有人参皂苷的方法。结果表明,添加Asp 可以显著增加三七花中稀有人参皂苷20(S)-Rg3、20(R)-Rg3、Rk1、Rg5的含量,这可能是因为Asp 是酸性氨基酸,在热裂解的条件下,较高浓度的H+和较多的二醇组皂苷显著促进了水解反应的发生。人参二醇组皂苷在C-20 位的糖苷键断裂生成中间产物20(S)-Rg3和20(R)-Rg3,再进一步脱水水解成稀有人参皂苷Rk1和Rg5,这大大促进了稀有人参皂苷的生成。
LPS 是全身炎症反应综合症的一种重要致病因子,可与巨噬细胞表面抗原识别受体相结合而刺激细胞[28-29],继而激活多条炎症通路,产生一系列促炎因子,引起机体严重的炎症反应[30-32]。适度的巨噬细胞增殖可提高机体抵御外界和修复机体损伤的能力,而过度刺激会引起细胞的免疫反应,导致细胞凋亡和机体损伤。因此本实验运用此炎症模型对转化后三七花与转化前抗炎效果进行比较,探究转化后三七花的药理作用。在转化前后的三七花提取物对LPS 诱导RAW264.7 细胞活性、NO 的分泌和炎症因子IL-6 的释放量的影响进行了考察中可以看出,与三七花提取物相比较,转化后三七花提取物对LPS 诱导RAW264.7 细胞炎症反应有更好的抑制作用(P<0.05)。这有可能是因为稀有皂苷的增加,根据文献记载稀有人参皂苷 20(S)-Rg3、20(R)-Rg3可通过调节iNOS的表达抑制NO的产生,抑制LPS 或UV 照射诱导的细胞ROS 水平[24];人参皂苷Rg5可以通过抑制LPS 与巨噬细胞Toll 样受体(TLR)-4 结合而减轻肺部炎症[33];Rk1和Rg5对TNF-α/IFN-γ-和LPS 诱导的趋化因子和细胞因子的产生有明显的抑制和下调作用,抑制这些介导因子的产生可降低LPS 诱导的RAW264.7 细胞NO 和ROS 的生成[25]。因此,稀有皂苷的增加可能是转化后三七花对于LPS 诱导RAW264.7 细胞炎症反应有显著抑制的原因。但其抗炎机理有待进一步验证。本论文对稀有人参皂苷的转化提供了新的绿色、安全和高效的转化方法,为三七花的生产与利用提供了新的思路。
利益冲突所有作者均声明不存在利益冲突