基于代谢组学的苦碟子注射液抗心肌缺血作用机制研究
李 瑛,邵 鑫,李春燕,毕成浩,王 幸,王玉明,李 钰,杨 彬*,李遇伯*
1.天津中医药大学中药学院,天津 301617
2.通化华夏药业有限责任公司,吉林 通化 134100
随着人口的老龄化,冠心病等心脑血管类疾病的发病率逐年增长,成为城乡居民死亡的首要原因,严重威胁人们的健康。冠心病是由于冠状动脉粥样硬化等病变引起心肌缺血、缺氧或坏死所致,主要表现为心绞痛、心肌梗死等心肌缺血典型症状。心肌缺血是一种常见的心肌损伤,是由于心脏的血液灌注量减少,导致心脏的供氧减少,心肌能量代谢异常,不能支持心脏正常工作的病理状态,可导致心脏功能障碍、心肌梗死、猝死等[1]。现代医学的发展虽在心肌缺血疾病的防治、诊断和治疗方面取得了一定进展,但仍未完全改变心肌缺血发病率和死亡率持续升高的现状[2]。因此,抗心肌缺血药物的研究仍然是医学界备受关注的重要课题。
在临床治疗中,苦碟子注射液(Kudiezi Injection,KDZ)广泛用于冠心病、冠状动脉粥样硬化性心脏病和心绞痛等心肌缺血类疾病的防治[3-4]。KDZ 是由抱茎苦荬菜经水煎提取精制而成的中药制剂,在扩张心脑血管、增加血流量、保护心脑细胞、改善神经功能缺损等方面作用较为突出[5-6]。其化学成分复杂,主要含黄酮类、倍半萜内酯类、三萜皂苷类、有机酸、氨基酸和多糖等化合物。目前,关于KDZ 的研究主要集中在化学成分、质量控制等方面,而KDZ 预防心肌缺血的药效作用及其机制研究较少。因此,本研究通过代谢组学技术探究KDZ 对大鼠心脏保护作用的作用机制。
代谢组学通过研究早期潜在的代谢标志物为生物系统提供完整、准确、动态的代谢网络图,并进一步揭示生物体新陈代谢过程中代谢产物的动态变化规律,有助于全面理解疾病的变化过程和阐释发病机制及体内物质代谢途径等[7]。本研究采用异丙肾上腺素(isoprenaline,ISO)建立大鼠心肌缺血模型,通过生化检测和病理组织切片研究,探究KDZ 对大鼠心脏的保护作用。采用UPLC-Q-TOF/MS 技术,对大鼠心脏组织和血浆样本进行无靶向代谢组学研究,通过多元统计分析筛选生物标志物,分析KDZ 对生物标志物的调控作用及调控通路,以期为阐明KDZ 预防心肌缺血的作用机制提供依据。
1 材料
1.1 仪器
XK96-A 快速混匀器(姜堰市新康医疗器械有限公司);ALLLEGRATM-64R 高速离心机(美国Beckman 公司);Waters Acquity UPLC 液相色谱仪、Waters Xevo G2 Q-Tof/MS 质谱仪、ACQUITY UPLC BEH C18色谱柱(美国Waters 公司);分析天平 [赛多利斯科学仪器(北京)有限公司];7020 全自动生化仪(日本日立公司);KQ-300DV 型数控超声波清洗器(江苏省昆山市超声仪器有限公司)。
1.2 药品与试剂
乙腈(HPLC 纯,瑞典Oceanpak 公司);甲酸(HPLC 纯,美国ROE 公司);甲醇(HPLC 纯,瑞典Oceanpak 公司);异丙肾上腺素(大连美仑生物技术有限公司);美托洛尔(大连美仑生物技术有限公司);生理盐水(大连大冢公司);KDZ(批号181006,规格10 mL/支,通化华夏药业有限责任公司);纯净水(广州屈臣氏公司)。
1.3 动物
洁净级Wistar 雄性大鼠,体质量为(200±20)g,由维通利华(北京)实验动物技术有限公司提供,合格证号为SCXK(京)2016-0006。所有动物实验均按照饲养和使用指南进行,并经天津中医药大学实验动物伦理委员会批准( 批准号TCM-2013-12-A06)。实验期间动物自由进食、饮水,昼夜节律正常。
2 方法
2.1 动物的分组与给药
所有大鼠均适应性喂养1 周,每天给予标准的食物与饮用水。将大鼠随机分为4 组,每组各15只。查阅文献并结合临床应用剂量分别给药[8-10],给药周期14 d,各组给药剂量、方式及时间见表1。

表1 各组大鼠给药剂量、方式及时间Table 1 Dosages,ways,and time of administration of each group of rats
2.2 样本采集
各组大鼠于末次给予相应药物30 min 后,10%水合氯醛麻醉后腹主动脉取血,2 mL 置离心管中,3500 r/min 离心8 min 离心取上清,用于当天生化指标检测;5 mL 置肝素钠试管中,3500 r/min 离心8 min 取上清,用于后续代谢组学研究。腹主动脉取血后,水合氯醛麻醉处死,剪下大鼠心脏,切下一部分放置于10%甲醛中保存用于病理组织评价,其余部分迅速放置于液氮中保存,用于后续代谢组学研究。样本均保存于-80 ℃冰箱。
2.3 生化指标检测和组织学评价
利用全自动生化仪测定血清中乳酸脱氢酶(lactate dehydrogenase,LDH)和天冬氨酸氨基转移酶(aspartate transaminase,AST)含量,采用试剂盒检测血浆和心脏组织中MDA(malondialdehyde,丙二醛)含量。
心脏组织进行HE 染色,观察药物对各组大鼠心脏组织损伤的影响。HE 染色过程:脱水石蜡切片后,经二甲苯脱蜡、水化、苏木素染色10 min、分化、伊红染色、脱水、二甲苯透明、中性树脂胶封片制成片(4 μm 厚)[11]。然后在光学显微镜下观察大鼠心脏的病理表现,对主要部位进行拍照,进行光学显微镜检查和组织学评价。
2.4 代谢组学研究
2.4.1 样本制备
(1)血浆样本制备:室温解冻,取100 μL 血浆,加入300 μL 乙腈,冰水浴超声10 min,涡旋混匀,以13 000 r/min、4 ℃离心15 min,取100 μL 上清进样分析。每个血浆样本各取20 μL 于离心管中,涡旋混合,按照上述操作制备血浆质控(quality control,QC)样本。
(2)心脏组织样本制备:室温解冻,剪碎并混匀,每100 毫克加200 μL 预冷的生理盐水匀浆。取100 μL,加入1000 μL 甲醇,涡旋混匀,冰水浴超声10 min,以13 000 r/min、4 ℃离心10 min,取上清液,氮气吹干,临测时纯甲醇复溶,涡旋,离心取上清进样分析。另外,每个心脏组织各取10 μL匀浆液于离心管中,涡旋混合,随后按照上述操作制备心脏组织QC 样本[12]。
2.4.2 UPLC-Q-TOF/MS 分析条件
(1)色谱条件:色谱柱ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm),体积流量为0.3 mL/min,柱温为40 ℃,进样量5 μL,流动相为0.1%甲酸-水(A)和0.1%甲酸溶液-乙腈(B)。梯度洗脱条件:0~0.5 min,1% B;0.5~2 min,1%~50%B;2~9 min,50%~99% B;9~10 min,99% B;10~10.5 min,99%~1% B;10.5~12 min:1% B。
(2)质谱条件:电喷雾电离源(ESI 源),正离子模式,辅助喷雾电离与脱溶剂气体为高纯N2,干燥气体积流量为10 mL/min,N2温度350 ℃,雾化气气压为310 kPa,脱溶剂氮气体积流量为600 L/h,锥孔反吹氮气体积流量为50 L/h,毛细管电离电压为2.1 kV,扫描范围:m/z50~1000。
2.4.3 方法学考察 分别用心脏组织和血浆QC样本进行方法学考察。取同一QC 样本溶液,连续进样6 次,随机选择20 个色谱峰,计算色谱峰峰面积和保留时间的RSD 值,进行仪器精密度考察;平行配制6 份QC 样本,连续分析,随机选取20个色谱峰,计算峰面积和保留时间的RSD 值,进行方法精密度考察;取同一QC 样本溶液,分别在0、4、8、12、16 h 进样分析,随机选取20 个色谱峰,计算峰面积和保留时间的RSD 值,进行样本稳定性考察。
2.4.4 数据处理 将采集所得的 UPLC-QTOF/MS 原始数据经过 MarkerLynx applications manager Version 4.1(美国Waters 公司)数据处理系统导出,对谱图进行峰发现、峰对齐、峰过滤等操作和数据修约,获得代谢组学数据,导入SIMCA-P12.0 统计软件(瑞典Umetrics 公司)进行主成分分析(principal component analysis,PCA)和偏最小二乘辨别分析(orthogonal partial least squares discrimination analysis,PLS-DA),筛选得到可变重要性(variable importance,VIP)>1 的作为潜在生物标志物。并使用SPSS17.0 统计软件(美国SPSS 公司)进行t检验,以VIP>1 且P<0.05 为标准筛选差异生物标志物,对其进行物质鉴定,通过与对照品比对二级质谱碎片,以及代谢物数据库如HMDB(http://www.hmdb.ca/)、KEGG(http://www.genome.jp/kegg/)匹配确定生物标志物。此外,通过分层聚类分析观察标志物的变化趋势,受试者工作特征曲线(receiver operating characteristic curve,ROC)对鉴定的生物标志物进行优化和验证,同时判断这些标志物对心肌缺血是否有诊断意义。通过MetaboAnalyst 数据库(https://www.metaboanalyst.ca/MetaboAnalyst/faces/home.xhtml)进行代谢通路分析[13]。
3 结果
3.1 生化分析
按照“2.3”项方法进行生化分析,结果显示,KDZ 和阳性药对心肌缺血有相同的保护作用,KDZ可以减轻大鼠心肌缺血的症状。心肌受到损伤时,细胞膜通透性增加而导致心肌酶的大量外漏,以LDH 的变化最为显著,其含量与损伤程度呈正比。另外,氧自由基与心肌缺血、缺氧损伤密切相关。心肌缺血后,MDA 大量蓄积,破坏细胞膜的结构和功能,造成心肌细胞的严重损伤,故可判断心肌损伤的程度。如图1 所示,与对照组比较,模型组大鼠血清中AST、LDH 及血浆和心脏组织中MDA水平显著升高(P<0.01),表明大鼠给予ISO 后对心肌造成明显的损伤。与模型组相比,KDZ 组大鼠血清AST、LDH 及血浆MDA 水平显著降低(P<0.05、0.01);阳性对照组血清LDH 及血浆和心脏组织MDA 水平显著降低(P<0.05、0.01),血清AST 水平具有下降趋势。
3.2 病理组织观察
病理组织学结果如图2 所示,显微镜下可见,对照组大鼠心脏组织形态正常,心肌纤维排列正常,间质无异常,未见炎症反应。模型组大鼠心脏组织形态损伤严重,心肌纤维水肿,胞质疏松淡染(箭头)面积较大,局部心肌纤维排列不规则(黑框),间质疏松,炎症症状明显。KDZ 组和阳性对照药组均可改善心肌缺血症状。
3.3 无靶向代谢组学研究结果

图1 各组大鼠生化指标的变化 (±s,n=6)Fig.1 Changes of biochemical indexes in rats of each group (±s,n=6)

图2 HE 染色观察各组大鼠心脏组织病理学变化 (×200)Fig.2 Pathological changes of heart of rats in each group observed by HE staining ( × 200)
3.3.1 方法学考察 分别采用心脏组织和血浆QC样本进行仪器精密度、方法精密度和样本稳定性考察,前期研究发现正离子模式下可检测更多生物标志物,大鼠心脏组织和血浆QC 样本正离子模式基峰强度(base peak intensity,BPI)图如图3 所示。结果显示心脏组织QC 样本正离子模式色谱峰峰面积RSD<3.0%,保留时间RSD<1.0%;血浆QC 样本正离子模式色谱峰峰面积RSD<2.5%,保留时间RSD<1.0%。方法学考察结果合格,可进行后续实验。
3.3.2 生物标志物的筛选 首先采用PCA 无监督模式识别法对心脏组织和血浆样本间的差异进行直观分析。在PCA 模型中,模型组大鼠心脏组织和血浆样本与对照组有一定的区分,为了使样本达到最大化分离,建立有监督模式识别的PLS-DA 模型,如图4 所示。结果显示,心脏组织R2X=0.467,R2Y=0.996,Q2=0.824;血浆样本R2X=0.565,R2Y=1.000,Q2=0.990,两组样本都分布在不同区域,且各样本点在一定区域聚集,表明2 个样本的R2和Q2值较高,说明PLS-DA 模型没有发生过拟合,模型可靠,有很好的预测能力。
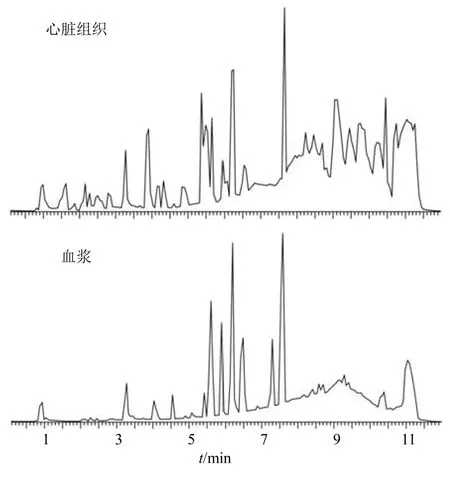
图3 QC 样本正离子模式BPI 图Fig.3 BPI diagram of positive ion mode of QC sample
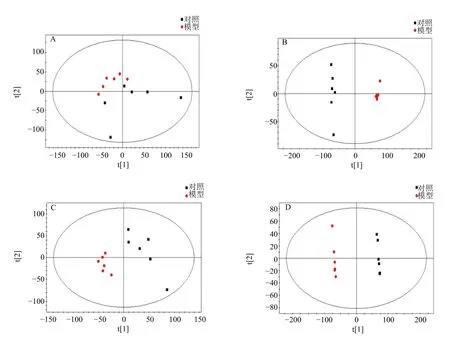
图4 大鼠心脏组织、血浆样本的多元数据分析Fig.4 Multivariate data analysis of heart tissue and plasma in rat
根据VIP 值结合t检验(P<0.05),在HMDB( http://www.hmdb.ca/ ) 数 据 库、 Chemspider(http://www.chemspider.com/)数据库中,利用m/z值寻找生物标志物,并通过二级碎片比对分析、代谢物数据库信息及文献信息确认潜在生物标志物。结果在心脏组织中筛选出生物标志物11 个,血浆样本中筛选出10 个生物标志物(表2)。
3.3.3 分层聚类分析 为了更形象化地分析心肌缺血诊断生物标志物的变化,采用分层聚类分析法,对以上发现的标志物进行分析,观察标志物的变化趋势。分层聚类分析得到的热图见图5。图中水平轴和垂直轴分别代表样本与生物标志物,颜色深浅反映变量值大小,棕色表示含量最高,蓝色表示含量最低,垂直轴中的分叉越近说明相似度越高。从图5 可以看出,在心脏组织和血浆样本中,对照组和模型组的生物标志物有明显的区别,且能完全分开,验证了这些生物标志物的判别能力。
3.3.4 ROC 曲线分析 利用ROC 曲线评价生物标志物的诊断准确性。如图6 所示,心脏组织和血浆样本的每个的标志物的曲线下面积(area under curve,AUC)均大于0.7,表明其对诊断心肌缺血具有较好的准确性,筛选的生物标志物具有诊断能力。
3.3.5 KDZ 对心脏组织和血浆中生物标志物的影响 KDZ 可以显著回调心脏组织中PC(18∶1/18∶1)的水平,显著调节血浆中LysoPC(20∶3)、肉豆蔻酸、硬脂酰肉碱、L-棕榈酰肉碱、植物鞘氨醇、LysoPC(22∶6)的水平。KDZ 对心脏组织和血浆中生物标志物的影响变化见表2。
3.4 代谢通路分析
将筛选到的生物标志物输入MetaboAnalyst 中进行通路分析,结果如图7 所示,主要涉及亚麻酸代谢、谷胱甘肽代谢、甘油磷脂代谢、鞘脂代谢和甾类激素生物合成等代谢通路。甘油磷脂代谢和谷胱甘肽代谢则与氧化应激关系密切,研究结果提示心肌缺血可能影响上述途径,使整个状态失调KDZ通过调控以上通路对心肌缺血起到预防作用。

表2 心脏组织和血浆中生物标志物具体信息Table 2 Specific information of biomarkers in heart tissue and plasma
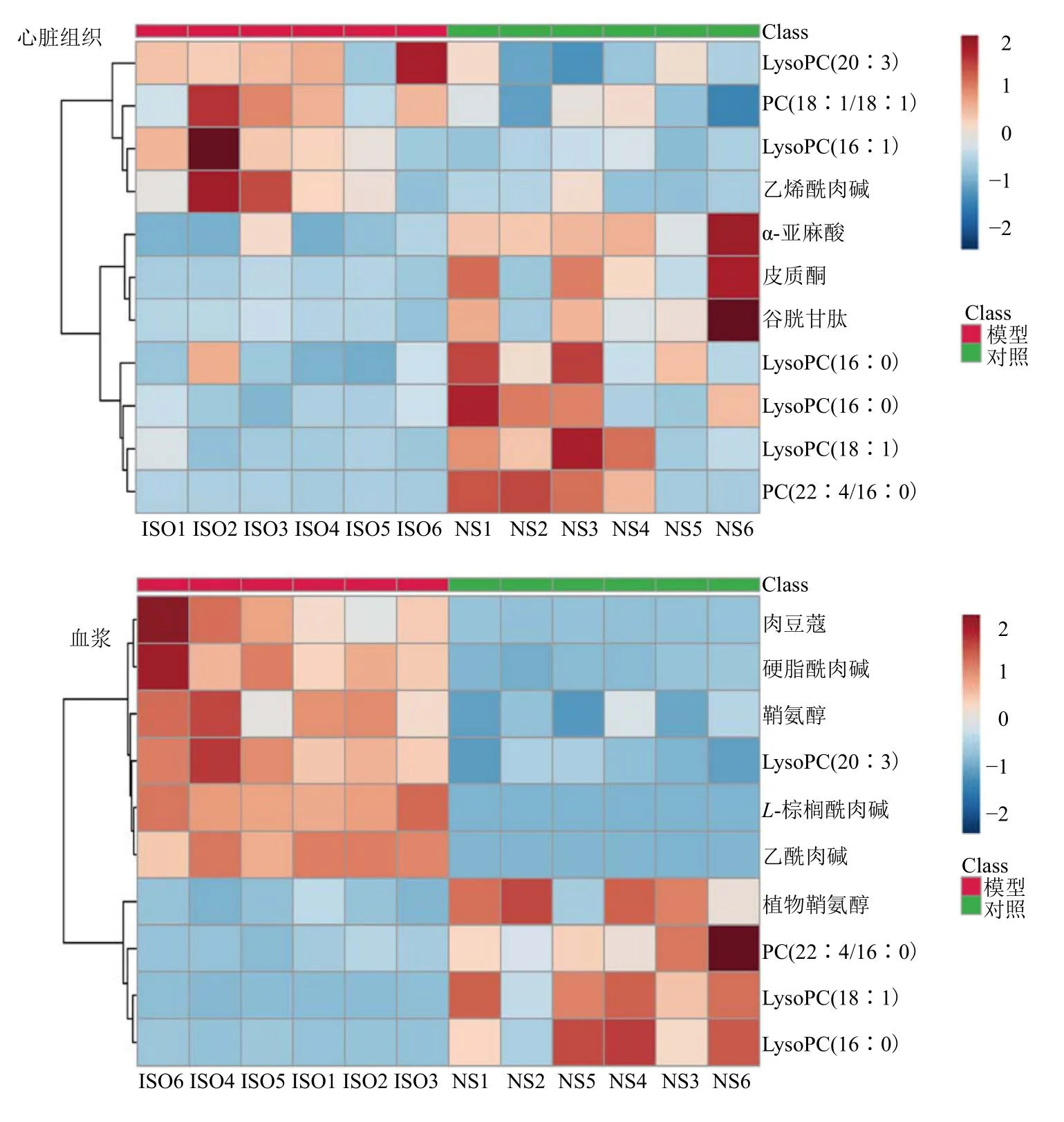
图5 心脏组织和血浆样本生物标志物聚类分析Fig.5 Cluster analysis of biomarkers in heart tissue and plasma samples
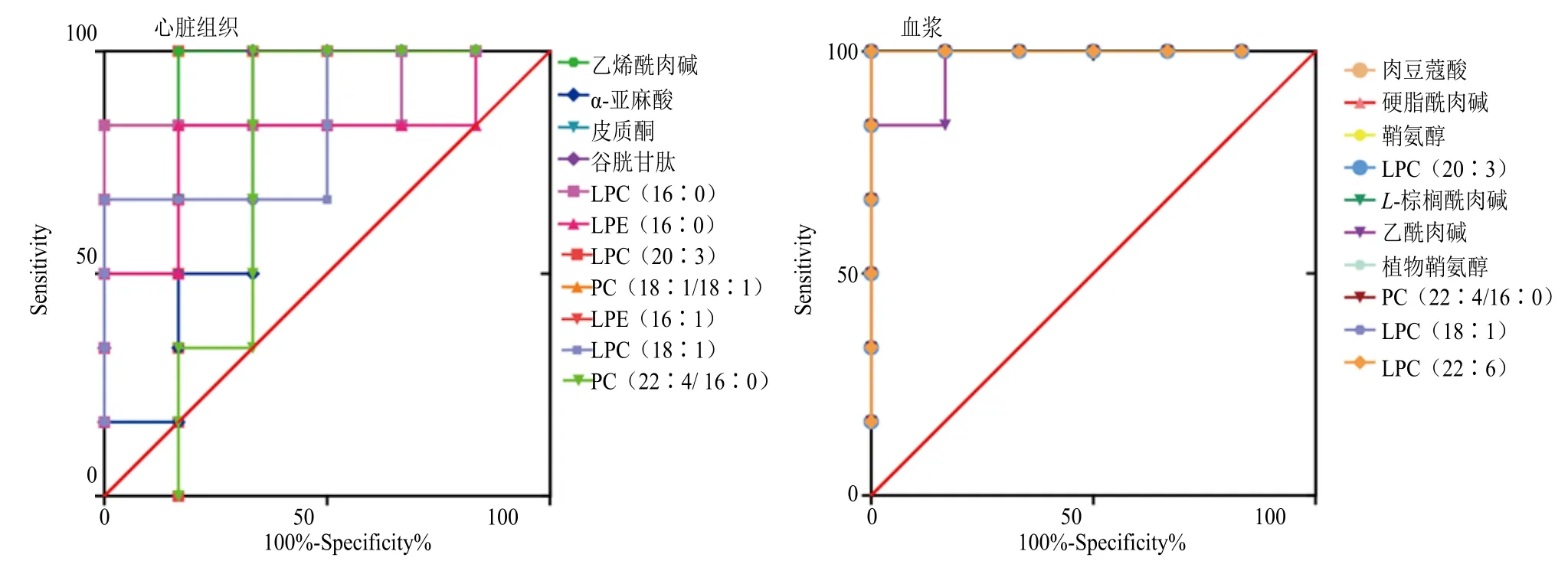
图6 心脏组织和血浆样本生物标志物ROC 曲线分析Fig.6 ROC curve analysis in heart tissue and plasma samples
4 讨论
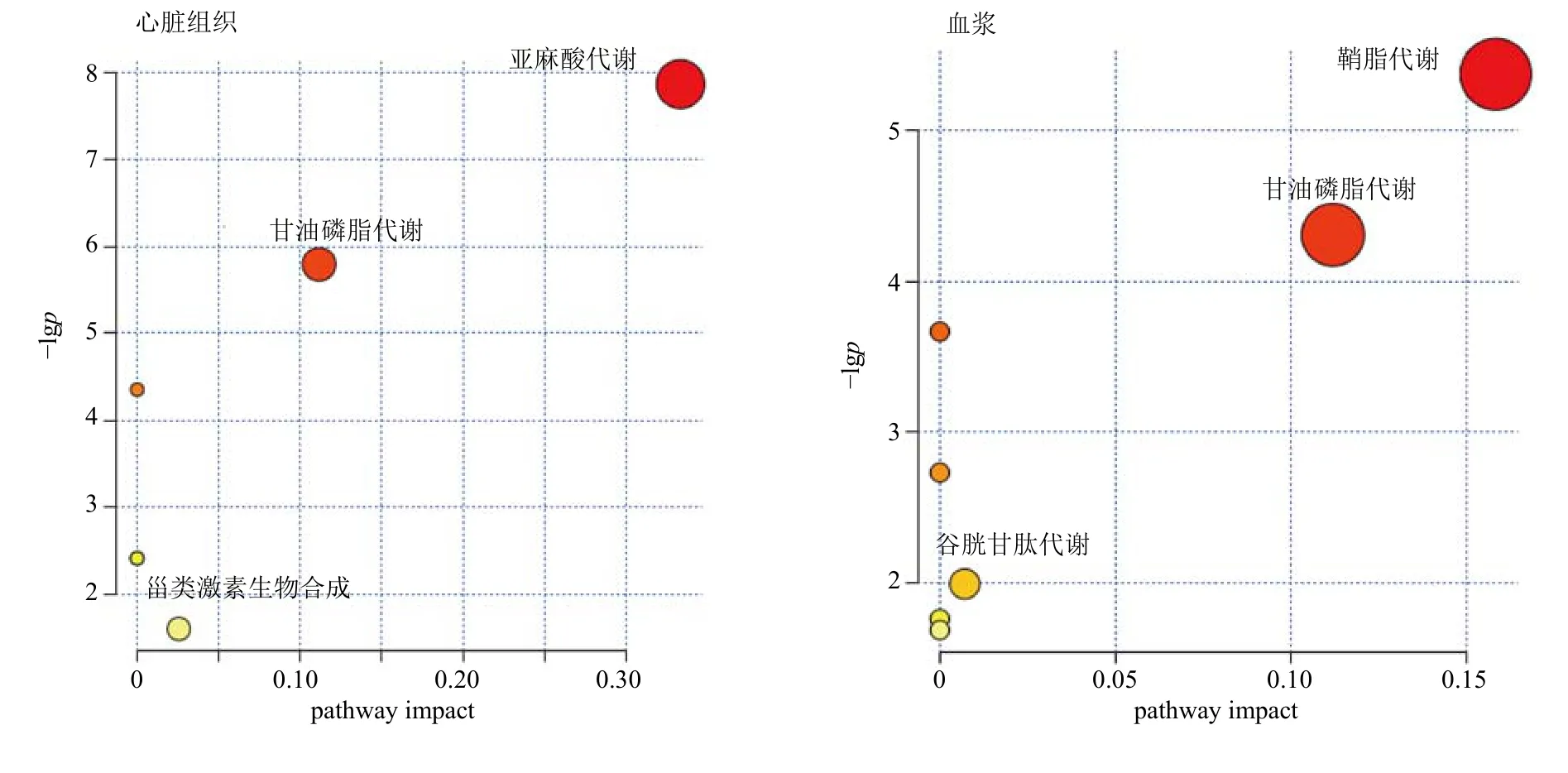
图7 生物标志物相关代谢通路富集分析Fig.7 Enrichment analysis of biomarker-related metabolic pathways
相关文献报道,KDZ 对大鼠心肌损伤有一定保护作用,作用机制可能与改善缺血心肌的能量代谢、稳定细胞膜、清除自由基、抗脂质过氧化有关,其可明显增加心肌血流量,降低冠脉血管阻力,改善微循环[8,14-15]。本研究发现,ISO 造成大鼠心肌缺血代谢紊乱,KDZ 可以有效保护大鼠心脏组织,血浆和心脏组织中均涉及甘油磷脂代谢通路,除此之外,血浆中还涉及鞘脂代谢和谷胱甘肽代谢通路,心脏组织还涉及亚麻酸代谢和甾类激素生物合成通路。
4.1 谷胱甘肽代谢
氧化应激是机体内产生过度的活性氧或抗氧化防御功能减弱,破坏氧化与抗氧化平衡,从而导致组织或细胞损伤的一种状态[16]。有一些内在的抗氧化系统可以阻止细胞内活性氧的积累。谷胱甘肽在维持细胞正常生理活动中起重要作用,是人体重要的生物活性物质、抗氧化剂和还原缓冲剂,可对氧化还原系统发挥活化作用,激活巯基酶,从而有效清除自由基和其他活性氧(如羟基自由基、脂质过氧自由基、过氧亚硝酸盐、H2O2),促进碳水化合物代谢、脂肪代谢以及蛋白质代谢,进而有效调节细胞膜代谢[17-19]。本研究中,模型组心脏组织内谷胱甘肽水平明显下降,KDZ 可使谷胱甘肽水平升高,表明KDZ 可以降低心脏组织的氧化应激反应。
4.2 甘油磷脂代谢
溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)类物质是一类磷脂类物质,是生物膜的重要组成部分。LPC 主要由组织中磷脂酶 A2(phospholipase A2,PLA2)家族的酶和血浆中糖蛋白卵磷脂胆固醇酰基转移酶(lecithin cholesterol acetyltransferase,LCAT)催化[20]。在疾病发展过程中,蛋白质激酶C(protein kinase C,PKC)途径被激活,PLA2 活性增加,因此血浆溶血性磷脂酰胆碱LysoPC(20∶3)、LysoPC(18∶2)、LysoPC(18∶1 ) 的含量显著降低。 磷脂酰胆碱(phosphatidylcholine,PC)经PLA2 水解产生LPC,在炎症过程中起重要作用[21-22]。有报道显示,LPC类物质含量的变化与机体免疫、炎症反应激活相关,因此LPC 与包括心肌缺血在内的许多疾病有密切联系[23-25]。当给予大鼠ISO 时,心脏受到损伤,激活了体内活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)的生成,致使体内氧化应激水平发生变化,机体氧化和抗氧化应激系统失衡,导致心肌细胞出现不同程度的损伤[26-27]。增加的LysoPC 可能诱发心肌缺血中的炎症,细胞凋亡和心脏收缩功能障碍[28]。据报道,LysoPE 被认为是重要的致心律失常脂质,在冠状动脉结扎所致的心肌梗死大鼠的梗死心肌中会增加。本研究表明,与对照组相比,模型组大鼠的心脏组织中LysoPE(16∶1)、LysoPE(16∶0)含量显著增加,KDZ 可维持LysoPC、PC和LysoPE 的正常水平;模型组大鼠的血浆PC(22∶4/16∶0)、LysoPC(22∶6)的含量明显增加,而KDZ 可维持LysoPC、PC 和LysoPE 的正常水平,表明KDZ 可维持心肌缺血期间甘油磷脂代谢紊乱的稳定性。
4.3 亚麻酸代谢
α-亚麻酸是一种具有抗氧化活性的不饱和脂肪酸,可降低血脂和纤维蛋白原含量,抑制血栓和动脉粥样硬化的形成,从而保护心血管,预防心肌梗死的发生[29]。当心肌损伤缺血、缺氧后,引发心肌动脉壁内层微小损伤,血压升高,导致心脏内α-亚麻酸的含量下降。提前给予KDZ 的大鼠心脏组织中α-亚麻酸的含量较模型组水平升高,表明KDZ可通过回调α-亚麻酸的水平抗心肌损伤。
4.4 其他
KDZ 在治疗冠心病心绞痛中得到了广泛的应用,其主要机制为扩张血管,增加血流量,降低氧代谢,提高缺氧耐受性,有效抑制血小板聚集,进而改善微循环,使得纤维蛋白溶解酶的活性增加,清除自由基。KDZ 主要成分包括黄酮类、有机酸类、倍半萜类等。黄酮类化合物具有保护心肌缺血损伤、提高机体清除自由基能力的作用,可有效扩张冠状动脉和血管,抑制血栓形成,使心肌平滑肌的收缩舒张能力得到改善,对铁具有螯合作用,抑制蛋白激酶以及钙拮抗。KDZ 的自由基清除作用可能与其含有腺苷和异黄酮有关。文献报道,异黄酮可提高机体抗氧化酶的活性,通过清除自由基而发挥保护作用。木犀草素及腺苷具有较强的抗氧化活性,有关药理活性及临床试验表明其在体内有调节血脂、降低胆固醇、抗菌以及抗病毒的作用。而有机酸类物质能够抑制血小板的聚集黏连,诱导血管舒张,并抑制脂新陈代谢中的酶作用,有助于防止冠心病、动脉粥样硬化和卒中等常见心脑血管疾病的发生[30]。
鞘脂是真核细胞膜的重要组成部分,鞘脂类作为生物膜的重要结构成分,在信号传输中起重要作用[31]。鞘氨醇水平高会降低缺血/再灌注过程中的心脏收缩力并诱导细胞凋亡。植物鞘氨醇可通过激活半胱氨酸天冬氨酸蛋白酶3(Caspase-3)和释放细胞色素来诱导细胞凋亡。本研究显示,与对照组相比,模型组大鼠血浆中的鞘氨醇、植物鞘氨醇水平升高,造成心脏血流动力学异常,从而造成心肌的损伤;而KDZ 中枢神经系统预处理降低了大鼠血浆鞘氨醇和植物鞘氨醇的水平。皮质酮与心肌纤维化有关系。心肌缺血大鼠体内皮质酮水平下降,KDZ 组皮质酮水平回调,表明KDZ 可通过回调皮质酮水平预防心肌缺血。肉碱类物质是判断能量代谢是否异常的可靠生物标志物,是参与脂肪酸代谢和三羧酸循环反应产生能量的重要成分[32]。肉碱不仅与体内氧化反应密切相关,也与心肌细胞的凋亡及能量代谢有联系。
综上,本研究通过ISO 建立大鼠心肌缺血模型探究KDZ 对心肌缺血损伤大鼠的心脏保护作用,采用UPLC-Q-TOF/MS 技术和代谢组学分析,探讨了心肌缺血的可能发病机制以及KDZ 预防心肌缺血的潜在作用机制。通过多元统计分析分别筛选得到11 个心脏标志物和10 个血浆标志物,其主要调控亚麻酸代谢、谷胱甘肽代谢、甘油磷脂代谢、甾类激素生物合成、鞘脂代谢等代谢通路。本研究为阐明KDZ 预防心肌缺血的作用机制提供依据,同时为KDZ 的临床合理应用提供参考。
利益冲突所有作者均声明不存在利益冲突