少棘蜈蚣多肽药用价值的研究进展
李钟杰,袁亚萍,王 勇
河南科技大学基础医学院,河南 洛阳 471003
少棘蜈蚣Scolopendra subspinipes mutilansL.Koch 主要分布于我国江苏、浙江、湖北、湖南、安徽、河南、陕西等地,其药用价值最早记录于2000多年前的《神农本草经》。其主治功能为息风镇痉、功毒散结、通络止痛,主要用于治疗小儿惊风、抽搐痉挛、中风口歪、破伤风、风湿顽痹和疮疡等。除我国外,东亚的其他国家也有少棘蜈蚣入药的历史。虽然少棘蜈蚣拥有悠久而广泛的应用历史且具有较好的临床治疗效果[1],但在传统中药中,其以整体入药为主,多为复方配伍,存在着药效物质基础不明确的问题,不利于对其药效机制进行深入的探究以及对其进行深入的开发利用。近年来,国内文献有关少棘蜈蚣药用活性组分的研究主要集中在提取物,这些提取物表现出了良好的抗肿瘤、镇痛、抗炎等药效作用[1-4]。这些研究在一定程度上阐释了少棘蜈蚣的药效物质基础,但其混合组分的特性在现代药物研发专注单体的框架下依然不利于少棘蜈蚣资源的开发利用。研究表明,少棘蜈蚣的化学成分含有蛋白质、氨基酸、脂肪酸等,其中蛋白质及多肽(占比50%~70%)为其主要成分[1,5]。随着分离纯化及鉴定技术不断提升,以及对少棘蜈蚣的深层次加工处理,发现其发挥药理活性的主要功能组分为多肽,而有关少棘蜈蚣基因组、转录组以及蛋白质组研究的开展,极大地促进了少棘蜈蚣中具有药效活性的多肽单体的发掘及研究[6-8]。这些功能活性多肽的发掘及研究,很好的诠释了少棘蜈蚣发挥药理作用的物质基础。本文通过对国内外有关少棘蜈蚣中具有潜在药物研发潜能的多肽进行综述,以期为少棘蜈蚣药用多肽资源的开发利用提供依据。
1 抗微生物多肽
抗微生物多肽的广谱抗微生物活性、不同于传统抗生素的独特作用机制以及不易诱导细菌产生耐药性的特性,使得它们成为抗菌药物研发中的一类明星分子[9-10]。目前通过分离纯化以及转录组学分析等方法手段,从少棘蜈蚣中获得了多种具有良好活性的抗微生物多肽。
1.1 直接作用的抗微生物多肽
1.1.1 天然来源的抗微生物肽 Ren 等[11]将大肠杆菌Escherichia coliK12D31 注入到少棘蜈蚣体内,4 d 后取毒液,所获得毒液对革兰阳性菌、革兰阴性菌以及真菌均具有良好的抑制活性,最小抑菌浓度为4.1~14.4 μg/mL,且其抗菌活性不受温度、pH值及离子强度的影响。通过利用阳离子交换色谱和2 步RP-HPLC 法,Ren 等[11]从毒液中分离获得抗微生物多肽scolopendrin I,其相对分子质量为4498,且在30 μmol/L 下不具有溶血活性和凝集活性。Peng等[12]利用葡聚糖凝胶滤过和RP-HPLC 法从少棘蜈蚣毒液中分离获得2 个新的抗微生物多肽scolopin 1和scolopin 2,其均对革兰阳性菌、革兰阴性菌、耐药菌株和真菌具有良好的抑制活性,最小抑菌浓度分别为1.2~15、0.5~7.5 μg/mL。二者均能在短时间内杀死所有大肠杆菌细胞,且其溶血率相对较低(50 μg/mL scolopin 1 和scolopin 2 对人红细胞的溶血率分别为25%、32%)。卢佳等[13]研究表明,scolopin 2 经酰胺化修饰后(scolopin 2-NH2)拥有更强的抗菌能力,且scolopin 2-NH2穿透细胞膜的效率比scolopin 2 更高。进一步的机制研究表明,scolopin 2 与scolopin 2-NH2均通过破坏细菌细胞膜,结合细菌DNA 和RNA、影响DNA 的二级结构、阻滞细菌细胞周期的进行以及影响细菌细胞内与DNA 复制和修复相关基因的表达等多重方式来抑制杀灭细菌[13]。同时,scolopin 2 与scolopin 2-NH2均具有良好的耐热性、耐酸碱性及抵抗离子强度和消化酶的能力。
1.1.2 非天然来源的抗微生物多肽 除了从少棘蜈蚣毒液中分离获得抗微生物肽,转录组学的研究极大地促进了少棘蜈蚣中抗微生物多肽的发现及研究。Choi 等[14]通过对少棘蜈蚣全体转录组学进行研究分析,发现1 条与lactoferricin B 有34.4%序列相似性的多肽,并将该多肽命名为LBLP。LBLP 对病原性真菌白色念珠菌Candida albicans、近平滑假丝酵母Candida parapsilosis、糠秕马拉色菌Malassezia furfur和白毛结节菌Trichosporon beigelii的最小抑菌浓度为10.0~20.0 μg/mL,且在80.0 μg/mL 浓度下不会引起溶血。机制研究表明,LBLP 可以导致白色念珠菌细胞皱缩、细胞膜电位的去极化以及在细胞膜上打孔(0.74~1.4 nm),进而通过杀细胞的方式最终使白色念珠菌细胞死亡[14]。Kwon 等[15]基于SVM 算法和GOR 算法从少棘蜈蚣的转录组中获得 1 条潜在抗微生物多肽 scolopendrasin II。scolopendrasin II 对革兰阳性菌、革兰阴性菌以及多重耐药菌株均有很好的抑制活性,且在320 µg/mL浓度下没有溶血活性。进一步的研究表明,scolopendrasin II 通过与脂多糖和磷壁酸的相互作用而结合到细菌表面,进而可能通过破坏细胞膜的完整性来抑制杀灭多重耐药的铜绿假单胞菌[15]。Yoo 等[16]同样通过对少棘蜈蚣全体转录组学进行研究,从中获得10 条新的抗微生物多肽。这些抗微生物多肽对革兰阳性菌和革兰阴性菌(包含多重耐药菌株)以及真菌均具有良好的抑制活性,且在100 μg/mL 时没有溶血活性[16-17]。在这10 条新的抗微生物多肽中,scolopendrasin V 对革兰阴性菌(包含耐药菌株)的活性更强,而scolopendrasin VII 对革兰阳性菌的活性更强。同时,scolopendrasin V 通过与脂多糖、磷壁酸和肽聚糖作用而结合在细菌表面,破坏细菌细胞膜的完整性,进而杀死细菌细胞[16-17]。
Lee 的研究团队通过对大肠杆菌感染后少棘蜈蚣的转录组进行测序分析,从中获得3 条新的抗微生物多肽scolopendin、scolopendin 1 和scolopendin 2[18-20]。scolopendin 对革兰阳性菌、革兰阴性菌、耐药菌株以及真菌均具有很好的抑制活性,最小抑菌浓度为5~25 μmol/L,且在100 μmol/L 时没有溶血活性[18]。机制研究表明,scolopendin 可以扰乱大肠杆菌和白色念珠菌细胞膜的膜电位,并通过在细胞膜上形成2.3~3.3 nm 的孔而破坏细胞膜的完整性并导致胞内组分的泄露,最终导致细胞的死亡[18]。进一步的研究表明,scolopendin 能够导致白色念珠菌细胞收缩、细胞质和线粒体中游离钙离子水平增加、细胞内尤其是线粒体中活性氧过量产生、线粒体中细胞色素c 的相对水平降低且细胞质中细胞色素c 的相对水平增加,进而诱导白色念珠菌细胞发生caspase相关性凋亡[21]。scolopendin 1 对革兰阳性菌、革兰阴性菌以及真菌的最小抑菌浓度为5~20 μmol/L,且在80 μmol/L 时没有溶血活性[19]。scolopendin 1可以导致白色念珠菌细胞中的活性氧积累使得线粒体去极化,进而使得细胞色素c 从线粒体中释放到细胞质中,还可以导致细胞质和线粒体中钙离子的增加,最终激活细胞内caspase,诱导白色念珠菌凋亡[19]。scolopendin 2 对革兰阳性菌、革兰阴性菌、耐药菌株以及真菌的最小抑菌浓度为 6.3~25 μmol/L,且在100 μmol/L 时没有溶血活性[20]。机制研究表明,scolopendin 2 通过在细胞膜上打孔(4.8~5.0 nm)来增加大肠杆菌和白色念珠菌的细胞膜的通透性和去极化,最终导致微生物细胞的死亡[20]。进一步的研究表明,在亚致死浓度下,scolopendin 2会引起白色念珠菌胞内活性氧和抗氧化分子水平的升高、脂质被氧化以及钙离子从内质网释放并在胞质和线粒体中积累;而在致死剂量下,scolopendin 2诱导白色念珠菌发生线粒体及caspase 介导的凋亡反应,最终导致细胞死亡[22]。
1.2 间接作用的抗微生物多肽
除了直接作用于微生物,许多抗微生物多肽还可以通过调节免疫系统来清除病原微生物。中性粒细胞迁移是宿主抵抗感染的免疫反应中的重要组成部分,是最早募集到感染区域的白细胞,而甲酰基肽受体(formyl peptide receptor,FPR)是介导白细胞趋化迁移的重要的趋化G 蛋白偶联受体,FPRs在中性粒细胞和单核细胞中的活化引发超氧阴离子的产生和杀菌活性,因此,增强中性粒细胞的募集和激活有利于促进感染区域病原微生物的清除[23-26]。少棘蜈蚣抗微生物多肽 scolopendrasin III 和scolopendrasin V 通过刺激FPR1,激活紫杉醇敏感的G 蛋白/ERK/Akt 信号通路,进而导致嗜中性粒细胞趋化性迁移,且在这个过程中不会引起细胞内钙的释放以及嗜中性粒细胞产生超氧阴离子及脱颗粒[27]。而scolopendrasin VII 则通过与FPR1 的结合激活细胞外调节蛋白激酶和蛋白激酶B,进而引发肌动蛋白聚合,导致巨噬细胞趋化性迁[28]。scolopendrasin X 与scolopendrasin IX 以浓度相关的方式导致中性粒细胞胞内钙离子及超氧阴离子浓度的增加,通过紫杉醇敏感的G 蛋白偶联受体刺激中性粒细胞的趋化,并通过作用于FPR2 导致中性粒细胞的活化;同时,还可以阻断脂多糖诱导中性粒细胞产生肿瘤坏死因子α、白介素6 和白介素10,具有抗炎作用[29-30]。
由此可见,从少棘蜈蚣中发现的抗微生物多肽(表1)通过多种多样的方式杀灭或清除病原微生物,它们所表现出来的优良性能,为新的抗微生物药物的研发提供了良好的先导分子或分子模板。
2 抗肿瘤多肽
抗微生物多肽scolopendrasin VII 可以有效的降低白血病U937 和Jurkat 细胞的存活率并破坏细胞膜的完整性,且具有浓度相关性[31]。抗肿瘤机制表明,scolopendrasin VII 可以与白血病细胞细胞膜上的磷酯酰丝氨酸(在肿瘤细胞细胞膜中富含)相互作用,进而破坏细胞膜的完整性,导致细胞膜的破裂,同时会诱导白血病细胞发生坏死,最终导致白血病细胞的死亡[31]。由于scolopendrasin VII 不具有溶血活性[16],因此可以作为治疗白血病的潜在药物以及用于相关药物的研发。
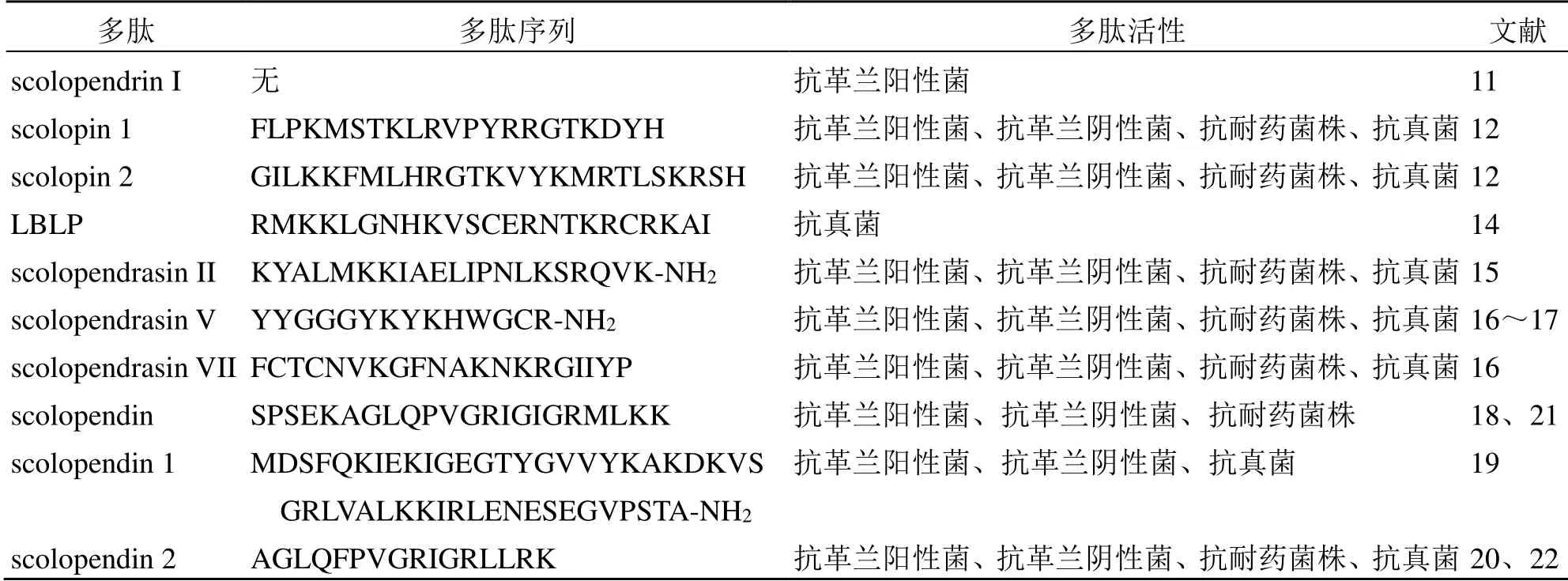
表1 少棘蜈蚣抗微生物多肽Table 1 Antimicrobial peptides from S. subspinipes mutilans
抗微生物多肽 scolopin-2 及其酰胺化肽scolopin-2-NH2以浓度相关性的方式抑制宫颈癌HeLa 细胞的增殖,而scolopin-2-NH2(35 μmol/L)对HeLa 细胞的半数抑制浓度(median inhibitory concentration,IC50)较scolopin-2(75 μmol/L)更低[32]。毒性检测显示,scolopin-2 及scolopin-2-NH2在120 μmol/L 时均不会抑制正常293T 和WRL-68细胞的增殖,但在200 μmol/L 时,scolopin-2-NH2(6%)比scolopin-2(11%)的溶血率更低[32]。进一步的机制研究表明,scolopin-2-NH2可以诱导HeLa细胞凋亡。在荷瘤鼠模型中,scolopin-2-NH2同样表现出良好的抗肿瘤活性,可以有效抑制肿瘤的增长(在100、150 mg/kg 时对肿瘤增长的抑制率分别为66.28%、47.90%),并抑制肿瘤内血管的形成[32]。由此可见,与scolopin-2 相比,scolopin-2-NH2是1个更加安全和有效的潜在的抗肿瘤分子。
3 治疗心血管疾病多肽
动脉粥样硬化是现代社会中死亡的主要病因,而高脂血症是动脉粥样硬化的重要危险因素。Wu等[33]从少棘蜈蚣干粉中分离获得酸性蛋白。在SD大鼠动脉粥样硬化模型中,酸性蛋白可以显著降低动脉粥样硬化大鼠血浆中的总胆固醇、三酰甘油以及低密度脂蛋白的含量,显著提高高密度脂蛋白的含量以及改善异常血液流变学参数[33]。酸性蛋白还可以通过升高血清中的一氧化氮水平、降低血浆中的人内皮素-1 水平、以及升高血清中超氧化物歧化酶的活性并降低血清中丙二醛的水平,进而抑制血清中脂质的过氧化[33]。同时,酸性蛋白可以改善动脉粥样硬化大鼠胸主动脉和肝脏的病理变化。而且,在整个实验周期中,酸性蛋白不会影响大鼠的体质量,说明其具有安全性[33]。这些研究结果表明,酸性蛋白具有用于治疗或改善动脉粥样硬化的潜能。
Kong 等[34]利用凝胶滤过、阴离子交换及RP-HPLC 从少棘蜈蚣干粉中分离获得三肽(Ser-Gln-Leu,SQL)。SQL 在体外以剂量相关性的方式延长部分凝血活酶的活化时间并抑制血小板聚集[34-35]。在氯化铁诱导的大鼠动脉血栓形成模型中,SQL 以剂量相关性的方式显著抑制血栓的形成;在大鼠房室分流血栓形成模型中,SQL 以剂量相关性的方式显著降低湿血栓及干血栓的质量,且这种效应与阿司匹林相似[35]。在有效剂量下,SQL 没有出血风险,且其出血风险低于阿司匹林[35]。机制研究表明,SQL可以与PI3Kβ 结合位点非保守区域的Ser775 和Lys776 残基结合以及与Lys799 和Asp807 残基间形成氢键来抑制PI3Kβ 的活性,还可以明显抑制晚期Akt Ser473 的磷酸化,进而通过PI3K/Akt 信号通路来抑制血小板凝集[35]。这些研究结果表明,SQL 可作为靶向PI3Kβ 的有效和安全的抗血栓形成剂或先导化合物的候选药物。
Kong 等[36]进一步利用凝胶滤过及RP-HPLC 从少棘蜈蚣毒液中分离获得五肽(Thr-Asn-Gly-Tyr-Thr,TNGYT)。TNGYT 是丝氨酸蛋白酶凝血因子Xa(blood coagulation factor Xa,FXa)的抑制剂,在体外和离体实验中以剂量相关的方式抑制FXa 的活性,进而延长部分凝血活酶时间和凝血酶原时间。虽然TNGYT 对FXa 的抑制率低于FXa 的抑制剂Ac-AP-12[37]、amblyomin-X[38]和AduNAP4[39],但依然具有作为靶向FXa抑制剂药物的前体分子用于抗凝药物研发的潜能。
4 治疗自身免疫疾病多肽
类风湿关节炎是一种众所周知的慢性自身免疫性疾病,在其发病过程中,炎症性免疫细胞(如中性粒细胞)被募集到关节区域和滑膜中,促进炎症和破骨细胞分化,从而导致软骨侵蚀和骨畸形[40-41]。因此,调节中性粒细胞的活性有利于控制类风湿关节炎。在小鼠K/BxN 血清转移性关节炎模型中,少棘蜈蚣抗微生物多肽scolopendrasin IX通过与FPR2相互作用,阻止嗜中性白细胞募集进入关节区域并抑制炎症细胞因子的产生,进而以剂量相关的方式显著降低由于炎症引起的小鼠爪的厚度,改善关节的破坏情况,最终改善炎症性关节炎[30]。因此,scolopendrasin IX 可以作为治疗自身免疫性关节炎的候选药物。
KV1.3 通道在免疫细胞中大量表达,同时也是用于治疗T 细胞介导的免疫疾病的靶标[42]。从少棘蜈蚣毒液中获得的SsTx 是1 条由53 个氨基酸残基组成含有2 对二硫键的多肽,以电压相关性的方式抑制KV1.3 通道的活性,且其对KV1.3 通道的IC50为5.26 µmol/L[43]。但是,SsTx 同样可以作用于KV7 通道,进而引起严重的血管和呼吸系统疾病或癫痫[43-44]。为降低SsTx 的毒性,Du 等[43]设计出突变体SsTx-R12A。SsTx-R12A 对KV1.3 通道的IC50为22.23 µmol/L,虽然低于SsTx,但对KV7.4没有抑制活性;通过抑制KV1.3 通道的活性,SsTx-R12A 抑制T 细胞的增殖和细胞因子的产生。这些研究结果表明,SsTx-R12A 可以用于研发治疗T 细胞介导的自身免疫疾病的药物。
5 镇痛多肽
Liu 等[45]从少棘蜈蚣毒腺cDNA 文库中获得多肽SsmTX-I,其由36 个氨基酸残基组成,含有2对(13-26、8-19)二硫键。在福尔马林诱导的小鼠舔爪试验中,SsmTX-I 大大降低了小鼠I 期和II 期疼痛反应,且在减轻I 期疼痛方面,SsmTX-I 比吗啡更加有效,在减轻II 期疼痛方面,SsmTX-I 几乎与吗啡一样有效;在小鼠热痛模型中,SsmTX-I 和吗啡有同样的镇痛效果;在乙酸诱导的小鼠腹部扭体模型中,SsmTX-I 的镇痛效果略差于吗啡[46]。虽然SsmTX-I的镇痛机制尚不明确,但这些数据表明,SsmTX-I 具有作为镇痛药物的潜能。
Yang 等[47]利用凝胶滤过及反相HPLC 从少棘蜈蚣的毒液中分离获得由46 个氨基酸残基组成含有3 对二硫键的Ssm6a。Ssm6a 对钠离子通道hNaV1.1、hNaV1、hNaV1.6 和hNaV1.7 的IC50分别为4.1、8.13、15.2、25.4 nmol/L,但对hNaV1.3、hNaV1.4、hNaV1.5 和hNaV1.8 没有活性。由此可见Ssm6a 对hNaV1.7 具有特异性。在福尔马林诱导的小鼠舔爪试验中,Ssm6a 表现出良好的阵痛效果,能够显著降低小鼠I 期和II 期疼痛反应,且其阵痛效果比吗啡更有效;在乙酸及热诱导的小鼠疼痛模型中,Ssm6a 的阵痛效果与吗啡相仿[47]。同时,Ssm6a没有不良反应,不会影响血压、心率及运动功能,而且拥有非常好的血清稳定性。由于NaV1.7 是治疗疼痛药物的一个靶标,这些研究结果表明Ssm6a 可作为研发靶向hNaV1.7 的镇痛药物的先导分子。
6 结语与展望
少棘蜈蚣具有悠久的药用历史,但其传统功效是基于整体入药为主,且多为复方配伍,由于针对其行使功效的确切有效成分的研究相对不足,严重影响其在现代医学中的应用。近年来,有关少棘蜈蚣提取物的研究逐渐增多,但提取物的混合物本质依然不利于其在现代医学中的应用。目前,国内外学者通过运用多种技术手段及方法,从少棘蜈蚣中获得了大量活性多肽单体,针对这些活性多肽单体的功能研究表明,少棘蜈蚣行使药效的物质基础主要为多肽。虽然这些研究工作大大促进了少棘蜈蚣在现代医学中的开发利用,为新型药物的设计及研发提供了大量优良的前体分子或分子模板,但依然存在几方面的研究工作需要深入开展。(1)有关少棘蜈蚣多肽的研究过少。经酶解加工或基于转录组学分析等多种技术方法,从少棘蜈蚣中获得数量巨大的多肽分子。但目前仅对其中的少量多肽进行了功能研究,只有进一步加大对少棘蜈蚣多肽的功能研究,才能获得更多的潜在药物分子,从而促进对少棘蜈蚣资源的开发利用。(2)少棘蜈蚣多肽的毒性研究有待深入。目前,有关少棘蜈蚣多肽的毒性研究大多为细胞水平,缺少动物水平上系统的毒性研究。有关毒性研究的缺乏,不利于对其进行后续的研发。(3)有关少棘蜈蚣多肽结构的研究较缺乏。活性多肽结构的解析,有助于深入研究其作用机制,同时也有助于毒理作用的探究,并最终有助于多肽分子的优化设计,从而获得最优的多肽分子,进而促进基于少棘蜈蚣多肽的药物研发。(4)缺乏少棘蜈蚣不同多肽间的协同作用研究。对于中药来说,其传统药效往往不是一种分子在发挥作用,可能是多种分子共同作用才能达到良好的药效。在中药的现代化研究中,过多的探究其单一活性分子药效。对于单一药效分子来说,在确保其有效活性的同时难免会展现出高毒性或高剂量等情况。而开展协同作用研究,有利于确保药效的前提下降低毒性或用药剂量。虽然很多的少棘蜈蚣多肽展现出了良好的药物研发潜能,但到目前为止,还没有关于少棘蜈蚣多肽的临床研究,更没有相关多肽在临床上的应用。由此可见,少棘蜈蚣多肽走向临床应用,急需开展更多更全面的研究工作。
利益冲突所有作者均声明不存在利益冲突