高频超声诊断侵袭性纤维瘤病的应用价值
董 叶 彭晓静 邓 晶 胡 彧 叶新华 杭 菁 李 奥
侵袭性纤维瘤病(aggressive fibromatosis,AF)作为一种交界性软组织肿瘤,是具有局部侵袭潜能的纤维母细胞/肌纤维母细胞性肿瘤,主要来源于肌肉内结缔组织及其被覆的筋膜[1],又称韧带样型纤维瘤病、肌腱膜纤维瘤病、硬纤维瘤等。因其具有侵袭性生长和局部复发率高的特点[2],临床极易误诊。为提高超声对其的认识,本研究回顾性分析31例经手术病理证实的AF 患者的超声和临床资料,总结其超声特征,以期为临床诊断及鉴别诊断提供参考。
资料与方法
一、临床资料
选取2015 年7 月至2019 年7 月于我院经手术病理证实的31 例AF患者(共34个病灶),男4例,女27例,年龄22~76岁,平均(35.8±12.8岁),其中20~45岁者23例。所有患者均以触及痛性或无痛性肿块就诊,其中25 例为初发,6 例为复发。排除标准:超声检查前曾行肿块穿刺活检或其他介入治疗者。本研究经我院医学伦理委员会批准,患者均知情同意。
二、仪器与方法
使用Philips iU 22、GE Logiq E 9、百胜MyLab Twice、西门子3000 彩色多普勒超声诊断仪,线阵探头,频率10~12 MHz。首先行二维超声检查观察病灶部位、大小、边界、形态、生长方式、内部回声及后方回声。观察病灶血流分布情况并采用Adler 半定量法[3]进行分级。二维及彩色血流图像特征分析由两名获得高级职称的超声专业医师在不知手术病理结果的情况下进行回顾性分析,观察不同类型肿块的超声表现,总结其超声特征,如有争议协商达成共识。
参考文献[4]关于AF 的分型标准,结合本研究并未发现腹内型AF 的情况,为了便于数据分析,本研究根据病灶发生部位分为:腹壁型、乳腺型及腹外型(除腹壁型、乳腺型的肿块均纳入该型)。所有病例均行手术切除,送检病灶组织均行常规HE染色,部分病例病检组织加行免疫组化检查。
结 果
一、超声表现
本研究中腹壁型8例、腹外型13例和乳腺型10例。腹壁型均为单发,位于腹壁肌层内;腹外型均为单发,4例位于肌内,4例位于肌间隙,3例位于皮下脂肪层,2例位于臀部皮下深筋膜层,其中3 例为复发患者;乳腺型共13 个病灶(位于胸壁1 个,位于乳腺实质12 个),其中3 例为多发(双乳各1 个病灶),3 例为复发患者。34个AF病灶的超声特征见表1。
1.腹壁型AF:病灶均呈低回声;大小约1.2~8.6 cm,其中最大径>5.0 cm 者3例;均呈膨胀性生长;病灶为椭圆形,沿肌肉长轴走行;边界清晰;仅1 例病灶内部出现液化;6 例后方回声增强;6例内部血流分级Ⅱ~Ⅲ级。见图1。
2.腹外型AF 超声:病灶均呈低回声,大小约1.0~16.5 cm,其中最大径>5.0 cm 者 7 例;11 例呈膨胀性生长;11 例病灶为椭圆形,沿肌肉长轴走行;11例边界清晰;2例病灶内部出现液化,1 例出现钙化;8 例后方回声增强;11 例内部血流分级Ⅱ~Ⅲ级。其中2 例位于皮下深筋膜层的病灶超声表现为形态不规则,边界不清晰,内部血流分级Ⅲ级。见图2。
3.乳腺型AF:12 例病灶以低回声为主,其中1 例位于胸大肌者呈高低混杂回声;大小约0.6~6.4 cm,其中最大径>5.0 cm者5例;12例呈“爪”形浸润性生长;8例边界不清晰;2例病灶内部出现钙化;9 例后方回声衰减;7 例内部血流分级Ⅱ~Ⅲ级。见图3。
二、病理学表现
大体观:病灶常呈白色,较大、质硬,边界不清晰,切面呈不规则漩涡状,常发生于肌肉筋膜内。光镜下为受累的横纹肌萎缩,呈多核巨细胞状散布其中,以肿块周边部易见;常见较小的出血灶及淋巴细胞浸润,部分可发生钙化及软骨或骨化生(图4)。免疫组化:可见瘤细胞Vim 强阳性,MSA 和SMA 阳性程度不等;少数细胞同时表达desmin 和S-100。本研究34 个病灶中有22 个病灶进行免疫组化检查,其中21 个β-catenin(+),18 个SMA(+)。本研究中1 例AF 患者,为局灶伴转移性腺癌(肺源性),转移灶为显微镜下发现,病灶最大径2 mm(图5)。
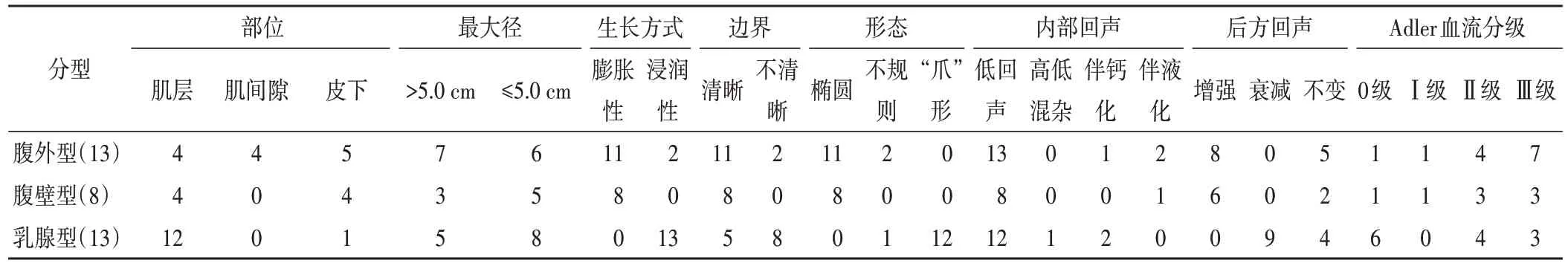
表1 34个AF病灶的超声特征 个
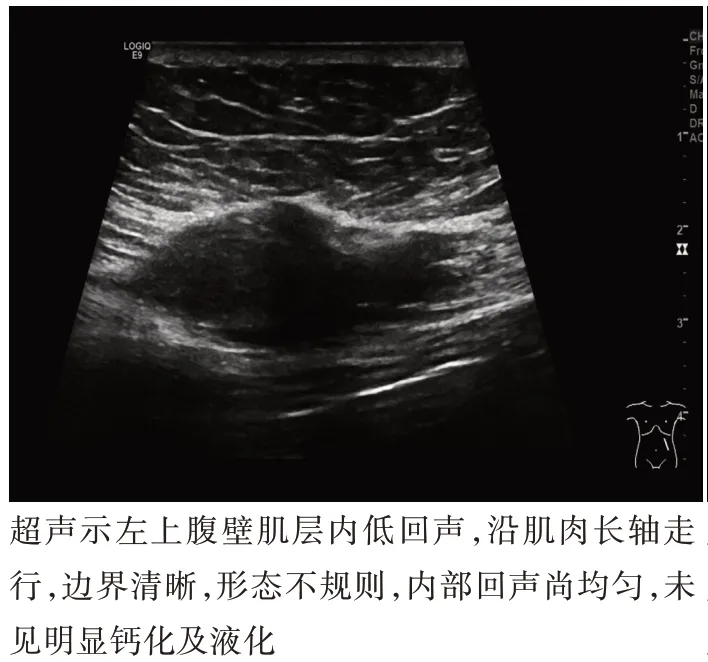
图1 腹壁型AF 超声图像(患者女,35 岁,扪及左上腹腹壁包块,质韧伴压痛)

图2 腹外型AF 超声图像(患者女,38 岁,右侧髋部包块,无明显疼痛,该处曾有外伤史)

图3 乳腺型AF超声图像(患者女,22岁,右侧乳腺包块,无明显疼痛,无乳头凹陷,无皮肤水肿及橘皮征,无乳头泌乳及溢液)
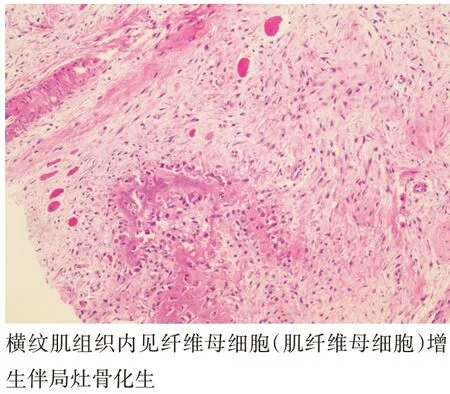
图4 腹股沟肌层内侵袭性纤维瘤病患者肿瘤病理图(HE染色,×200)
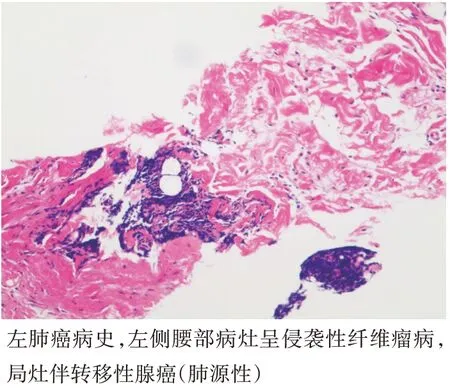
图5 左侧腰部侵袭性纤维瘤病患者肿瘤病理图(HE染色,×100)
讨 论
2013年WHO 关于软组织与骨肿瘤分类中,将AF归类为来源于成纤维细胞或肌成纤维细胞性肿瘤,生物学行为介于良恶性肿瘤之间,不易发生远处转移,属中间型肿瘤[4]。本病发病率较低,占软组织肿瘤的0.03%,占纤维肿瘤的1.19%[5]。每年新发患者为百万分之2~4,约70%发生于25~45岁成人,以女性多见[6],本研究病例中女性占 87.1%(27/31),且 25~45 岁占61.3%(19/31),与上述文献大致相符。AF病因和发病机制尚不明确,可能与手术、外伤、内分泌及遗传因素等有关[7]。研究[8]发现部分切口瘢痕和腹壁疝修补术后患者可伴发AF,Cohen等[9]也认为AF与发病部位创伤史关系密切。本研究31例患者中15例有手术病史,其中12例发生在原位手术切口处。此外,研究[10]认为AF的发生机制与β-catenin基因异常导致的Wnt信号通路障碍有关。本研究中,进行免疫组化检查的病灶中95.5%(21/22)提示β-catenin(+),从病理学角度印证了这一发生机制。
AF 按病变部位可分为腹外型(60%)、腹壁型(25%)、腹内型(15%)[4],本研究未见腹内型,可能与腹内型病灶首选CT 或MRI 检查,术前未行超声检查等有关。由于本研究发生于乳腺病例较多,且极易将其误诊为恶性肿瘤,故将其单独归为乳腺型。本研究中三种类型的AF 病灶声像图表现均以低回声为主,内部回声多不均匀,较少出现钙化及液化。其中乳腺型AF病灶多呈“爪”形浸润性生长,边缘不规则,与镜下所见AF 边缘肿瘤组织与周围正常结构交叉呈“触须”状相符[11];而腹壁型和腹外型病例中除发生在皮下深筋膜层内的病灶外,均呈肿块样生长。分析其原因,发生在肌层的AF 生长受肌束膜及肌外膜的束缚,而乳腺内组织较疏松,故病灶呈浸润性生长。本研究乳腺型病例中69.2%(9/13)的病灶后方回声有不同程度衰减,病理同时提示胶原化,但腹壁型和腹外型所有病灶后方回声均未出现衰减。由于AF 组织学上主要由纤维母细胞和胶原纤维组成[12],纤维母细胞和胶原纤维的比例不同造成了其超声表现不同,有学者[13]指出不同时期肿瘤瘤体内细胞含量和组织成分会发生相应的变化,当肿瘤处于早期时,瘤体内纤维母细胞含量高于胶原纤维含量,此时超声表现为病灶后方回声衰减较轻;随着肿瘤进展,病灶中胶原纤维含量高于纤维母细胞含量,此时超声表现为后方回声衰减常较明显。本研究中三种类型病灶血流显示均无明显特异性,可能是不同仪器和病灶深度不同所致。
本研究10 例乳腺型AF 超声均误诊为乳腺恶性肿瘤,原因可能与AF 的超声表现无特异性,以及超声医师对AF 的认识不足有关。本研究所有乳腺型病例声像图均表现为浸润性生长,均未发现腋窝淋巴结肿大,Alder 血流分级为0 级和Ⅱ~Ⅲ级的病灶比例相当,且与瘤体大小无明显相关,即使部分病灶较大,但由于瘤内血管间质较少,致其内血流信号并不丰富。因此笔者认为,当年轻育龄女性患者超声检查发现乳腺内病灶呈“爪”形浸润性生长,且无腋窝淋巴结肿大、皮肤颜色改变及水肿等其他恶性征象时,需考虑AF 的可能;当中老年女性乳腺内出现此类病灶时,难以与恶性肿瘤鉴别,两者均可表现为浸润性生长,边界不清晰,形态不规则,仅凭超声诊断及鉴别诊断较困难,确诊仍需要穿刺或手术病理检查。
当腹壁肌层内发现沿肌肉长轴走行呈膨胀性生长的肿块时,尤其是生育年龄的女性,且该处有创伤史时,应考虑AF 的可能。腹外型AF 可以生长在身体的任何部位,超声表现多样,需与其他软组织肿瘤相鉴别。①腹壁型和腹外型AF 需与软组织肉瘤鉴别,软组织肉瘤通常压迫周围组织形成假包膜,瘤体较大时易发生液化坏死,而AF 呈浸润性生长,边界常不清晰或欠清晰,即使瘤体较大也常无液化坏死。②腹壁型和腹外型AF 需与神经鞘瘤鉴别,后者通常两端可见与神经相连,且边界较清晰,此外两者均可发生液化,血流均可多可少。③腹壁型AF 需与子宫内膜异位症鉴别,后者常发生于有剖宫产病史的患者,病灶大小随月经周期发生周期性变化,当发生不典型病灶时,超声难以鉴别。
综上所述,AF 的超声表现具有一定的特征性。超声对不同类型的AF诊断具有一定的价值。

