心脏hERG 钾通道结构及其电压门控调节分子机制
郑泽群 廉姜芳
自从1994 年鉴别出了KCNH2(hERG)基因,众多研究逐渐揭示了该基因编码的快速激活延迟整流钾电流(IKr)在构成完整动作电位中的重要地位。KCNH2 基因全长包含1 159 个氨基酸,发生在不同位点的突变影响了通道的电压门控特性,称为Ⅲ类突变[1-2]。Ⅲ类突变发生在hERG 通道的不同结构域改变了其门控动力学,主要表现为通道的激活减慢或去激活加速[3-4]。因涉及复杂的通道结构域间相互作用,理解hERG 通道在心肌复极化过程中正常的电压门控机制,需要全面认识不同结构域在其构象改变中发挥的作用。
同属电压门控钾(Kv)通道的Shaker 通道为hERG 通道的结构及动力学提供了研究基础,加上定点突变鉴定出了调节hERG 通道构象改变的重要结构域以及药物结合的高亲和力位点,逐步奠定了hERG 钾通道在心脏动作电位的重要角色。近来,hERG 冷冻电镜结构显示出的结构细微差异,提示了门控机制可能涉及的新观点以及药物高敏感性的分子基础[5]。由于hERG 通道各个不同的结构域都可能参与了其构象改变的调节,无论是先天性基因突变还是药物导致通道功能改变,结合定点突变后的功能研究与新的结构差异性认识,以及分子动力学模拟等可以更好地理解潜在的复杂机制[6],为纠正hERG 通道功能丧失带来希望。本文就近年来心脏hERG 钾通道结构及其电压门控调节分子机制的研究新进展作一综述。
1 动作电位中的hERG 钾通道
Ether-a-go-go(EAG)钾通道家族包含ether-ago-go(eag)、eag-like(elk)和eag-related(erg)亚 家族。心脏hERG 通道也称为Kv11.1 通道或ERG1 钾通道,隶属于erg 亚家族,是EAG 钾通道家族成员之一[7-8]。hERG 基因编码了IKr的成孔α 亚基,与KCNE2 编码的辅助β 亚基MiRP1 共同形成完整钾通道发挥作用。hERG 通道蛋白的生物合成顺序依次是:翻译和插入内质网膜,天冬酰胺连接(N-连接)聚糖的添加,α- 亚基的四聚化以及电压传感器、孔域、NH2和COOH 末端的正确或自然折叠[9]。hERG 通道主要在动作电位的平台期及复极化阶段起作用,构成心脏复极化储备的重要成分,是除复极化的钠或钙内向电流外,负责心肌复极化时程最重要的外向离子流[10]。
除了先天性突变导致功能改变外,众多药物的脱靶效应靶向hERG 通道,引起IKr电流减少,由此引发的心脏毒性有时是致命的。hERG 基因的失功能突变使其蛋白表达呈现单倍型不足或显性负效应,使IKr电流部分或完全减少,延长复极化时程;同样地,心脏毒性药物直接结合在hERG 钾通道高敏感芳香族氨基酸残基位点(Y652、F656 等)上产生了直接的通道阻滞效应[11],或者阻碍了通道蛋白的成熟表达使电流减少,这些可表现为心电图的QT 间期延长,如果延长超出正常范围(男性为440 ms,女性为460 ms),临床上称为长QT 综合征(LQTS)[12]。专家共识表明:在先天性LQTS 中,QT 间期的长度为心脏事件(包括心源性猝死)风险的重要预测指标,并且当使用延长QT 间期的药物(如索他洛尔或多非利特)时,QT 间期≥500 ms 时应减少或终止药物使用[13]。QT 间期的过度延长促使早后除极的发生,并可能触发尖端扭转型室性心动过速甚至心室颤动[14]。
2 hERG 钾通道结构
hERG 通道与其他Kv 通道具有结构同源性[15]。不同的是,4 个hERG 亚基在膜上呈环状而非线性排列[16]。IKr通道四聚体的每个亚基包含6 个跨膜片段(S1-S6),N 端Per-Arnt-Sim(PAS)域和C 端环状核苷酸结合域(cNBD)[7,17]。S1-S4 作为电压感应域(VSD),有多个带正电的残基,感受跨膜电压变化,其中尤以S4 最重要。而S1-S3 含一些带负电荷的氨基酸,被认为是整个VSD 的抵消电荷。4 个以正方形排列的跨膜螺旋S5-S6 是构成通道孔区(PD)的重要结构,通过与4 个亚基的中间孔环耦联形成围绕中心传导途径的四聚体结构,并构成离子渗透孔结构域[7,18]。S4 和S5 之间的连接部分称为S4-S5接头,将VSD 感受到的电压变化信息传递到PD,起到重要的桥梁作用(图1)。N 端PAS 域和PAS-Cap一起被称为“Eag 域”。据报道,Eag 域在稳定hERG亚基组装和转运中至关重要[19]。此外,该结构域还参与了hERG 通道门控动力学的调节[20-21]。
近来,电压门控钾通道的冷冻电子显微镜(cryo-EM)结构引起了极大的关注。先是hERG 同源家族Eag1(Kv10.1)结构的出现,该结构去除了C 端非结构化的114 个残基(773~886)。这种高达3.78 A分辨率的结构被称为rEag1Δ,它保持了与全长通道相似的所有特性[15]。之后的hERG cryo-EM 结构(hERGT)删除了两个片段(N 端141-350 和C 端871-1005),剩下的814 个氨基酸残基同样与通道拥有类似的主要门控特性(图1)。hERGT结构的分辨率高达3.8 A,显示出了与先前结构的细微差异,它的S4-S5 接头与rEag1Δ 结构一样,是一个含有5 个残基的短环[5]。不同于Shaker Kv 通道,该结构S4 螺旋仅有5 个正电荷的氨基酸,且前3 个K1、R2和R3 位于胞外,而R4 和R5 在下方,提示以S4 为主的VSD 处于去极化的激活状态[22]。此外,hERGT中的孔区处于开放状态,并且通道中央腔的体积非常小,中央腔周围有4 个深的细长的疏水性口袋,药物敏感性的氨基酸正好排列在这些口袋表面上,经典的hERG 通道阻滞剂阿司咪唑和多非利特在进入狭小的中央腔后嵌入到口袋中,这对于解释药物对hERG 通道的异常敏感性可能有用[5,23]。
cryo-EM 结构提供了完整的通道结构的开创性见解,但其对于通道在胞内的固有结构域的原子分辨率细节的推导是有限的。分辨率为1.5 A 的第1 个hERG 通道高分辨率晶体结构鉴别出了新的盐桥(E807-R863),这并未在cryo-EM 结构中出现,电生理学分析表明该盐桥可能既支持了内在配体的空间组织,又维持了细胞内的复杂界面[24]。
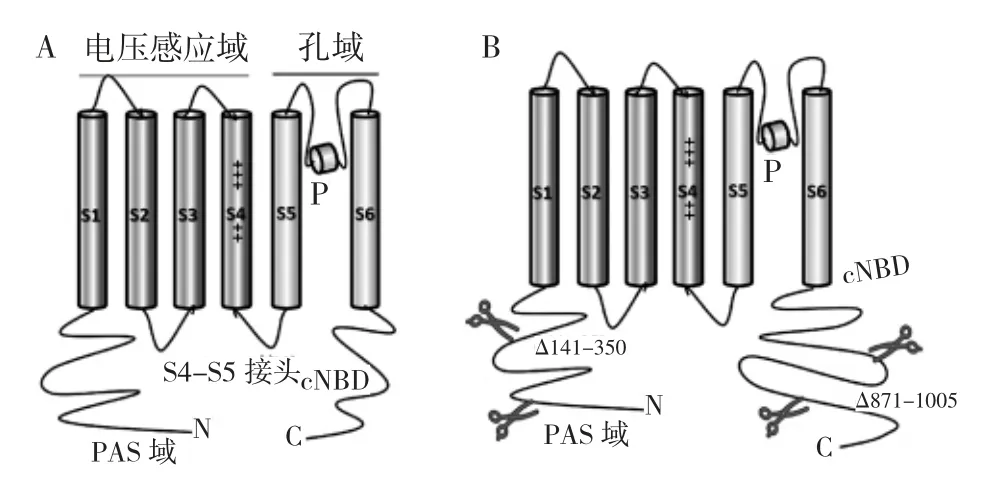
图1 心脏hERG 钾通道在细胞膜上的单个α 亚基(A),冷冻电镜结构删除了N 端(Δ141-350)和C 端(Δ871-1005)部分氨基酸序列(B)
3 hERG 通道电压门控及其分子机制
3.1 hERG 通道电压门控 同其他Kv 通道一样,hERG 通道具有3 种不同的构象,分别是闭合、开放和失活[11,16-17]。但hERG 也有其独特的门控动力学,即快速的失活及从失活中恢复,而激活和去激活则相对缓慢[11,17]。也就是说,hERG 通道的灭活性质比活化更活跃,这导致了其向内整流特性[25]。
在动作电位的早期,hERG 通道缓慢打开,但迅速失活。随着去极化电压的持续降低,通道逐渐从失活中恢复。当膜电位为-40 mV 时,跨膜电流达到峰值。IKr电流在复极化过程中逐步升高,随后是通道缓慢的去激活过程(图2)。可见,通道在整个动作电位时程中经历了激活、失活、再激活及去激活状态,且通道在静息电位以下仍保持很长一段时间的打开状态(200~300 ms),产生了典型的尾电流[11,26]。尾电流的分析和绘制激活曲线对于研究通道打开、关闭和失活的动力学非常有帮助。通道性质的改变会导致激活曲线向左或向右移动,尾电流衰减过程变得更快或更慢。

图2 心脏hERG 钾通道电压门控(动作电位早期,hERG 激活后然后快速失活,随后在复极化时再次快速激活,之后是缓慢的去激活过程产生了经典的尾电流)
3.2 hERG 通道门控的分子机制 hERG 通道不同构象变化的调节十分复杂,因为几乎所有结构域都参与了这种调节。因此,很难阐明门控动力学的确切机制。研究证实:包括C 端和N 端的胞质结构域在hERG 通道门控调节中起关键作用,它们可能通过PAS 域与不同亚基中cNBD 域之间的相互作用而产生效应,称为PAS/cNBD 复合物[17,26-27]。这种不同亚基的不同结构域之间的物理作用,通过进一步的耦联能够产生电活动,是电压门控钾通道的不同构象变化的经典解释。但是,在近来的研究中这种机-电耦联模式遭到了质疑。
3.2.1 激活 hERG 通道的激活过程很慢,其电压阈值为-40 mV 至-30 mV,在+20 mV 至+40 mV 达到平台。缓慢激活的生理学意义是使通道的使用最小化以促进去极化的完成[17]。一般认为,VSD 中的结构重排通过S4-S5 接头与S6 螺旋的胞质末端之间的物理作用转移至PD,从而打开和关闭激活门,称为VSD/PD 耦合机制[7,17-18,28-29]。这种模式的基础是S4 带正电的残基感应了跨膜电场施加的力而发生移动,成为导致孔区构象变化的驱动力[30]。此外,S4的缓慢移动也可能解释了缓慢的激活。然而,切断了S4-S5 接头从而打断了VSD 与PD 的联系并没有改变通道的激活动力学[31]。通过在VSD 与PD 间的S4-S5 接头的不同位点插入荧光非标准氨基酸标记的研究表明:S4-S5 接头运动与S6 运动没有关联,但通道仍正常打开[29]。
hERGT结构同样对VSD/PD 模式提出了质疑。如前所述,S4-S5 接头是一个含有5 个残基的短环,无法充当机械杠杆因而并未进行域交换,它与S6段C 末端之间的相互作用发生在同一亚基中,并不涉及另一个相邻的亚基[5]。但是,即使是在包含有2个α 螺旋的相当长的S4-S5 的小电导钙激活的钾通道中,非域交换的架构仍然存在[32];并且即使没有明显的S4-S5 接头或只有一个短的S4-S5 接头,域交换也可以发生[33]。与经典的Kv 通道相比,这种非域交换结构表明VSD 的运动作为通道开口的机制有所不同。此外,S4 螺旋中的电荷重排表明VSD 处于去极化状态下也可能进一步改变了其对门控特性的影响。基于新的结构差异,研究人员提出了VSD/PD 的另一种模式,表明S4 直接与C 端接头相互作用造成S6 的弯曲和松弛,而并不需要S4-S5接头的作用。S6 的弯曲和松弛是由S4 的不同状态引起的,在VSD 处于去极化状态时,S4-S5 接头与S6 的细胞内部分相互作用从而将S4 的C 端引向C端接头,引起S6 松弛打开通道,相反,超极化状态下的VSD 造成S6 弯曲关闭了孔门[5,15,23]。
综上,VSD/PD 耦合机制并不能简单地解释通道缓慢的激活,虽然新的模式提供了可能的解释,但确切的VSD 的构象状态与激活门控间的关系仍有待证实。并且,如前所述,cryo-EM 对于蛋白质结构外围的分辨率通常较低,这阻碍了对侧链构象的明确鉴定和对通道功能特征的精确建模[9,34]。因此,进一步的分子动力学模拟可能是一种有效的工具来支持上述假说。
3.2.2 失活 hERG 通道缓慢激活后,在复极化阶段出现异常快速的失活过程,在+60 mV 处通道能够在1~2 ms 内失活[17]。hERG 通道的失活本质上是P/C 型的,因为它并不受N 端缺失的影响。与其他K+通道一样,hERG 失活涉及选择性过滤器(SF)中一个或多个位点的K+占位丢失[35]。这种类型的失活对SF 中的离子占有率很敏感,表明失活可能涉及SF 的结构重排。不同于其他Kv 通道,hERG通道位于PD 上的SF 部分残基并不保守,且具有一些轻微的序列差异,这些残基使SF 更容易发生构象变化进而导致失活[36]。功能研究也证实位于SF残基的特定突变可能会改变hERG 通道的失活特性[37]。结合cryo-EM 获得的通道结构现实模型和计算机模拟,将KCNH2 基因组信息与功能结果联系起来,新的研究为位于SF 的功能获得突变N629D(影响失活及离子转运)如何影响K+的选择性渗透提供了新的见解[38]。最近,对S5 螺旋上的灭活减弱I560T突变的研究表明:S5 螺旋的构象干扰很可能通过与孔螺旋的相互作用而与SF 相关联[39]。在分子动力学模拟中,SF 中的几个残基在孔轴中发生了位移,尤其是GFG 基序中的F627[40]。
F627 的位置特殊性在cryo-EM 结构下得到证实,hERGT中F627 的方向是偏移的。Wang 等[5]还构建了非灭活的S631A 突变体的结构hERGTs S631A 来模拟其他Kv 通道的非瞬时失活,结果显示其SF 中F627 的位置同其他Kv 通道相似。F627的独特位置代表了SF 构象的细微差别,提示可能通过调节单个残基引起hERG 快速失活。同时,他们强调SF 的构象变化十分细微,当观察到K+从SF中流出时,它不同于KcsA K+通道那样发生较大的构象变化[5,22]。
3.2.3 去激活 快速的从失活中恢复之后,hERG通道经历了缓慢去激活。去激活代表了hERG 通道的关闭过程,是其重要的标志性特征。去激活的调控非常复杂,并无法用VSD 的缓慢移动来解释。N端Cap 结构域(N-Cap)、PAS 和cNBD 间的相互作用对于调节缓慢去激活十分重要[41-42]。N-Cap 的突变加速了通道的去激活[42],而PAS 和cNBD 之间的直接相互作用决定了缓慢的去激活,特别是在PAS的R56 和cNBD 的D803 之间以及N-Cap 的N12和cNBD 的E788 之间的作用[20]。这些结果表明在去激活的调节过程中,PAS/cNBD 复合物占据着中心地位,而包含N-Cap 和PAS 的Eag 域尤为突出。
hERGT结构也进一步证明N 端确实整合在VSD/PD 界面上,表明N 端PAS 域在缓慢的去激活过程中可能会向质膜移动以改变VSD/PD 的相互作用[43]。最近,研究表明VSD 的弛豫是导致hERG 通道缓慢去激活门控的原因之一[17,44]。弛豫现象是VSD 的固有属性,它是在hERG 通道激活后将激活的VSD 稳定在松弛的构象中。这种弛豫会导致通道激活和去激活路径的能量分离,从而产生磁滞现象进而调节去激活门控[44]。hERG 通道VSD 弛豫的动力学模型也表明VSD 弛豫状态的不稳定可能会加速去激活过程。
调控hERG 通道的去激活门控动力学似乎更加重要,因为无论是通道的阻滞剂还是激活剂,通过作用于相应的结构域改变了这一过程均可能产生致病或治疗效应。而基于更加详细的关于Eag 域、VSD 以及VSD/PD 之间的作用可能有益于开发更加有效的通道激活剂。
4 结语
参与调节心肌细胞动作电位的钾通道种类繁多,hERG 钾通道因其在心肌复极化过程中的重要角色而备受重视。随着研究不断深入,新的hERG 通道结构显示出与既往经典结构的细微差异,结合精确的动力学模型为解释通道的门控动力学机制提供了新的观点。这些成果提供了进一步的证据说明hERG 钾通道在心肌细胞电活动中的重要地位以及药物对该通道的高度亲和力的原因,并且将在开发针对通道阻滞的纠正剂中有所裨益。