中度嗜盐菌S61生防因子分析及其对马铃薯干腐病的防效





摘要:【目的】測定中度嗜盐菌S61对马铃薯干腐病病原菌的抑菌活性及对干腐病的防效,为马铃薯干腐病的生物防治及绿色防控提供科学依据。【方法】以来源于青海察尔汗盐湖的1株中度嗜盐菌S61为材料,采用形态学、生理生化特征及分子生物学方法对菌株S61进行鉴定。通过对峙培养法和马铃薯活体试验,进行菌株S61及其发酵液有机溶剂萃取物抑制马铃薯干腐病病原菌活性测定及对储藏期马铃薯安全性评价。采用平板透明圈法和排油圈法,分别测定菌株S61发酵液分泌抑菌蛋白和产生脂肽类物质的能力。【结果】结合菌株S61的形态特征、生理生化特征和系统发育进化树分析结果,将菌株S61鉴定为特氏盐芽孢杆菌(Halobacillus trueperi)。其发酵液能产生蛋白酶、淀粉酶和纤维素酶,并能产生脂肽类物质。菌株S61及其有机溶剂萃取物对3株马铃薯干腐病病原菌(青9A-4-13、青9A-5-2和65B-2-6)均有不同程度的抑菌活性,其中对青9A-4-13的抑菌活性最强,对峙培养7 d后的抑制率为55.67%。菌株S61发酵液不同浓度(1、5、10和20 mg/mL)正丁醇萃取物对青9A-4-13的抑菌活性最高,抑制率分别为61.50%、63.00%、64.00%和66.00%。菌株S61发酵液及其正丁醇萃取物对马铃薯储藏安全。【结论】中度嗜盐菌S61在体外和马铃薯活体上均对干腐病病原真菌具有抑制作用,其发酵产物的正丁醇萃取物活性最高,并存在生防因子,能产生一些具有抑菌活性的次级代谢产物,具有较好的马铃薯干腐病生物防治潜力。
关键词: 中度嗜盐菌;生防因子;马铃薯干腐病;防效;安全性评价
中图分类号: S435.32;S476 文献标志码: A 文章编号:2095-1191(2021)10-2619-13
Abstract:【Objective】The inhibitory activity and control effect of moderate halophilic bacteria S61 against pathogenic fungi of potato dry rot was determinedto provide a scientific basis for the biological control and green prevention and control of potato dry rot. 【Method】A moderately halophilic strain S61 from Qarhan Salt Lake in Qinghai was used as material and was was identified by morphology, physiological and biochemical characteristics and molecular biology methods. The inhibitory activity of strain S61 and its organic solvent extract from fermentation against potato dry rot pathogens and the safety assessment were determined by confrontation culture method and potato experiment in vivo. The capacity of producing lipopeptides and proteins of strain S61’s fermentation was determined by transparent circle and oil drain ring methods. 【Result】Combining the morphological characteristics, physiological and biochemical characteristics and phylogenetic tree analysis results, the strain S61 was identified as Halobacillus trueperi. Its fermentation could produce protease, amylase, cellulose, and lipopeptides. S61 and its organic solvent extract had different inhibitory activities against 3 potato dry rot pathogenic fungi (Qing 9A-4-13, Qing 9A-5-2 and 65B-2-6). S61 had the highest inhibitory activity against pathogen Qing9A-4-13, with an inhibition rate 55.67% (7 d). Its N-butyl alcohol extract at the different concentrations (1, 5, 10 and 20 mg/mL) had the highest inhibitory activity against pathogen Qing 9A-4-13, with inhibition rates 61.50%, 63.00%, 64.00% and 66.00%, respectively. The strain S61 and its N-butyl alcohol extract were safe for potato in storage. 【Conclusion】The moderate halophilic bacterium S61 has inhibitory activity against potato dry rot pathogenic fungi both in vitro and in vivo. The N-butyl alcohol extract has the highest inhibitory activity. It has biocontrol factors and could produce metabolic products with anti-fungi activity. It proves that S61 has good biocontrol potential in potato dry rot.
Key words: moderate halophilic bacterium; biocontrol factor; potato dry rot; control effect; safety assessment
Foundation item: General Project of Qinghai Natural Science Foundation(2019-ZJ-914); Major Science and Techno-logy Project of Qinghai(2019-NK-A1); Special Funds for National Modern Agricultural Industrial Technology System (CARS-10)
0 引言
【研究意义】马铃薯干腐病是马铃薯贮藏期主要真菌性病害之一,由多种镰刀菌(Fusarium spp.)的种或变种引起(Delaplace et al.,2008;李金花等,2011)。马铃薯干腐病对马铃薯贮藏期造成的产量损失最高可达60%(Bojanowski et al.,2013;雷娅红等,2016;许苗等,2018)。采用化学防治手段对马铃薯进行防腐保鲜处理是当前减少马铃薯腐烂损失的重要手段,但长期使用化学药剂防治会造成菌株抗药性、环境污染和农药残留等问题(Romualdo et al.,2010;王丽丽等,2016;Krüsemann et al.,2017;孙清华等,2019)。目前,多利用具有安全无毒、不污染环境和不易产生抗药性等优点的生物防治手段进行植物病害防治(Gerbore et al.,2014;Krüsemann et al.,2017)。因此,生物防治尤其是利用微生物等天然资源及其产生的天然产物对马铃薯干腐病进行防治,对马铃薯产业的健康发展具有重要意义。【前人研究进展】目前,有关马铃薯干腐病拮抗菌的研究主要集中在拮抗菌的筛选及活性物质的抑菌活性研究方面。马铃薯干腐病拮抗菌筛选结果显示,生防菌大部分为木霉菌(Trichoderma spp.)(崔岩,2013)、芽孢杆菌(Bacillus spp.)、放线菌(Actinomyces spp.)(孙现超等,2013;牛世全等,2017)和假单胞菌(Pseudomonas spp.)(Ramlawi et al.,2021)。王爱军(2013)研究发现,萎缩芽孢杆菌(B. atrophaeus)能同时抑制马铃薯干腐病菌接骨木镰刀菌(F. sambucinum)和茄病镰刀菌(F. solani),并采用AFLP技术对其遗传多样性进行了研究;贾鹏莉等(2020)研究发现贝莱斯芽孢杆菌(B. velezensis)的正丁醇萃取物对马铃薯干腐病病原菌尖孢镰刀菌(F. oxysporum)的抑菌活性高达80.07%,同时该拮抗菌能产生蛋白酶、淀粉酶、纤维素酶及脂肽类物质;胡英杰等(2021)通过生长速率法测定发现,地衣芽孢杆菌(B. licheniformis)的正丁醇萃取物对马铃薯干腐病病原菌的抑制率高达78.57%;贾鹏莉和沈硕(2021)通过平板对峙法及稳定性评价发现,暹罗芽孢杆菌(B. siamensis)和贝莱斯芽孢杆菌对马铃薯干腐病病原镰刀菌具有较高的抑菌活性。在次级代谢产物的研究方面,发现来源于蓝桉的蓝桉叶精油及其主要单体组分能抑制马铃薯干腐病致病菌菌丝生长,其对黄色镰刀菌(F. culmorum)和拟枝镰刀菌(F. sporotrioides)的抑制效果更好(韩峰,2017);来源于真菌寡雄腐霉(Pythium oligandrum)的寡雄蛋白(Oligandrin)对马铃薯块茎干腐病的扩展有一定控制效果,其能提高马铃薯块茎组织苯丙烷代谢相关的酶活及相关基因的表达,从而提高马铃薯块茎的抗病性(刘筱等,2017);壳聚糖能抑制尖孢镰刀菌的生长和孢子萌发,增强马铃薯对该病原菌的抗性(Ren et al.,2021)。在嗜盐菌研究方面,由于嗜盐菌在特殊盐碱生境下生长,其中必然存在着特殊活性的次级代谢产物(任培根和周培瑾,2003;Mathabatha,2010;谈峰等,2021)。目前国内外有关来源于盐湖的嗜盐菌研究主要包括新菌种的发现及鉴定、群落结构及多样性分析、耐盐碱能力及防治植物病害等。王钱福(2007)从青岛和甘肃河西走廊地区的高盐环境样品中分离到中度和极端嗜盐菌菌株,并对分离到的菌株进行形态学、生理生化特征、细胞化学组分分析及16S rDNA序列分析等多相分类学研究。沈硕(2017)从察尔汗盐湖样品中分离到中度嗜盐菌421株,并对其群落结构和多样性进行分析,发现该盐湖中度嗜盐菌具有丰富的遗传多样性,存在可分离的新物种。王艳红等(2017)成功克隆了中度嗜盐菌Halobacillus Y5的甘氨酸甜菜碱转运蛋白opu D基因,对其结构及蛋白功能进行分析,验证了该菌的耐盐碱特性。【本研究切入点】目前,针对马铃薯干腐病拮抗菌的研究多为从马铃薯薯块病样病健交界处分离得到拮抗菌,而且都为对马铃薯干腐病病原菌的体外活性测定;针对嗜盐菌的研究方面多集中在嗜盐菌的多样性、群落结构及嗜盐机制方面。有关利用特殊环境微生物中的中度嗜盐菌及其次级代谢产物进行马铃薯窖藏病害生物防治、以及利用生防菌发酵液有机溶剂萃取物及次级代谢产物抑制马铃薯干腐病病原菌的马铃薯活体防效及安全性评价的研究尚未见报道。【拟解决的关键问题】通过体外对峙培养法与马铃薯活体试验相结合,对来源于青海察尔汗盐湖的1株中度嗜盐菌S61及其发酵液有机溶剂萃取物抑制马铃薯干腐病病原菌的活性和干腐病活体防效进行评价,对生防因子进行分析,旨在寻找高效、低毒的马铃薯干腐病生防菌剂、生防制剂及其先导化合物,以期为马铃薯干腐病的生物防治及绿色防控提供科学依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 生防菌 中度嗜盐菌S61分離自青海察尔汗盐湖(东经99°02′~99°02′,北纬36°18′~36°45′)湖水样品,由青海省农林科学院微生物研究室分离并保存。
1. 1. 2 植物病原真菌 马铃薯干腐病病原真菌青9A-4-13(F. acuminatum)和青9A-5-2(F. solani)分离自马铃薯青薯9号薯块病样,65B-2-6(F. tricinctum)分离自马铃薯下寨65薯块病样。供试菌株均由青海省农林科学院微生物研究室分离并保存。
1. 1. 3 马铃薯品种 供试马铃薯品种为青薯2号,由青海省农林科学院生物技术研究所提供。
1. 1. 4 培养基 中度嗜盐菌S61分离培养于ATCC 213改良培养基(沈硕,2017),所有马铃薯干腐病病原菌培养于PDA培养基(沈硕和王舰,2013)。
1. 2 试验方法
1. 2. 1 菌株S61形态学与生理生化特征鉴定 根据《伯杰氏细菌鉴定手册》(Buchanan and Gibbons,1999)和《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)对菌株S61进行形态学和生理生化特征鉴定。
1. 2. 2 菌株S61可利用碳源分析 采用Biolog细菌鉴定系统,菌株S61经革兰氏染色和酶活性测定后,在Biolog微生物鉴定系统专用的平板培养基(Biolog,USA)上划线培养12 h,取单菌落用稀释液稀释至合适浊度,透光率为90%~98%,将稀释液加至Biolog全自动生化鉴定板中,每孔加100 μL,30 ℃培养20 h后上机读数,记录读数结果,并进行菌株S61对95种碳源的利用特征分析。
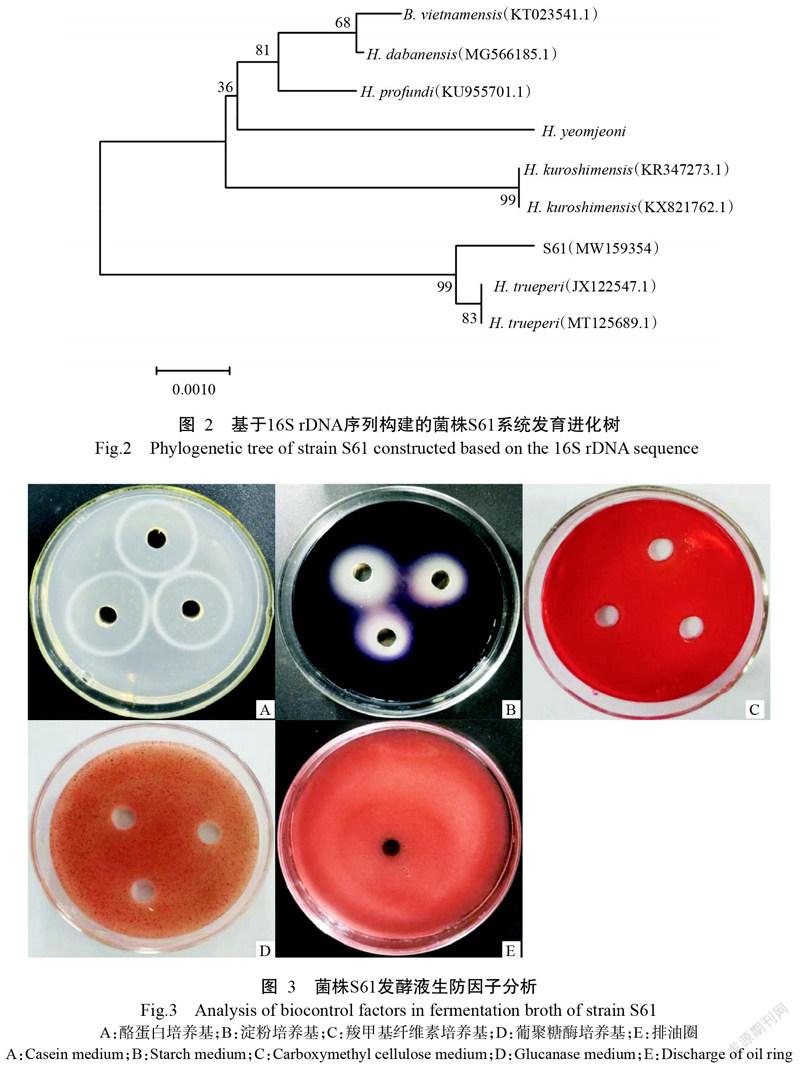
1. 2. 3 菌株S61分子生物学鉴定 菌株S61的DNA提取根据生工生物工程(上海)股份有限公司的柱式细菌DNA提取试剂盒的程序操作。选择细菌16S rDNA通用引物F27(5'-AGAGTTTGATCCTGGCT CAGG-3')和P1541(5'-AAGGAGGTGGTGATCCA GCCGCA-3')。PCR反应体系25.0 μL:10×Buffer 2.5 μL,dNTP(10 mmol/L) 2.0 μL,DNA模板1.0 μL,上、下游引物各1.0 μL,Taq DNA聚合酶0.2 μL,無菌水补足至25.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 40 s,55 ℃ 45 s,72 ℃ 80 s,进行35个循环;72 ℃延伸10 min。反应结束后,取5.0 μL PCR产物进行琼脂糖凝胶电泳检测,回收产物送至生工生物工程(上海)股份有限公司测序。将得到的16S r DNA序列登录NCBI网站通过BLAST进行序列比对,运用MEGA 7.0中的邻接法(Neighbor-joining,NJ)(Bootstrap值为1000次)构建菌株S61 16S rDNA序列的系统发育进化树。
1. 2. 4 菌株S61发酵液制备及其萃取物制备 将菌株S61接种至装瓶量为400 mL的ATCC213改良液体培养基中,置于37 ℃ 180 r/min恒温摇瓶柜中振荡培养5~7 d,收集发酵液,然后将其经布氏漏斗减压过滤去除菌体,得到去菌体发酵液,备用。
取去菌体发酵液600 mL于3000 mL的分液漏斗中,依次用等体积的氯仿、乙酸乙酯和正丁醇对发酵液进行萃取,萃取液经旋转蒸发得萃取物;将萃取物预溶于二甲基亚砜(≤0.1%),并用无菌水分别将其配成质量浓度为1.00、5.00、10.00和20.00 mg/mL的萃取物溶液,溶液经0.22 μm微孔滤膜抽滤,备用。
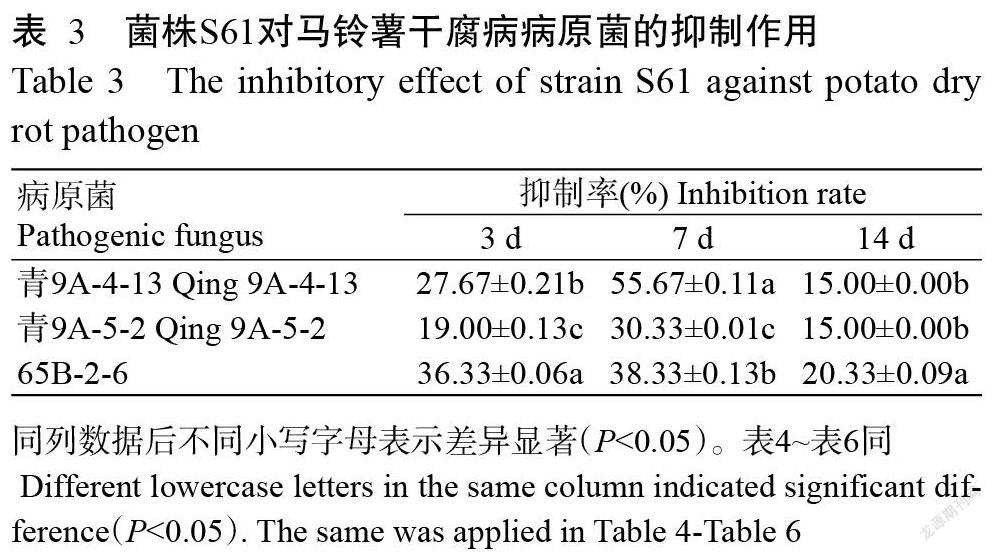
1. 2. 5 菌株S61生防因子分析 采用平板透明圈法(潘晓梅等,2019),用直径6 mm的打孔器分别在淀粉、酪蛋白、葡聚糖酶和羧甲基纤维素培养基上打取3个孔,向每孔中加入菌株S61发酵液100 μL,每个培养基处理设3次重复。将培养基平板置于30 ℃培养箱中培养48~72 h,向淀粉酶培养基中加入2 mL碘液,使碘液均匀覆盖平板,静置10 min,观察平板上出现透明圈情况;同时观察酪蛋白酶、葡聚糖酶和羧甲基纤维素培养基平板出现透明圈的情况。
采用排油圈法(魏新燕等,2017),取适量橄榄油加入苏丹Ⅲ染色剂混匀,向直径为9 cm的培养皿中加入60 mL纯水,并缓慢加入染色后的橄榄油,水面形成一层油膜,向培养皿油膜中心持续滴加菌株S61发酵液,观察是否形成排油圈,检测菌株S61发酵液是否有脂肽类物质生成。
1. 2. 6 菌株S61及其萃取物抑菌活性测定 采用平板对峙法(Sadfi et al.,2001),在直径9 cm的培养皿底部用十字交叉法划线,并以交叉点为中心,在中心点接种菌株S61,在距离中心点2.5 cm处呈对称分布的4个点接种直径为5 mm的同一种病原菌菌饼。每个培养皿为1个处理,每处理3次重复,以只接种病原菌的培养皿为对照。7 d后测定菌株S61的抑菌活性。计算公式:抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
采用牛津杯法(吴海霞和田志芳,2020)测定发酵液有机溶剂萃取物的抑菌活性。计算公式:抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1. 2. 7 菌株S61发酵液及其萃取物对活体马铃薯上干腐病病原菌的抑制效果和马铃薯储藏的安全性评价 参照Sadfi等(2001)的方法,首先将活化后的菌株S61接种于ATCC213改良液体培养基中,在37 ℃ 200 r/min的摇瓶柜中振荡培养2 d,收获发酵液,用血球计数板将菌株S61发酵液的浓度调至1.0×108 CFU/mL;将3株供试马铃薯干腐病病原菌接种于PDB液体培养基中,在28 ℃ 200 r/min的摇瓶柜中振荡培养2 d,收获发酵液,用血球计数板分别将3株病原菌发酵液的孢子浓度调整为1.0×107 个/mL。然后在已消毒处理的马铃薯上用直径为5 mm的打孔器打造2个深3 mm的孔口,每个孔口先接入40 μL病原菌发酵液,随后接入40 μL菌株S61发酵液,将接种完成的马铃薯用封口膜包扎放入自封袋中,并在28 ℃、相对湿度75%左右的恒温培养箱中培养14 d;以接病原菌发酵液和等量无菌水的处理作为阳性对照,以接等量无菌水和菌株S61发酵液的处理为阴性对照,以只接等量无菌水的处理为空白对照。每处理接种1个马铃薯,重复3次。
菌株S61发酵液萃取物对活体马铃薯上干腐病防效测定方法与发酵液防效测定方法一致。
培养14 d后,分别测定发酵液和萃取物溶液处理下马铃薯块茎的坏果率、病斑深度及抑制率,并进行菌株S61发酵液及其萃取物对贮藏期马铃薯的安全性评价(李永才等,2009;刘筱等,2017)。计算公式:抑制率(%)=LP-LA/LP×100;其中,LP=未经中度嗜盐菌处理的马铃薯块茎原质量-镰刀菌侵染后质量,LA=中度嗜盐菌处理后的马铃薯块茎原质量-镰刀菌侵染后质量。马铃薯储藏安全性评价中无需计算抑制率。
1. 3 统计分析
试验数据运用SPSS 19.0进行统计分析,应用Duncan’s新复极差法进行各处理间的差异显著性分析。
2 结果与分析
2. 1 菌株S61的鉴定
2. 1. 1 形态学鉴定 如图1所示,菌株S61菌落呈乳黄色,不透明,表面褶皱,边缘不规则;革兰氏染色后镜检呈蓝紫色,杆状,表明该菌株为阳性菌。
2. 1. 2 生理生化特征 菌株S61过氧化氢酶、氧化酶、β-半乳糖苷酶、硝酸盐还原、明胶液化、淀粉水解和酪蛋白测定呈阳性,精氨酸双水解酶、精氨酸脱羧酶、H2S产生、水杨酸、吲哚试验、溶血试验、厌氧试验和脲酶呈阴性(表1)。
2. 1. 3 菌株S61可利用碳源 采用Biolog细菌鉴定系统进行菌株S61对95种碳源利用情况分析,结果见表2。
2. 1. 4 分子生物学鉴定 将菌株S61测序得到的16S rDNA序列提交至NCBI数据库,登录号为MW 159354。经BLAST序列比对分析,菌株S61与H. trueperi(MT125689.1)和H. trueperi(JX122547.1)的亲缘关系最近,同源性达99.78%。使用MEGA 7.0中的邻接法,以菌株S61与其他同源性相近的菌株16S rDNA序列构建系统发育进化树,结果(图2)显示,菌株S61的16S rDNA序列与H. trueperi(MT125689.1)和H. trueperi(JX122547.1)聚类为同一分支。结合菌株S61的形态特征、生理生化特征和系统发育进化树结果,将菌株S61鉴定为特氏盐芽孢杆菌(H. trueperi)。
2. 2 菌株S61生防因子分析
采用透明圈法测定菌株S61发酵液的产酶能力,结果(图3)显示,菌株S61发酵液在酪蛋白培养基(图3-A)、淀粉培养基(图3-B)和羧甲基纤维素培养基(图3-C)上均产生了明显的酶解圈,其中在酪蛋白培养基和淀粉培养基上酶解圈边缘界限清晰;在酪蛋白培养基上酶解圈明显较大;在羧甲基纤维素培养基上酶解圈边缘界限模糊。说明菌株S61发酵液产蛋白酶较多,淀粉酶次之。菌株S61发酵液在葡聚糖酶培养基上未产生透明圈(图3-D),说明菌株S61发酵液不具有产葡聚糖酶的能力。
采用排油圈法测定菌株S61发酵液是否具有产生表面活性功能的脂肽类物质的能力,结果(图3-E)显示,菌株S61发酵液产生了明显的排油圈,但排油圈较小,说明菌株S61发酵液能产少量脂肽类物质。
2. 3 菌株S61抑菌活性测定结果
由表3可知,菌株S61与3株马铃薯干腐病病原菌在培养皿中分别对峙培养3 d后,对青9A-4-13、青9A-5-2和65B-2-6的抑制率分别27.67%、19.00%和36.33%;培养7 d后,抑制率升高,分别为55.67%、30.33%和38.33%;培养14 d后,对3株病原菌的抑制效果相当,抑制率分别为15.00%、15.00%和20.33%。由此可见,培养7 d后,菌株S61对病原菌的抑制效果最强,其中对青9A-4-13的抑制活性最好(图4)。
2. 4 菌株S61发酵液萃取物的抑菌活性测定结果
由表4可知,菌株S61的正丁醇萃取物对3株马铃薯干腐病病原菌的抑制活性最高,乙酸乙酯萃取物活性次之,氯仿萃取物活性最低。就正丁醇萃取物而言,1和5 mg/mL萃取物仅对青9A-4-13具有高抑菌活性,抑制率分别为61.50%和63.00%;10 mg/mL萃取物对青9A-4-13和青9A-5-2具有高抑菌活性,抑制率分别为64.00%和68.50%;20 mg/mL萃取物对青9A-4-13、青9A-5-2和65B-2-6均具有较高的抑菌活性,抑制率分別为66.00%、70.00%和58.00%。就乙酸乙酯萃取物而言,5和10 mg/mL萃取物仅对青9A-4-13具有较高的抑菌活性,抑制率分别为58.00%和59.00%;20 mg/mL萃取物对青9A-4-13和65B-2-6具有较高的抑菌活性,抑制率分别为61.00%和56.50%。就氯仿萃取物而言,仅10和20 mg/mL萃取物对青9A-4-13具有较高的抑菌活性,抑制率分别为59.00%和67.00%。
由此可见,3种不同的菌株S61发酵液萃取物对青9A-4-13的抑菌活性最高;同时,正丁醇和乙酸乙酯萃取物对3株马铃薯干腐病病原菌均具有不同的抑菌活性,且正丁醇萃取物的抑菌活性更高。
2. 5 菌株S61发酵液对活体马铃薯上干腐病病原菌的抑制效果
由表5可知,菌株S61发酵液对活体马铃薯上干腐病病原菌青9A-4-13的抑菌活性最高,坏果率为0.89%,病斑深度为1.92 cm,抑制率达76.33%;对65B-2-6的抑菌活性次之,抑制率为65.53%;对青9A-5-2的抑菌活性最弱,抑制率为44.67%。
2. 6 菌株S61发酵液萃取物对活体马铃薯上干腐病病原菌的抑制效果
由表6可知,菌株S61发酵液萃取物对活体马铃薯上干腐病病原菌有明显的抑制活性,其中对青9A-4-13具有高抑菌活性,抑制率为62.51%~85.50%;对65B-2-6的抑菌活性次之,抑制率为49.28%~81.78%;对青9A-5-2的抑菌活性最低,抑制率为38.30%~64.53%。此外,菌株S61发酵液的正丁醇萃取物对青9A-4-13和65B-2-6的抑菌活性最高,各供试浓度下对2株病原菌的抑制率均高于60.00%,浓度为10和20 mg/mL的正丁醇萃取物对2株病原菌的抑制率均高于80.00%。同时,浓度为10和20 mg/mL的正丁醇和乙酸乙酯萃取物作用下的坏果率和病斑深度均较低。
2. 7 菌株S61发酵液及其有机溶剂萃取物对马铃薯储藏的安全性评价
由表7可知,马铃薯接种青9A-4-13后,经菌株S61发酵液及其正丁醇萃取物处理,马铃薯表现出一定程度的失重,但马铃薯块茎创伤处无任何病害症状,病斑深度及发病率均为零。说明菌株S61发酵液及其正丁醇萃取物对马铃薯储藏安全。
3 讨论
中度嗜盐菌特殊的生存环境使其具有极为特殊的生理结构和代谢机制,并且还产生了许多具有特殊功能的天然活性物质,是一类具有生物技术潜能的自身利益资源,因而其应用已引起人们的广泛关注。目前对中度嗜盐菌应用方面的研究主要集中在对其产生的酶、一些功能性分子和大分子多聚物以及生物环保等方面(冯二梅等,2009)。除此之外,也有学者对来源于青海察尔汗盐湖的中度嗜盐菌萃取物对辣椒疫霉菌的抑菌活性进行了研究(韩峰,2017)。本研究利用青海察尔汗盐湖的中度嗜盐菌S61及其发酵液萃取物对马铃薯干腐病的抑制作用进行了评价,结果表明,菌株S61及其发酵液萃取物对3株马铃薯干腐病病原菌具有不同程度的抑制作用;在对马铃薯块茎的安全性评价中,马铃薯接种病原菌青9A-4-13后,经菌株S61发酵液及其正丁醇萃取物处理,马铃薯块茎创伤处无任何病害症状,菌株S61及其发酵液萃取物对马铃薯储藏安全。可见菌株S61具有作为马铃薯储藏期间干腐病生防制剂的潜力。关于其发酵液提取物中活性物质的分离、结构鉴定以及寻找具有高效抑制马铃薯干腐病病害的化合物是下一步研究工作的重点。
截至目前,大量的国内外学者将芽孢杆菌作为多种植物病原真菌潜在的生防制剂在培养皿中和生物活体上进行了研究(Sadfi et al.,2002;van den Boogert and Luttikholt,2004;王颖等,2014;Chen et al.,2016;程欢欢等,2019)。本研究对中度嗜盐菌S61进行了生理生化鉴定及基于16S rDNA序列分析的分子生物学鉴定,将菌株S61鉴定为特氏盐芽孢杆菌。大量研究显示,芽孢杆菌中的短小芽孢杆菌可对小麦根腐病病原菌(崔云龙等,1995)、番茄细菌性青枯病(连玲丽等,2009)、大豆疫病(曹舜,2015)、烟草赤星病菌、黑胫病菌和白粉病菌(王静等,2010,2015)等多种植物病害及病原物具有生防作用;简单芽孢杆菌对根结线虫和胞囊线虫的生防作用显著(刘冬梅等,2006;李永才等,2009)。但有关特氏盐芽孢杆菌在生物防治方面的研究还处于空白状态;而本研究中特氏盐芽孢杆菌S61及其发酵液萃取物对3种不同马铃薯干腐病病原菌均有一定的抑制作用,为开发防治植物病害的新型生物源农药打下基础。
菌株S61在体外对峙培养和马铃薯活体试验中均对干腐病病原菌表现出明显的抑制作用,经生理生化试验发现可产生过氧化氢酶、氧化酶、β-半乳糖苷酶、硝酸盐还原酶、淀粉水解酶和酪蛋白酶等多种酶活性;同时,其发酵产物的3种不同有机溶剂萃取物在体外和马铃薯活体试验中对干腐病病原菌均表现出一定的抑制作用,其中,正丁醇萃取物活性最高。由此可见,菌株S61会产生一些具有抑菌活性的次级代谢产物,如抗生素(Korsten,1995)、生物表面活性剂(梅雨薇等,2020)、酶类物质(Sadfi et al.,2001;刘邮洲等,2017)、嗜铁素(Zhang et al.,2016)和酯肽类(Isabel et al.,2015;魏新燕等,2017;车建美等,2017)等。此外,菌株S61发酵液及其萃取物在体外和马铃薯活体试验中对马铃薯干腐病病原菌的抑菌活性相当,说明生防制剂的有效性通常受到生防菌和病原菌类型、寄主植物对病原菌的抗性以及环境等多种因素的影响(Recep et al.,2009)。后续课题组将进一步探究菌株S61的活性组分对干腐病病原菌的相关生防作用机制,以期为生防菌剂、生防制剂及其先导化合物的开发提供理论依据和技术支持。
4 结论
中度嗜盐菌S61在体外和马铃薯活体上均对干腐病病原菌具有抑制作用,其发酵产物的正丁醇萃取物活性最高,并存在生防因子,能产生一些具有抑菌活性的次级代谢产物,具有较好的马铃薯干腐病生物防治潜力。
参考文献:
曹舜. 2015. 短小芽孢杆菌BS-4菌株对大豆疫病的生防作用及其机制研究[D]. 合肥:安徽农业大学. [Cao S. 2015. Biological control and mechanism of Bacillus pumilus strain BS-4 against soybean blight(Phytophthorasojae)[D]. Hefei:Anhui Agriculture University.]
車建美,刘波,陈冰冰,刘国红,葛慈斌,蓝江林. 2017. 短短芽胞杆菌产抗菌物质——羟苯乙酯发酵培养基的优化[J]. 中国生物防治学报,33(2):248-257. [Che J M,Liu B,Chen B B,Liu G H,Ge C B,Lan J L. 2017. Medium optimization for the production of antimicrobial ethylparaben from Brevi bacillus brevis FJAT-0809-GLX using response surface methodology[J]. Chinese Journal of Biological Control,33(2):248-257.] doi:10.16409/j.cnki.2095-039x.2017.02.016.
程欢欢,余水,姚伟伟,李忠,彭丽娟,丁海霞. 2019. 辣椒炭疽病生防芽孢杆菌的筛选及田间防效[J]. 河南农业大学学报,53(4):568-573. [Cheng H H,Yu S,Yao W W,Li Z,Peng L J,Ding H X. 2019. Screening of antagonistic Bacillus strains and control effect against pepper anthracnose in field trial[J]. Journal of Henan Agricultural University,53(4):568-573.] doi:10.16445/j.cnki.1000-2340.2019. 04.012.
崔岩. 2013. 马铃薯干腐病与黑痣病菌拮抗木霉菌的筛选及木霉菌遗传多样性分析[D]. 兰州:甘肃农业大学. [Cui Y. 2013. Screening of antagonistic Trichoderma strains against pathogens of Fusarium dry rot and black scurf in potato in Gansu and its analysis of genetic diversity[D]. Lanzhou:Gansu Agricultural University.]
崔云龙,姬金红,衣海青. 1995. 短小芽孢杆菌D82对小麦根腐病原菌拮抗的研究[J]. 中国生物防治,11(3):114-118. [Cui Y L,Ji J H,Yi H Q. 1995. Antagonism of Bacillus pumillus D82 to Helminthosporium sativum,a common root rot pathogen of wheat[J]. Chinese Journal of Biological Control,11(3):114-118.] doi:10.16409/j.cnki. 2095-039x.1995.03.005.
东秀珠,蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京:科学出版社. [Dong X Z,Cai M Y. 2001. Common bacterial system identification manual[M]. Beijing:Science Press.]
冯二梅,宿红艳,王磊. 2009. 中度嗜盐菌的研究进展[J]. 安徽农业科学,37(31):15125-15126. [Feng E M,Su H Y,Wang L. 2009. Reseach progress of moderately halophilic bacteria[J]. Anhui Agriculture Science,37(31):15125-15126.] doi:10.13989/j.cnki.0517-6611.2009.31. 005.
韩峰. 2017. 蓝桉精油的高效分离及对马铃薯干腐病镰刀菌抑制作用的研究[D]. 哈尔滨:东北林业大学. [Han F. 2017. Efficient separation of essential oil from Eucalyptus globulus and the study of inhibitory effect of potato Fusarium dry rot[D]. Harbin:Northeast Forestry University.]
胡英杰,沈硕,贾鹏莉,陈菲儿. 2021. 中度嗜盐菌抑制马铃薯干腐病病原菌活性的筛选及活性菌株的鉴定[J]. 青海大学学报,39(1):24-30. [Hu Y J,Shen S,Jia P L,Chen F E. 2021. Screening of moderate halophiles against the pathogen activity of potato dry rot and identification of active strains[J]. Journal of Qinghai University,39(1):24-30.] doi:10.13901/j.cnki.qhwxxbzk.2021.01.004.
賈鹏莉,沈硕. 2021. 拮抗马铃薯干腐病病原菌活性菌株的筛选及鉴定[J]. 青海大学学报,39(2):34-41. [Jia P L,Shen S. 2021. Screening and identification of active strains against the pathogen of potato dry rot[J]. Journal of Qing-hai University,39(2):34-41.] doi:10.13901/j.cnki.qhwxxbzk.2021.02.005.
贾鹏莉,沈硕,胡英杰. 2020. 一株马铃薯干腐病拮抗菌芽孢杆菌的筛选、鉴定及生防因子初探[J]. 福建农业学报,35(12):1336-1345. [Jia P L,Shen S,Hu Y J. 2020. Screening,identification,and preliminary analysis on antagonistic Bacillus sp. against potato dry rot[J]. Fujian Journal of Agricultural Sciences,35(12):1336-1345.] doi:10.19303/j.issn.1008-0384.2020.12.007.
雷娅红,况卫刚,郑春生,李秀璋,高文娜,李春杰. 2016. 基于DNA条形码技术对镰刀菌属的检测鉴定[J]. 植物保护学报,43(4):544-551. [Lei Y H,Kuang W G,Zheng C S,Li X Z,Gao W N,Li C J. 2016. Detection and identification of the genus Fusarium by DNA barcoding[J]. Journal of Plant Protection,43(4):544-551.] doi:10.13802/j.cnki.zwbhxb.2016.04.003.
李金花,王蒂,柴兆祥,Burgess L W. 2011. 甘肃省马铃薯镰刀菌干腐病优势病原的分离鉴定[J]. 植物病理学报,41(5):456-463. [Li J H,Wang D,Chai Z X,Burgess L W. 2011. Isolation and identification of the dominant pathogens causing potato Fusarium dry rot in Gansu Province[J]. Acta Phytopathologica Sinica,41(5):456-463.] doi:10.13926/j.cnki.apps.2011.05.002.
李永才,毕阳,胡洁,张春园. 2009. 真菌菌丝细胞壁提取物对马铃薯块茎组织抗干腐病的诱导效应[J]. 西北植物学报,29(4):749-753. [Li Y C,Bi Y,Hu J,Zhang C Y. 2009. Induced resistance in potato tuber tissue against Fusarium sulphureum infection by hyphal cell wall extract from Trichothecium roseum[J]. Acta Botanica Boreali-Occidentalia Sinica,29(4):749-753.] doi:10.3321/j.issn:1000- 4025.2009.04.016.
连玲丽,谢荔岩,郑璐平,林奇英. 2009. 短小芽孢杆菌EN16诱导番茄对细菌性青枯病的抗性[J]. 福建农林大学学报(自然科学版),38(5):460-464. [Lian L L,Xie L Y,Zheng L P,Lin Q Y. 2009. Induced resistance to bacterial wilt of tomato by Bacillus pumilus strain EN16[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition),38(5):460-464.] doi:10.13323/j.cnki.j.fafu (nat.sci.).2009.05.012.
刘冬梅,李理,杨晓泉,梁世中. 2006. 用牛津杯法测定益生菌的抑菌活力[J]. 食品研究与开发,27(3):110-111. [Liu D M,Li L,Yang X Q,Liang S Z. 2006. Determination of the antimicrobial activity of probiotic by oxford plate assay system[J]. Food Research and Development,27(3):110-111.] doi:10.3969/j.issn.1005-6521.2006.03.044.
刘筱,潘静宇,李永才,杨兰,高春丽,毕阳. 2017. 寡雄蛋白(Oligandrin)处理对马铃薯块茎干腐病及苯丙烷代谢的影响[J]. 食品工业科技,38(6):297-302. [Liu X,Pan J Y,Li Y C,Yang L,Gao C L,Bi Y. 2017. Effects of Oligandrin treatment on dry rot and phenylpropanoid pathway metabolism of potato tubers[J]. Science and Technology of Food Industry,38(6):297-302.] doi:10.13386/j.issn1002-0306.2017.06.056.
刘邮洲,梁雪杰,乔俊卿,刘永锋,邵明灿. 2017. 梨果贮藏期病害拮抗细菌的筛选、鉴定和评价[J]. 中国生物防治学报,33(1):121-127. [Liu Y Z,Liang X J,Qiao J Q,Liu Y F,Shao M C. 2017. Screening,identification and evalua-tion of antagonistic bacteria for the control of pear ring rot and anthracnose during storage[J]. Chinese Journal of Biological Control,33(1):121-127.] doi:10.16409/j.cnki. 2095-039x.2017.01.017.
梅雨薇,楊子云,于樊,龙旭伟. 2020. 生物表面活性剂脂肽的发酵生产及抑菌应用研究进展[J]. 中国生物工程杂志,40(5):105-116. [Mei Y W,Yang Z Y,Yu F,Long X W. 2020. Recent progress on fermentation and antibacterial applications of surfactin[J]. China Biotechnology,40(5):105-116.] doi:10.13523/j.cb.1912023.
牛世全,李渭娟,李海云,惠娜娜,龙洋. 2017. 河西走廊盐碱土壤中抗马铃薯干腐病放线菌的筛选鉴定[J]. 西北师范大学学报(自然科学版),53(2):94-98. [Niu S Q,Li W J,Li H Y,Hui N N,Long Y. 2017. Screening of Actinomyces on antagonism to Fusariun spp. isolated from saline-alkali soils in Hexi corridor[J]. Journal of Northwest Normal University(Natural Science),53(2):94-98.] doi:10.16783/j.cnki.nwnuz.2017.02.017.
潘晓梅,李昭煜,石晓玲,林胜红,李佳佳,田永强. 2019. 番茄灰霉生防菌XF的筛选、鉴定及生防因子的初步探索[J]. 西北农业学报,28(11):1888-1895. [Pan X M,Li Z Y,Shi X L,Lin S H,Li J J,Tian Y Q. 2019. Screening,identification and biocontrol effects of antagonistic bacterial strain XF and preliminary exploration of biocontrol factors[J]. Acta Agriculturae Boreali-occideotalis Sinica,28(11):1888-1895.] doi:10.7606/j.issn.1004-1389.2019. 11.018.
任培根,周培瑾. 2003. 中度嗜盐菌的研究进展[J]. 微生物学报,43(3):427-431. [Ren P G,Zhou P J. 2003. Reseach progress of moderately halophilic eubacteria[J]. Acta Microbiologica Sinica,43(3):427-431.] doi:10.13989/j.cnki.0517-6611.2009.31.005.
沈硕. 2017. 青藏高原察尔汗盐湖地区可培养中度嗜盐菌的群落结构与多样性[J]. 微生物学报,57(4):490-499. [Shen S. 2017. Community structure and diversity of culturable moderate halophilic bacteria isolated from Qrhan salt lake on Qinghai-Tibet plateau[J]. Acta Microbiologica Sinica,57(4):490-499.] doi:10.13343/j.cnki.wsxb. 20160232.
沈硕,王舰. 2013. 青海盐湖地区嗜盐菌的分离纯化及抑制植物病原菌的活性初探[J]. 广东农业科学,40(1):79-81. [Shen S,Wang J. 2013. Isolation,petrifaction and inhibitory activity against plant pathogenic fungi of halophilic strains from Qinghai salt lake[J]. Guangdong Agriculture Science,40(1):79-81.] doi:10.16768/j.issn.1004-874x. 2013.01.041.
孙清华,任向宇,冯志文,杜密茹,张若芳. 2019. 贮藏期马铃薯干腐病防治药剂筛选及其安全性评价[J]. 中国马铃薯,33(6):364-371. [Sun Q H,Ren X Y,Feng Z W,Du M R,Zhang R F. 2019. Screening and safety evaluation of fungicides for control of potato dry rot during storage[J]. Chinese Potato Journal,33(6):364-371.] doi:10. 3969/j.issn.1672-3635.2019.06.008.
孙现超,彭健芳,张宁,史梦蝶,周常勇. 2013. 马铃薯干腐病菌拮抗放线菌JY-22的抑菌作用及菌株鉴定[J]. 植物保护学报,40(1):38-44. [Sun X C,Peng J F,Zhang N,Shi M D,Zhou C Y. 2013. Inhibitory effect and identification of an antagonistic Actinomyces strain JY-22 against Fusarium solani causing potato dry rot[J]. Journal of Plant Protection,40(1):38-44.] doi:10.13802/j.cnki.zwbhxb. 2013.01.006.
谈峰,王莹,李玉娟. 2021. 1株可提高植物耐盐能力菌株的分离[J]. 江西农业学报,33(4):52-58. [Tan F,Wang Y,Li Y J. 2021. Isolation of a strain specific for plant salt tole-rance[J]. Acta Agriculturae Jiangxi,33(4):52-58.] doi:10.19386/j.cnki.jxnyxb.2021.04.09.
王爱军. 2013. 马铃薯干腐病和黑痣病菌拮抗芽孢杆菌的筛选及芽孢杆菌遗传多样性研究[D]. 兰州:甘肃农业大学. [Wang A J. 2013. Screening of antagonistic Bacillus strains against pathogens of Fusarium dry rot and black scurf in potato and its AFLP analysis of genetic[D]. Lanzhou:Gansu Agricultural University.]
王静,孔凡玉,秦西云,张成省,张秀玉. 2010. 短小芽孢杆菌AR03对烟草黑胫病菌的拮抗活性及其田间防效[J]. 中国烟草学报,16(5):78-81. [Wang J,Kong F Y,Qin X Y,Zhang C S,Zhang X Y. 2010. Inhibition and bio-control activity of Bacillus pumilus AR03 against tobacco black shank[J]. Acta Tobacaria Sinica,16(5):78-81.] doi:10. 3969/j.issn.1004-5708.2010.05.015.
王静,田华,孔凡玉,王贻鸿,张成省,冯超. 2015. 短小芽孢杆菌AR03對烟草赤星病菌和白粉病菌的防治[J]. 应用生态学报,26(10):3167-3173. [Wang J,Tian H,Kong F Y,Wang Y H,Zhang C S,Feng C. 2015. Inhibition of Bacillus pumilus AR03 on Alternaria alternata and Erysipheci choracearum on tobacco[J]. Chinese Journal of Applied Ecology,26(10):3167-3173.] doi:10.13287/j.1001-9332. 20150921.022.
王麗丽,徐韬,李琳,相阳,魏涛,李克梅. 2016. 马铃薯干腐病病菌生物学特性及室内药剂筛选[J]. 新疆农业大学学报,39(3):222-226. [Wang L L,Xu T,Li L,Xiang Y,Wei T,Li K M. 2016. Biological characteristics of the pathogens of the potato dry rot and fungicides selection in laboratory[J]. Journal of Xinjiang Agricultural University,39(3):222-226.] doi:10.3969/j.issn.1007-8614. 2016.03.009.
王钱福. 2007. 嗜盐菌的分离及其多相分类学研究[D]. 兰州:兰州大学. [Wang Q F. 2007. Studies on isolation and polyphasic taxonomy of halophiles[D]. Lanzhou:Lanzhou University.]
王颖,王玉琴,杨成德,姚玉玲,陈秀蓉,薛莉. 2014. 马铃薯贮藏期主要病害拮抗内生细菌的筛选、鉴定及功能评价[J]. 草业学报,23(3):269-275. [Wang Y,Wang Y Q,Yang C D,Yao Y L,Chen X R,Xue L. 2014. Screening,identification and biological function evaluation of endophytic bacteria against potato storage disease[J]. Acta Prataculturae Sinica,23(3):269-275.] doi:10.11686/cyxb20140332.
王艳红,曹宁,贾桂燕,余丽芸,姜巨全. 2017. 中度嗜盐菌Halobacillus Y5甘氨酸甜菜碱转运蛋白opu D基因的克隆及功能分析[J]. 中国生物制品学杂志,30(3):258-263. [Wang Y H,Cao N,Jia G Y,Yu L Y,Jiang J Q. 2017. Cloning and functional identification of glycine betaine-cholinecarnitine transporter opu D gene from Halobacillus Y5[J]. Chinese Journal of Biologicals,30(3):258-263.] doi:10.13200/j.cnki.cjb.001680.
魏新燕,黄媛媛,黄亚丽,杜克久. 2017. 拮抗灰霉菌的海洋细菌甲基营养型芽胞杆菌的筛选、鉴定及其抑菌活性物质的研究[J]. 中国生物防治学报,33(5):667-674. [Wei X Y,Huang Y Y,Huang Y L,Du K J. 2017. Screening,identification of antagonistic ocean bacteria Bacillus methylotrophicus and its antimicrobial substances to botrytis cinerea pres[J]. Chinese Journal of Biological Control,33(5):667-674.] doi:10.16409/j.cnki.2095-039x.2017.05. 013.
吴海霞,田志芳. 2020. 银杏果实(白果)多糖提取工艺优化及其抑菌活性分析[J]. 江苏农业学报,36(6):1551-1558. [Wu H X,Tian Z F. 2020. Optimization of extraction technology of polysaccharides from Ginkgo biloba L.Fruit(Ginkgo biloba seed) and antibacterial activity[J]. Jiangsu Journal of Agricultural Sciences,36(6):1551-1558.] doi:10.3969 /j.issn.1000-4440.2020.06.027.
许苗,叶文武,王淑琛,冯慧,郑小波. 2018. 快速检测马铃薯干腐病病原接骨木镰孢的环介导等温扩增技术[J]. 植物病理学报,48(1):55-60. [Xu M,Ye W W,Wang S C,Feng H,Zheng X B. 2018. Rapid diagnosis of potato dry rot caused by Fusarium sambucinum using a loop-mediated isothermal amplification assay[J]. Acta Phytopathologica Sinica,48(1):55-60.] doi:10.13926/j.cnki.apps. 000038.
Bojanowski A,Avis T J,Pelletier S,Tweddell R J. 2013. Mana-gement of potato dry rot[J]. Postharvest Biology and Technology,84:99-109. doi:10.1016/j.postharvbio.2013. 04.008.
Buchanan R E,Gibbons N E. 1999. Bergey’s manual of systematic bacteriology[M]. The 9th Edition. Baltimore:Williams & Wilkins Company.
Chen X Y,Zhang Y Y,Fu X C,Li Y,Wang Q. 2016. Isolation and characterization of Bacillus amyloliquefaciens PG12 for the biological control of apple ring rot[J]. Postharvest Biology and Technology,115(1):113-121. doi:10.1016/j.postharvbio.2015.12.021.
Delaplace P,Rojas-Beltran J,Frettinger P,Jardin P D,Fauconnier M L. 2008. Oxylipin profile and antioxidant status of potato tubers during extended s torage at room temperature[J]. Plant Physiology and Biochemistry,46(12):1077-1084. doi:10.1016/j.plaphy.2008.09.001.
Gerbore J,Benhamou N,Vallance J,Floch G,Grizard D,Regnault-Roger C,Rey P. 2014. Biological control of plant pathogens:Advantages and limitations seen through the case study of Pythium oligandrum[J]. Environmental Scien-ce and Pollution research,21(7):4847-4860. doi:10. 1007/s 11356-013-1807-6.
Isabel M,Jordi C,Emilio M,Vittorio V. 2015. Cyclic lipopeptide biosynthetic genes and products,and inhibitory acti-vity of plant-associated Bacillus against phytopathogenic bacteria[J]. PLoS One,10(5):e0127738. doi:10.1371/journal.pone.0127738.
Korsten L. 1995. Evaluation of bacterial epiphytes isolated from avocado leaf and fruit surfaces for biocontrol of avocado postharvest diseases[J]. Plant Disease,79(11):1149-1156. doi:10.1094/PD-79-1149.
Krüsemann E J Z,Cremers J W J M,Visser W F,Punter P H,Talhout R. 2017. The sensory difference threshold of menthol odor in flavored tobacco determined by combining sensory and chemical analysis[J]. Chemical Senses,42(3):233-238. doi:10.1093/chemse/bjw123.
Mathabatha E S. 2010. Diversity and industrial potential of hydrolase producing halophilic/halotolerant eubacteria[J]. African Journal of Biotechnology,9(11):1555-1560. doi:10.5897/AJB10.051.
Ramlawi S,Chiu J O,Cloutier A,Avis T J. 2021. Suppression of Fusarium dry rot of potato using beneficial bacterial treatments[J]. Journal of Plant Pathology,103:269-281. doi:10.1007/s42161-020-00731-y.
Recep K,Fikrettin S,Erkol D,Cafer E. 2009. Biological control of the potato dry rot caused by Fusarium species using PGPR strains[J]. Biological Control,50(2):194-198. doi:10.1016/j.biocontrol.2009.04.004.
Ren J,Tong J,Li P H,Huang X Q,Dong P,Ren M Z. 2021. Chitosan is an effective inhibitor against potato dry rot caused by Fusarium oxysporum[J]. Physiological and Molecular Plant Pathology,113(16):101601. doi:10. 1016/J.PMPP.2021.101601.
Romualdo C,Gemma C,Lourdes A M,Rosa B M,Javier C F. 2010. Thiabendazole resistance and mutations in the β-tubulin gene of Penicillium expansum strains isolated from apples and pears with blue mold decay[J]. FEMS Microbiology Letters,297(2):189-195. doi:10.1111/j.1574-6968.2009.01670.x.
Sadfi N,Chérif M,Fliss I,Antoun H. 2001. Evaluation of bacterial isolates from salty soils and Bacillus thuringiensis strains for the biocontrol of fusarium rot of potato tubers[J]. Journal of Plant Pathology,83(2):101-117. doi:10. 2307/41998046.
Sadfi N,Chérif M,Hajlaoui M R,Boudabbous A. 2002. Biological control of the potato tubers dry rot caused by Fusarium roseum var. sambucinum under greenhouse,field and storage conditions using Bacillus spp. isolates[J]. Journal of Phytopathology,150(11-12):640-648. doi:10. 1046/j.1439-0434.2002.00811.x.
van den Boogert P H J F,Luttikholt A. 2004. Compatible biological and chemical control systems for Rhizoctonia solani in potato[J]. European Journal of Plant Pathology,110(2):111-118. doi:10.1023/B:EJPP.0000015325.332 99.e0.
Zhang W W,Liang W K,Li C H. 2016. Inhibition of marine Vibrio sp. by pyoverdine from Pseudomonas aeruginosa PA1[J]. Journal of Hazardous Materials,302(2):217-224. doi:10.1016/j.jhazmat.2015.10.003.
(責任编辑 麻小燕)

