木薯粉及制品中高灵敏度AFB1快速检测方法研究
余厚美 王琴飞 林立铭 徐缓 李其铸 范武波 张振文


摘要:【目的】基于酶聯免疫吸附测定法(ELISA)检测原理,建立高灵敏度的直接竞争法检测木薯粉及其制品中的黄曲霉毒素B1(AFB1),为木薯食品安全提供技术支持。【方法】通过对AFB1抗原结构改造、免疫和细胞融合等过程获得抗原抗体,建立高灵敏度检测方法,并进行木薯粉及其制品样本的实例验证。【结果】制备的AFB1抗原和抗体,其抗体亚型均为IgG1,灵敏度最高的3F2细胞株产生的抗体对黄曲霉毒素G1、G2和B2交叉反应率分别为21.4%、1.9%和8.8%,且对其他毒素类无交叉反应,建立的ELISA线性区间为0.02~0.48 μg/kg,半数抑制浓度(IC50)为0.047 μg/kg,标准方程为y=-3.074x-4.3066(R2=0.9978)。以35%甲醇水溶液作为标准品稀释液,木薯食品原料用70%甲醇水溶液加0.2 g NaCl作为提取液,含油脂的木薯糕点用70%甲醇水溶液作为提取液,所有样本均为10倍稀释,检测限0.2~4.8 μg/kg,样品添加回收率81.5%~120.0%,变异系数均小于8.5%。应用验证试验表明,自建ELISA试剂盒对96份样本检出19份阳性样本,购买试剂盒检出7份阳性,大于2.0 μg/kg的样本检测结果完全符合,自建ELISA试剂盒方法灵敏度优于购买的ELISA试剂盒。【结论】本研究建立的直接竞争ELISA方法灵敏度高,操作简单,可广泛应用于木薯粉及其制品样本中AFB1的快速测定。
关键词:黄曲霉毒素B1;快速检测;酶联免疫分析;木薯粉
中图分类号:S379.9 文献标志码: A 文章编号:2095-1191(2021)10-2824-10
Abstract:【Objective】Based on the principle of enzyme-linked immunoassay(ELISA),to establish high-sensitive direct competitive ELISA for detecting aflatoxin B1(AFB1) in cassava flour and based products samples,provide technical support for cassava food processing and utilization. 【Method】Antigen and antibody were obtained through structural modification of AFB1 antigen,immunization,cell fusion and others protocol. Then the highly sensitive rapid test was established,and it was carries on to test examples comparison with kits from market for verification for cassava flour and based products sample. 【Result】The results showed that AFB1 antigen and antibody were successfully synthesized,whose antibody subtypes were all IgG1. One of the most sensitive 3F2 cell line had a cross-reactivity to aflatoxins G1,G2,and B2 for 21.4%,1.9%,8.8% respectively,and they had no cross-reactivity to other toxins. The linear range of ELISA was 0.02-0.48 μg/kg,half inhibitory concentration(IC50) was 0.047 μg/kg,the standard equation was y=-3.074x-4.3066(R2=0.9978). With 35% methanol aqueous solution as standard diluent,cassava food raw materials were extracted with 70% methanol aqueous solution and 0.2 g NaCl,the oil-containing cassava pastries were using 70% methanol aqueous solution as the extract,all samples were 10 times diluted. It also found the detection limit was 0.2-4.8 μg/kg and,the recovery rate of cassava flour and based products samples addition was 81.5%-120.0%,whose coefficient of variation was less than 8.5%. While,the test results showed that,the self-built ELISA kit detected 19 positive samples from 96 samples,and the purchased ELISA kit detected 7 positive samples. The detection results of samples more than 2.0 μg/kg were in complete agreement,self-developed ELISA kit was more sensitive than the ELISA kits from market. 【Conclusion】The direct competitive ELISA method established in this study has high sensitivity,simple operation to be widely used for rapid determination for AFB1 in cassava flour and based products.
Key words:aflatoxin B1; rapid test; enzyme-linked immunoassay(ELISA); cassava flour
Foundation item:National Key Research and Development Program(2018YFF0213502);Modern Agricultural Industrial Technology System Construction Project(CARS-11-HNZZW);Central Public-interest Scientific Institution Basal Research Fund for Chinese Academy of Tropical Agricultural Sciences(1630052020018)
0 引言
【研究意义】黄曲霉毒素(Aflatoxins)是黄曲霉菌及曲霉寄生菌族类产生的一类结构类似物的总称(李少晖等,2015),在各种粮食、食品和饲料中广泛存在(刘伟伟等,2011),且理化性质稳定,现有的农业技术和食品加工工艺无法避免和消除污染(孙清,2017)。其中黄曲霉毒素B1(Aflatoxin B1,AFB1)毒性和“三致”(致癌、致畸、致突变)均居首位(王督等,2014)。欧盟规定AFB1含量不得高于2 μg/kg,我国国家标准GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定粮食中AFB1含量不得超过5 μg/kg,特殊膳食用食品不得超过0.5 μg/kg。木薯是一种重要的块根粮食作物(朱艳梅等,2016;胡广和梁大成,2019),全世界木薯产量的65%左右用于人类食物(韩和悦,2017)。我国是世界木薯第一进口大国,现行国家标准GB 5009.22—2016《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》第五法中AFB1在薯干中的检出限是5 μg/kg。因此,制备抗原和单克隆抗体,利用酶联免疫吸附测定法(Enzyme linked immunosorbent assay,ELISA)抗原抗体特异性结合的免疫学检测原理,建立高灵敏度的检测方法检测木薯粉及其制品中AFB1,对木薯粉及其食品制品的推广和木薯食用化利用具有重要意义。【前人研究进展】检测AFB1含量的方法主要有液相色谱法、液相色谱—串联质谱法等仪器方法(赵浩军等,2013;谢洁,2017;任宏彬等,2019)和ELISA、免疫层析试纸条等快速检测方法(王春燕等,2019;李丹阳等,2020;张敏等,2020)。仪器方法虽然灵敏、准确,但仪器昂贵、耗时长,无法满足基层对大量样本的筛查。ELISA利用抗原抗体特异性结合的原理,具有灵敏度高、通量大、耗时短和成本低等优点,被广泛应用于源头监测和成规模的样本筛查(蔡雪等,2019;Satyanarayana et al.,2019)。蒋佳伊等(2020)利用ELISA检测中药材酸枣仁中AFB1,线性范围为0.05~0.58 μg/kg,检测限达1.69 μg/kg,与超高液相色谱—质谱联用技术检测结果符合良好。真菌毒素污染广泛,王国强等(2019)对来自不同省份的饲料及其原料进行霉菌毒素检测,结果发现所有样本均被污染,同时被3种以上毒素污染的样本高达76.55%。在喀麦隆、贝宁、尼日利亚等国家有木薯中检测出AFB1的报道,除尼日利亚木薯样本的检测方法为薄层色谱法外,喀麦隆和贝宁木薯的检测方法均为液相色谱—质谱联用技术(Adegoke et al.,1991,1993;Ediage et al.,2011,2014)。【本研究切入点】虽然国内外己有AFB1的很多快速检测产品出现,但目前未见有针对木薯粉及其制成的系列食品进行AFB1定量检测的相关报道。【拟解决的关键问题】经制备单克隆抗体,建立直接竞争ELISA法,检测木薯粉及其制品中的AFB1,为木薯食品安全提供技術支持。
1 材料与方法
1. 1 试验材料
标准品黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)、黄曲霉毒素M1(AFM1)、黄曲霉毒素M2(AFM2)、赭曲霉毒素A(OTA)、呕吐毒素(DON)、玉米赤霉烯酮(ZEN)、牛血清白蛋白(BSA)和卵清蛋白(OVA)购自天津阿尔塔科技有限公司;AFB1 ELISA试剂盒购自河北伊莱莎生物技术有限公司;AFB1-BSA抗原和AFB1抗体购自海南亿康生物科技有限公司;小鼠抗体亚型鉴定试剂盒和辣根过氧化物酶(HRP)购自Sigma公司;氯化钠和甲醇等化学试剂购自国药集团化学试剂有限公司;Balb/C小鼠购自汕头大学医学中心;木薯全粉(Whole cassava flour,WCF)、 木薯淀粉(Cassava starch,CS)、木薯粉(Cassava flour,CF)、木薯干片(Dry cassava chips,DCC)、木薯面条(Cassava noodle,CN)、木薯粉条(Casssava starch noodles,CSN)、木薯粉酥饼(Cassava flour shortbread,CFS)、木薯蔓越莓饼干(Cassava cranberry cookies,CCC)和木薯蛋糕(Cassava cake,CC)样品参照《木薯及其食品加工技术》(张振文和李开绵,2019)进行制作,木薯由国家薯类加工技术研发分中心提供;玉米和大豆购自当地市场。主要仪器设备:Multiskan FC酶标仪(美国Thermo公司)、DT5-2B离心机(北京时代北利离心机有限公司)、AWL-0501-B纯化仪(美国艾科浦公司)、SRY-150生化培养箱(宁波赛福实验仪器有限公司)、MCO-18AC二氧化碳培养箱(日本三洋公司)和BDS200倒置显微镜(重庆奥特光学仪器有限责任公司)。
1. 2 AFB1抗原抗体的制备及鉴定
1. 2. 1 AFB1抗原制备及鉴定 偶联物制备:参考邓娟(2016)、孙清(2017)的方法合成AFB1肟化物(AFB1·O),经质谱扫描鉴定正确。用碳化二亚胺法(DCC法)将AFB1·O与载体蛋白BSA、OVA和HRP分别进行偶联,然后在pH 7.2的PBS中透析48 h,分装保存于-20 ℃。
偶联物鉴定:取偶联产物AFB1-BSA、AFB1-OVA、AFB1-HRP和阴性对照BSA、OVA、HRP,与购买的AFB1-BSA抗原作为包被抗原包被于酶标板,同时包被PBS作空白对照,以购买的AFB1抗体作为一抗、HRP标记的羊抗兔IgG作为二抗进行间接ELISA鉴定偶联效果。
1. 2. 2 AFB1单克隆抗体制备 用免疫原皮下多点注射免疫Balb/C小鼠,用免疫前的小鼠血清作阴性对照,小鼠血清梯度稀释,分别用间接竞争ELISA检测效价和AFB1、AFB2、AFM1、AFM2、AFG1、AFG2标准品20 μg/kg对抗原抗体结合抑制的情况,挑选效价和抑制率高(刘伟伟等,2011)的小鼠,加强免疫后取小鼠脾细胞与SP2/0融合,挑选抑制率高的阳性细胞克隆至阳性单克隆率为100%,小鼠体内诱生腹水,硫酸铵纯化后-20 ℃分装保存。
1. 2. 3 AFB1单克隆抗体效价及亚型鉴定 梯度稀释包被抗原包被于酶标板,梯度稀释抗体,采用间接法检测抗体效价,选择阳性孔OD值1.8~2.1的最高稀释倍数为抗原抗体的效价;亚型的测定根据Sigma试剂盒说明书进行。
1. 3 竞争ELISA检测方法建立
1. 3. 1 AFB1标准曲线建立 采用竞争ELISA棋盘方阵测定效价,选取OD450最接近2.0的抗原、抗体和酶标抗原稀释倍数作为效价,将标准品浓度倍比稀释进行竞争ELISA,以标准品浓度的对数值为横坐标、吸光度值的logit值为纵坐标,建立ELISA标准曲线,获得线性回归方程和相关系数。
1. 3. 2 单克隆抗体的特异性测定 以AFB1、AFB2、AFG1、AFG2、AFM1、AFM2、OTA、ZEN、DON和BSA分别作为标准品,采用已建立的ELISA曲线进行检测,分别计算半数抑制浓度(IC50),以AFB1的IC50为标准,各标准品IC50与标准品AFB1的IC50比值即为交叉反应率,比值越大,交叉反应率越高。
1. 3. 3 快速检测方法的稳定性测试 将上述包被好单克隆抗体的酶标板、HRP·AFB1酶标抗原工作液和不同浓度的标准品液体等,分别分装置于4 ℃冰箱和37 ℃生化培养箱保存,保存前和保存后第1、3、5、7、10和15 d分别对比保存在不同温度条件试剂盒的OD值和IC50变化,根据检测结果推断试剂盒储存稳定性。用不同批次制备的试剂盒分别做多个批次内和批次间平行曲线,检测其变异系数。
1. 3. 4 样本中标准品的添加回收试验与样本实测 参照谢珲等(2015)、宋卫得等(2016)的方法进行优化。对木薯干片、木薯蔓越莓饼干、木薯粉条、木薯面条、木薯蛋糕、玉米和大豆等大块样本进行烘干粉碎,过80目筛。准确称取样本2 g,分别加入一定量的AFB1标准品溶液,使其浓度为0、0.5和2.0 μg/kg,再加入10 mL 60%~80%的甲醇水溶液(含0.2 g NaCl)作为提取液,封口后强力振荡5 min,3500 r/min离心5 min后取上清液,用去离子水稀释2~5倍,取50 μL进行检测,并计算样本的回收率。木薯蔓越莓饼干和木薯蛋糕等木薯食品样本含油脂,在样本中加70%甲醇水溶液作提取液,提取后取1.0 mL上清液,加入0.8 mL正己烷,封口后强力振荡5 min,3500 r/min离心5 min后取下层上清液,用去离子水稀释2~3倍,取50 μL进行检测。回收率(%)=实测浓度/添加浓度×100,回收率越接近100%表明检测结果越准确。同时将检测结果与外购AFB1 ELISA试剂盒进行结果比对,判断该方法的准确性。
1. 4 统计分析
所有试验均重复3次,数据采用Excel 2010分析并制图。
2 结果与分析
2. 1 AFB1抗原鉴定结果
2. 1. 1 半抗原的鉴定 将AFB1肟化生成半抗原AFB1·O,AFB1的分子量為321,偶联间隔臂羧甲基羟胺后,半抗原的分子量为385,半抗原作质谱鉴定,正离子峰为386,结构正确(图1)。经质谱分析有AFB1·O单体峰存在,且AFB1特征峰消失,证明该物质合成成功。
2. 1. 2 偶联产物的ELISA鉴定 利用间接ELISA鉴定载体蛋白和半抗原的偶联效果,购买的偶联抗原(AFB1-BSA)和偶联产物(AFB1-BSA、AFB1-OVA、AFB1-HRP)的OD450远大于阴性对照(BSA、OVA、HRP)和空白对照(PBS)OD450的2.1倍,确定偶联成功(图2)。
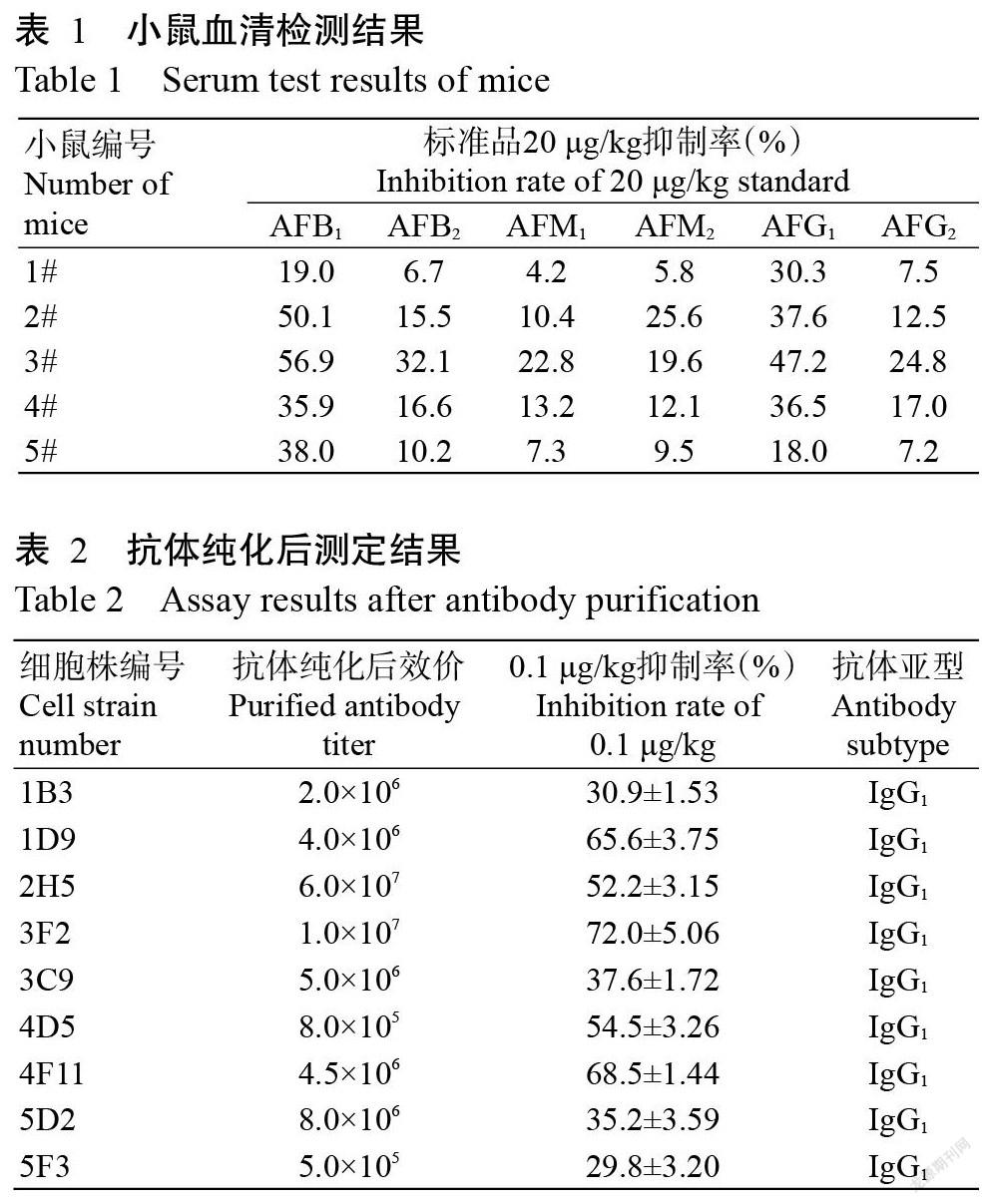
2. 2 小鼠血清效价及抑制率的测定结果
5只小鼠血清检测抑制率结果如表1所示,2#鼠和3#鼠的血清在20 μg/kg的抑制率均超过50.0%,且对其他黄曲霉类标准品交叉率也较其他小鼠高,故挑选对标准品抑制效果好的2#鼠和3#鼠进行细胞融合。
2. 3 单抗的效价及亚型测定结果
融合后的杂交瘤细胞经克隆筛选,得到9株阳性单克隆细胞(表2),7株阳性单克隆细胞体外诱导法制备的腹水效价均达到106及以上,抗体亚型均为IgG1型。9株单克隆抗体对AFB1标准品的抑制率有所差别,细胞株3F2的抑制率最高(72.0%),故选择细胞株3F2产生的抗体用以建立间接竞争ELISA方法。
2. 4 竞争ELISA标准曲线的建立
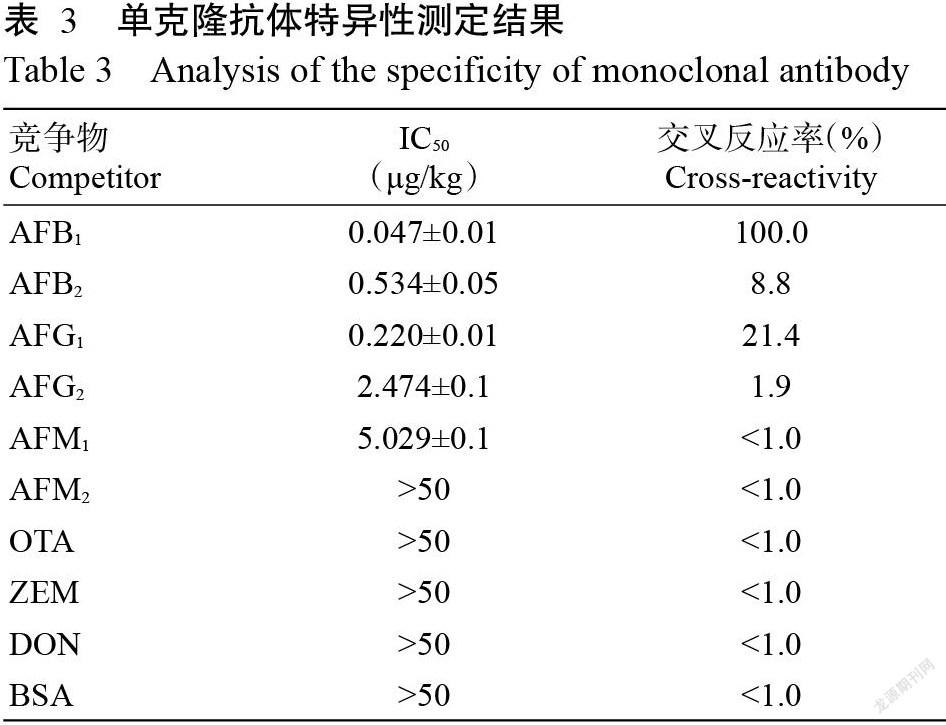
如图3所示,建立的间接竞争ELISA和直接竞争ELISA均随着反应时间延长,IC50明显降低,反应时间同为30 min时,直接竞争ELISA法IC50为0.029 μg/kg,间接竞争ELISA法IC50为1.040 μg/kg。直接竞争法更灵敏,IC50更低,更稳定,加样方法也更简单,故选取直接竞争ELISA方法体系进行后续试验。以AFB1标准品浓度的对数值作横坐标、吸光度值的logit值为纵坐标绘制标准曲线,当标准品AFB1浓度在0.02~0.48 μg/kg时有较好的线性关系,得到标准方程y=-3.074x-4.3066(R2=0.9978),灵敏度为0.02 μg/kg,IC50为0.047 μg/kg。
2. 5 单克隆抗体特异性测定结果
将不同种类标准品带入建立的ELISA中检测,结果(表3)显示,该单克隆抗体对AFB1抑制效果最好,其次是AFG1、AFB2和AFG2,對AFM1、AFM2、OTA、ZEN、DON和BSA的交叉反应率均小于1.0%,说明制备的AFB1单克隆抗体的特异性良好。
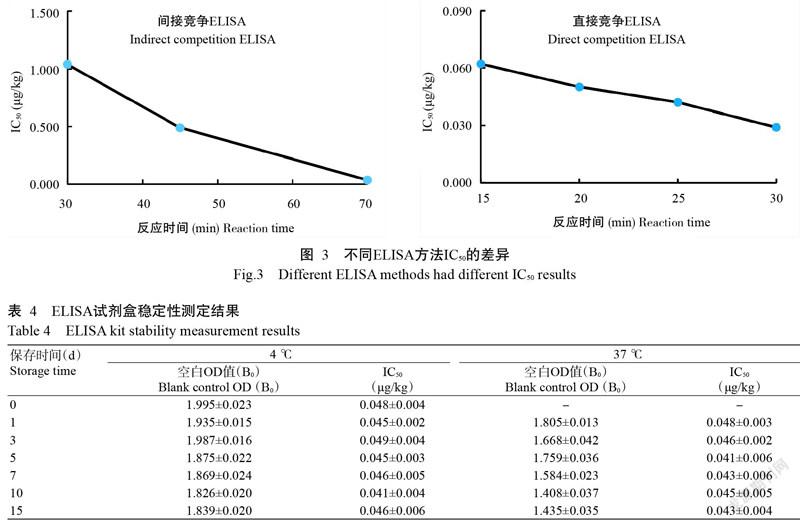
2. 6 检测方法的稳定性测试结果
对比4和37 ℃保存不同时间条件的稳定性,经ELISA检测,试剂盒空白OD值(B0)在37 ℃生化培养箱中保存7 d后下降了0.411,10 d下降0.587,15 d下降0.560,但IC50未见明显变化。试剂盒在37 ℃生化培养箱保存10和15 d OD值下降不明显,说明试剂盒在下降到一定程度后较稳定。按照37 ℃保存1 d相当于4 ℃保存一个半月的模型计算,在37 ℃保存7 d稳定的试剂盒,理论上在4 ℃可以保存10个月左右,保存15 d后IC50变化不大,只是OD值下降,不影响试剂盒的使用。经检测,批内差异和批间差异均小于8.5%,说明该检测产品稳定性良好。
2. 7 标准品AFB1的添加回收率
2. 7. 1 样本提取方法的确定 60%甲醇水溶液提取后直接检测回收率为64%,70%和80%甲醇水溶液提取后直接检测ELISA不显色,可能是过高的甲醇会影响抗原抗体结合所致。回收率随着甲醇溶液浓度升高而降低,80%甲醇水溶液的回收率最低;添加的NaCl越多,回收率越高,但本底和假阳性也越高;相同的提取方法,回收率随着检测前稀释倍数增大而升高。为避免假阳性率,对比在60%和70%甲醇水溶液中加入不同NaCl和标准品的量,分别进行10倍、15倍和25倍稀释。如图4所示,添加0.2 g NaCl时,回收率也可达100%左右,回收率随样本稀释倍数增大而升高,添加0.5 μg/kg的回收率高于2.0 μg/kg,且70%甲醇水溶液提取的样本0.5和2.0 μg/kg回收率差异更小,故优选70%甲醇水溶液作为样本提取液。
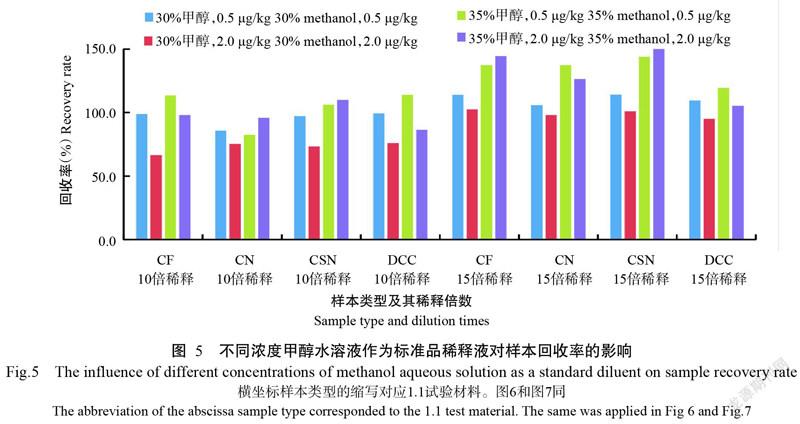
2. 7. 2 不同浓度甲醇水溶液作为标准品稀释液对样本回收率的影响 样品不同稀释倍数和不同浓度甲醇水溶液作为标准品稀释液对样本添加回收率的影响如图5所示,样本10倍稀释、35%甲醇作为标准品稀释液的回收率和样本15倍稀释、30%甲醇作为标准品稀释液的回收率更接近100%,添加0.3 g NaCl也得出同样的结果。为减少稀释带来的误差,选择样本10倍稀释、35%甲醇水溶液作为标准品稀释液。
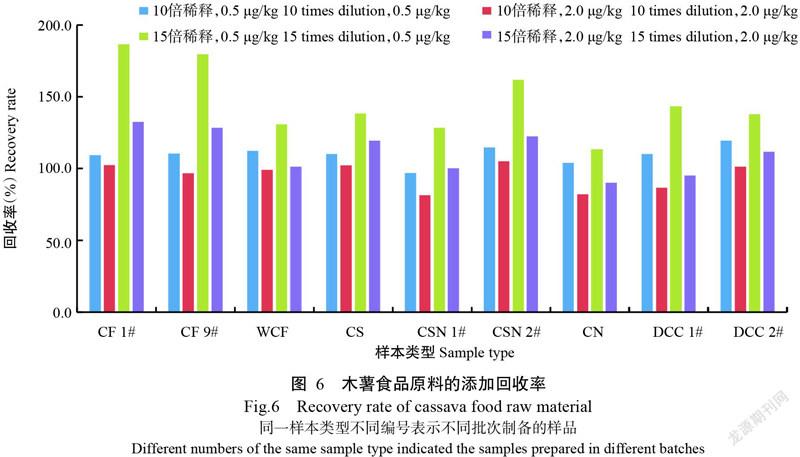
2. 7. 3 不同类型木薯样本的回收率 不同类型木薯食品原料样本10倍和15倍稀释后添加回收率如图6所示,所有样本10倍稀释回收率在81.5%~120.0%,添加0.5 μg/kg的回收率均高于2.0 μg/kg,15倍稀释的回收率均高于10倍稀释,且部分回收率高于120.0%,容易造成假阳性,故选用70%甲醇水溶液加0.2 g NaCl提取,封口强力振荡5 min,3500 r/min离心5 min取上清液,再用去离子水2倍稀释后检测,作为木薯食品原料的样本处理方法。该方法样本检测限范围为0.2~4.8 μg/kg。
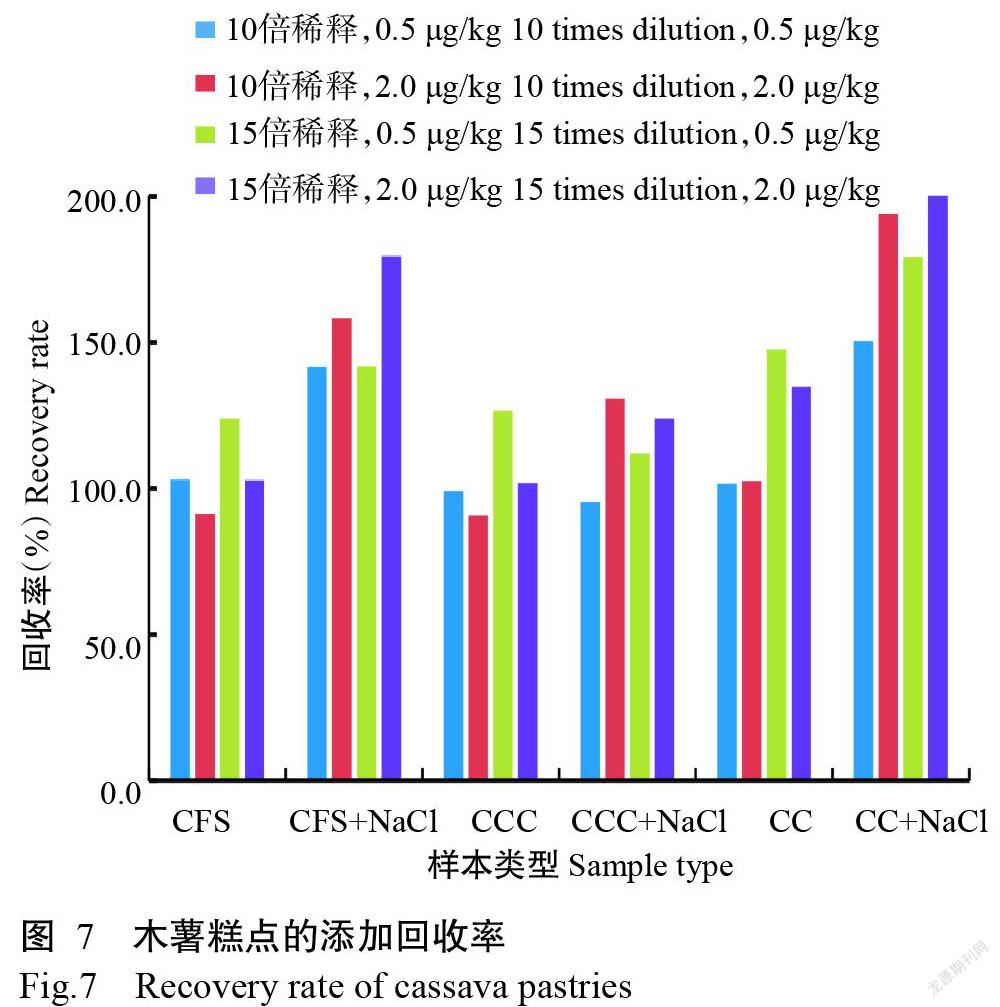
木薯蔓越莓饼干和木薯蛋糕等含油脂木薯糕点食品对比10倍和15倍稀释后检测,添加回收率如图7所示,加大稀释倍数和提取过程中加NaCl均可使回收率升高,不加NaCl提取的样本10倍稀释后样本回收率为90.8%~103.1%,选用70%甲醇水溶液提取后取上清液1.0 mL,加入0.8 mL正己烷,振荡离心后取下层上清液2倍稀释后检测,作为含油脂的木薯糕点食品样本处理方法。该方法样本检测限范围为0.2~4.8 μg/kg。
2. 8 样本实测结果
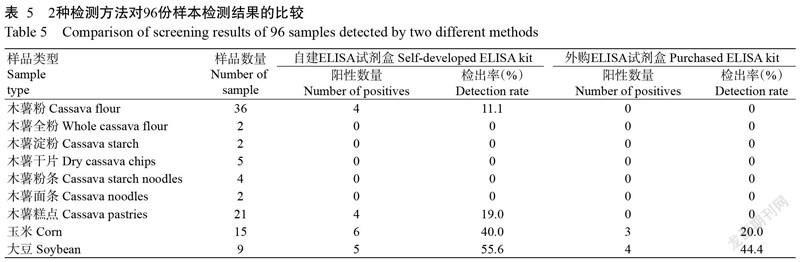
用自建ELISA试剂盒和外购的试剂盒对96份待检样本进行初筛检测,其中包括72份木薯粉及其制品样本、15份玉米样本和9份大豆样本,结果(表5)显示,自建ELISA试剂盒共检出19份阳性样本,外购ELISA试剂盒检出7份阳性样本。
检测的72份木薯粉及其制品样本中,自建方法共筛出8份污染样品,外购试剂盒未筛出阳性样本。所检测的36份木薯粉样本中,4份样本含有AFB1但未超标,含量在0.32~0.75 μg/kg;其中17份木薯粉样本敞口置于室温条件下长达20个月,检测结果和密封保存结果一致。木薯淀粉、木薯全粉、木薯干片、木薯粉条和木薯面条中未检出AFB1,部分存放最久的木薯粉和木薯干片长达5年仍未检出AFB1。检测的21份木薯糕点样品中17份样本已室温存放1年,仅有4份样本检出含有AFB1,含量在0.41~0.54 μg/kg。
对15份玉米样本进行检测的结果显示,自建ELISA试剂盒共检出6份阳性样本,其中超过2.0 μg/kg的有3份;外购ELISA试剂盒检出3份阳性样本。自建ELISA试剂盒对9份大豆样本检出阳性样本为5份,其中超过2.0 μg/kg的有4份;外购ELISA试剂盒检出4份大豆阳性样本。
自建试剂盒检测区间为0.2~4.8 µg/kg,外购试剂盒检测区间为2~50 µg/kg,所有已检测出的木薯粉及其制品阳性样本含量已低于外购试剂盒的检测范围,玉米和大豆样本中大于2.0 μg/kg的样本检测结果完全符合,因此,本研究建立的检测方法灵敏度优于外购试剂盒。
根据国家食品药品监督管理总局《食品快速检测方法评价技术规范》中评价方法进行一致性分析,结果表明,卡方值为10.08,大于3.84,表示自建方法与外购试剂盒的阳性确认比率在95%的置信区间内有显著性差异;所有样本假阴性率均为0,假阳性率为13.5%,相对准确度为87.5%。
3 讨论
AFB1属于小分子化合物,需偶联大分子蛋白载体后才具有免疫原性(杨利国等,1998;章飚等,2018)。本研究选取BSA作为免疫原的载体蛋白,OVA作为包被原的载体蛋白,这2种蛋白理化性质稳定,物美价廉。在AFB1全抗原偶联鉴定方面,许多文献均采用紫外扫描,强调偶联比(陈宇熹等,2017;潘明飞等,2019),本研究利用现成的抗原抗体来验证是否已偶联成功是最直观和最廉价的评价方式,且可操作性强,对后期抗体的验证也可提供参考。
抗原抗体结合受反应时间、温度、pH和缓冲液成分等影响(杨利国等,1998)。试验用相同的抗原抗体,不同反应条件下,灵敏度和IC50差异較大,与反应时间和加样模式有关,且相同条件下,反应时间越短,抗原抗体效价越低,所需抗原抗体用量越大。本研究中虽然直接竞争法和间接竞争法2种反应模式的反应时间同为30 min,但检测数据差距较大,直接竞争ELISA法IC50为0.029 μg/kg,间接竞争ELISA法IC50为1.040 μg/kg。同样是直接竞争法,反应时间越长,抗原抗体越能充分结合,但当抗原抗体结合和解离反应达到一个新的平衡后差异减小,结果趋于平稳。
检测AFB1等小分子物质均采用直接竞争ELISA或间接竞争ELISA(詹屋强和王弘,2015)。本研究采用包被固定单克隆抗体,样本中AFB1和HRP-AFB1酶标抗原均处于游离状态,使其均在相同条件下竞争结合酶标板上的抗体形成复合物,更具有公平竞争性。本研究采用直接竞争ELISA法,与间接竞争ELISA法相比,加样更简单,从方法上减少操作误差,准确性更高(余厚美等,2017)。
不同样本类型、稀释倍数和标准品添加浓度等因素均对回收率有明显影响,可能与样本基质效应有关(秦珊珊,2015)。许娇娇等(2017)用直接稀释—超高液相色谱—串联质谱法测定谷物及制品中真菌毒素时发现大部分真菌毒素有基质抑制或增强效应;符金华等(2019)在25种饲料及饲料原料中对16种真菌毒素的添加研究表明绝大多数真菌毒素在不同样本中均有基质效应,AFB1在所有类型的样本中均有基质抑制效应。范叶等(2019)在检测蔬菜农药残留过程中用相同仪器能减小基质效应,用与本底一致的基质标准溶液校正样品可有效消除基质效应。秦珊珊(2015)在采用HPLC-MS/MS检测食用菌中80种农药残留分析中发现稀释法能消除大多数农药的基质效应。净化和稀释是常用的去基质效应方法,但净化需萃取、层析等步骤,成本高,操作复杂,本研究在灵敏度和检测限允许的前提下,适当稀释样本,去除基质效应,是低成本、易操作的一种去除基质效应的处理方式。评价方法分析中得出该方法有13.5%假阳性,全部样本无假阴性,是因为自建方法灵敏度高于参比方法所致。在各自检测限范围内检测结果一致,因灵敏度更高,本研究建立的检测方法实际检测样本更精确。
本研究中,部分木薯粉样品在室温下放置20个月仍未检测出AFB1阳性,所有样本中只有少数样本检测出低阳性,可能与新鲜木薯天然抗黄曲霉毒素污染有关,但在经过烘干、烘焙加工等处理后会丧失这种特性(Adjovi et al.,2014);也有可能是木薯粉和木薯干片在储藏过程中受外界环境影响小;还有可能是木薯粉加工原材料——木薯肉表面原本无菌,在加工过程中感染的概率小。为了保证食用安全性,减少木薯粉中生氰糖苷含量,木薯粉是木薯去除外皮和周皮后加工生产(张振文和李开绵,2019),加工前无黄曲霉菌等产毒菌株污染,所以相对其他农作物如玉米、大豆(刘凤芝等,2017)、花生(张杏等,2019)等在生长过程中受污染,其感染概率低。比较检测出弱阳性对应的木薯粉外观,所有检出阳性的样本颜色均呈褐色,有污染的样本肉眼可辨。木薯食品中检测出阳性率稍高可能是加工过程中添加了鸡蛋、黄油等高蛋白的原因,有部分有霉变现象但未检测出AFB1阳性,可能是有霉菌污染未产生毒素,或是其他类型的毒素污染(许娇娇等,2017;王国强等,2019)。本研究结果表明,只要储藏得当,木薯粉及其制品在一定时期内受AFB1污染较少。此外,采用本研究建立的方法对玉米、大豆和花生等样品进行检测,结果和外购试剂盒检测结果基本一致,说明本方法也同样适用于其他粮食样本的检测。
4 结论
本研究成功制备了AFB1抗原和单克隆抗体,并建立直接竞争ELISA法,该方法既能检测木薯粉及其制品样本中的AFB1,也能检测其他粮食样本中的AFB1。该方法具有灵敏度高、操作简单、快速、准确、可批量检测样本等特点,易于被企业和基层检测人员掌握和应用,可为木薯食品中AFB1污染筛查提供快速检测技术。
参考文献:
蔡雪,周川,杨淑芬,李梦瑶,黄多. 2019. 大米中黄曲霉毒素B1酶联免疫法与液相色谱—柱后衍生法的比对探讨[J]. 现代食品,(11):186-188. [Cai X,Zhou C,Yang S F,Li M Y,Huang D. 2019. Comparison of aflatoxin B1 ELISA and liquid chromatography-post-column derivatization in rice[J]. Modern Food,(11):186-188.] doi:10.16736/j.cnki.cn41-1434/ts.2019.11.058.
陈宇熹,方振霞,雷美玲,吴艺岚,张月珠,牛蓉,叶舟. 2017. 黄曲霉毒素B1人工抗原的制备、鉴定与免疫特性研究[J]. 武夷科学,33(1):80-87. [Chen Y X,Fang Z X,Lei M L,Wu Y L,Zhang Y Z,Niu R,Ye Z. 2017. Preparation and identification and immunological properties of aflatoxin B1 artificial antigen[J]. Wuyi Science Journal,33(1):80-87.] doi:10.15914/j.cnki.wykx.2017.33.12.
邓娟. 2016. 黄曲霉毒素B1酶联免疫检测方法研究[D]. 天津:天津科技大学. [Deng J. 2016. Development of enzyme-linked immunosorbent assay for the detection of aflatoxin B1[D]. Tianjin:Tianjin University of Science and Technology.]
范叶,易泽夫,王壮波. 2019. 蔬菜农药残留检测中基质效应影响因素分析[J]. 蔬菜,(2):60-64. [Fan Y,Yi Z F,Wang Z B. 2019. Analysis of influencing factors of matrix effect in vegetable pesticide residues detection[J]. Vegetables,(2):60-64.]
符金华,杨琳芬,董泽民,徐国茂,姜文娟,叶金,吴宇,邢磊,刘国花,樊晶,周仁丹,廖丰. 2019. 饲料和饲料原料等25种样品中16种真菌毒素超高效液相色谱—三重四级杆/线性离子阱串联质谱法基质效应的研究[J]. 中国饲料,(21):66-71. [Fu J H,Yang L F,Dong Z M,Xu G M,Jiang W J,Ye J,Wu Y,Xing L,Liu G H,Fan J,Zhou R D,Liao F. 2019. The matrix effect research of determination of 16 mycotoxins by UPLC-Quadrupole/Qtrap mass spectrometry in 25 kinds of feed and feedstuff samples[J]. Chinese Feed,(21):66-71.] doi:10.15906/j.cnki.cn11-2975/s.20192114.
韩和悦. 2017. 11个食用木薯品种的品质研究与评价[D]. 广州:仲恺农业工程学院. [Han H Y. 2017. Research and evaluation of 11 edible cassava breed quality[D]. Guangzhou:Zhongkai University of Agriculture and Enginee-ring.]
胡广,梁大成. 2019. 木薯NOX基因家族成员的生物信息学及其表达分析[J]. 南方农业学报,50(10):2178-2187. [Hu G,Liang D C. 2019. Bioinformatics of cassava NOX gene family and its expression analysis[J]. Journal of Southern Agriculture,50(10):2178-2187.] doi:10.3969/j.issn.2095-1191.2019.10.06.
蔣佳伊,张磊,秦露,骆骄阳,付延伟,秦家安,王长健,欧阳臻,杨美华. 2020. 高灵敏度黄曲霉毒素B1单克隆抗体的制备及其在中药材酸枣仁污染快速检测中的应用[J]. 中国中药杂志,45(16):3900-3907. [Jiang J Y,Zhang L,Qin L,Luo J Y,Fu Y W,Qin J A,Wang C J,Ouyang Z,Yang M H. 2020. Preparation of highly sensitive monoclone antibody against aflatoxin B1 and its application in rapid detection of contamination in Ziziphin spinosae Semen[J]. China Journal of Chinese Materia Medica,45 (16):3900-3907.] doi:10.19540/j.cnki.cjcmm.2020.0522. 201.
李丹阳,李立煌,艾超超,任磊. 2020. 上转换荧光—适配体免疫层析试纸条的构建及其在黄曲霉毒素B1检测上的应用[J]. 厦门大学学报(自然科学版),59(2):238-245. [Li D Y,Li L H,Ai C C,Ren L. 2020. Construction of immunochromatographic strip based on upconversion fluorescence-aptamer and its application for detection of aflatoxin B1[J]. Journal of Xiamen University(Natural Scien-ce),59(2):238-245.] doi:10.6043/j.issn.0438-0479. 201906026.
李少晖,任丹丹,谢云峰,刘佳,杨永坛. 2015. 食品中黄曲霉毒素检测方法研究进展[J]. 食品安全质量检测学报,6(4):1107-1115. [Li S H,Ren D D,Xie Y F,Liu J,Yang Y T. 2015. Research progress on determination methods of aflatoxins in foodstuffs[J]. Journal of Food Safety and Quality,6(4):1107-1115.] doi:10.19812/j.cnki.jfsq11-5956/ts.2015.04.002.
刘凤芝,李锋,王永丽. 2017. 2017年上半年我国部分地区饲料及饲料原料中霉菌毒素的污染状况分析[J]. 粮食与饲料工业,(11):46-50. [Liu F Z,Li F,Wang Y L. 2017. Investigation of mycotoxins contamination in feeds and feed ingredients in the first half of 2017 in some parts of China[J]. Cereal & Feed Industry,(11):46-50.]
刘伟伟,孙秀兰,张银志,樊惠良,陈文君,李在均. 2011. 超顺磁性免疫磁珠体系用于植物油中黄曲霉毒素B1的检测研究[J]. 分析测试学报,30(12):1345-1350. [Liu W W,Sun X L,Zhang Y Z,Fan H L,Chen W J,Li Z J. 2011. Research of the super paramagnetic immune magnetic beads system for detection aflatoxin B1 vegetable oil[J]. Journal of Instrumental Analysis,30(12):1345-1350.] doi:10.3969/j.issn.1004-4957.2011.12.003.
潘明飞,李诗洁,郭丹丹,王俊平,王硕. 2019. 间接竞争酶联免疫分析方法检测花生中黄曲霉毒素B1[J]. 中国食品学报,19(9):255-261. [Pan M F,Li S J,Guo D D,Wang J P,Wang S. 2019. Determination of aflatoxin B1 in peanut by indirect competitive enzyme-linked immunosorbent assay[J]. Journal of Chinese Institute of Food Science and Technology,19(9):255-261.] doi:10.16429/j.1009-7848. 2019.09.030.
秦姗姗. 2015. 农产品中农药残留分析方法研究及基质效应探讨[D]. 郑州:郑州大学. [Qin S S. 2015. Studies on determination of pesticides residues and matrix effects in agricultural products[D]. Zhengzhou:Zhengzhou University.]
任宏彬,贾晓婷,杨晓伟,杨蒲晨,张志华,郭素平. 2019. 高效液相色谱—串联质谱法快速检测粮油制品中黄曲霉毒素B1的含量[J]. 食品安全質量检测学报,10(19):6438-6442. [Ren H B,Jia X T,Yang X W,Yang P C,Zhang Z H,Guo S P. 2019. Rapid determination of aflatoxin B1 in grain and oil products by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality,10(19):6438-6442.] doi:10. 19812/j.cnki.jfsq11-5956/ts.2019.19.005.
宋卫得,厉雪芹,高尧华,刘培海,刘冰,卢志晓,孙灿. 2016. 高效液相色谱法测定木薯干中黄曲霉毒素B1的不确定度评定[J]. 酿酒科技,(4):93-95. [Song W D,Li X Q,Gao Y H,Liu P H,Liu B,Lu Z X,Sun C. 2016. Evaluation of the uncertainties in the determination of aflatoxins B1 in dry cassava by HPLC[J]. Liquor-Making Science & Technology,(4):93-95.] doi:10.13746/j.njkj.2015 415.
孙清. 2017. 食品及饲料中黄曲霉毒素的快速免疫检测试剂盒研究[D]. 北京:北京科技大学. [Sun Q. 2017. Study on rapid immunoassay test kits for aflatoxins in food and feed[D]. Beijing: University of Science and Technology Beijing.]
王春燕,蒋晓青,周泊. 2019. 基于Cu-TPA的电化学生物传感器对黄曲霉毒素B1的检测[J]. 高等学校化学学报,40(11):2301-2307. [Wang C Y,Jiang X Q,Zhou B. 2019. An electrochemical biosensor based on Cu-TPA for determination of aflatoxin B1[J]. Chemical Journal of Chinese Universities,40(11):2301-2307.] doi:10.7503/cjcu2019 0233.
王督,张文,李培武,张奇,张兆威,丁小霞,姜俊. 2014. 胶体金免疫层析法快速定量分析粮油农产品中黄曲霉毒素B1[J]. 中国油料作物学报,36(4):529-532. [Wang D,Zhang W,Li P W,Zhang Q,Zhang Z W,Ding X X,Jiang J. 2014. Rapid and quantitative of aflatoxin B1 in plant grain and oilseeds products using colloid golden immuno-chromatogrephic method[J]. Chinese Journal of Oil Crop Sciences,36(4):529-532] doi:10.7505/j.issn. 1007-9084.2014.04.016.
王国强,刘耀东,段胜和. 2019. 2019年上半年饲料及饲料原料霉菌毒素污染及调查报告[J]. 养猪,(6):17-20. [Wang G Q,Liu Y D,Duan S H. 2019. Mycotoxin contamination and investigation report of feed and feed ingredients in the first half of 2019[J]. Swine Production,(6):17-20.] doi:10.13257/j.cnki.21-1104/s.2019.06.008.
谢珲,章先,王歆,凡鹏程,时玉菲,方维焕. 2015. 黄曲霉毒素B1单克隆抗体的制备及间接竞争ELISA检测技术研究[J]. 微生物学通报,42(10):2033-2040. [Xie H,Zhang X,Wang X,Fan P C,Shi Y F,Fang W H. 2015. Preparation of anti-aflatoxin B1 monoclonal antibodies and its use in an indirect competitive ELISA for aflatoxin B1[J]. Microbiology China,42(10):2033-2040.] doi:10.13344/j.microbiol.china.141030.
謝洁. 2017. 基于黄曲霉毒素广谱性抗体的高效分离净化样品前处理技术研究[D]. 北京:中国农业大学. [Xie J. 2017. Study of high effective separation and purification of sample pretreatment techniques based on aflatoxins broad-spectrum antibody[D]. Beijing:China Agricultural University.]
许娇娇,黄百芬,周健,项瑜芝,任一平,蔡增轩. 2017. 直接稀释—超高效液相色谱—串联质谱法快速测定谷物及其制品中16种真菌毒素[J]. 中国食品卫生杂志,29(6):708-715. [Xu J J,Huang B F,Zhou J,Xiang Y Z,Ren Y P,Cai Z X. 2017. A dilute-and shoot approach using ultra high-performance liquid chromatograph-mass/mass spectrometry for 16 mvcotoxins analysis in cereals and products[J]. Chinese Journal of Food Hygiene,29(6):708-715.] doi:10.13590/ j.cjfh.2017.06.015.
杨利国,胡少昶,魏平华,郭爱珍. 1998. 酶免疫测定技术[M]. 南京:南京大学出版社:323-339. [Yang L G,Hu S C,Wei P H,Guo A Z. 1998. Enzyme immunoassay technology[M]. Nanjing:Nanjing University Press:323-339.]
余厚美,安飞飞,罗秀芹,陈松笔,欧文军. 2017. 淀粉磷酸化酶原核表达及单克隆抗体的制备[J]. 中国农学通报,33(14):28-32. [Yu H M,An F F,Luo X Q,Chen S B,Ou W J. 2017. Starch phosphorylase prokaryotic expression and preparation of monoclonal antibodies[J]. Chinese Agricultural Science Bulletin,33(14):28-32.]
詹屋强,王弘. 2015. 小分子物质酶联免疫分析方法的研究进展[J]. 食品安全质量检测学报,6(3):857-862. [Zhan W Q,Wang H. 2015. Research progress on enzyme-linked immunoassay for small molecules substances[J]. Journal of Food Safety and Quality,6(3):857-862.] doi:10.19812/j.cnki.jfsq11-5956/ts.2015.03.023.
张敏,张先舟,李聪,高浩,刘健慧,田益玲,马雯,李英军,檀建新. 2020. 黄曲霉毒素B1核酸适配体筛选和检测方法的建立[J]. 食品科学,41(24):295-303. [Zhang M,Zhang X Z,Li C,Gao H,Liu J H,Tian Y L,Ma W,Li Y J,Tan J X. 2020. Screening of aptamers for aflatoxin B1 and establishment of a method for aflatoxin B1 detection[J]. Food Science,41(24):295-303.] doi:10.7506/spkx1002-6630-20190628-369.
张杏,岳晓凤,丁小霞,李培武,余秋玉,谢华里,张奇,张兆威,张文. 2019. 中国西南花生产区黄曲霉菌分布、产毒力及花生黄曲霉毒素污染[J]. 中国油料作物学报,41(5):773-780. [Zhang X,Yue X F,Ding X X,Li P W,Yu Q Y,Xie H L,Zhang Q,Zhang Z W,Zhang W. 2019. Distribution and aflatoxin contamination by Aspergillus flavus in peanut from the southwest China[J]. Chinese Journal of Oil Crop Sciences,41(5):773-780.] doi:10.19802/j.issn.1007-9084.2018242.
张振文,李开绵. 2019. 木薯及其食品加工技术[M]. 北京:中国农业出版社. [Zhang Z W,Li K M. 2019. Cassava and its food processing technology[M]. Beijing:China Agriculture Press.]
章飚,李彦川,高雯,李细芬,张兰兰,李萍. 2018. 中药小分子单克隆抗体制备技术研究进展[J]. 中草药,49(10):2469-2476. [Zhang B,Li Y C,Gao W,Li X F,Zhang L L,Li P. 2018. Research progress on preparation of small molecular monoclonal antibodies in Chinese materia me-dics[J]. Chinese Traditional and Herbal Drugs,49(10):2469-2476.] doi:10.7501/j.issn.0253-2670.2018.10.032.
赵浩军,王坤,杨卫花,杨朝义. 2013. 高效液相色谱柱后光化学反应—荧光检测茶叶中黄曲霉毒素B1[J].茶叶科学,33(3):237-241. [Zhao H J,Wang K,Yang W H,Yang C Y. 2013. Determination of aflatoxins B1 in tea by high performance liquid chromatography-fluorescence detector with post-column photochemical reaction[J]. Journal of Tea Science,33(3):237-241.] doi:10.13305/j.cnki.jts. 2013.03.001.
朱艳梅,罗兴录,樊吴静. 2016. 木薯内源细胞分裂素含量对块根淀粉积累的影响[J]. 南方农业学报,47(8):1279-1284. [Zhu Y M,Luo X L,Fan W J. 2016. Effects of endogenous cytokinin content on starch accumulation in root tuber of cassava[J]. Journal of Southern Agriculture,47(8):1279-1284.] doi:10.3969/j:issn.2095-1191. 2016.08.1279.
Adegoke G O,Akinnuoye O F A,Akanni A O. 1993. Effect of processing on the mycoflora and aflatoxin B1 level of a cassava-based product[J]. Plant Foods for Human Nutrition,43(3):191-196. doi:10.1007/BF01886219.
Adegoke G O,Babalola A K,Akanni A O. 1991. Effects of sodium rnetabisulphite,hydrogen peroxide and heat on aflatoxin B1 in lafun and gari-two cassava products[J]. Die Nahrung,35(10):1041-1045.
Adjovi Y C S,Bailly S,Gnonlonfin B J G,Tadrist S,Querin A,Sanni A,Oswald I P,Puel O,Bailly J D. 2014. Analysis of the contrast between natural occurrence of toxigenic Aspergilli of the Flavi section and aflatoxin B1 in cassava[J]. Food Microbiology,38:151-159. doi:10.1016/j.fm. 2013.08.005.
Ediage E N,di Mavungu J D,Monbaliu S,van Peteghem C,de Saeger S. 2011. A validated multianalyte LC-MS/MS method for quantification of 25 mycotoxins in cassava flour,peanut cake and maize samples[J]. Journal of Agricultural and Food Chemistry,59(10):5173-5180. doi:10. 1021/jf2009364.
Ediage E N,Hell K,de Saeger S. 2014. A comprehensive study to explore differences in mycotoxin patterns from agro-ecological regions through maize,peanut,and cassava products:A case study,Cameroon[J]. Journal of agricultural and food chemistry,62(20):4789-4797. doi:10. 1021/jf501710u.
Satyanarayana T,Deshmukh S K,Deshpande M. 2019. Advancing frontiers in mycology & mycotechnology:Basic and applied aspects[M]. Singapore:Springer:377-404. doi:10.1007/978-981-13-9349-5.
(責任编辑 罗 丽)

