迪庆藏猪ADFP基因多态性及其组织表达特征
相德才 张斌 韩敏 刘韶娜 赵智勇 吴国权

摘要:【目的】从分子遗传学角度分析不同基因型迪庆藏猪群体不同组织中ADFP基因的表达差异,为迪庆藏猪的选育工作提供参考依据。【方法】利用PCR扩增测序方法对113头迪庆藏猪ADFP基因进行扩增测序,利用DNASTAR 5.0对序列进行比对分析及多态性位点(SNPs)检测;同时利用实时荧光定量PCR方法对迪庆藏猪不同组织中ADFP基因相对表达量进行检测,并运用SPSS 20.0分析ADFP基因多态性对迪庆藏猪群体不同组织中ADFP基因表达水平的影响。【结果】在迪庆藏猪ADFP基因外顯子6上发现3个SNPs,分别为SNP1(C→T)、SNP2(C→T)和SNP3(T→C),其中SNP1和SNP2位点属于低度多态(PIC/He<0.25),SNP3位点属于中度多态(0.25<PIC/He<0.5)。迪庆藏猪不同组织中ADFP基因相对表达量存在显著差异(P<0.05,下同),皮下脂肪中相对表达量最高,其次为肺脏、肝脏、脾脏、肾脏、腿肌和背肌,心脏中相对表达量最少;另外,ADFP基因SNPs不同基因型迪庆藏猪群体中各组织的相对表达量也存在显著差异,尤其在SNP2位点杂合基因型群体肾脏中相对表达量显著高于纯合基因型群体肾脏中相对表达量,表明ADFP基因SNPs变异对迪庆藏猪组织中ADFP基因表达具有影响。【结论】ADFP基因SNPs变异对迪庆藏猪组织中ADFP基因会产生差异表达,进而影响机体脂肪沉积,ADFP基因可作为迪庆藏猪肌内脂肪沉积的候选基因。
关键词:迪庆藏猪;ADFP基因;多态性;脂肪沉积
中图分类号:S828.89 文献标志码: A 文章编号:2095-1191(2021)10-2872-08
Abstract:【Objective】This study aimed to analyze the expression difference of ADFP gene in different tissues of Diqing Tibetan pig with different genotypes from the perspective of molecular genetics, so as to provide a reference for breeding of Diqing Tibetan pig. 【Method】In this study, the ADFP gene of 113 Diqing Tibetan pigs were amplified using PCR and sequenced, and the sequence alignment and the polymorphic sites(SNPs) were detected with DNASTAR 5.0. Meanwhile, the real-time fluorescence quantitative PCR(qPCR) was used to detect the relative expression of the ADFP gene in tissues of Diqing Tibetan pigs, and the SPSS 20.0 was used to analyze the effect of ADFP gene polymorphism on its expression in the tissues of Diqing Tibetan pigs. 【Result】Three SNP1(C→T), SNP2(C→T) and SNP3(T→C) were found on exon 6 of ADFP gene in Diqing Tibetan pig, and SNP1 and SNP2 were low polymorphic(PIC/He<0.25) and SNP3 was moderate polymorphic(0.25<PIC/He<0.5). There were significant differences in the relative expression levels of ADFP gene in different tissues of Diqing Tibetan pigs(P<0.05, the same below). Subcutaneous fat had the highest relative expression level, followed by lung, liver, spleen, kidney, leg muscle and back muscle, heart had the lowest expression level. In addition, there were also significant differences in the relative expression levels of ADFP gene polymorphisms among different genotypes in the Diqing Tibetan pig. Especially, the relative expression of the gene in the heterozygous genotype groups at SNP2 was significantly higher than that in the homozygous genotype groups, the results showed that the polymorphisms of ADFP gene had an effect on the expression of ADFP gene in tissues of Diqing Tibetan pig. 【Conclusion】The difference of ADFP gene polymorphism sites can cause differential expression of ADFP gene in tissues of Diqing Tibetan pig, and then affect fat deposition in the body, ADFP gene can be used as a candidate gene for fat deposition in Diqing Tibetan pig。
Key words: Diqing Tibentan pig;ADFP gene;polymorphism;fat deposition
Foundation item:Major Science and Technology Project of Yunnan (202102AE090039);Yunnan Applied Basic Research Project(2017FD055,2018FD001);Yunnan Animal Science and Veterinary Institute Applied Basic Research Project(2019RW008)
0 引言
【研究意義】脂肪沉积受肌肉中脂肪细胞数量或脂肪细胞沉积速度的影响,其中,脂肪分化相关蛋白(Adipose differentiation-related protein,ADFP)可能是脂肪沉积性状的候选基因(Desruisseaux et al.,2007)。猪ADFP基因由8个外显子组成,全长约13 kb,位于1号染色体q2.3~q2.7上、微卫星标记SW2185和SW974之间(Nie et al.,2005)。猪ADFP基因cDNA(1848 bp)含有一个1377 bp的开放阅读框,编码一个由459个氨基酸组成的蛋白(Kim et al.,2005)。脂肪分化相关蛋白(ADFP)覆盖在磷脂蛋白脂滴表面,其参与巨噬细胞的脂质代谢(Wang et al. 1999),可上调脂肪酸的生成(Imamura et al.,2002),同时参与脂质转移(Schultz et al.,2002),促进脂滴的形成并储存脂肪酸(Listenberger et al.,2007)。因此,研究与肌内脂肪沉积相关的候选基因及其分子机制已成为合理提高肌内脂肪含量的重要方向。【前人研究进展】ADFP基因的遗传变异可能与背脂厚度(BF)和肌内脂肪(IMF)性状的表型变异有关(Imamura et al.,2002),奶山羊ADFP基因过表达也会显著促进乳腺上皮细胞中的脂质积累(余康,2014);ADFP基因在地方鸡不同组织的表达量变化在脂肪沉积过程中发挥调控作用(张斌等,2016;相德才等,2017;Li et al.,2018)。奶牛ADFP基因超表达会促进乳腺上皮细胞中脂滴含量的显著增加(庞坤等,2019)。大量相关研究表明,ADFP基因与肌内脂肪沉积有关,可将ADFP基因作为调控猪肌内脂肪沉积的一个候选基因。Kim等(2005)研究发现ADFP基因可作为猪肌内脂肪沉积和大理石纹特征的候选基因。ADFP基因多态性与酮体性状具有相关性,且ADFP基因表达量在脂肪含量较高的组织中呈升高趋势(Davoli et al.,2010)。顾丽菊等(2016)研究表明ADFP基因在地方猪不同组织中的差异表达与脂肪沉积有关。Cui等(2016)研究3个猪品种肌肉中ADFP基因相对表达量时,发现ADFP基因在猪的脂肪沉积和调节中存在相关性。Zhao等(2020)发现ADFP基因表达水平差异与猪肌内脂肪含量高低有关。【本研究切入点】迪庆藏猪为云南地方良种,属于典型的高原藏猪种,具有抗逆性强、耐高寒、耐缺氧、耐粗饲、瘦肉率高及肉鲜嫩等优点,且香味特殊、营养丰富(国家畜禽资源委员会,2011)。肌内脂肪(Intramuscular fat, IMF)含量是评价猪肉品质的一个重要指标,与肉的嫩度、含水量和口感呈正相关(Wood et al.,2004;Lu et al.,2008;Hausman et al.,2009),但至今有关ADFP基因调控迪庆藏猪肌内脂肪沉积过程及脂肪沉积遗传规律的研究鲜见报道。【拟解决的关键问题】利用PCR扩增测序和实时荧光定量PCR分析ADFP基因多态性变化对ADFP基因在迪庆藏猪各组织中相对表达量的影响,从分子遗传学方面阐述迪庆藏猪不同基因型在不同组织中脂肪沉积过程中的影响,为建立迪庆藏猪的分子标记筛选和分子标记辅助育种提供理论基础。
1 材料与方法
1. 1 试验材料的采集和保存
随机挑选6月龄的迪庆藏猪共113头,采集耳组织,置于装有75%酒精的冻存管中,-70 ℃保存。挑选其中13头迪庆藏猪进行屠宰试验,采集其心脏、肝脏、脾脏、肺脏、肾脏、腿肌、胸肌和皮下脂肪等组织样品,立即置于装有RNA Save液的冻存管中,-70 ℃保存。
1. 2 基因组DNA的提取、扩增及多态性检测
1. 2. 1 基因组DNA提取 使用组织/血液基因组DNA提取试剂盒提取迪庆藏猪耳组织DNA,提取步骤参见试剂盒说明书,1.0%琼脂糖凝胶电泳检测DNA提取效果。
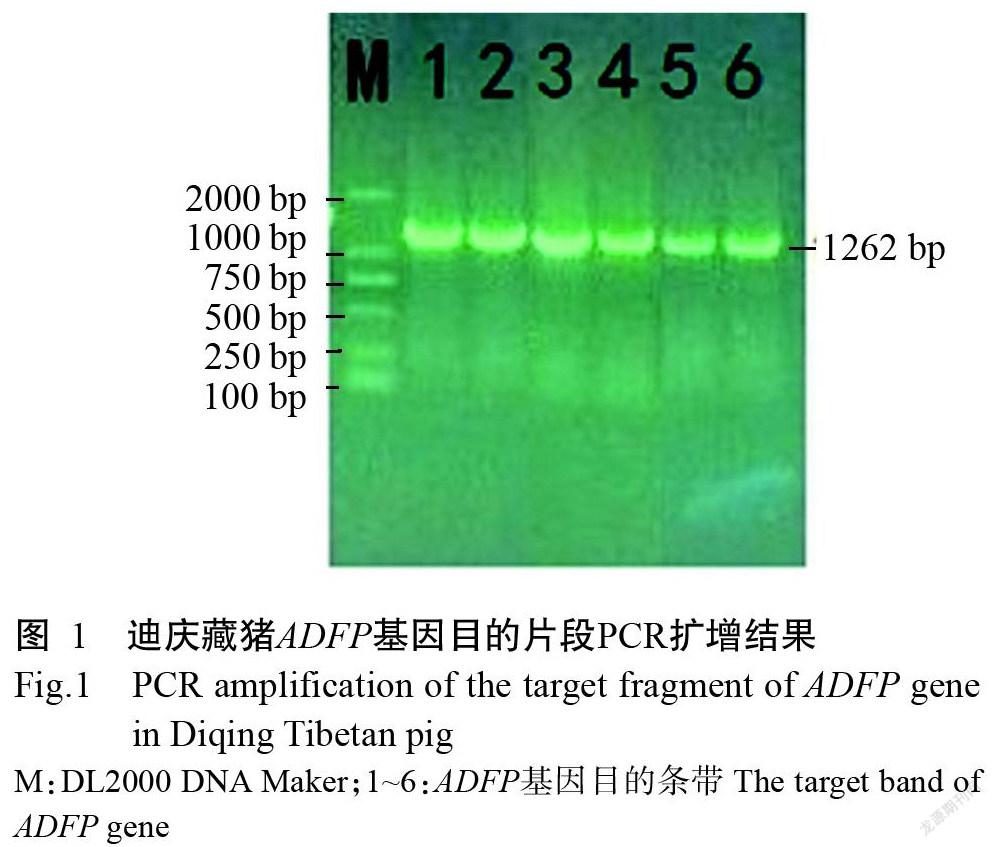
1. 2. 2 引物设计 利用Primer Premier 5.0,参考GenBank已发布的猪ADFP全基因序列(NC_010443.5),对迪庆藏猪ADFP基因设计1对特异性引物(F:5'-CCCTATCTCCCCATGAAAATATGC-3';R:5'-CAGT GGTGTTCTAGAAGCTAAGAG-3'),目的片段为1262 bp,委托英潍捷基(上海)贸易有限公司合成。
1. 2. 3 PCR扩增及测序 使用Master Mix试剂对113头迪庆藏猪耳组织DNA样品进行PCR扩增,25.0 μL扩增体系:Master Mix 12.5 μL,10 μmol/L上、下游引物各1.0 μL,DNA模板(约50 ng)2.0 μL,补ddH2O至25.0 μL。扩增反应条件:94 ℃预变性3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,进行40个循环;72 ℃延伸7 min;4 ℃保存。使用1.5%琼脂糖凝胶电泳对PCR扩增产物进行检测,检测合格后送至中美泰和生物技术(北京)有限公司进行单向(正向)测序。
1. 2. 4 多态性位点(SNPs)检测及遗传分析 使用DNASTAR 5.0进行序列比对检测SNPs,SeqMan软件分析SNPs。参考张斌等(2020)的方法计算:多态性(SNP)位点的基因型频率Xa=(2Naa+Nab)/2N,式中,Xa为等位基因a的频率,Naa为基因型aa的个体数,Nab为基因型ab的个体数,N为个体总数;等位基因频率Xaa=Naa/N,式中,Xaa为基因型aa的频率,Naa为基因型aa的个体数,N为总的个体数;杂合度He=1-Σ(Pi)2,式中,Pi表示某群体第i个等位基因的基因频率;多态信息含量PIC=1−[i=1nP2i−i=1n=1j=i+1n2P2iP2j],式中,Pi和Pj分别表示第i和第j个等位基因在群体中的频率,n为等位基因数。
1. 3 基因表达量检测
1. 3. 1 总RNA提取及反转录 总RNA提取采用天根TRNzol-A+总RNA试剂直接从组织中提取总RNA。利用超微量核酸蛋白分析仪检测RNA纯度(OD260/OD280=1.8~2.0)。使用天根FastQuant cDNA第一链合成试剂盒中的反转录试剂合成cDNA,反应条件参见试剂盒说明书。
1. 3. 2 引物设计 利用Primer Premier 5.0针对目的基因ADFP(XM_005660075.3)mRNA区域设计了1对引物,内参基因GAPDH(NM_205518.1)基因引物参考前人已发表的引物(张斌等,2020)(表1)。
1. 3. 3 实时荧光定量PCR 使用SuperReal PreMix Plus(SYBR Green)试剂盒进行荧光实时定量PCR试验,优化后的反应体系(20.0 μL): 2×SuperReal PreMix 10.0 μL,上、下游引物(10 μmol/L)各0.6 μL;cDNA 1.0 μL;补ddH2O至20.0 μL。每个样品设置3个重复。定量扩增条件:95 ℃ 3 s;60 ℃ 30 s;72 ℃ 20 s,循环40次,最后增加熔解曲线。
1. 4 统计分析
使用Excel 2010计算各样品Ct值,利用2-ΔΔCt法进行相对定量分析。运用SPSS 20.0完成目的基因相对表达量间的多重比较(Duncan法)。
2 结果与分析
2. 1 迪庆藏猪ADFP基因PCR扩增及序列分析结果
迪庆藏猪ADFP基因目的片段PCR扩增结果如图1,扩增产物无非特异性扩增。且扩增片段与引物设计片段大小一致。
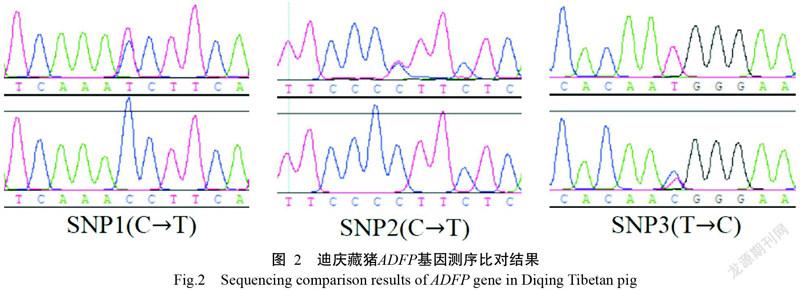
对113份PCR扩增产物进行测序分析,测序结果与GenBank已公布的猪ADFP基因序列一致。在测序序列中发现3个SNPs(SNP1、SNP2和SNP3),均位于外显子6上,均只存在2种基因型(图2),分别是SNP1(C→T)、SNP2(C→T)和SNP3(T→C)。
2. 2 迪庆藏猪ADFP基因SNPs位点的遗传分布情况
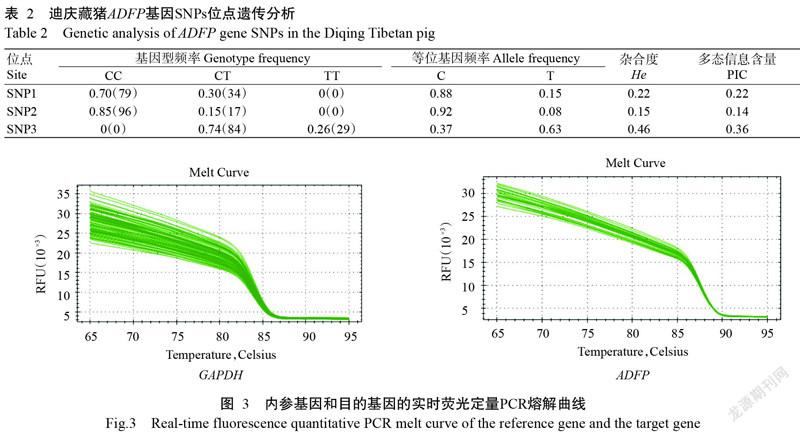
由表2可知,在迪庆藏猪群体中,ADFP基因SNP1、SNP2和SNP3位点的优势基因型分别为CC型(0.70)、CC型(0.85)和CT型(0.74),优势等位基因分别为C(0.88)、C(0.92)和T(0.63)。通过计算各SNPs位点的He和PIC,发现迪庆藏猪群体中SNP1和SNP2位点属于低度多态(PIC/He<0.25),而SNP3位点属于中度多态(0.25<PIC/He<0.5),说明迪庆藏猪ADFP基因SNP1和SNP2位点自然选择和人工选择程度较大,而SNP3位点自然选择和人工选择程度较小。
2. 3 迪庆藏猪不同组织中ADFP基因的相对表达量
对13头迪庆藏猪不同组织样品进行目的基因和内参基因相对表达量检测,通过观察熔解曲线(图3)可看出,目的基因和内参基因的实时荧光定量PCR熔解曲线单一,没有产生引物二聚体和非特异性产物,说明2个基因的实时荧光定量PCR扩增效果良好。
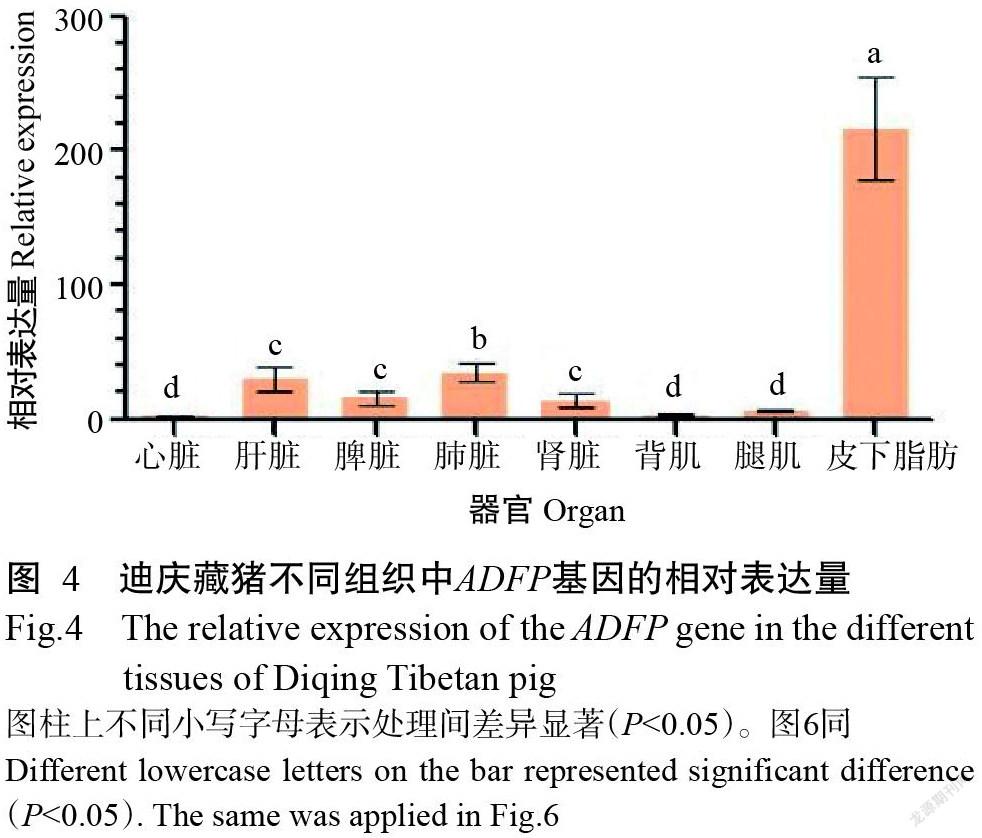
以编号892迪庆藏猪心脏组织中ADFP基因Ct值的平均值为对照,计算其余迪庆藏猪各组织中ADFP基因的相对表达量。由图4可知,ADFP基因在迪庆藏猪心脏、肝脏、脾脏、肺脏、肾脏、背肌、腿肌和皮下脂肪等组织均有表达,皮下脂肪中ADFP基因的相对表达量显著高于其他组织中ADFP基因的相对表达量(P<0.05,下同),肺脏中ADFP基因的相对表达量显著高于心脏、背肌和腿肌中ADFP基因的相对表达量。
2. 4 不同基因型對迪庆藏猪群体中ADFP基因表达的影响
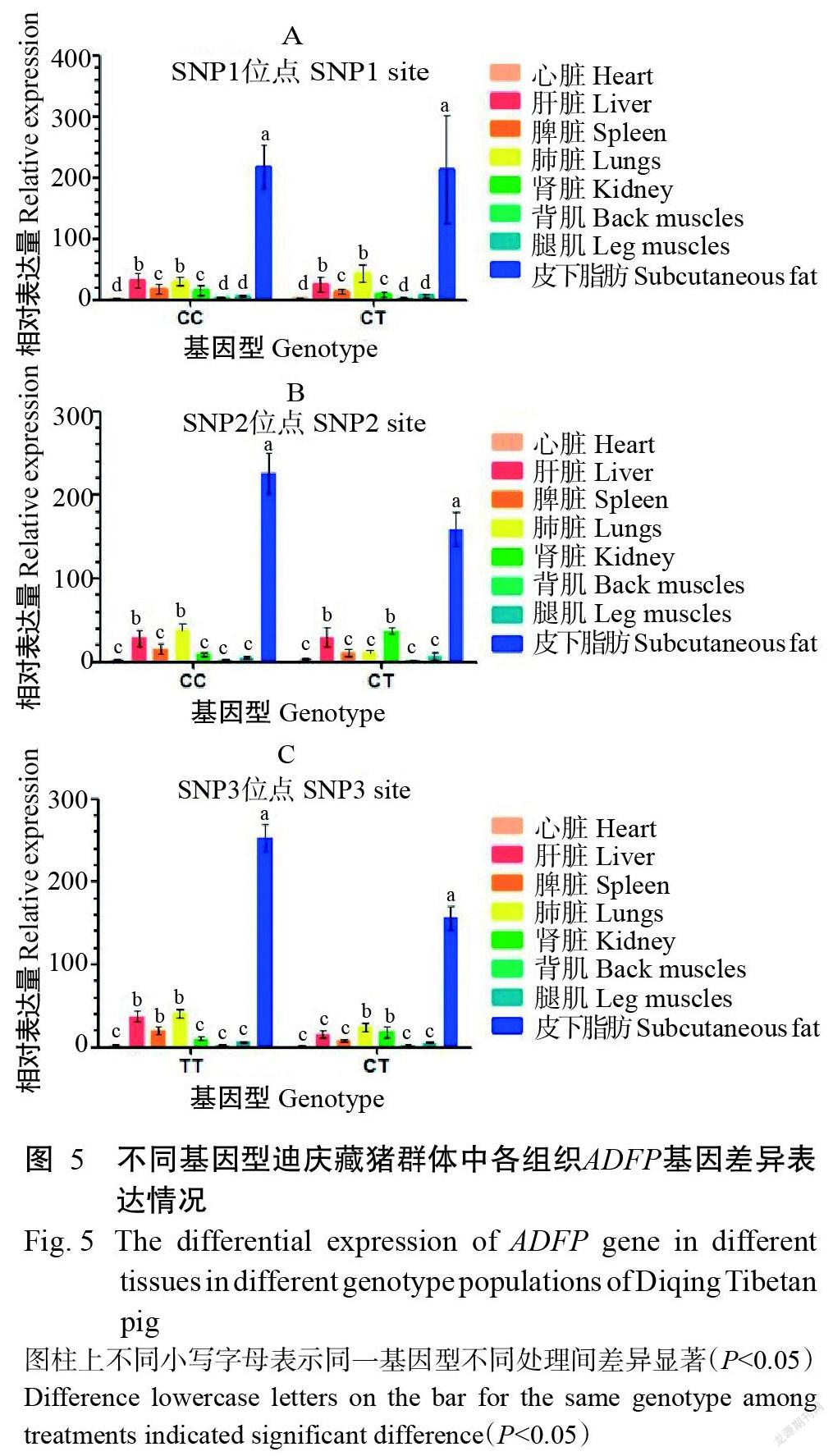
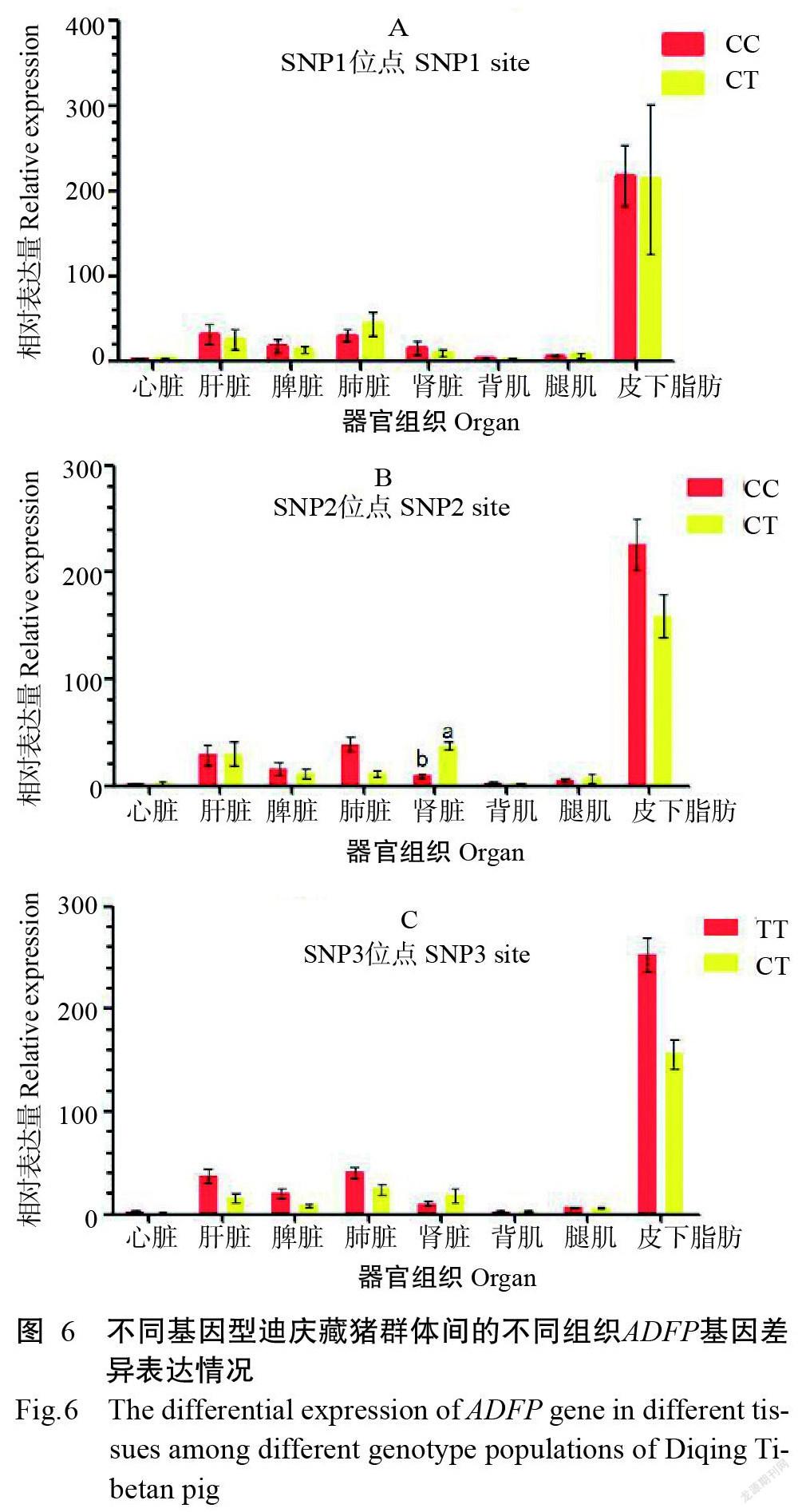
由图5可知,在13头迪庆藏猪3个SNPs位点纯合和杂合群体中,皮下脂肪中ADFP基因相对表达量都是最高的,且显著高于其他组织中ADFP基因相对表达量。如图5-A所示,在迪庆藏猪SNP1位点纯合(CC)群体中,肝脏和肺脏中ADFP基因相对表达量显著高于心脏、背肌和腿肌中ADFP基因相对表达量;在杂合(CT)群体中,肝脏和肺脏中ADFP基因相对表达量显著高于心脏、背肌和腿肌中ADFP基因相对表达量。如图5-B所示,在迪庆藏猪SNP2位点纯合(CC)群体中,肝脏和肺脏中ADFP基因相对表达量显著高于其他组织(除皮下脂肪)中ADFP基因相对表达量;在杂合(CT)群体中,肝脏和肾脏中ADFP基因相对表达量显著高于心脏、脾脏、肺脏、背肌和腿肌中ADFP基因相对表达量。在迪庆藏猪SNP3位点纯合(CC)群体中,ADFP相对表达量趋势与SNP2位点纯合(TT)群体中表达量趋势相同;在杂合(CT)群体中,肺脏和肾脏中ADFP基因相对表达量显著高于其他组织(除皮下脂肪)中ADFP基因相对表达量。
迪庆藏猪不同基因型群体不同组织中ADFP基因相对表达量如图6所示。由图6-A和图6-C可知,在迪庆藏猪SNP1和SNP3位点不同基因型群体中,ADFP基因相对表达量在纯合基因型群体和杂合基因型群体各组织中均无显著差异(P>0.05,下同)。由图6-B可知,在迪庆藏猪SNP2位点不同基因型群体中,杂合基因型群体肾脏中ADFP基因相对表达量显著高于纯合基因型群体肾脏中ADFP基因相对表达量,在2个基因型群体其他组织中ADFP基因相对表达量无显著差异。
3 讨论
在许多不同类型的哺乳动物细胞中,细胞内的中性脂质储存在由三酰基甘油和胆固醇酯核心组成的离散脂滴中(Brasaemle et al.,1997)。ADFP是一种脂滴相关蛋白,最初在脂肪分化早期时作为诱导蛋白被发现。Kim等(2005)研究发现在多个猪种中ADFP基因均存在多态性,并推测ADFP可能是猪脂肪沉积的候选基因。赵雪莲(2005)克隆获得梅山猪第4、第5和第7内含子序列,在与韩国本土猪ADFP基因结构比较时发现,梅山猪在第4内含子和第7内含子上均发生了SINE缺失。顾丽菊等(2015)在2个猪种ADFP基因中筛查到5个SNPs,其引起ADFP基因mRNA二级结构、编码蛋白二级结构及三级结构变化。本研究对迪庆藏猪ADFP基因进行了多态性检测,在第6外显子上检测出3个SNPs位点,分别是SNP1(C→T)、SNP2(C→T)和SNP3(T→C),针对不同基因型的迪庆藏猪群体进行了不同组织中ADFP基因相对表达量分析。
脂肪沉积过程中ADFP基因主要调控甘油三酯的形成,所以不同组织中ADFP基因表达水平也可从另一个方面反映该组织脂肪沉积潜力。已有研究表明,在大多数的脂质聚集细胞中均发现了ADFP表达(Mishra et al.,2004),且ADFP表达是脂质聚集的标志(Jiang et al.,1992)。ADFP基因在畜禽不同组织中均有表达,不同组织中也存在差异表达(崔景香,2011;Xiang et al.,2017;Li et al.,2018;Zhang et al.,2019)。ADFP表达水平可调控多种细胞内的脂肪含量,ADFP基因过表达或欠表达能增加或降低细胞内脂肪含量(Chang et al.,2006)。赵雪莲(2005)利用半定量RT-PCR检测发现ADFP基因在梅山猪脑和脂肪组织中的表达量最高,其次为睾丸、肝脏、心脏、脾脏、肠和肌肉组织,在肾脏中的表达量最低。顾丽菊等(2016)研究发现ADRP基因在地方猪不同组织中均有表达,且不同组织中的差异表达可能与脂肪沉积有关。本研究利于实时荧光定量PCR方法检测迪庆藏猪不同组织中ADFP基因表达水平,发现在8种组织中均有表达且存在一定差异,在皮下脂肪中的表达量最高,具体表现为皮下脂肪>肺脏>肝脏>脾脏>肾脏>腿肌>背肌>心脏,与前人研究结果存在一些差异。ADFP基因在猪前体脂肪细胞分化过程中起到促进作用,同时与脂滴的形成相关,能上调脂滴的含量(赵永艳,2014)。Davoli等(2010)研究表明意大利杜洛克猪ADFP基因多态性与酮体性状具有相关性,且肌间脂肪含量较高的猪ADFP基因表达水平较高。Zhao等(2020)研究发现ADFP基因在肌内脂肪含量较高的组织中表达量比在肌内脂肪含量较低的组织中表达量高,且存在显著性差异,说明ADFP基因可能与猪肌内脂肪含量高低有关。本研究分析了ADFP基因多态性在不同迪庆藏猪群体中对ADFP基因相对表达量的影响,结果发现不同基因型迪庆藏猪ADFP基因在不同组织中也存在显著差异表达;另外,ADFP基因在SNP2位点杂合群体肾脏中相对表达量显著高于纯合群体肾脏中相对表达量,表明ADFP基因SNPs变异对迪庆藏猪组织中ADFP基因表达具有影响。
4 结论
ADFP基因在迪庆藏猪不同组织中均有表达,并存在差异表达。ADFP基因SNPs变异对迪庆藏猪组织中ADFP基因表达会产生差异表达,进而影响机体脂肪沉积,SNP2位点可作为迪庆藏猪选育工作的一个分子遗传标记。
参考文献:
崔景香. 2011. 猪肌内脂肪沉积相关基因的mRNA表达及功能分析[D]. 泰安:山东农业大学. [Cui J X. 2011. Intramuscular fat deposition related genes mRNA expression and functional analysis in pigs[D]. Tai’an:Shandong Agricultural University.]
国家畜禽遗传资源委员会. 2011. 中国畜禽遗传资源志 猪志[M]. 北京:中国农业出版社:364-368. [China National Commission of Animal Genetic Resources. 2011. Animal genetic resources in China(pigs)[M]. Beijing:China Agriculture Press:364-368.]
顾丽菊,任麗群,燕志宏,张依裕,宋高翔,田松军,刘华钧,杨秀江,杨通斌. 2015. 宗地花猪和从江香猪ADRP基因多态性及生物信息学分析[J]. 基因组学与应用生物学,34(11):2395-2401. [Gu L J, Ren L Q, Yan Z H, Zhang Y Y, Song G X, Tian S J, Liu H J, Yang X J, Yang T B. 2015. Ploymorphism and bioinformatics analysis of ADRP gene in pigs of Zongdihua and Congjiangxiang[J]. Geno-mics and Applied Biology,34(11):2395-2401.] doi:10. 13417/ j.gab.034.002395.
顾丽菊,燕志宏,林鹏飞,任丽群,李平,田松军,魏小红,张芸. 2016. ADRP基因在宗地花猪及其杂交猪不同组织中的表达分析[J]. 基因组学与应用生物学,35(8):1939-1943. [Gu L J, Yan Z H, Lin P F, Ren L Q, Li P, Tian S J, Wei X H, Zhang Y. 2016. Expression analysis of ADRP gene in different tissues from Zongdihua pig and bi-crossbreeding pig[J]. Genomics and Applied Biology,35(8):1939-1943.] doi:10.13417/j.gab.035.001939.
龐坤,朱松波,常磊,孙娅莉,韩立强. 2019. 奶牛ADRP基因超表达细胞株的建立及对细胞脂滴的影响[J]. 中国兽医学报,39(8):1604-1608. [Pang K, Zhu S B,Chang L,Sun Y L,Han L Q. 2019. Establishment of bovine ADRP overexpression cell line and its effect on lipid droplet[J]. Chinese Journal of Veterinary Science,39(8):1604-1608.] doi:10.16303/j.cnki.1005-4545.2019.08.30.
相德才,赵智勇,张斌,饶军,覃兴合,李晶. 2017. 盐津乌骨鸡ADFP、FATP1和ApoB基因表达量变化及其与脂肪性状的相关分析[J]. 中国畜牧杂志,53(9):33-37. [Xiang D C,Zhao Z Y,Zhang B,Rao J,Qin X H,Li J. 2017. Expression of ADFP,FATP1,ApoB and correlation analysis of relative quantity and fat depositionin Yanjin Black-bone chicken[J]. Chinese Journal of Animal Science,53(9):33-37.] doi:10.19556/j.0258-7033.2017-09-033.
余康. 2014. 奶山羊ADRP基因对GMEC脂滴的影响及其分子机制的初步研究[D]. 杨凌:西北农林科技大学. [Yu K. 2014. Effects of ADRP gene of Dairy goat to lipid droplets in GMEC(goat mammary gland epithelial cells) and its preliminary molecular mechanism exploration[D]. Yang-ling: Northwest A&F University.]
张斌,韩敏,相德才,刘韶娜,沙茜,张桂生,赵智勇,赵彦光. 2020. 滇陆猪Nramp1基因多态性对其在组织中表达的影响[J]. 南方农业学报,51(1):202-208. [Zhang B,Han M,Xiang D C,Liu S N,Sha Q,Zhang G S,Zhao Z Y,Zhao Y G. 2020. Effects of Nramp1 gene polymorphism on its expression in the tissues of Dianlu pig[J]. Journal of Southern Agriculture,51(1):202-208.] doi:10.3969/j.issn.2095-1191.2020.01.026.
张斌,赵智勇,相德才,王啟华,段天才,王传禹,张兴旺,李晶. 2016. 武定鸡APOB、ADFP、FATP1基因表达量变化及其与脂肪沉积的相关性[J]. 中国家禽,38(24):11-17. [Zhang B,Zhao Z Y,Xiang D C,Wang Q H,Duan T C,Wang C Y,Zhang X W,Li J. 2016. Correlation analysis on expression of ADFP, FATP1 and APOB genes and fat deposition in Wuding chicken[J]. China Poultry,38(24):11-17.] doi:10.16372/j.issn.1004-6364.2016.24.003.
赵雪莲. 2005. 猪ADFP基因的克隆、染色体定位及其生物学功能研究[D]. 武汉:华中农业大学. [Zhao X L. 2005. Cloning, chromosome mapping and study on the functions of pig ADFP gene[D]. Wuhan: Huazhong Agricultural University.]
赵永艳. 2014. 脂肪分化相关蛋白(ADRP)基因对猪IMF含量影响的研究[D]. 南京:南京农业大学. [Zhao Y Y. 2014. Study on the effect of adipose differention related proten gene of porcine IMF content[D]. Nanjing: Nanjing Agricultural University.]
Brasaemle D L,Barber T,Wolins N E,Serrero G,Blanchette-Mackie E J,Londos C. 1997. Adipose differentiation-related protein in an ubiquitously expressed lipid storage droplet-associated protein[J]. Journal of Lipid Research,38(11):2249-2263. doi:10.1016/S0022-2275(20)34939-7.
Chang H J,Li L,Paul A,Taniguchi S,Nannegari V,Heird W C,Chan L. 2006. Protection against fatty liver but normal adipogenesis in mice lacking adipose differentiation-related protein[J]. Molecular and Cellular Biology,26(3):1063-1076. doi:10.1128/MCB.26.3.1063-1076.2006.
Cui J X,Chen W,Liu J,Xu T,Zeng Y Q. 2016. Study on quantitative expression of PPARγ and ADRP in muscle and its association with intramuscular fat deposition of pig[J]. SpringerPlus,5:1501. doi:10.1186/s40064-016-3187-0.
Davoli R,Gandolfi G,Braglia S,Comella M,Zambonelli P,Buttazzoni L,Russo V. 2010. New SNP of the porcine Perilipin 2(PLIN2) gene, association with carcass traits and expression analysis in skeletal muscle[J]. Molecular Biology Reports,38:1575-1583. doi:10.1007/s11033-010-0266-0.
Desruisseaux M S,Nagajyothi,Trujillo M E,Tanowitz H B,Scherer P E. 2007. Adipocyte, adipose tissue, and infectious disease[J]. Infection and Immunity,75(3):1066-1078. doi:10.1128/IAI.01455-06.
Hausman G J,Dodson M V,Ajuwon K M,Azain M J, Barnes K M,Guan L L,Jiang Z H,Poulos S, Sainz R, Smith S B, Spurlock M,Novakofski J,Fernyhough Culver M E, Bergen W G. 2009. Board-invited review: The biology and regulation of preadipocytes and adipocytes in meat animals[J]. Journal of Animal Science,87(4):1218-1246. doi:10.2527/jas.2008-1427.
Imamura M,Inoguchi T,Ikuyama S,Taniquchi S,Kobayashi K,Nakashima N,Nawata H. 2002. ADRP stimulates lipid accumulation and lipid droplet formation in murine fibroblasts[J]. AJP Endocrinology and Metabolism,283(4):775-783. doi:10.1152/ajpendo.00040.2002.
Jiang H P,Harris S E,Serrero G. 1992. Molecular cloning of a differentiation-related mRNA in the adipogenic cell line 1246[J]. Cell Growth & Differentiation,3:21-30. doi:10.1.1.962.3791.
Kim T H,Choi B H,Chang G W,Lee K T,Lee H Y,Lee J H,Kim K S,Park C K,Moran C. 2005. Molecular characterization and chromosomal mapping of porcine adipose differentiation-related protein(ADRP)[J]. Journal of Animal Breeding and Genetics,122(4):240-246. doi:10. 1111/j.1439-0388.2005.00518.x.
Li J,Zhao Z Y,Xiang D C,Zhang B,Xiong F. 2018. Expression of APOB, ADFP and FATP1 and their correlation with fat deposition in Yunnan’s top six famous chicken breeds[J]. British Poultry Science,59(5):494-505. doi:10.1080/00071668.2018.1490494.
Listenberger L L,Ostermeyer-Fay A G,Goldberg E B,Brown W J,Brown D A. 2007. Adipocyte differentiation-related protein reduces lipid droplet association of adipose triglyceride lipase and slows triacylglycerol turnover[J]. Journal of Lipid Research,48(12):2751-2761. doi:10.1194/ jlr.M700359-JLR200.
Lu P,Li D F,Yin J D,Zhang L Y,Wang Z Y. 2008. Flavour differences of cooked longissimus muscle from Chinese indigenous pig breeds and hybrid pig breed(Duroc×Landrace×Large White)[J]. Food Chemistry,107(4):1529-1537. doi:10.1016/j.foodchem.2007.10.010.
Mishra R,Emancipator SN,Miller C,Kern T,Simonson M S. 2004. Adipose differentiation-related protein and regulators of lipid homeostasis identified by gene expression profiling in the murine db/db diabetic kidney[J]. American Journal of Physiology,286(5):913-921. doi:10.1152/ajprenal.00323.2003.
Nie T,Zhao X L,Qiu H,Xia T,Chen X D,Gan L,Feng S Q,Lei T,Dai M H,Yang Z Q. 2005. Sequence analysis and map assignment of pig SREBF2 and ADFP[J]. Animal Genetics,36(5):455-457. doi:10.1111/j.1365-2052.2005. 01344.x.
Schultz C J,Torres E,Londos C,Torday J S. 2002. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells[J].American Journal of Physiology. Lung Cellular and Molecular Physiology,283(2):L288-L296. doi:10.1152/ajplung.00204.2001.
Wang X K,Reape T J,Li X,Rayner K,Webb C L,Burnand K G,Lysko P G. 1999. Induced expression of adipophilin mRNA in human macrophagcs stimulated with oxidized low-density lipoprotein and in atherosclerotic lesions[J].FEBS Letters,462(1-2):145-150. doi:10.1016/S0014-5793(99)01521-5.
Wood J D,Nute G R,Richardson R I,Whittington F M,Southwood O,Plastow G,Mansbridge R,da Costa N,Chang K C. 2004. Effects of breed, diet and muscle on fat deposition and eating quality pigs[J]. Meat Science,67(4):651-667. doi:10.1016/j.meatsci.2004.01.007.
Xiang D C,Zhao Z Y,Zhang B,He Z C,Wan Q S,Li J. 2017. Correlation analysis of relative expression of APOB, ADFP and FATP1 with lipid metabolism in daweishan mini chickens[J]. Brazilian Journal of Poultry Science,19(1):151-158. doi:10.1590/1806-9061-2016-0357.
Zhao Y Y,Lin X S,Liu K Q,Tian Y,Zhang L F,Wei W,Chen J. 2020. Promoter CpG methylation status affects ADRP gene expression level and intramuscular fat content in pigs[J]. Italian Journal of Animal Science,19(1):783-791. doi:10.1080/1828051X.2020.1729261.
Zhang B,Xiang D,Yang R,Yang L,Li J, Zhao Z. 2019. Varia-tions in tissue-specific expression of adipose differentiation-related protein gene in two native Yunnan chicken breeds[J]. Brazilian Journal of Poultry Science,21(1):1-7. doi:10.1590/1806-9061-2017-0780.
(責任编辑 邓慧灵)

