广西涠洲岛3种海参共附生细菌多样性及其延缓衰老活性分析
银江林 李蜜 易湘茜 刘永宏 于清武 高程海
摘要:【目的】明確广西涠洲岛海参共附生细菌多样性,筛选出具有延缓衰老活性的菌株,为挖掘延缓衰老活性的新化合物提供菌种资源。【方法】选用9种选择性培养基对来源于广西涠洲岛的3种海参[异色哈威参(Havelockia versicolor)、玉足海参(Holothuria leucospilota)和方柱翼手参(Colochirus quadrangularis)]共10份样品进行共附生细菌分离纯化,基于16S rRNA测序分析其多样性,并以秀丽隐杆线虫(Caenorhabditis elegans)为模型评价共附生细菌发酵粗提物的延缓衰老活性。【结果】从广西涠洲岛3种海参中共分离获得63株共附生菌株,隶属于3门4纲14目25科35属,以放线菌纲(Actinobacteria)为优势菌群,共有31株(占49.21%);放线菌GXIMD LM0085和GXIMD LM0159有可能为潜在新种,与对应有效发表菌株Kocuria assamensis、K. salsicia的相似性分别为97.38%和97.00%。不同培养基分离获得的海参共附生细菌在属类水平上存在明显的数量差异,以M9培养基分离获得的菌属数量最多(19属28株),P7培养基分离获得的最少(仅6属6株);在筛选确定的35属细菌中,仅Cobetia和嗜盐单胞菌属(Halomonas)在9种培养基均有生长分布,多达13个属仅在单一的培养基中生长。不同海参分离获得的共附生细菌数量排序为1#异色哈威参>方柱翼手参>2#异色哈威参>玉足海参,除了玉足海参外,其他3只海参体内的共附生放线菌相对丰度明显高于体表共附生放线菌相对丰度。线虫寿命试验发现,有6株共附生细菌的发酵粗提物能显著延长秀丽隐杆线虫寿命(P<0.05),分别是GXIMD LM0037(寡养单胞菌属)、GXIMD LM0005(链霉菌属)、GXIMD LM0071(副球菌属)、GXIMD LM0114(寡养单胞菌属)、GXIMD LM0099(原小单孢菌属)和GXIMD LM0032(短状杆菌属)。【结论】广西涠洲岛海域海参蕴含着多样性丰富的共附生细菌资源,具有潜在的新物种,且部分菌株具有延缓衰老活性,在延缓衰老活性物质挖掘及新型抗衰老药物研发方面具有巨大潜力。
关键词:海参;共附生细菌;多样性;延缓衰老;广西涠洲岛
中图分类号:S917.1 文献标志码: A 文章编号:2095-1191(2021)10-2904-09
Abstract:【Objective】In order to reveal the bacterial diversity and screen out the coepiphytic bacteria for new anti-aging compounds of sea cucumbers from Weizhou Island, Guangxi. 【Method】Nine kinds of media were used to cultivate and separate associated bacteria from 10 samples come from 3 species of sea cucumbers (Havelockia versicolor, Holothuria leucospilota, and Colochirus quadrangularis). 16S rRNA sequencing was applied to analyze the community diversity. C. elegans models were used to estimate the anti-aging activities of the coepiphytic bacteria metabolites. 【Result】A total of 63 species bacteria were isolated and identified, which belonging to 3 phyla, 4 classes, 15 orders, 25 families and 35 genera. The dominant microflora was Actinobacteria (31 strians, 49%), and 2 of them (GXIMD LM0085 and GXIMD LM0159) were identified to be putatively novel bacterial species, whose similarities to the published Kocuria assamensis and K. salsicia were 97.38% and 97.00%, respectively. Differences were found in the number of coepiphytic bacteria isolated from different media at genus level. The M9 medium had the largest number of strains and the richest diversity (19 genera, 28 strains). However, the P7 medium had the least number (6 genera, 6 strains). Among the identified 35 genera, only Cobetia and Halomonas were distributed in all 9 growth media, another 13 genus could grow in single medium. The number of symbiotic bacteria isolated from different sea cucumbers was in the order to sort as follows: 1# H. versicolor>C. quadrangularis>2# H. versicolor>H. leucospilota. For these sea cucumbers except H. leucospilota, the relative abundance of symbiotic actinomycetes in vivo were greatly higher than those on their surface. In the anti-aging research, the lifetime of C. elegans was significantly prolonged (P<0.05) by the crude extracts of GXIMD LM0037(Stenotrophomonas), GXIMD LM0005(Streptomyces), GXIMD LM0071(Paracoccus), GXIMD LM0114(Stenotrophomonas),GXIMD LM0099(Promicromonospora),and GXIMD LM0032(Brachybacterium). 【Conclusion】There are abundant marine coepiphytic bacteria and potential opportunity to discover new species in the sea cucumbers from Weizhou Island. Some bacteria show anti-aging activity, which provides huge potential in the research and development of anti-aging active substances and new anti-aging drugs.
Key words:sea cucumber; coepiphytic bacteria; diversity; anti-aging; Weizhou Island, Guangxi
Foundation item:Joint Fund of National Natural Science Foundation of China (U20A20101); Guangxi Natural Science Foundation (2020GXNSFGA297002); Scientific Research Group Foundation of Institute of Marine Drugs, Guangxi University of Chinese Medicine (2018ZD005-A06); Open Project of Institute of Marine Drugs, Guangxi University of Chinese Medicine (XP019069)
0 引言
【研究意义】目前,我国人口老龄化形势严峻,预计到2030年我国60岁以上老年人口规模将超过3.0亿人,到2050年将攀升至4.7亿人左右,65岁以上老年人口规模将从2020年的1.7亿人上升至3.6亿人。因衰老引起的老年病发病率逐年上升,而有效延缓衰老及预防老年病已成为应对人口老龄化的社会焦点。当前,临床上应用于抗衰老的药物大多数属于全合成药物,其不良反应较多,存在安全隐患(林韬等,2018),因此亟待研发出新型的天然抗衰老药物。庞大的海洋生态系统孕育着丰富的海洋微生物资源,尤其是高盐高压的特殊生境赋予微生物特殊的代谢途径,易产生结构新颖且生物活性显著的化合物,在药物研发领域具有广泛的应用前景(李韦霖等,2018;游竣驿,2019)。海洋共附生微生物是指与海洋动植物处于共生、共栖、寄生或附生的微生物(缪莉等,2002),海洋动植物作为宿主可为共附生微生物提供良好的生长环境,而共附生微生物代谢产生的各种活性物质有利于促进宿主代谢生长或提供化学保护(Fenical,1993;Jensen et al.,1998),即海洋共附生微生物能为研发延缓衰老药物提供新来源。【前人研究进展】海参隶属于棘皮动物门(Echinodermata)海参纲(Holothuroidea),其资源非常丰富,全球有1000多种,我国约有140种,主要分布于热带和温带地区(姜健等,2004;李妍等,2012)。海参富含增强免疫力、抗肿瘤、抗凝血、抗衰老及抗菌等生物活性物质(张梅秀等,2012),其蕴藏的共附生微生物资源也非常丰富,同样具有极高的开发利用价值。近年来,已有研究从马来西亚、印度尼西亚、日本等海域的海参中分离获得种类繁多的共附生微生物,发现潜在新物种,并证实部分菌株具有抗菌及降解多糖等生物活性(Farouk et al.,2007;Zhang et al.,2012;Wibowo et al.,2019)。国内针对海参共附生微生物的研究相对较少,且主要集中在北方的刺参(Stichopus japonicus)和仿刺参(Apostichopus japoni-cus)。孙奕和陈騳(1989)从刺参不同部位分离出359株细菌和57株酵母菌,并证实刺参不同部位的微生物具有不同的生物活性,包括降解褐藻酸鈉、琼脂、淀粉、几丁质、明胶及酪蛋白等。张文姬等(2011)从大连地区冬季和春季的仿刺参肠道中分离获得141株菌株,经16S rDNA序列测定和系统发育进化分析,发现这些菌株分布于假单胞菌属(Pseudomonas)、弧菌属(Vibrio)、芽孢杆菌属(Bacillus)、希瓦氏菌属(Shewanella)及交替假单胞菌属(Pseudoalteromonas)等10个属。李智等(2018)从福建吊笼养殖的海参肠道分离出95株菌株,包括31株潜在益生菌、37株潜在致病菌及27株普通肠道菌,从中筛选获得2株抑菌能力较强的益生菌,并确定其抑菌成分为环脂肽类化合物。李昌明 (2019)从山东威海市的海参肠道内容物中共分离获得226株菌株,隶属于4门49属102种,优势属为芽孢杆菌属,且有16株菌株具有褐藻胶降解能力。【本研究切入点】涠洲岛是广西北部湾海域最大的岛屿,全岛海岸线长26.43 km,其沿岸海域分布的珊瑚礁是我国珊瑚礁的北缘(王欣和黎广钊,2009;梁文等,2010)。涠洲岛海域分布有异色哈威参(Havelockia versicolor)、玉足海参(Holothuria leucospilota)及方柱翼手参(Colochirus quadrangularis)等海参,但至今鲜见针对这3种海参共附生微生物多样性及其活性分析的相关报道。【拟解决的关键问题】分析广西涠洲岛海域异色哈威参、玉足海参及方柱翼手参的共附生细菌多样性,筛选出具有延缓衰老活性的菌株,以期为挖掘延缓衰老活性的新化合物提供菌种资源。
1 材料与方法
1. 1 样品采集
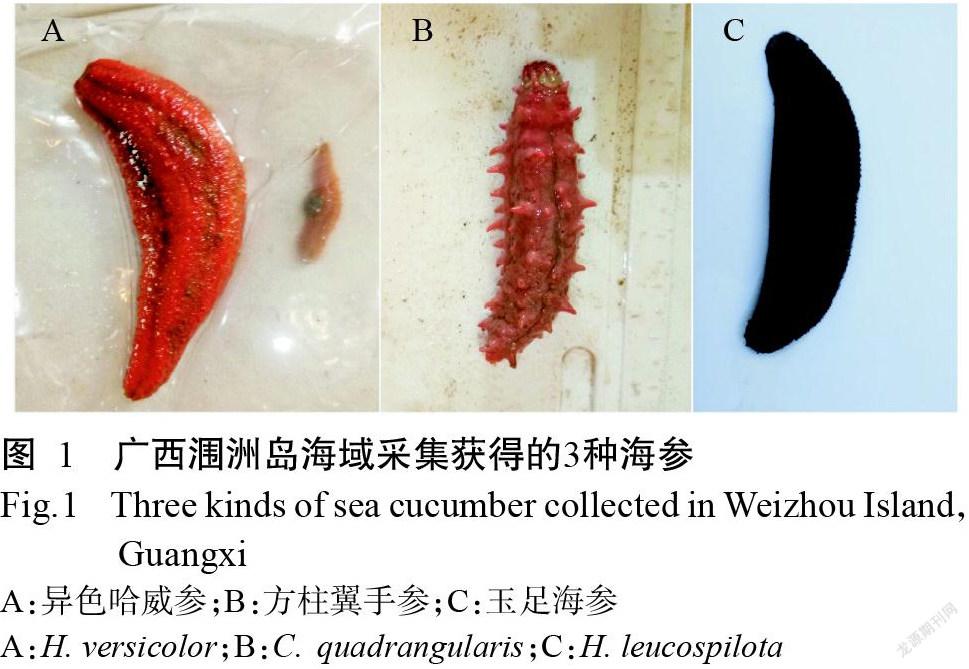
2018年5月在广西涠洲岛海域采集获得4只海参(图1),经广西中医药大学刘昕明博士鉴定,分别为2只异色哈威参、1只玉足海参及1只方柱翼手参。活体海参采集后放入装有适量海水的取样箱,及时送回实验室进行处理。以无菌水清洗干净海参体表,利用无菌手术剪在超净工作台中对海参进行解剖,剪取其肠道、胃和表皮组织各2.0 g,分别加入3.0 mL无菌水充分研磨均匀;将研磨得到的液体转移至无菌EP管中,即为海参样品原液,样品信息如表1所示。
1. 2 试验材料
野生型秀丽隐杆线虫(N2)、尿嘧啶缺陷型大肠杆菌(OP50)由广西科学院汪斌博士惠赠。Chelex-100树脂及2×Easy Taq SuperMix购自美国Bio-Rad公司;PCR引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3'和1492R:5'-GGTTACCTTGTTACGACTT-3')购自北京全式金生物技术股份有限公司;二甲基亚砜(DMSO)购自西陇科学股份有限公司;其他有机试剂均为国产分析纯。细菌分离培养基:M5(海藻糖—脯氨酸培养基)、M7(改良ISP5培养基)、M9(精氨酸—天冬酰胺培养基)、M10(葡萄糖—水解酪素培养基)、M11(棉籽糖—组氨酸培养基)、P7(酪氨酸—天冬酰胺培养基)、P3(燕麦培养基)、AGG(改良高氏培养基)及2216E培养基;细菌纯化与保藏培养基:改良ISP2固体培养基(酵母提取物2.0 g,麦芽提取物2.0 g,葡萄糖2.0 g,琼脂15.0 g,海水1000.0 mL);细菌发酵培养基:改良ISP2液体培养基。主要仪器设备:超净工作台(苏州安泰空气技术有限公司)、PCR仪(美国Bio-Rad公司)、凝胶成像系统(美国Bio-Rad公司)、HVE-110高压灭菌锅(日本Hirayama公司)、体视显微镜(日本Olypus公司)及恒温培养箱(上海精宏实验设备有限公司)。
1. 3 试验方法
1. 3. 1 细菌分离、纯化与保藏 采用梯度稀释法,以无菌水将海参样品原液制备成10-3和10-4的稀释液,涂布于9种细菌分离培养基上,置于28 ℃恒温培养箱中培养3~7 d;根据菌落颜色、大小及表面是否光滑等形态特征,挑选形态差异的菌落接种于改良ISP2固体培养基上进行重复划线分离,以获得单一菌落,记录菌落形态特征。纯化菌株以20%(v/v)甘油保藏于 -80 ℃超低温冰箱内。
1. 3. 2 细菌分子鉴定 参考周双清等(2010)的方法,以Chelex-100法提取的细菌基因组DNA为模板,以27F和1492R为引物,进行16S rRNA序列扩增。PCR反应体系25.0 μL:DNA模板1.0 μL,上、下游引物各1.0 μL,2×Easy Taq SuperMix 12.5 μL,ddH2O 9.5 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,进行34个循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,送至上海美吉生物医药科技有限公司广州分公司测序;运用DNAStar进行基因序列信息整理,基于EzBioCloud数据库(https://www.ezbiocloud.net/)进行序列比对分析。
1. 3. 3 细菌发酵粗提物制备 参考覃媚等(2016)的方法,将分离获得的菌株接种至装有ISP2液体培养基(300.0 mL)的三角瓶中,28 ℃下摇床(180 r/min)发酵培养7 d,发酵液用等量体积的乙酸乙酯萃取3次,取乙酸乙酯相经旋转蒸发仪减压浓缩,所得浸膏干燥后即为细菌发酵粗提物。
1. 3. 4 细菌发酵粗提物延缓衰老活性检测 以秀丽隐杆线虫(Caenorhabditis elegans)为模型,通过线虫寿命试验评价细菌发酵粗提物的延缓衰老活性(Lakowski and Hekimi,1998)。产卵期的线虫以M9缓冲液清洗,无菌离心后弃上清液,按1∶3的比例加入裂解液(5 mol/L NaOH+5% NaClO,2∶1混匀),振荡离心收集沉淀;沉淀以M9培养基清洗3次,转移至含OP50的NGM培养基中,20 ℃培养48 h后即获得L4期线虫。细菌发酵粗提物用1% DMSO配制成500 μg/mL的药液,以1% DMSO为空白对照,将L4期线虫挑至添加有50.0 μL药液的NGM培养基中培养,每组设2个板,每板挑取20条L4期线虫,培养当天记为0 d。隔天对培养线虫的生存及死亡情况进行观察记录,每2 d将线虫转移至新的含药NGM培养基中,直至线虫全部死亡。试验数据采用SPSS 22.0进行统计分析。
2 结果与分析
2. 1 海参共附生细菌的分离鉴定结果
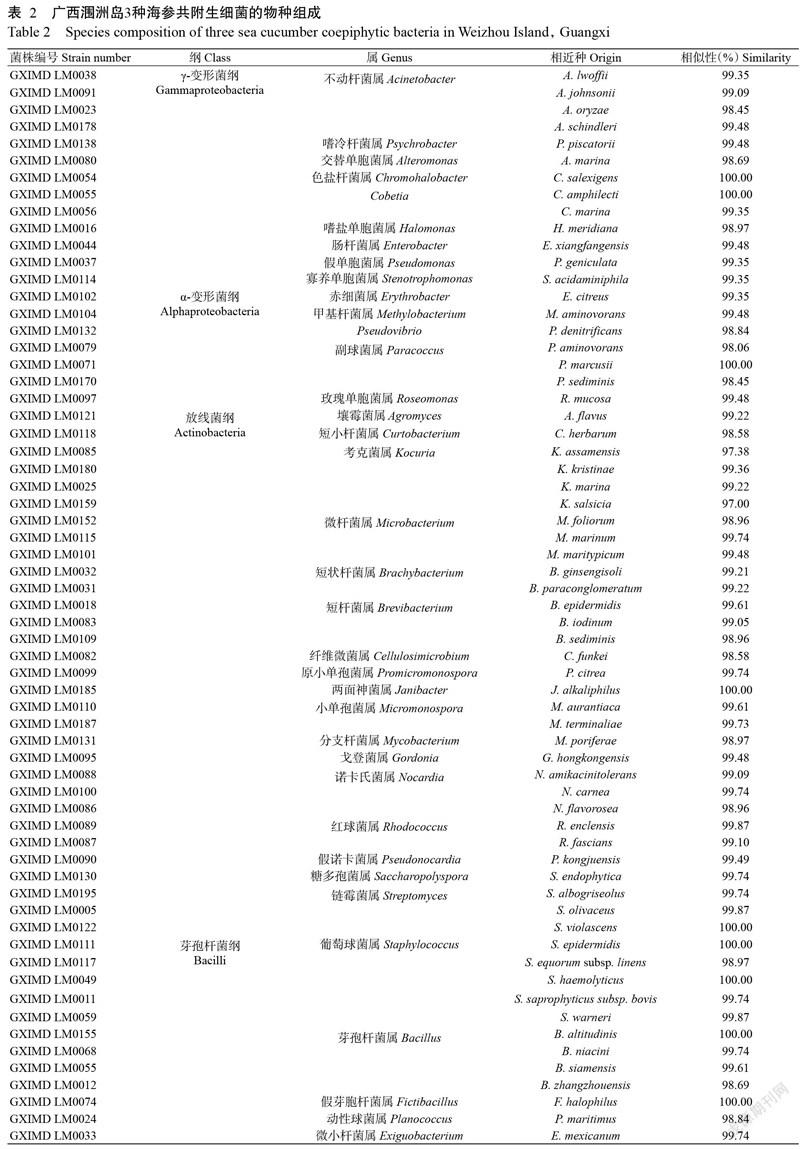
细菌分离纯化后,根据菌落顏色、大小及表面是否光滑等形态特征进行排重,共获得129株分离菌株,经16S rRNA序列比对分析,最终得到63株菌株,隶属于3门4纲14目25科35属(表2)。在纲分类水平上,放线菌纲(Actinobacteria)有31株17个属,γ-变形菌纲(Gammaproteobacteria)有13株9个属,α-变形菌纲(Alphaproteobacteria)有7株5个属,芽孢杆菌纲(Bacilli)有12株5个属。可见,放线菌纲为优势菌群,包含考克菌属(Kocuria)4株,链霉菌属(Streptomyces)、诺卡氏菌属(Nocardia)、微杆菌属(Microbacterium)和短杆菌属(Brevibacterium)各3株,短状杆菌属(Brachybacterium)、红球菌属(Rhodococcus)和小单孢菌属(Micromonospora)各2株, 短小杆菌属(Curtobacterium)、分支杆菌属(Mycobacterium)、假诺卡菌属(Pseudonocardia)、两面神菌属(Janibacter)、壤霉菌属(Agromyces)、糖多孢菌属(Saccharopolyspora)、纤维微菌属(Cellulosimicrobium)、原小单孢菌属(Promicromonospora)及戈登菌属(Gordonia)各1株。
根据16S rRNA序列最高相似性小于98.00%菌株为潜在新物种的归类原则(Stackebrandt and Ebers,2006),从广西涠洲岛3种海参样品中分离获得的放线菌GXIMD LM0085和GXIMD LM0159有可能为潜在新种,与对应有效发表菌株K. assamensis、K. salsicia的相似性分别为97.38%和97.00%。
2. 2 不同培养基分离的海参共附生细菌分布情况
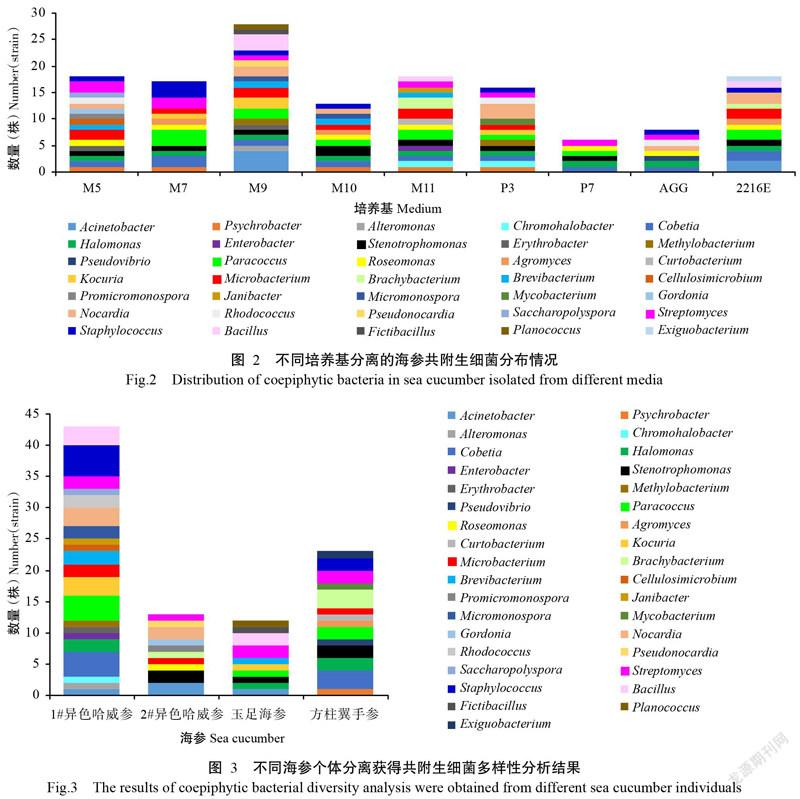
利用9种选择性培养基进行海参共附生细菌分离,结果(图2)发现在属类水平上存在明显的数量差异。其中,M9培养基分离获得的细菌种属数量最多,共19属28株;P7培养基分离获得的细菌种属数量最少,仅有6属6株。在分离获得的17属31株放线菌中,M5培养基获得的放线菌种属数量最多,共9属11株,分离效果最优;P7培养基分离获得的放线菌种属数量最少,仅得到1株放线菌。在最终筛选确定的35属细菌中,仅Cobetia和嗜盐单胞菌属(Halomonas)在9种培养基均有生长分布,多达13个属仅在单一的培养基中生长,其中,纤维微菌属、原小单孢菌属、戈登菌属和糖多孢菌属仅生长于M5培养基,交替单胞菌属(Alteromonas)、假诺卡菌属、假芽胞杆菌属(Fictibacillus)和动性球菌属(Planococcus)仅分离自M9培养基,肠杆菌属(Enterobacter)和短小杆菌属仅分离自M11培养基,分支杆菌属、Pseudovibrio、微小杆菌属(Exiguobacterium)则分别分离自P3培养基、AGG培养基和2216E培养基。可见,部分菌属对培养基具有高度的偏好性,采用多种培养基相结合可筛选获得多样性更丰富的海参共附生细菌。
2. 3 不同海参共附生细菌多样性分析结果
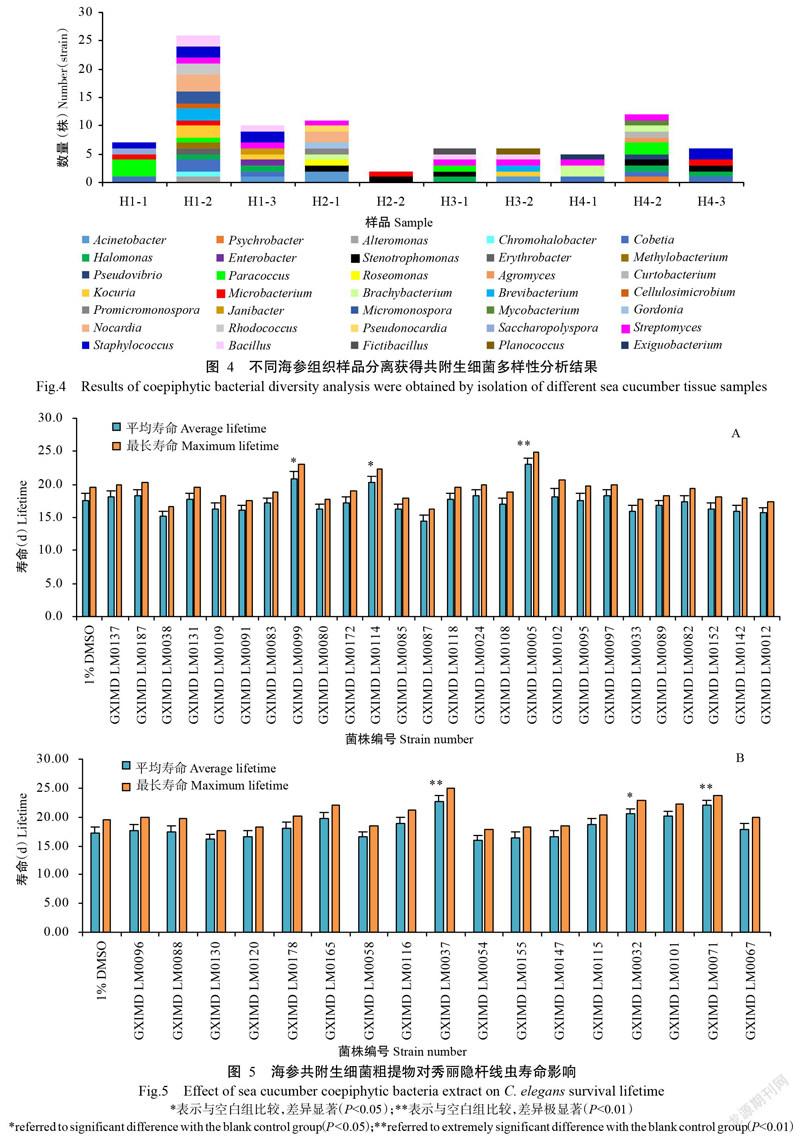
不同海参及其组织样品分离获得的共附生细菌种类和数量也存在明显差异(图3和图4)。不同海参分离获得的共附生细菌数量排序为1#异色哈威参>方柱翼手参>2#异色哈威参>玉足海参,不同海参组织样品分离获得的共附生细菌数量排序则表现为H1-2>H4-2=H2-1>H1-3>H1-1>H3-1=H3-2=H4-3>H4-1>H2-2。由此可见,以来自海参胃部的可培养共附生细菌最多,其多样性高于肠道和表皮组织,2#异色哈威参和玉足海参因个体太小未能获取胃部样品,因此其可培养共附生细菌多样性低于1#异色哈威參和方柱翼手参。
海参体内存在大量共附生放线菌(Wang et al.,2018)。Wibowo等(2019)利用Illumina MiSeq分析2只海参共附生细菌多样性时发现,海参内部放线菌相对丰度分别是体表的3.6和9.6倍。本研究结果表明,除了玉足海参外,其他3只海参体内的共附生放线菌相对丰度也明显高于体表共附生放线菌相对丰度,其中1#海参体内放线菌相对丰度是体表的5.33倍,2#海参体内放线菌相对丰度是体表的6.00倍,方柱翼手参体内放线菌相对丰度是体表的8.00倍。
2. 4 海参共附生细菌发酵粗提物延缓衰老活性分析结果
将分离到的海参共附生细菌分成2组,进行发酵粗提物延缓衰老活性检测,结果(图5)显示,有6株菌株的发酵粗提物能显著延长秀丽隐杆线虫寿命(P<0.05),分别是GXIMD LM0037(寡养单胞菌属)、GXIMD LM0005(链霉菌属)、GXIMD LM0071(副球菌属)、GXIMD LM0114(寡养单胞菌属)、GXIMD LM0099(原小单孢菌属)和GXIMD LM0032(短状杆菌属),其发酵粗提物培养的秀丽隐杆线虫寿命分别较空白对照组延长31.50%、31.13%、26.88%、18.81%、18.79%和18.50%。
3 讨论
近年来,许多学者通过优化培养基配方以期获得多样性更丰富的可培养微生物。Zhang等(2012)综合考虑海洋微生物生长环境的pH和盐度,设计出13种培养基用于分析玉足海参肠道菌群多样性。赵雅慧等(2018)基于原位环境的营养组成,设计不同营养物质及碳氮源组成的5种培养基,用于对比分析普通红树和盐碱地红树根际土壤细菌的多样性。本研究选用9种培养基对广西涠洲岛海参共附生细菌进行分离纯化,结果发现,以M9培养基分离获得的细菌种属数量最多,分离效果最佳;而M5培养基分离获得的放线菌数量最多,多样性最丰富,与姜舒等(2020)从真红树中筛选内生放线菌的结果一致。在35个菌属中,有13个属仅在单一的培养基中生长,说明不同微生物对培养基具有明显的偏好性,采用多种培养基相结合能满足不同微生物的生长需求,进而提高海参共附生细菌的筛选效率(Dupont et al.,2014)。随着宏基因组等高通量测序技术的发展,研究人员虽然通过免培养技术也能全面了解微生物多样性,但要深入研究微生物的生理特征、代谢产物及活性等内容,仍需通过可培养法获得纯培养菌株。因此,开发设计新型培养基、优化培养基配方、改进微生物分离方法仍是开发利用微生物资源及发掘具有生物活性微生物新物种的重要途径。
本研究利用多种选择性培养基对广西涠洲岛海参共附生细菌进行分离纯化,通过16S rRNA测序分析,共获得63 株共附生细菌,隶属于3门4纲14目25科35属,以放线菌纲(49.21%)为优势菌群,且发现有2株考克菌属菌株(GXIMD LM0085和GXIMD LM0159)为潜在新种。Zhang等(2012)研究发现,日本海域海参共附生细菌以放线菌门、变形杆菌门及厚壁菌门为主,其中厚壁菌门(56.7%)为优势菌门;Wibowo等(2019)对印度尼西亚海域2种海参共附生细菌进行多样性分析时发现,主要门类为放线菌门、变形杆菌门及厚壁菌门,以放线菌门(49.6%)为优势菌门。优势菌门间的差异可能与海参来源、食用沉积物及生长阶段有关(成功,2011;Gao et al.,2014;Wang et al.,2018)。海洋放线菌易产出潜在的活性物质,大量存在海洋沉积物中,而海参主要以生长环境的沉积物为食,其体内及体表共附生大量放线菌,是挖掘新型活性化合物的重要资源库。
此外,本研究以秀丽隐杆线虫为模型探究海参共附生细菌发酵粗提物的延缓衰老活性,结果发现,有6株菌株的发酵粗提物能显著延长线虫寿命。其中,GXIMD LM0037(寡养单胞菌属)、GXIMD LM0005(链霉菌属)发酵粗提物对秀丽隐杆线虫寿命延长了31.50%和31.13%,与100 μmol/L白藜芦醇(30.08%)及80 mg/L铁皮石斛多糖(30.54%)对线虫寿命的延长效果相当(王婷婷等,2015;李海春,2016);GXIMD LM0071(副球菌属)发酵粗提物对秀丽隐杆线虫寿命延长了26.88%,略高于100 μmol/L牛蒡木脂素及25 mg/L桑叶多酚的效果(Shan and Michael,2015;Zheng et al.,2014);GXIMD LM0114(寡养单胞菌属)、GXIMD LM0099(原小单孢菌属)及GXIMD LM0032(短状杆菌属)发酵粗提物分别延长秀丽隐杆线虫18.81%、18.79%和18.50%的寿命,略低于45 μmol/L淫羊藿苷(20.67%)及20 μmol/L淫羊藿次苷Ⅱ(20.00%)对线虫寿命的延长效果(蔡外娇,2012)。但具体是活性菌株发酵粗提物中的何种成分对秀丽隐杆线虫具有延缓衰老作用,尚有待进一步验证。
4 结论
广西涠洲岛海域海参蕴含着多样性丰富的共附生细菌资源,具有潜在的新物种,且部分菌株具有延缓衰老活性,在延缓衰老活性物质挖掘及新型抗衰老药物研发方面具有巨大潜力。
参考文献:
蔡外娇. 2012. 淫羊藿总黄酮、淫羊藿苷、淫羊藿次苷Ⅱ延长健康寿限及其作用机制的研究[D]. 上海:复旦大学. [Cai W J. 2012. Research on the effect and mechanism of EF,icariin and icariside II in extending healthspan[D]. Shanghai:Fudan University.]
成功. 2011. 仿刺参体表微生物多样性研究[D]. 大连:大连工业大学. [Cheng G. 2011. Study on the diversity of microorganizm carried by Apostichopus japonicus[D]. Dalian:Dalian Polytechnic University.]
姜健,楊宝灵,邰阳. 2004. 海参资源及其生物活性物质的研究[J]. 生物技术通讯,15(5):537-540. [Jiang J,Yang B L,Tai Y. 2004. Studies on resources and bioactive substances of sea cucumber[J]. Letters in Biotechnology,15(5):537-540.] doi:10.3969/j.issn.1009-0002.2004.05.033.
姜舒,李蜜,候师师,韩敏敏,银江林,高程海. 2020. 海南西海岸真红树内生放线菌多样性及其延缓衰老活性初筛[J]. 广西植物,40(3):327-334. [Jiang S,Li M,Hou S S,Han M M,Yin J L,Gao C H. 2020. Diversity and anti-aging activity of endophytic actinobacteria from true mangrove plants collected from the west coast of Hainan[J]. Guihaia,40(3):327-334.] doi:10.11931/guihaia.gxzw201904036.
李昌明. 2019. 海参肠道微生物多样性分析及菌株s12T褐藻胶裂解酶研究[D]. 济南:山东大学. [Li C M. 2019. Analysis of microbial diversity in the intestine of sea cucumber and studies on alginate lyase of strain s12T[D]. Jinan:Shandong University.]
李海春. 2016. 八种石斛多糖抗氧化、抗衰老活性的比较研究[D]. 广州:华南农业大学. [Li H C. 2016. Studies on anti-oxidation and anti-aging of polysaccharides from eight Dendrobium species[D]. Guangzhou:South China Agricultural University.]
李韦霖,徐睿航,张敬燕,张国庚. 2018. 海洋微生物活性物质研究进展[J]. 农村经济与科技,29(8):46. [Li W L,Xu R H,Zhang J Y,Zhang G G. 2018. Research development of marine microbial active substances[J]. Rural Economy and Science-Technology,29(8):46.] doi:10.3969/j.issn. 1007-7103.2018.08.032.
李妍,张付云,李云冰,王斌,张瑛. 2012. 海参及其共附生微生物的生物活性研究进展[J]. 食品研究与开发,33(6):223-226. [Li Y,Zhang F Y,Li Y B,Wang B,Zhang Y. 2012. Advances in biologocal activity of sea cucumber and symbiotic microorganism[J]. Food Research and Development,33(6):223-226.] doi:10.3969/j.issn.1005-6521.2012.06.063.
李智,黄晓山,郑宝东,邓凯波. 2018. 福建海参内源微生物多样性分析及益生菌抑菌机理初探[J]. 食品工业科技,39(12):137-141. [Li Z,Huang X S,Zheng B D,Deng K B. 2018. Analysis of endogenous microbial diversity of Fujian sea cucumber and probiotic mechanism[J]. Scien-ce and Technology of Food Industry,39(12):137-141.] doi:10.13386/j.issn1002-0306.2018.12.025.
梁文,黎广钊,范航清,农华琼,王欣. 2010. 广西涠洲岛珊瑚礁物种生物多样性研究[J]. 海洋通报,29(4):412-416. [Liang W,Li G Z,Fan H Q,Nong H Q,Wang X. 2010. Study on the species diversity of coral reef on Weizhou Island,Guangxi[J]. Marine Science Bulletin,29(4):412-416.] doi:10.3969/j.issn.1001-6392.2010.04.010.
林韬,李谭,赵育林,张萌,曾馨,龚冬梅. 2018. 抗衰老药物的研究进展[J]. 中国临床药理学杂志,34(20):2486-2488. [Lin T,Li T,Zhao Y L,Zhang M,Zeng X,Gong D M. 2018. Research progress of anti-aging drugs[J]. The Chinese Journal of Clinical Pharmacology, 34(20): 2486-2488.] doi:10.13699/j.cnki.1001-6821.2018.20.025.
缪莉,郑忠辉,苏文金. 2002. 共附生海洋微生物活性物质的研究进展[J]. 海洋通报,21(3):62-68. [Miao L,Zheng Z H,Su W J. 2002. Research development of bioactive substance of symbiotic and epibiotic marine microorgani-sms[J]. Marine Science Bulletin,21(3):62-68.] doi:10. 3969/j.issn.1001-6392.2002.03.010.
孙奕,陈騳. 1989. 刺参体内外微生物组成及其生理特性的研究[J]. 海洋与沼泽,20(4):300-307. [Sun Y,Chen D. 1989. The microbial composition of Stichopus japonicus and its physiological property[J]. Oceanologia et Limnologia Sinica,20(4):300-307.]
覃媚,于清武,竺利波,李菲,颜栋美,余炼,高程海. 2016. 三种江蓠共附生細菌多样性及抑菌活性分析[J]. 南方农业学报,47(11):1966-1973. [Qin M,Yu Q W,Zhu L B,Li F,Yan D M,Yu L,Gao C H. 2016. Diversity of epiphytic bacteria of three species of gracilaria and their bacteriostatic activities[J]. Journal of Southern Agriculture,47(11):1966-1973.] doi:10.3969/jissn.2095-1191. 2016.11.1966.
王婷婷,张玉瑶,王吉锡,刘洋,陈永春,姜国华. 2015. 白藜芦醇对秀丽隐杆线虫寿命的影响及其初步机制研究[J]. 神经药理学报,5(5):1-6. [Wang T T,Zhang Y Y,Wang J X,Liu Y,Chen Y C,Jiang G H. 2015. Effect of resveratrol on longevity of Caenorhabditis elegans and its potential mechanism[J]. Acta Neuropharmacologica,5(5):1-6.] doi:10.3969/j.issn.2095-1396.2015.05.001.
王欣,黎广钊. 2009. 北部湾涠洲岛珊瑚礁的研究现状及展望[J]. 广西科学院学报,25(1):72-75. [Wang X,Li G Z. 2009. The status and prospect of researches on coral reef in Weizhou island[J]. Journal of Guangxi Academy of Sciences,25(1):72-75.] doi:10.3969/j.issn.1002-7378. 2009.01.019.
游竣驿. 2019. 海洋微生物药物开发的研究进展[J]. 中国高新科技,(9):101-104. [You J Y. 2019. Research progress on marine microbial drug development[J]. China High-Tech,(9):101-104.] doi:10.13535/j.cnki.10-1507/n.2019.09.22.
张梅秀,王锡昌,刘源. 2012. 海参生物活性研究进展[J]. 天然产物研究与开发,24(8):1151-1159. [Zhang M X,Wang X C,Liu Y. 2012. Advances on the research of sea cucumber biological activities[J]. Natural Product Research and Development,24(8):1151-1159.] doi:10.3969/j.issn.1001-6880.2012.08.031.
张文姬,侯红漫,张公亮,李琴艳,杜晨萌. 2011. 仿刺参肠道可培养微生物多样性研究[J]. 食品工业科技,32(9):149-151. [Zhang W J,Hou H M,Zhang G L,Li Q Y,Du C M. 2011. Study on diversity of intestine cultivable microorganisms from Apostichopus japonicus[J]. Scien-ce and Technology of Food Industry,32(9):149-151.] doi:10.13386/j.issn1002-0306.2011.09.001.
赵雅慧,张舒琳,吴家法,黄新静,吴霜,张政,杨立芳,龙寒,禤金彩,姜明国. 2018. 山口红树林根际土壤可培养细菌多样性及其活性筛选[J]. 海洋学报,40(8):138-151. [Zhao Y H,Zhang S L,Wu J F,Huang X J,Wu S,Zhang Z,Yang L F,Long H,Xuan J C,Jiang M G. 2018. Screening the diversity and activity of culturable bacteria isolated from mangrove rhizosphere soil at Shankou[J]. Acta Oceanologica Sinica,40(8):138-151.] doi:10.3969/j.issn.0253-4193.2018.08.014.
周双清,黄小龙,黄东益,胡新文,陈吉良. 2010. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报,26(2):123-125. [Zhou S Q,Huang X L,Huang D Y,Hu X W,Chen J L. 2010. A rapid method for extrac-ting DNA from actinomycetes by Chelex-100[J]. Biotechnology Bulletin,26(2):123-125.] doi:10.13560/j.cnki.biotech.bull.1985.2010.02.024.
Dupont S,Carre-Mlouka A,Domart-Coulon I,Vacelet J,Bourguet-Kondracki M L. 2014. Exploring cultivable bacteria from the prokaryotic community associated with the carnivorous sponge Asbestopluma hypogea[J]. FEMS Microbiology Ecology,88(1):160-174. doi:10.1111/1574-6941.12279.
Farouk A E,Hamid Ghouse F A,Ridzwan BH. 2007. New bacterial species isolated from Malaysian sea cucumbers with optimized secreted antibacterial activity[J]. American Journal of Biochemistry and Biotechnology,3(2):60-65. doi:10.3844/ajbbsp.2007.60.65.
Fenical W. 1993. Chemical studies of marine bacteria:Deve-loping a new resource[J]. Chemical Reviews,93(5):1673-1683. doi:10.1021/cr00021a001.
Gao F,Tan J,Sun H L,Yan J P. 2014. Bacterial diversity of gut content in sea cucumber (Apostichopus japonicus) and its habitat surface sediment[J]. Journal of Ocean University of China,13:303-310. doi:10.1007/s11802-014-2078-7.
Jensen P R,Jenkins K M,Porter D,Fenical W. 1998. Evidence that a new antibiotic flavone glycoside chemically defends the sea grass Thalassia testudinum against Zoosporic fungi[J]. Applied and Environmental Microbiology,64(4):1490-1496. doi:10.1128/AEM.64.4.1490-1496. 1998.
Lakowski B,Hekimi S. 1998. The genetics of caloric restriction in Caenorhabditis elegans[J]. Proceedings of the National Academy of Sciences of the United States of America,95(22):13091-13096. doi:10.1073/pnas.95.22. 13091.
Shan S,Michael W. 2015. Natural lignans from Arctium lappa as antiaging agents in Caenorhabditis elegans[J]. Phytochemistry,117:340-350. doi:10.1016/j.phytochem. 2015.06.021.
Stackebrandt E,Ebers J. 2006. Taxonomic parameters revisi-ted:Tarnished gold standards[J]. Microbiology Today,8(4):6-9.
Wang Q,Zhang X M,Chen M Y,Li W T,Zhang P D. 2018. Comparison of intestinal microbiota and activities of digestive and immune-related enzymes of sea cucumber Apostichopus japonicus in two habitats[J]. Journal of Oceannology and Limnology,36(3):990-1001. doi:10. 1007/s00343-018-7075-z.
Wibowo J T,Kellermann M Y,Versluis D,Putra M Y,Murnia-sih T,Mohr K I,Wink J,Engelmann M,Praditya D F,Steinmann E,Schupp P J. 2019. Biotechnological potential of bacteria isolated from the sea cucumber Holothuria leucospilota and Stichopus vastus from Lampung,Indonesia[J]. Marine Drugs,17(11):635. doi:10.3390/md17110635.
Zhang X C,Nakahara T,Miyazaki M,Nogi Y,Taniyama S,Arakawa O,Inoue T,Kudo T. 2012. Diversity and function of aerobic culturable bacteria in the intestine of the sea cucumber Holothuria leucospilota[J]. The Journal of General and Applied Microbiology,58(6):447-456. doi:10.2323/jgam.58.447.
Zheng S Q,Liao S T,Zou Y X,Qu Z,Shen W Z,Shi Y. 2014. Mulberry leaf polyphenols delay aging and regulate fat metabolism via the germline signaling pathway in Caenorhabditis elegans[J]. Age,36(6):9719. doi:10.1007/s 11357-014-9719-z.
(責任编辑 兰宗宝)

