基于核磁共振氢谱的组学技术在中药制药过程研究中的应用与展望
赵芳 李文竹 潘坚扬 杨嘉誉 瞿海斌
摘要 中药制药过程工艺复杂,过程控制水平与产品质量直接相关。进行制药过程质量评价与质量控制研究,提高制药过程理解,对保证中药制剂的安全性与有效性具有重要的意义。随着核磁共振技术的发展,核磁共振氢谱已在中药质量评价与代谢组学研究等领域得到广泛应用。本文主要介绍了氢核磁共振组学技术应用于中药炮制、提取等制药过程研究时,在辨识过程化学标志物、研究代谢物在过程中的转化转移规律等方面的应用进展,同时展望了基于氢核磁共振技术的过程组学研究在中药制药领域的应用前景。
关键词 核磁共振氢谱;组学技术;中药;制药过程;质量控制
Application and Prospects of 1H NMR-based Omics Study in Pharmaceutical Processes of Traditional Chinese Medicine
ZHAO Fang1,2,3,LI Wenzhu1,2,PAN Jianyang1,2,YANG Jiayu1,2,QU Haibin1,2
(1 Pharmaceutical Informatics Institute,College of Pharmaceutical Sciences,Zhejiang University,Hangzhou 310058,China; 2 Innovation Center in Zhejiang University,State Key Laboratory of Component-Based Chinese Medicine,Hangzhou 310058,China; 3 Hisun Biopharmaceutical Co.,Ltd.,Hangzhou 311400,China)
Abstract The pharmaceutical process of Chinese medicinal is complex,and the level of process control is directly related to product quality.Carrying out research on the quality evaluation and quality control of the pharmaceutical process and improving the understanding of the pharmaceutical process are of great significance to ensure the safety and effectiveness of Chinese medicinal preparations.With the development of nuclear magnetic resonance technology,hydrogen nuclear magnetic resonance spectroscopy has been widely used in the fields of quality evaluation of Chinese medicinal and metabolomics research.This paper mainly introduces the application progress of proton nuclear magnetic resonance omics technology in the research of Chinese medicinal processing,extraction and other pharmaceutical processes,identifying process chemical markers,studying the transformation and transfer law of metabolites in the process,etc.The application prospect of process omics research of proton nuclear magnetic resonance (1H NMR) in the field of traditional Chinese medicine and pharmaceuticals.
Keywords Proton nuclear magnetic resonance (1H NMR); Omics technology; Chinese medicinal; Pharmaceutical process; Quality control
中圖分类号:R282.4文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.23.002
核磁共振(Nuclear Magnetic Resonance,NMR)技术最早被应用于天然产物领域是在20世纪60年代。数十年来,NMR技术的应用范围得到了不断拓展。作为一种全面的化学信息获取技术,NMR能够用于高通量、定性定量分析中药制剂及其生产过程中间体的多类化学成分,在有机和生化分子的识别和结构鉴定,复杂混合物中各个化合物的精确定量测定和多组分分析,以及与化学计量学技术结合的代谢组学研究发挥了极大的作用。
在中成药生产过程中,各工艺单元中发生的化学物质组成变化不清是导致中成药质量难控的根本原因之一。本文就基于核磁共振氢谱(1H Nuclear Magnetic Resonance Spectra,1H NMR)技术的组学分析在中药制药过程研究中的应用及展望进行综述。
1 中药制药过程质量控制
为克服现有质量标准的不足,提高质量一致性、可控性和溯源性,刘昌孝院士提出了中药质量标志物(Quality Marker,Q-Marker)的概念[1],明确了Q-Marker应具有“存在性”“特有性”“可测性”“功效关联性”以及“溯源和传递性”5大特点,进一步明确了中药质量认识、质量评价和质量控制应着眼于中药形成全过程的质量属性及物质基础的复杂、动态变化规律,即质量“传递与溯源”的要求,以期实现阐明最终药效物质基础和建立可溯源的全程质量控制体系的目的[2]。中药所含的化学成分较为复杂,在临床上应用时,多种成分协同起效,但也有一些成分可能导致不良反应的产生,因此仅对少数几个药效成分的检测和控制并不能保证中药的安全性。一些中药特殊剂型,如中药注射液,其冗长的、复杂的生产工艺流程中,各工艺单元中化学物质组成变化不清,同时存在药材质量的批次或产地等差异,制药过程全成分监测困难,过程理解不易,导致其质量控制难度大大提高[3-4]。药品质量源于设计(Quality by Design)[5]的理念已在中药领域引起广泛重视,通过获取中药制药过程各工艺单元化学信息,分析各工艺单元前后综合化学信息与关键质量属性的变化情况,揭示生产工艺的内在规律,提高中药制药的过程理解,进而实现过程控制,使制药过程波动与风险可控,是进一步提高中药质控水平、推进中药制造智能化的重要途径。
随着分析化学、计算机辅助技术与化学计量学的迅猛发展,中药质量分析技术已逐步发展为定量分析(药效成分、活性成分、指标成分或主要化学成分,以及有毒有害成分)与色谱指纹图谱、红外(Infrared,IR)、近红外(Near-infrared,NIR)等光谱分析并重的质量分析模式[6-7]。现行的中药质量分析着眼于药效成分、活性成分、指标成分或主要化学成分的定量分析及指纹图谱相似度评价,主要采用色谱分析技术,而针对中药制剂中的糖类、氨基酸、有机酸、核苷等初生代谢产物的检测与控制则较为少见。
针对中药制剂中初生代谢物的分析,高通量的核磁共振技术进入了研究人员的视野[8-9]。1H NMR波谱中,相应信号的位置和强弱反映了检测对象中含氢元素的代谢物的结构特征和相对含量[10],是有机化合物结构鉴定、反应动力学研究及植物代谢组学研究等领域的重要技术方法。PMR在中药材、中药提取物及中药制剂的研究中具有诸多优点[11-15]:样品无需复杂预处理,前处理简便且能够保留待测样品的理化特征;分析脉冲多样化,检测适用范围广;分析过程快速;光谱化学信息丰富,可解释性高;通过内标或外标法辅助可实现定量核磁共振(Quantitative Nuclear Magnetic Resonance,qNMR)分析技术;NMR仪器性能稳定,重现性好,精密度高,构建的方法稳健性强。综上所述,NMR技术在中药制药过程全成分分析中优势显著,适合作为中药制剂生产过程质量控制方法研究的有力工具。
2 基于1H NMR组学技术的中药制药过程分析
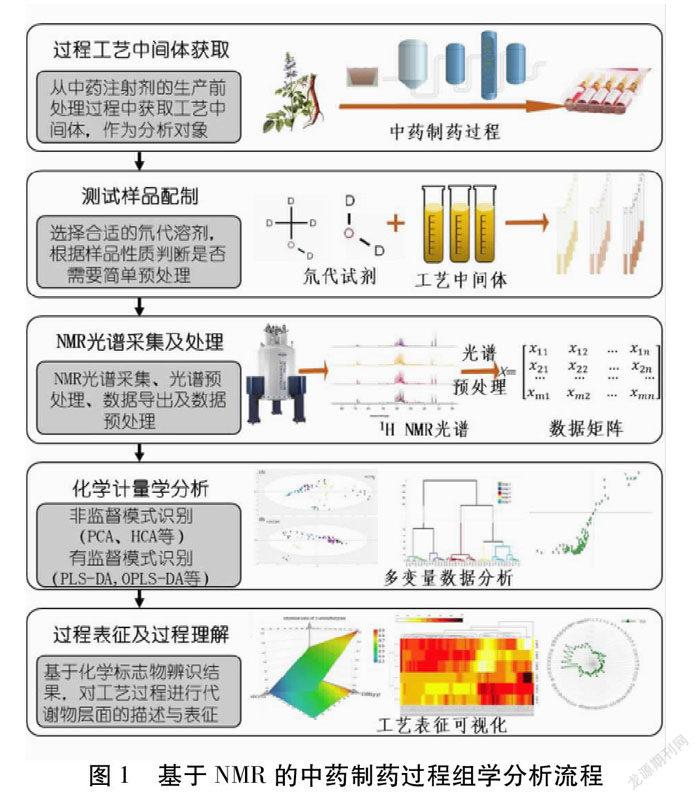
近年来,基于NMR技术的植物代谢组学研究发展飞速,也在中药领域得到广泛应用[13,16-17]。植物代谢组学通过检测并分析植物体在内、外因刺激施加前后的代谢物状态,结合多元统计分析与模式识别技术,量化并解释内外因导致的植物体代谢变化,进而发现代谢过程的关键生物标志物(Bio-marker)及其代谢通路,为探究中药的重要次级代谢产物的合成、转化、积累规律与机制等提供了有效的方法,为提高中药材的产量和质量提供了理论参考。对于中药制药过程,可参考代谢组学的基本流程与分析手段,构建中药制药过程组学方法,即通过中药制药过程代表性样本采集、NMR分析与数据采集、数据处理、化学计量学分析、化学标志物(Chemical-marker)筛选等,对工艺中间体化学组成进行全面分析,阐明中药中各类代谢物在制药过程中各工艺环节内的动态变化规律,促进对制药过程的科学理解,探究工艺过程的本质。基于NMR的中药制药过程组学分析流程。见图1。
2.1 过程工艺中间体的获取 对中药制药过程进行组学分析,首先需要获取相应工艺过程的原料与产物,即过程中间体(Process Intermediates)。對于制药过程的组学研究,可在工业规模下的生产过程中进行定点取样,获取过程中间体并留样分析;也可在直接小试或者中试规模下进行工艺模拟,制备得到过程中间体并进行NMR分析。
2.2 测试样品的配制 根据待测工艺中间体的溶剂极性及成分属性,选择合适的氘代试剂对样品进行化学标记。部分样品可直接加入一定比例的氘代试剂后进行NMR分析;部分样品需要进行简单的预处理,以提高代谢物的信号响应,或避免原始样品中的溶剂信号对代谢物信号产生干扰。如,部分中药制药工艺需要使用乙醇作为溶媒,此类样品若直接进行NMR分析,则采集到的NMR光谱中乙醇的特征信号响应极强,其余代谢物的信噪比将受到显著影响,不利于后续数据分析。针对此类样品,可通过真空冻干或真空离心浓缩等方式挥干溶剂,再使用氘代甲醇或氘代水将样品复溶后进行NMR分析。
2.3 NMR光谱的采集及处理 在NMR光谱采集过程中,为获得化学信息丰富的NMR图谱,需要优化仪器操作程序与采集参数,如匀场程序、温度控制、数据采集时间、脉冲角、分辨率、激发偏置(O1P)、弛豫延迟时间(D1)、采集次数(NS)以及接收器增益值(RG)等,进行选择与优化。如,样品浓度偏低时,可以通过提高RG及增加NS;选择合适的D1(D1应该是自旋晶格弛豫T1的7倍以上)以保证定量结果的准确性;将O1P设置于全谱的中心,以避免边缘信号的形变;优化采集温度,避免样品在光谱采集过程中持续受热,导致信号漂移、信噪比降低[18]。由于不同样品的原始NMR光谱间可能存在的信号漂移、线宽变化等差异,不利于后续的数据分析,因此还需对光谱进行预处理,包括充零、相位矫正、基线校正、信号对齐、分箱(Binning)处理、谱线解卷积或线性拟合、调整谱线增宽(LB)参数、信号对齐等,使得不同样品间的光谱基线形态、信号分布、峰形与峰宽等实现相对一致,提高不同样品NMR光谱间的可比性,减小系统误差,提高定量结果准确性。如,中药制剂成分复杂,NMR光谱中常有多个代谢物的部分结构与氢原子化学环境相似,对应的特征信号发生重叠,对后续分析产生干扰,此时需要通过线性拟合或解卷积获取单个特征峰的准确峰面积[19];同类样品间的pH值与离子浓度可能因为代谢物浓度、比例的不同而存在差异,导致NMR光谱间存在代谢物特征峰偏移,此时可采用CluPA[20]或ICOSHIFT[21]等方法进行光谱对齐。
2.4 化学计量学分析 过程中间体的NMR光谱经处理后得到数据矩阵X(m×n)用于化学计量学分析,其中为m工艺中间体的数量,n为变量数(NMR光谱经降维处理后的数据点数)。常用的化学计量学方法包括非监督的模式识别法,如主成分分析(Principal Component Analysis,PCA)、层次聚类分析(Hierarchical Classification Analysis,HCA)方法,以及有监督的模式识别方法,如偏最小二乘判别分析法(Partial Least Squares Discriminant Analysis,PLS-DA)或正交偏最小二乘判别分析(Orthogonal Partial Least Square-Discriminant Analysis,OPLS-DA)等[22]。其中,PCA和HCA通常用于获取所有样本的全局分布概貌,通过得分图等工具进行无监督的分类来观察不同样品之间的异同,从而分析不同工艺条件对样品化学组成的影响;PLS-DA和OPLS-DA等则基于既定的样本类别建立模型,进而通过相应统计量来辨识模型的关键变量,并通过光谱信号归属确定这些变量所对应的代谢物,将其视作相应过程的潜在化学标志物,认为这些代谢物在该工艺过程中变化较大,存在着可能的转移、转化现象,是潜在的工艺中间体关键质量属性。
2.5 过程表征与过程理解 基于对过程化学标志物的辨识结果,通过对相应NMR信号峰进行解卷积积分,对化学标志物进行定量或半定量分析,获得代谢物在过程中的含量变化趋势,辨析不同工艺过程及过程参数对代谢物的影响程度,从而对其在制药过程中的溶出、沉淀、降解、聚合等转移或转化规律进行推断,即可在代谢物层面实现对工艺过程的表征,进而加深对工艺过程的理解。
3 基于NMR的组学技术在中药制药过程中的应用
中药炮制过程是中药材增效减毒的重要手段。在炮制过程中,中药化学成分经常发生变化,炮制品的质量关乎中医药临床疗效的发挥[23]。NMR技术应用于炮制过程研究时,有助于加深对炮制前后药品成分变化的认识,挖掘炮制前后中药材的药效或活性差异的内在原因。Li等[24]采用NMR技术研究了柴胡的醋制过程,通过对不同醋制前后柴胡样品的1H NMR光谱数据的多变量分析,解析了由醋制引起的柴胡中10种初生代谢物与6种次生代谢物的变化,并阐述了不同醋制条件对柴胡中代谢物含量的影响规律。Zhao等[25-26]对金银花的炒炭法炮制过程进行了研究,分析金银花经过不同温度及时间的碳制处理后NMR光谱中各特征信号,通过热图分析法及PCA得分图定性分析碳制工艺过程中特征信号的变化规律;在此基础上,通过柱色谱法分离了5个特征代谢物,分别为绿原酸、肌醇、异绿原酸A、异绿原酸B、异绿原酸C,并定量分析其在不同加热条件下的变化规律。Zhai等[27]通过辨识白术经麸炒后其1H NMR光谱中特征信号的变化,发现并鉴定了5个新特征代谢物,并解析了特征代谢物的结构与来源。Li等[28]基于1H NMR光谱分析了鹿茸中52种常见代谢物在经热水煮炸法炮制后的变化情况,采用PCA及OPLS-DA法辨识出过程的11个化学标志物,包括丙氨酸、苯丙氨酸、尿苷、尿嘧啶、胆汁酸、胆碱等。王雪洁等[29]对生远志、蜜远志和甘草制的远志进行了1H NMR代谢组学分析,证明了炮制会改变远志的药用特性;Dai等[30]采用NMR代谢组学技术研究不同干燥方式下丹参药材中次级代谢产物的变化规律,发现晾干能够促进莽草酸介导的多酚酸类成分的合成,而晒干会抑制多酚酸的产生;李艺等[31]采用基于1H NMR的代谢组学技术结合多元统计分析对细辛及米醋制细辛、老陈醋制细辛的化学成分进行比较分析,从而探究传统理论中细辛入药时需用老陈醋炮制的理论依据;李震宇等[32]采用方差分析及OPLS-DA法对白芍及其2种醋制品的化学成分进行了比较分析,探討了炮制用醋种类对白芍醋制后化学成分的影响。此外,对于黄芪[33]、地黄[34]、款冬花[35]、大海马[36]、柴胡[37]以及王不留行[38]等中药的炮制过程,也有研究者开展了基于1H NMR组学技术的代谢物变化研究。以上研究均表明基于NMR技术,可以阐释炮制工艺过程中多类别特征代谢物变化规律,能够为中药炮制工艺现代化标准加工规程与质量控制标准的制定提供新的思路与方法。
中成药制备过程经常包含提取、浓缩、醇沉等工艺单元,由于中药化学成分复杂,目前对这些工艺单元开展中药制药过程组学研究还不多。Li等[39]在丹参提取工艺表征研究中引入组学分析技术,以1H NMR光谱为分析工具,对不同组成溶媒提取的丹参提取物进行质量表征,采用PCA、OPLS-DA和HCA等多变量数据分析技术,解释了丹参提取液中各类代谢物的浓度随乙醇浓度的变化趋势,并通过OPLS-DA法识别出不同溶剂中的溶出规律有显著不同的代谢物,将其视作过程表征中的特征代谢物。在此基础上,基于光谱解卷积技术,使用半定量1H NMR方法获得了特征代谢物的相对浓度信息,进一步说明了不同溶剂组间的代谢物溶出规律变化。该研究表明了基于NMR技术的中药制药过程组学方法可表征中药提取过程,帮助阐明代谢物在提取工艺中溶出规律。Zhao等[40]通过对丹参川芎嗪注射液生产过程中工艺中间体的1H NMR光谱进行HCA、OPLS-DA分析,辨识生产过程中的关键质控工艺,以及相关工艺的潜在化学标志物。此外,Zhao等[41]以基于1H NMR的OPLS-DA法辨识了丹参醇沉工艺的化学标志物,在此基础上结合实验设计法(Design of Experiment,DoE)获取具有代表性的醇沉上清液,基于半定量1H NMR法考察不同的工艺参数对化学标志物在醇沉工艺中保留情况的影响。以上研究说明NMR光谱法具有揭示中药生产全过程中各类化学物质转移、转化规律及识别潜在化学标志物的能力。
4 展望
将基于1H NMR的组学技术引入到中药制药过程研究中,通过获取中药制剂及工艺中间体的NMR分析数据,结合网络数据库及NMR化合物信息,可发现中药制剂及工艺中间体中所含的化学成分,结合基于化学计量学与模式识别等多变量数据分析工具,可用于全面、整体、定量地评估各类初生、次生代谢物在制药过程中的动态变化,发掘各工艺单元中化学标志物,阐明其转移转化规律,同时有助于考察各工艺条件对化学标志物的影响程度及影响规律,以实现对化学标志物的全过程追溯。
基于1H NMR的制药过程组学技术,将有望为中药生产过程表征以及深入过程理解提供方法,包括但不限于构建中成药代谢物NMR数据库,生药炮制工艺的研究与优化,中成药制药过程全流程Q-Marker及其他化学标志物的转移转化规律研究,基于qNMR技术的工艺过程监测与过程控制,工艺表征与工艺优化,中药制剂贮存过程全成分转化、降解规律研究等。这为探究工艺过程的本质,为制定与提升中药制剂的质量控制标准提供参考,在中药制药过程研究中具有较大的研究价值与应用前景。
参考文献
[1]Liu C,Cheng Y,Guo D,et al.A New Concept on Quality Marker for Quality Assessment and Process Control of Chinese Medicines[J].Chin Herb Med,2017,9(1):3-13.
[2]趙鸿鹏,许浚,张洪兵,等.基于质量传递与溯源的中药质量标志物(Q-Marker)的发现策略及应用[J].中草药,2021,52(9):2557-2565.
[3]Houson I.Process Understanding:For Scale-Up and Manufacture of Active Ingredients[M].Hoboken:Wiley-VCH,2011:255-281.
[4]张伯礼,范骁辉,刘洋,等.中成药二次开发战略及其核心技术体系[J].中国中药杂志,2013,38(22):3797-3800.
[5]龚行楚,陈滕,瞿海斌.基于质量源于设计理念的中成药二次开发研究进展[J].中国中药杂志,2017,42(6):1031-1036.
[6]Li P,Qi L,Liu E,et al.Analysis of Chinese herbal medicines with holistic approaches and integrated evaluation models[J].TrAC Trends Analyt Chem,2008,27(1):66-77.
[7]Alaerts G,Dejaegher B,Smeyers-Verbeke J,et al.Recent developments in chromatographic fingerprints from herbal products:set-up and data analysis[J].Comb Chem High Throughput Screen,2010,13(10):900-922.
[8]Xie J,Zhang A,Sun H,et al.Recent advances and effective strategies in the discovery and applications of natural products[J].Rsc Adv,2018,8(2):812-824.
[9]Halabalaki M,Vougogiannopoulou K,Mikros E,et al.Recent advances and new strategies in the NMR-based identification of natural products[J].Curr Opin Biotechnol,2014,25:1-7.
[10]Huang T,Li H,Zhang W,et al.Advanced approaches and applications of qNMR[J].Metrologia,2020,57(1):14004.
[11]Schripsema J.Application of NMR in plant metabolomics:techniques,problems and prospects[J].Phytochem Anal,2010,21(1):14-21.
[12]Putri SP,Nakayama Y,Matsuda F,et al.Current metabolomics:practical applications[J].J Biosci Bioeng,2013,115(6):579-589.
[13]Carlomagno T.NMR in natural products:understanding conformation,configuration and receptor interactions[J].Nat Prod Rep,2012,29(5):536-554.
[14]Pauli GF,Jaki BU,Lankin DC.Quantitative 1H NMR:development and potential of a method for natural products analysis[J].J Nat Prod,2005,68(1):133-149.
[15]刘霞,王映红.基于NMR的代谢组学技术在药用植物研究中的应用[J].药学学报,2017,52(4):541-549.
[16]Kim HK,Choi YH,Verpoorte R.NMR-based metabolomic analysis of plants[J].Nat Protoc,2010,5(3):536-549.
[17]Valentino G,Graziani V,D′Abrosca B,et al.NMR-based Plant Metabolomics in Nutraceutical Research:An Overview[J].Molecules,2020,25(6):1444.
[18]Saito T,Nakaie S,Kinoshita M,et al.Practical guide for accurate quantitative solution state NMR analysis[J].Metrologia,2004,41(3):213-218.
[19]Mihaleva VV,Korhonen SP,van Duynhoven J,et al.Automated quantum mechanical total line shape fitting model for quantitative NMR-based profiling of human serum metabolites[J].Anal Bioanal Chem,2014,406(13):3091-3102.
[20]Vu TN,Valkenborg D,Smets K,et al.An integrated workflow for robust alignment and simplified quantitative analysis of NMR spectrometry data[J].BMC Bioinformatics,2011,12:405.
[21]Savorani F,Tomasi G,Engelsen SB.icoshift:A versatile tool for the rapid alignment of 1D NMR spectra[J].J Magn Reson,2010,202(2):190-202.
[22]Uarrota VG,Moresco R,Coelho B,et al.Metabolomics combined with chemometric tools(PCA,HCA,PLS-DA and SVM) for screening cassava(Manihot esculenta Crantz) roots during postharvest physiological deterioration[J].Food Chem,2014,161:67-78.
[23]孙娥,徐凤娟,张振海,等.中药炮制机制研究进展及研究思路探讨[J].中国中药杂志,2014,39(3):363.
[24]Li ZY,Sun HM,Xing J,et al.Chemical and biological comparison of raw and vinegar-baked Radix Bupleuri[J].J Ethnopharmacol,2015,165:20-28.
[25]Zhao J,Wang M,Avula B,et al.Effect of Processing on the Traditional Chinese Herbal Medicine Flos Lonicerae:An NMR-based Chemometric Approach[J].Planta Med,2015,81(9):754-764.
[26]Zhao J,Wang M,Avula B,et al.Change of chemical composition in Flos lonicerae:An investigation of herbal processing(PAO ZHI) using NMR spectroscopy[J].Planta Med,2015,81(11):888-897.
[27]Zhai C,Zhao J,Chittiboyina AG,et al.Newly generated atractylon derivatives in processed Rhizomes of Atractylodes macrocephala Koidz[J].Molecules,2020,25(24):5904.
[28]Li J,Sun H,Bian X,et al.Research on mechanism of traditional hot processing on velvet antler based on 1H nuclear magnetic resonance and multivariate statistical analysis[J].Pharmacogn Mag,2019,15(63):378-384.
[29]王雪洁,李震宇,薛水玉,等.基于植物代谢组学技术的远志不同炮制品质量控制研究[J].中草药,2012,43(9):1727-1737.
[30]Dai H,Xiao C,Liu H,et al.Combined NMR and LC-MS analysis reveals the metabonomic changes in Salvia miltiorrhiza Bunge induced by water depletion[J].J Proteome Res,2010,9(3):1460-1475.
[31]李艺,范玛莉,邢婕,等.龟龄集中细辛特殊炮制工艺的代谢组学研究[J].中草药,2015,46(16):2385-2393.
[32]李震宇,范玛莉,秦雪梅.基于NMR代谢组学技术的白芍及其醋制品的化学比较[J].药学学报,2015,50(2):211-217.
[33]Jung JY,Jung Y,Kim JS,et al.Assessment of peeling of Astragalus roots using 1H NMR-and UPLC-MS-based metabolite profiling[J].J Agric Food Chem,2013,61(43):10398-10407.
[34]He P,Li Z,Xing J,et al.1H NMR based metabolic profiling of the processing effect on Rehmanniae Radix[J].Anal Methods,2014,6(8):2736-2744.
[35]李娟,张松,秦雪梅,等.基于NMR代谢组学技术的款冬花生品与蜜炙品化学成分比较[J].中草药,2015,46(20):3009-3016.
[36]赵晓喆.基于代谢组学技术研究不同海马商品药材化学成分差异性[D].太原:山西大学,2018.
[37]孙慧敏.柴胡醋制前后的化学及药理比较研究[D].太原:山西大学,2015.
[38]周国洪.王不留行化学成分及炮制对其影响研究[D].北京:中国中医科学院,2016.
[39]Li W,Zhao F,Pan J,et al.Influence of ethanol concentration of extraction solvent on metabolite profiling for Salviae miltiorrhizae Radix et Rhizoma extract by 1H NMR spectroscopy and multivariate data analysis[J].Process Biochem,2020,97(1):158-167.
[40]Zhao F,Li W,Pan J,et al.A novel critical control point and chemical marker identification method for the multi-step process control of herbal medicines via NMR spectroscopy and chemometrics[J].Rsc Adv,2020,10(40):23801.
[41]Zhao F,Li W,Pan J,et al.Process characterization for ethanol precipitation of Salviae miltiorrhizae Radix et Rhizoma(Danshen) using 1H NMR spectroscopy and chemometrics[J].Process Biochem,2021,101(1):218-229.
(2021-10-25收稿 責任编辑:王明)

