响应面试验优化桑葚果酒发酵工艺及其品质分析
吴 均,黄传书*,赵 珮,刘 艳
(重庆市蚕业科学技术研究院,重庆 400700)
桑葚(Fructus mori)是桑科桑属多年生木本植物桑树的果实,未成熟时为绿色,逐渐成长变为白色、红色,成熟后为紫红色或紫黑色,味酸甜。我国果桑广泛分布于全国各地,品种70余种[1-2],产量位居世界前列[3-4]。桑葚富含糖、蛋白质、脂肪酸、粗纤维、果胶、维生素、桑色素、花色苷、白藜芦醇、鞣质、芦丁等成分,花青素含量是蓝莓的3倍、白藜芦醇含量是葡萄的5倍[5],具有抗氧化、抗衰老、抑制动脉粥样硬化和抑制有害物质的生成的作用[6-10],其营养丰富并具有药用价值,于1993年被国家卫生部确定为药食同源的水果[11]。目前桑葚一般以鲜食为主,市面上桑葚的加工制品主要有桑葚干、桑葚果汁[12]、桑葚醋[13]、桑葚粉[14]、桑葚膏[15]和桑葚酒[16]等,虽然对桑葚的研究越来越多,但总体来说其利用率并不高,原料浪费问题依然严重。将易腐败变质、易损坏、易霉变的桑葚制成果酒,既能解决其保藏问题和避免浪费,又能延长果桑的产业链,提高果桑附加值,增加收入,还可丰富市面上果酒的种类。
随着生活水平的不断提高,人们越来越青睐具有保健和美容功效的低度发酵果酒,研究发现,桑葚果酒的保健功能及营养均高于葡萄酒,桑葚果酒中花色苷的含量是葡萄酒的5倍,蛋白质的含量是葡萄酒的8倍,硒元素含量是葡萄酒的12倍,白黎芦醇含量高达1.38 μg/mL[17-19]。桑葚酒的发展时间较短,还需在广度和深度方面进行大量的研究,以提高桑葚果酒的品质,改变市面上现有桑葚果酒品质不稳定、质量良莠不齐的现状。本研究以桑葚为原料,以桑葚果酒的花色苷含量和酒精度为评价指标,对桑葚果酒的发酵工艺进行优化,旨在得到最佳桑葚果酒的发酵工艺参数,既能保证果酒的酒精度,又能降低果酒酿造过程中花色苷含量的损失,为酿造富含功能成分的桑葚果酒提供科学依据和技术支持。
1 材料与方法
1.1 材料与试剂
桑葚(可溶性固形物含量为10.2%,总酸含量为5.22 g/kg,pH值为4.20,总糖含量为86.69 g/L):采于重庆市蚕业科学技术研究院;RW酵母:安琪酵母股份有限公司;果胶酶(10万U/g):美国Solarbio公司;柠檬酸(分析纯):潍坊英轩实业有限公司;焦亚硫酸钾(食品级):浙江一诺生物科技有限公司;白砂糖(食品级):广西东亚扶南精糖有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基:日本东京化成工业株式会社;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基、维生素C(vitamin C,VC):北京索莱宝科技有限公司。
1.2 仪器与设备
H-200原汁机:上海韩惠人爱家电科技有限公司;HH-S8A恒温水浴锅:北京科伟永兴仪器有限公司;PHS-3C pH计:上海雷磁仪器有限公司;PAL-α手持便携式折光仪:日本爱拓公司;HPX-Ⅱ-400生化培养箱:上海跃进仪器有限公司;Ultra-3600 紫外可见光分光光度计:北京普源精电科技有限公司。
1.3 方法
1.3.1 桑葚果酒酿造工艺流程[20]

1.3.2 操作要点
冷冻桑葚解冻、榨汁:新鲜采摘的桑果经过挑选之后放入-18 ℃冰箱保存,解冻后的桑葚通过原汁机进行榨汁得到桑葚果汁。
酶解、过滤:在桑葚果汁自然pH条件下,加入0.1%的果胶酶,搅拌均匀,于50 ℃水浴中酶解处理120 min 并于90 ℃条件下灭酶3 min。将灭酶后的果汁通过200目的滤网袋进行过滤。
调pH、调糖:原汁中添加柠檬酸将pH值调整为3.8。原汁添加白砂糖为了提高糖度,保证果酒达到一定酒精度。
添加偏重亚硫酸钾:原汁中添加偏重亚硫酸钾使得SO2的质量浓度为100 mg/L,可起到杀菌、抗氧化和护色的作用。
酵母活化:称取1 g RW酵母于20 mL 5%葡萄糖溶液中,搅拌均匀后于38 ℃活化30 min备用[21]。
发酵:将调整好成分、添加了偏重亚硫酸钾和酵母的桑葚原汁装入消毒后的自动排气发酵瓶,置于26 ℃恒温发酵3 d达旺盛阶段,液面有大量泡沫和蛋白质组成的泡盖;发酵7 d时液体逐渐澄清,总糖降至3 g/L左右时,此时发酵接近终点。根据液体澄清并再无小气泡不断从底部产生和测定总糖含量来确定发酵达到终点。
过滤:上层果酒用虹吸管抽取至玻璃瓶中,下层果酒用300目的滤网袋进行过滤。
灭菌:将果酒置于60 ℃的水浴锅中水浴20 min,冷却后即得桑葚果酒。
1.3.3 检测方法
糖度:手持便携式折光仪测定;pH:pH计测定;总糖:蒽酮-硫酸法[22]测定;酒精度:按照GB/T15038—2006《葡萄酒、果酒通用分析方法》中的酒精计法进行测定;花色苷:pH示差法[23]测定;菌落总数测定、大肠菌群测定、沙门氏菌检测、金黄色葡萄球菌检测按照文献[24-27]中的方法测定。
1.3.4 桑葚果酒发酵工艺条件优化单因素试验设计
在初始糖度分别为20°Bx、22°Bx、24°Bx、26°Bx、28°Bx,初始pH值分别为3.4、3.6、3.8、4.0、4.2,SO2质量浓度分别为60 mg/L、80 mg/L、100 mg/L、120 mg/L、140 mg/L,酵母接种量分别为0.06 g/L、0.08 g/L、0.10 g/L、0.12 g/L、0.14 g/L,发酵温度分别为22 ℃、24 ℃、26 ℃、28 ℃、30 ℃,发酵时间分别为2 d、4 d、6 d、7 d、8 d、9 d、10 d条件下制备桑葚果酒,考察初始糖度、初始pH、SO2质量浓度、酵母接种量、发酵温度、发酵时间对桑葚果酒花色苷含量和酒精度的影响。
1.3.5 桑葚果酒发酵工艺条件优化响应面试验
以单因素试验的结果为依据,选择对结果影响较大的发酵温度(A)、发酵时间(B)、初始糖度(C)和酵母接种量(D)为自变量,以桑葚果酒花色苷含量(Y)为响应值,采用响应面法进行优化,筛选出桑葚果酒最佳发酵工艺条件,Box-Behnken试验设计因素与水平见表1。

表1 Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Benhnken experiment design
1.3.6 桑葚果酒抗氧化活性分析
(1)DPPH自由基清除率[28]
分别取0.04 mL、0.06 mL、0.08 mL、0.10 mL、0.12 mL、0.14 mL、0.16 mL、0.18 mL果酒于试管中,用纯水补充至2mL,加入0.2mmol/LDPPH溶液2mL摇匀,避光放置30 min,于波长517nm处测定吸光度值Ai。同时测定0.04mL、0.06mL、0.08 mL、0.10 mL、0.12 mL、0.14 mL、0.16 mL、0.18 mL的果酒与无水乙醇各2 mL混合后的吸光度值Aj,以及无水乙醇与0.2 mmol/L DPPH溶液各2 mL混合后的吸光度值Ac;以0.2 mg/mL的VC作阳性对照。DPPH自由基清除率计算公式如下:
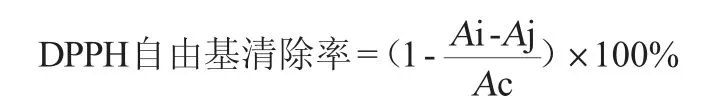
(2)ABTS+自由基清除率[29]
分别取0.05 mL、0.10 mL、0.15 mL、0.20 mL、0.25 mL、0.30 mL、0.35 mL的果酒于试管中,用纯水补充至2 mL,加入ABTS+工作液2 mL,摇匀,避光放置30 min,于波长734 nm处测定吸光度值Ai;以纯水替代样品为空白对照,测得吸光度值为A0;以0.2 mg/mL的VC作阳性对照。ABTS+自由基清除率计算公式如下:

1.3.7 数据处理
3次重复试验计算平均值;采用Origin 9.0和Design Expert 8.0.6进行绘图和响应面分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 初始糖度对桑葚果酒花色苷含量和酒精度的影响

图1 初始糖度对果酒花色苷含量和酒精度的影响Fig.1 Effects of initial sugar concentration on anthocyanin and alcohol content in mulberry wine
由图1可知,当初始糖度<24°Bx时,随着糖度的增加,花色苷含量和酒精度上升,当初始糖度>24°Bx时,随着糖度的增加,酒精度和花色苷含量下降。当初始糖度较低时,由于酵母增殖需要消耗一定的糖,使得用于发酵的糖不足而导致酒精度较低;当初始糖度过高时,又抑制了酵母的生长和繁殖,使得发酵不完全,由糖转变为酒精较少,残糖量过高。综合考虑,桑葚果酒的最佳初始糖度为24°Bx。
2.1.2 初始pH值对桑葚果酒花色苷含量和酒精度的影响
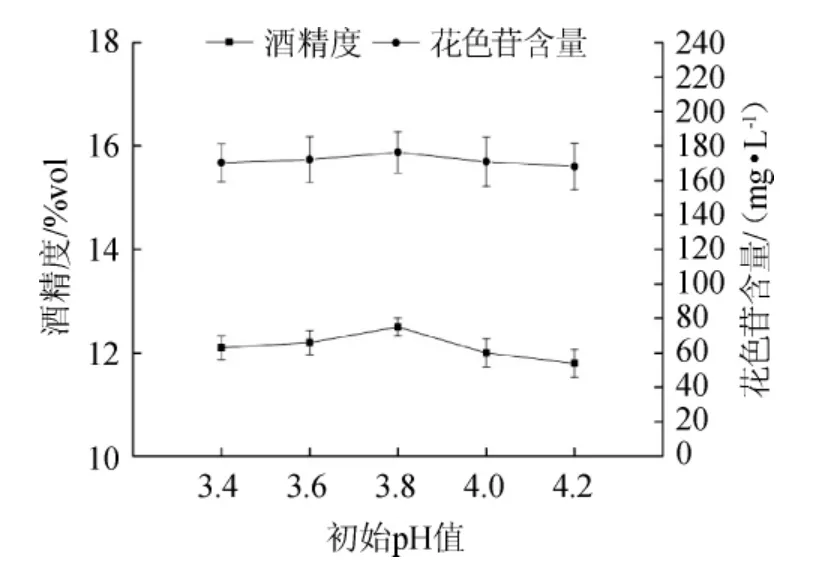
图2 初始pH值对果酒花色苷含量和酒精度的影响Fig.2 Effects of initial pH on anthocyanin and alcohol content in mulberry wine
在适宜微酸性环境下,酵母菌生长、繁殖和发酵都很迅速,且花色苷在pH 2~4之间最稳定。由图5可知,pH<3.8时,花色苷含量和酒精度随pH值增加而升高,pH>3.8时,花色苷含量和酒精度随初始pH增加而降低,酵母的生长繁殖受到了抑制,花色苷也越来越不稳定。综合考虑,桑葚果酒的最佳初始pH值为3.8。
2.1.3 SO2质量浓度对桑葚果酒花色苷含量和酒精度的影响
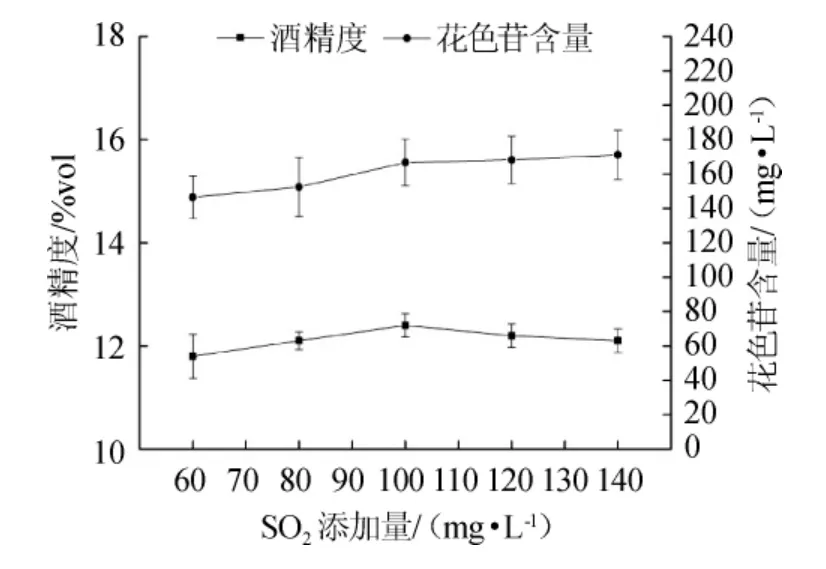
图3 SO2添加量对果酒花色苷含量和酒精度的影响Fig.3 Effects of sulfur dioxide addition on anthocyanin and alcohol content in mulberry wine
适宜的SO2质量浓度不仅能抑制杂菌生长,也能起到护色和抗氧化的作用,进而提高果酒的品质;过高的SO2质量浓度不仅会使原汁中的酸度上升导致酵母发酵缓慢,又使桑葚的颜色变浅[34-35];过低的SO2质量浓度不能抑制杂菌生长,使得果酒发酵不完全而变得浑浊。由图3可知,在发酵过程中,SO2质量浓度对果酒酒精度和花色苷含量影响不显著,随着SO2质量浓度的升高,花色苷含量增加,说明SO2对花色苷具有保护作用。综合考虑,桑葚果酒的最佳SO2质量浓度为100 mg/L。
2.1.4 酵母接种量对桑葚果酒花色苷含量和酒精度的影响
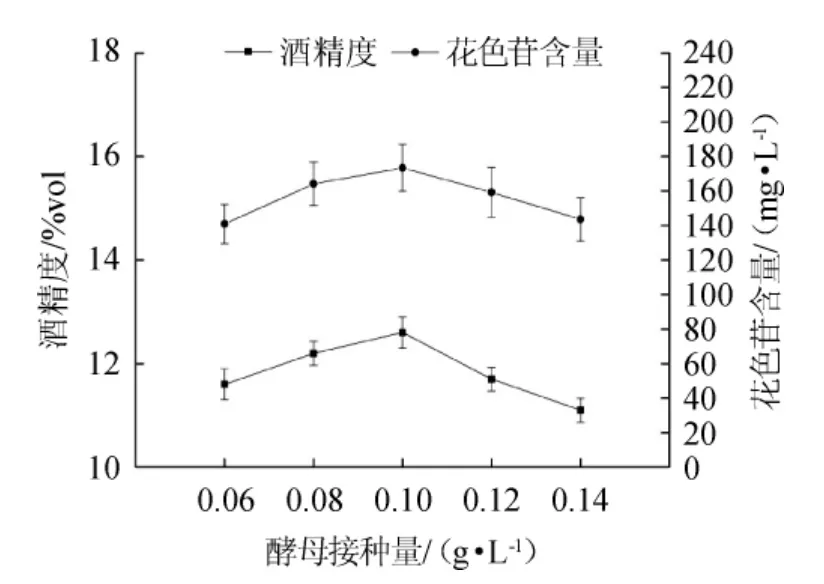
图4 果酒酵母接种量对果酒花色苷含量和酒精度的影响Fig.4 Effect of yeast inoculum on anthocyanin and alcohol content in mulberry wine
由图4可知,酵母接种量<0.10 g/L时,随接种量的增加,桑葚果酒花色苷含量和酒精度不断增加;酵母接种量>0.10 g/L时,随接种量的增加,桑葚果酒花色苷含量和酒精度不断减少。酵母接种量较少时,果酒发酵不彻底,果酒的酒精度不高且花色苷溶出含量较少;酵母接种量较大时,桑葚果酒花色苷含量和酒精度都较低的原因在于酵母自身大量繁殖和代谢产生的物质使得酒精转化受到抑制,且酵母的细胞壁又能够吸附花色苷从而降低果酒中花色苷的含量[30]。综合考虑,桑葚果酒的最佳酵母接种量为0.10 g/L。
2.1.5 发酵温度对桑葚果酒花色苷含量和酒精度的影响
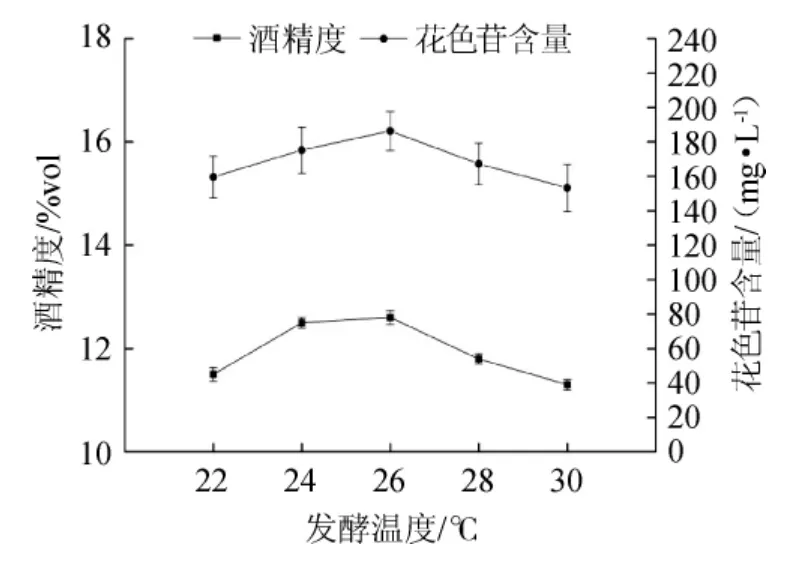
图5 发酵温度对果酒花色苷含量和酒精度的影响Fig.5 Effects of fermentation temperature on anthocyanin and alcohol content in mulberry wine
发酵温度过低,酵母生长缓慢,酶活低下,酒精和香气成分积累不足,风味平淡[31];温度过高不仅使得酵母容易提早衰老,又产生大量副产物,造成果酒的风味不佳,口感品质降低[32-33]。由图5可知,随着发酵温度的上升,桑葚果酒花色苷含量和酒精度呈现先上升后降低的变化趋势,发酵温度为26 ℃时,果酒花色苷含量和酒精度达到最大值;发酵温度高于26 ℃时,酵母过度繁殖大量消耗糖分,酒精度低下,花色苷分解加快。综合考虑,桑葚果酒的最佳发酵温度为26 ℃。
2.1.6 发酵时间对桑葚果酒花色苷含量和酒精度的影响
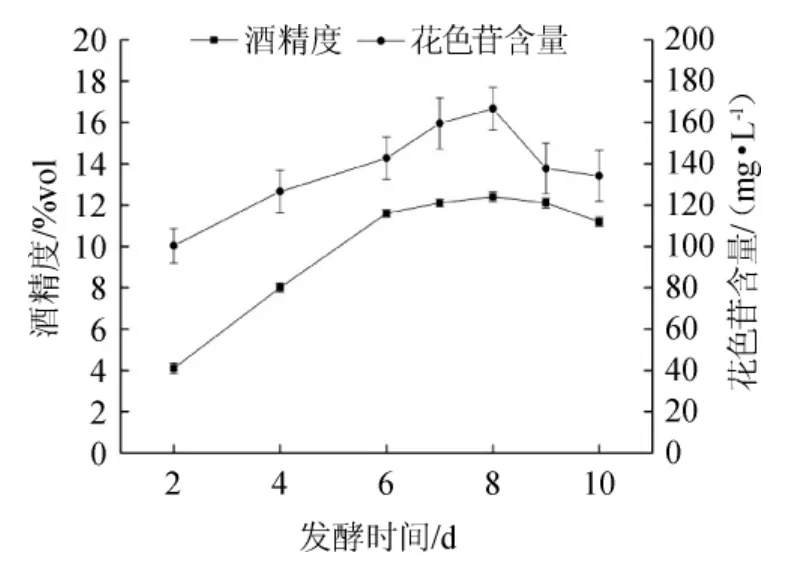
图6 发酵时间对果酒花色苷含量和酒精度的影响Fig.6 Effect of fermentation time on anthocyanin and alcohol content in mulberry wine
由图6可知,随着发酵时间延长,桑葚果酒花色苷含量和酒精度逐渐增加,第8天时,花色苷含量和酒精度达到最高值,分别为166.66 mg/L和12.4%vol,8 d后逐渐降低。发酵液中的花色苷随着酒精度的增加而不断溶出,在发酵前期花色苷含量逐渐增加,8 d后花色苷含量逐渐降低,可能是因为花色苷不稳定分解所致。综合考虑,桑葚果酒的最佳发酵时间为8 d。
2.2 响应面试验结果
2.2.1 响应面试验结果与方差分析
在单因素试验基础上,选择发酵温度(A)、发酵时间(B)、初始糖度(C)和酵母接种量(D)为自变量,以桑葚果酒花色苷含量(Y)为响应值,采用响应面法进行优化,筛选出桑葚果酒最佳发酵工艺条件,试验设计及结果见表2,方差分析结果见表3。
采用Design-expert 8.0.6分析软件对表2试验结果进行多元回归分析,得到预测模型回归方程如下:
Y=211.79+1.73A+1.59B+4.33C-0.42D-1.55AB-6.03AC-4.59AD-7.09BC-0.76BD+3.73CD-20.46A2-22.87B2-13.72C2-22.16D2
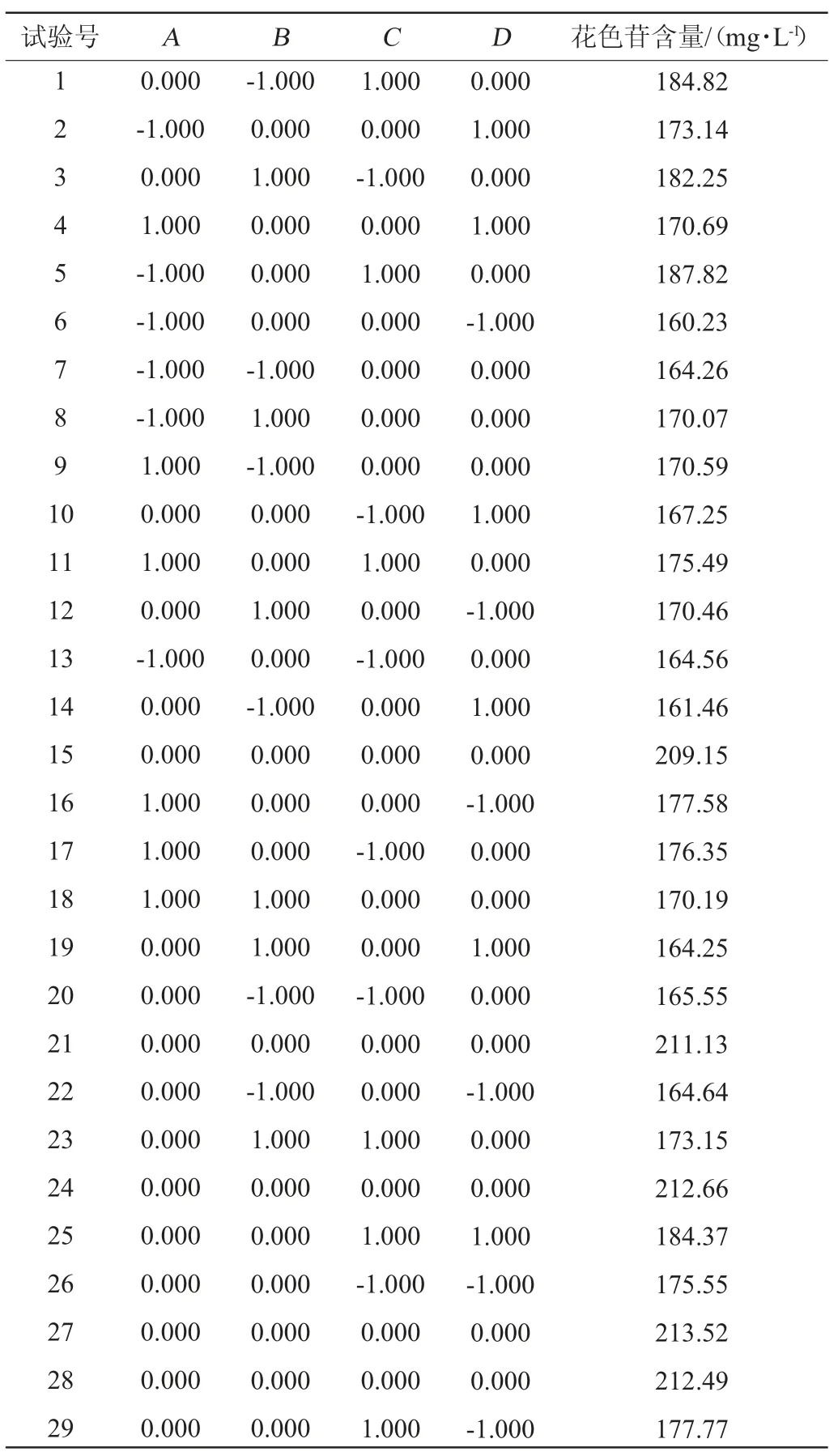
表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments
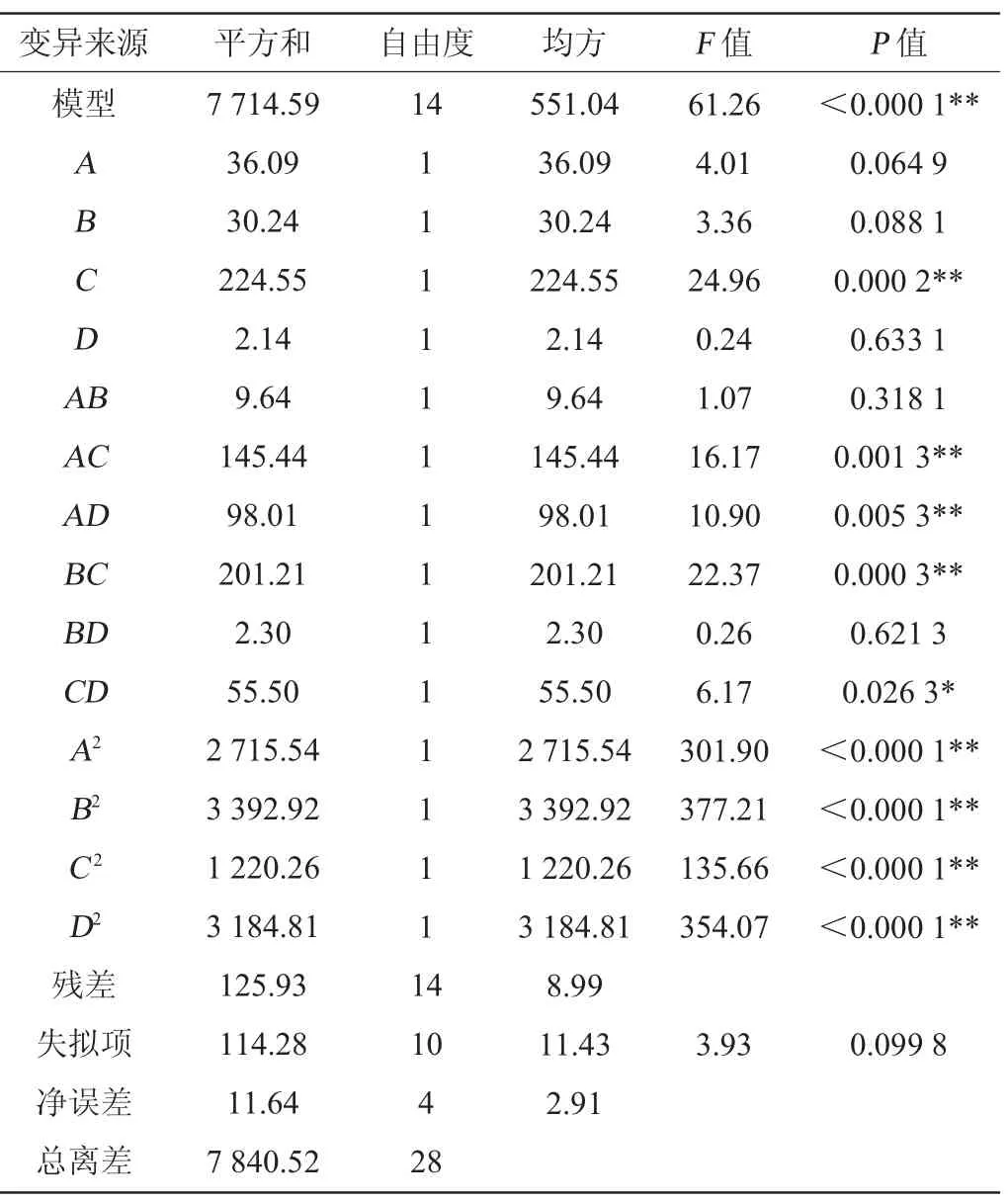
表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可知,该模型极显著(P<0.000 1),失拟项不显著(P=0.099 8>0.05),说明该模型拟合度较好,得到的方程能很好地预测结果[36]。一次项C、交互项AC、AD、BC、二次项A2、B2、C2、D2对桑葚果酒花色苷含量的影响极显著(P<0.01),说明它们对响应值的影响比较复杂,不仅是简单的线性关系。决定系数R2=0.913 7,调整决定系数R2adj=0.967 9,说明该模型能解释96.79%的变化,拟合度较好,因此能用此模型对桑葚果酒发酵工艺进行分析和预测。由方差分析可知,4个因素对响应值的影响顺序为:初始糖度(C)>发酵温度(A)>发酵时间(B)>酵母接种量(D)。
2.2.2 响应面交互作用
三维图和等高线能够预测和检验自变量的响应值及自变量之间的关系[37]。由图7可知,AC、AD、BC的等高线呈椭圆形,说明两者交互作用对花色苷含量的影响大,达到极显著效果,CD的等高线呈近似椭圆形,说明交互作用达到显著效果,AB、BD的等高线呈圆形,说明两者有交互作用,但是两者交互不显著。
经系统分析得到桑葚果酒最佳工艺条件为发酵时间8.02 d、发酵温度26.02 ℃、初始糖度24.30°Bx、酵母接种量0.10 g/L,桑葚果酒花色苷含量预测值为212.14 mg/L;为了方便操作,将最佳工艺条件调整为发酵时间8 d、发酵温度26 ℃、初始糖度24.5°Bx、酵母接种量为0.10 g/L。在此优化发酵工艺条件下进行3次平行验证试验,得到花色苷含量实际值为208.79 mg/L,实际值与预测值相差不大,表明该工艺可行。
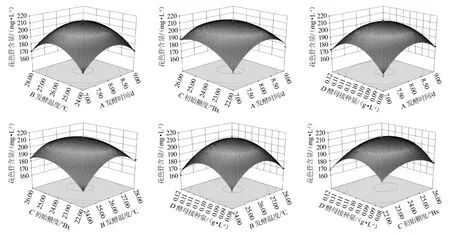
图7 各因素交互作用对花色苷含量影响的响应面及等高线Fig.7 Response surface plots and contour line of effects of interaction between each factors on anthocyanin content
2.3 桑葚果酒品质分析
该工艺条件下发酵得到的桑葚果酒呈紫红色、澄清透明,酒香馥郁,口感柔和,带有明亮的桑葚果香风味。酒精度为12%vol、总糖含量为3~5 g/L、菌落总数<1 CFU/mL、大肠菌群<3.0 MPN/100 mL、沙门氏菌、金黄色葡萄球菌等未检出。
2.4 桑葚果酒抗氧化性结果
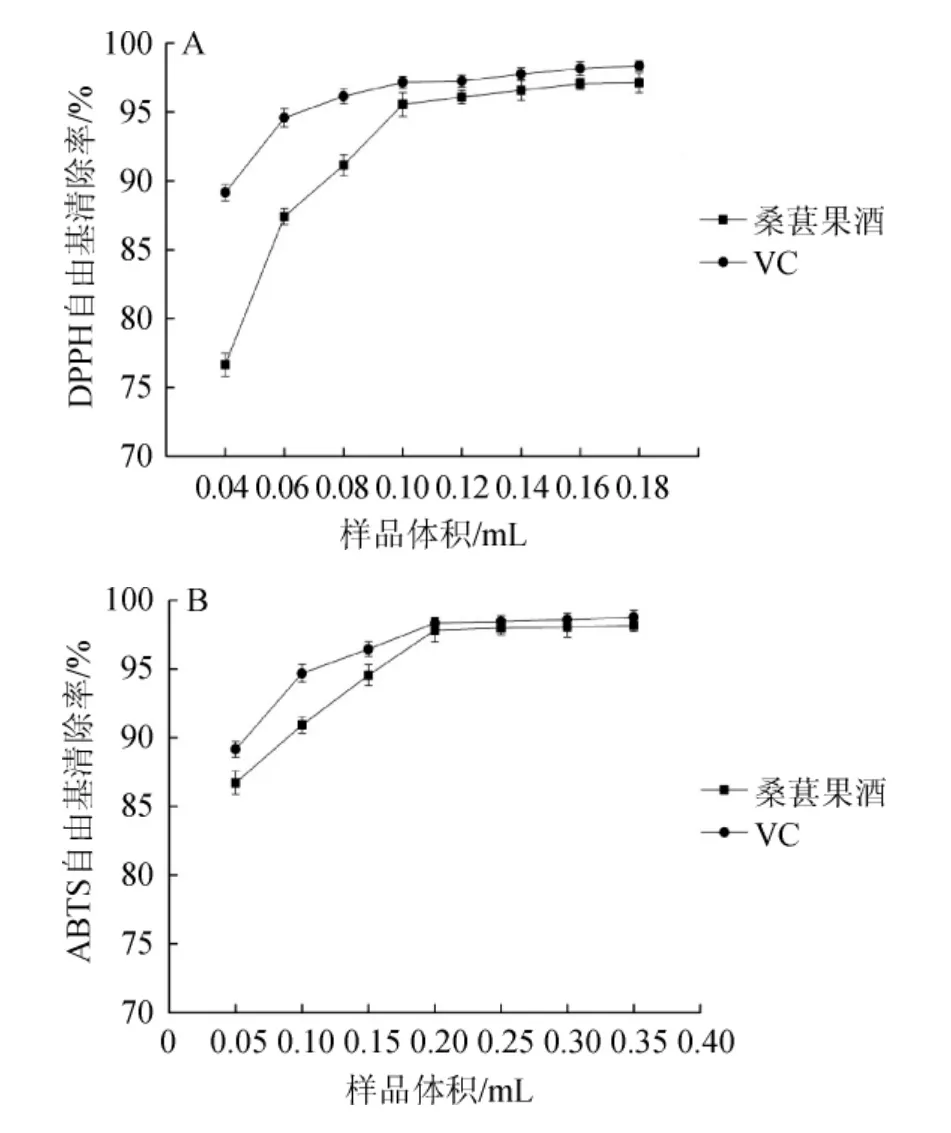
图8 桑葚果酒的DPPH(A)及ABTS(B)自由基清除率Fig.8 DPPH (A) and ABTS (B) free radical scavenging capacity of mulberry wine
由图8A可知,样品体积<0.10 mL时,DPPH自由基清除率随样品量的增加而增加;当样品体积为0.10 mL时,桑葚果酒和VC溶液的DPPH自由基清除率分别为95.55%和97.16%;样品体积>0.10 mL时,桑葚果酒和VC溶液对DPPH自由基的清除率的增长缓慢。相同体积的桑葚果酒的DPPH自由基的清除能力要低于VC溶液。
由图8B可知,样品体积<0.20 mL时,ABTS自由基清除率随样品量的增加而增加;当样品体积为0.2mL时,桑葚果酒和VC溶液的ABTS自由基清除率分别为97.82%和98.34%;样品体积>0.20 mL时,桑葚果酒和VC溶液对ABTS自由基的清除率的增长缓慢。相同体积的桑葚果酒的ABTS自由基的清除能力要低于VC溶液。
3 结论
通过响应面分析法得到桑葚果酒的最佳发酵工艺条件:发酵时间8 d、发酵温度26 ℃,初始糖度24.5°Bx,酵母接种量0.10 g/L。在此优化条件下,桑葚果酒花色苷含量可达208.79 mg/L。表明该模型拟合程度良好,能用此模型对桑葚果酒花色苷含量进行分析和预测,其残留总糖量为3.1 g/L,酒精度为12.7%vol,菌落总数<1 CFU/mL、大肠菌群<3.0 MPN/100 mL、沙门氏菌、金黄色葡萄球菌未检出,桑葚果酒的DPPH、ABTS自由基最大清除率为95.55%、97.82%。

