一株伯克霍尔德菌所产类细菌素的分离纯化
刘 静,杨富民 *,王丽君,苏阿伦
(1.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070;2.甘肃省食品检验研究院,甘肃 兰州 730030)
伯克霍尔德菌是一种广泛存在于水、土壤、植物和人体中的革兰氏阴性细菌。1949年美国植物病理学家BURKHOLDER WH等[10]首次发现它可以引起洋葱茎腐烂,称为洋葱假单胞菌(Pseudomonas cepacia),1992年YABUUCHI E等[11]正式将该菌及其他6个属于rRNA群的假单胞菌归为一个新属,即伯克霍尔德菌属(Burkholderia)。伯克霍尔德菌能产生多种具有抑菌活性的代谢产物如铁载体(Pyochenlin,Pyoverdine)、吩嗪、硝吡咯菌素、苯基吡咯、单萜生物碱、Cepaciamide A、Cepacidine A、Cepacin A等[12-14]。对于伯克霍尔德菌抑菌物质的分离基本遵循三步走原则,目前相关的报道并不多,权春善等[15]通过Sephadex-75pg及Sephacryl S-100两步柱层析,然后用HPLC分离,成功实现了洋葱伯克霍尔德菌CF-66抑菌物质的纯化;任嘉红等[16]利用硫酸铵分级盐析、Sephadex G-50葡聚糖凝胶层析和DEAE-Sephadex A-25高流速离子型葡聚糖凝胶层析对吡咯伯克霍尔德菌JK-SH007产生的抑菌物质进行了纯化;陈京元等[17]利用超滤、Sephadex G-25凝胶柱层析对洋葱伯克霍尔德菌C23抗真菌活性多肽进行了分离,并确定了其分子质量,成为首个报道的伯克霍尔德菌属产分子量超过5 000 Da的多肽。
本实验从甘肃省地方特色发酵产品-陇西腊肉中成功的分离出一株具有抑菌活性的菌株,经16S rDNA全序列测序,鉴定为伯克霍尔德菌(Burkholderia),在前期研究的基础上,利用不同浓度的硫酸铵进行分级沉淀,高速离心获得的沉淀经两次固相萃取(solid phase extraction,SPE)小柱层析,粗分离液分别用制备型和分析型高效液相色谱进一步纯化,以期获得纯物质,为后续抑菌物质结构的分析及抑菌机理的深入研究奠定了基础。
1 材料与方法
1.1 材料与试剂
伯克霍尔德菌:由本实验室前期分离保藏;金黄色葡萄球菌(标准菌株ATCC6538):广州环凯微生物科技有限公司;种子培养基、Baird-Parker培养基、脑心浸液(brian heart infusion,BHI)培养基、7.5%氯化钠肉汤培养基:北京陆桥技术股份有限公司;硫酸铵、NaH2PO4·2H2O(均为析纯):天津市科密欧化学试剂有限公司;Na2HPO4·12H2O(分析纯):天津市光复科技发展有限公司;硝酸(分析纯):中国医药集团有限公司;考马斯亮蓝G-250(分析纯):天津市凯信化学工业有限公司;乙醇、磷酸(均为析纯):天津市百世化工有限公司;牛血清蛋白(纯度>98%):上海中秦化学试剂有限公司;固相萃取小柱:北京振翔科技有限公司。
1.2 仪器与设备
Ultimate 3000高效液相色谱仪、Evolution 60紫外分光光度计、Kromasil 100-5-C18色谱柱:美国Thermo Fisher公司;1200 Infinity Series高效液相色谱仪、CAPCELL PAK C18MGⅡ色谱柱:美国Agilent公司;DUO-PUR1308酸纯化仪:意大利Milestone公司;AE 200分析天平:瑞士Mettler公司;Avanti J-26XP高速冷冻离心机:美国Beckman公司;Syncore平行蒸发定量浓缩仪:瑞士Buchi公司;PPM48正压固相萃取仪:美国J2 Scientific公司;CL-32L高压灭菌器:日本ALP公司;IPP260plus恒温培养箱:德国Memmert公司。
1.3 方法
1.3.1 抑菌实验
将实验室保存的伯克霍尔德菌接种于种子培养基中,在36 ℃的培养箱中厌氧培养24 h,取出后3 000 r/min离心10 min,弃去沉淀,收集上清液,用0.45 μm的滤膜过滤除菌,即得发酵上清液。
1950年8月,李铁夫从香港回到广州,任华南文艺学院名誉教授、华南文联副主席,住在华南文艺学院内(即广州光孝寺)。李铁夫于1952年6月在广州逝世,按其生前将全部作品捐献给国家的遗愿,其随身作品、遗物由华南文艺学院保管。1953年,华南文艺学院并入“中南美专”。中南美专设在武汉,李氏作品随即运往武汉。1958年,中南美专迁至广州并更名为“广州美术学院”,李铁夫藏品也回到广州,收藏在广州美术学院美术馆(2003年以前称“陈列馆”)。
活化:挑取金黄色葡萄球菌标准菌株,在BHI培养基上划线分离,放入36 ℃的培养箱培养24 h,传代2~3次,得到标准菌的纯菌株。增菌:挑取单菌株,接种到7.5%氯化钠肉汤中,在36 ℃的培养箱中培养24 h。
在平板中倾倒10~15 mL 50 ℃左右的Baird-Parker培养基,取200 μL已稀释至10-5的金黄色葡萄球菌标准菌增菌液,用L棒均匀的涂布于该培养基表面,然后在表面放置牛津杯,在牛津杯中加入200 μL实验菌的发酵上清液,放入36 ℃的培养箱中培养48 h,取出观察抑菌圈大小,并用游标卡尺测量抑菌圈大小。
1.3.2 硫酸铵沉淀试验
向制备好的发酵上清液中添加硫酸铵至饱和度分别为20%、30%、40%、50%、60%、70%、80%,高速离心(10000 r/min)分离上清液和沉淀,分别测定不同饱和度上清液和沉淀对金黄色葡萄球菌的抑菌活性。将添加了70%硫酸铵的发酵液在离心机上10 000 r/min离心20 min,弃掉上清液,沉淀用蒸馏水溶解,备用。
1.3.3 固相萃取小柱层析
将固相萃取小柱固定在正压固相萃取仪上,用20 mmol/L的磷酸盐缓冲溶液(pH=6.0)平衡30 min,取粗提液上样,用相同的缓冲溶液洗脱,洗脱速度为1.0 mL/min,洗脱2~3次,合并收集洗脱液,以相同的洗脱液和洗脱速度在固相萃取小柱上再洗脱一次,洗脱液在旋转蒸发仪上80 ℃进行旋蒸,沉淀用20 mmol/L的磷酸盐缓冲溶液(pH=6.0)溶解,备用。
1.3.4 分离纯化
将上述粗分离液用高效液相色谱仪进行纯化,HPLC色谱柱条件:色谱柱为C18柱(4.6 mm×250 mm);流动相A为20 mmol/L pH=6.0的磷酸盐缓冲溶液,流动相B为乙腈;进样量100 μL;柱温为室温;检测波长220 nm;流速3.0 mL/min;时间10 min;洗脱条件为A:92%,B:8%(等度洗脱)。
将以上具有抗菌活性的组分用高效液相色谱仪进一步纯化,HPLC色谱条件:色谱柱为C18柱(4.6 mm×250 mm);进样量50 μL;柱温35 ℃;检测波长220 nm;流速1.0 mL/min;流动相A为20 mmol/L pH=6.0的磷酸盐缓冲溶液,流动相B为甲醇;时间11 min;洗脱条件为A:98%,B:2%(等度洗脱)。
1.3.5 蛋白质含量测定
采用考马斯亮蓝法测定菌株的蛋白质含量。准确称取牛血清蛋白10 mg,溶于蒸馏水,并定容至100 mL,配制成质量浓度为100 μg/mL的标准储备液。分别取6只试管,其中0号试管加入1.0 mL的蒸馏水作空白对照,另外5只试管分别加入0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL质量浓度为100 μg/mL牛血清蛋白标准溶液,补充蒸馏水至1.0 mL,每只试管中加入5.0 mL的考马斯亮蓝G-250 染色剂,摇匀,此标准系列的质量浓度为0、20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL,放置2~5 min,以0号管为空白对照,在波长595 nm处比色。取经过纯化所得的待测试样0.1 mL,补加蒸馏水至1.0 mL,再加入5.0 mL考马斯亮蓝G-250,摇匀,放置2~5 min,以0号管为空白对照,在波长595 nm处比色。蛋白质含量计算公式:

式中:X为试样中蛋白质的含量,μg/mL;A为由标准曲线算得待测液中蛋白质,μg/mL;V1为测定用试样体积,mL;V2为试样定容体积,mL。
2 结果与分析
2.1 硫酸铵沉淀结果
添加不同比例的硫酸铵,分离上清液和沉淀后,分别做抑菌实验,结果如表1所示。
从表1可以看出,饱和度为70%硫酸铵所得沉淀的抑菌效果最好,说明该沉淀中抑菌物质浓度较高,所以选择饱和度为70%硫酸铵离心后的沉淀液进行后续实验。

表1 不同比例硫酸铵处理后上清液和沉淀的抑菌效果Table 1 Antibacterial effect of supernatant and precipitation treated with ammonium sulfate of different proportions
2.2 抑菌物质分离纯化结果
2.2.1 固相萃取小柱分离
粗提液经两次固相萃取小柱层析并洗脱后,分别做处理前后的抑菌实验,测量抑菌圈直径大小,取平均值,结果见表2。由表2可知,两次固相萃取小柱层析后抑菌圈直径变化不大,说明抑菌物质损失较小,此粗分离液可继续用于后续的分离纯化。

表2 固相萃取小柱层析处理前后抑菌效果对比Table 2 Comparison of antibacterial effect of crude extract before and after treatment with solid phase extraction column chromatography
2.2.2 制备型HPLC纯化
由图1可知,层析液经1200 Infinity Series HPLC纯化后,出现3个吸收峰(分别用A、B、C表示),根据峰形分段收集各个峰,测定抑菌活性,结果发现只有峰C具有抑菌活性,对应物质的抑菌圈直径为17.42 mm,因此,利用Ultimate 3000分析型HPLC对峰C进行进一步纯化。
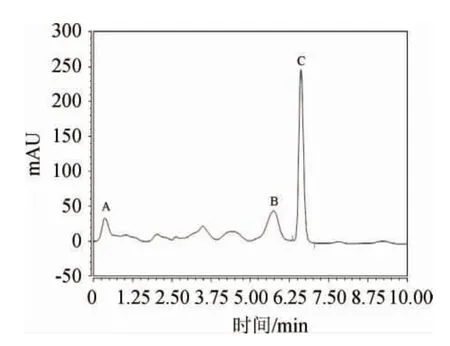
图1 制备型HPLC纯化抗菌物质Fig.1 Antibacterial substances purified by preparative HPLC
2.2.3 分析型HPLC纯化
对组分C用Ultimate 3000 HPLC进行进一步分离纯化,调整洗脱液有机相比例为磷酸盐缓冲溶液∶甲醇=98∶2,结果如图2所示。由图2可知,在保留时间为5.783 min时出现一个较强的吸收峰,说明其是纯化物质。
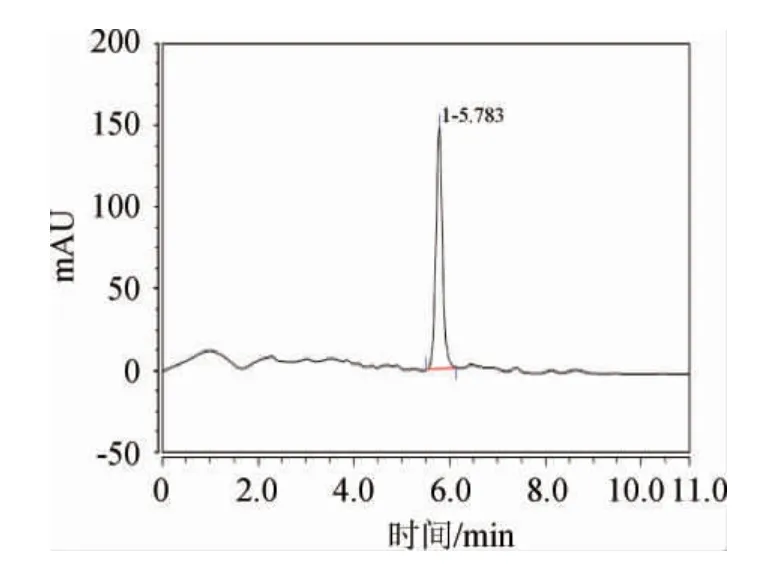
图2 组分C的高效液相色谱图Fig.2 HPLC chromatography of fractionC
2.2.4 紫外光谱扫描
采用Ultimate 3000 HPLC对组分C的最大吸收波长进行光谱扫描,结果如图3所示。由图3可知,在190~800 nm的扫描范围内,最大吸收波长为223.06 nm,表明该纯化物质中可能包含肽键(肽键的最大吸收波长在220 nm左右[18])。
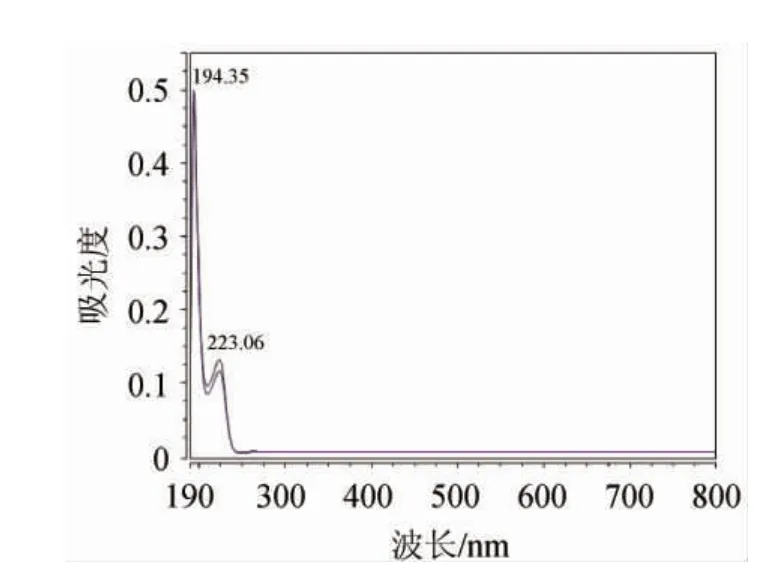
图3 抗菌物质的最大吸收波长Fig.3 Maximum absorption wavelength of antimicrobials
2.3 蛋白质含量测定结果
由于组分C可能为蛋白质,故利用紫外分光光度计测定其蛋白质含量。经测定蛋白质含量在0~100 μg/mL范围内呈良好的线性关系,牛血清蛋白标准曲线回归方程为:Y=0.005 97X-0.006 86,相关系数R2=0.999 66。组分C样品测试结果表明其蛋白质含量为452 μg/mL。
3 讨论
3.1 细菌素纯化方法
目前,没有一套成型通用的细菌素分离纯化方法,需根据其多肽的性质、产细菌素菌株的来源及特性设计纯化的策略[16],大多数细菌素的纯化都遵循粗分离-中度纯化-精制的步骤[17]。如果不了解将要纯化的细菌素性质,建议使用硫酸铵分级沉淀较好,如果对纯度要求较高,可以多种方法结合使用[18]。由于对即将纯化的细菌素性质不甚了解,所以本文遵循一般原则,利用不同浓度的硫酸铵分级沉淀发酵上清液,通过对抑菌试验抑菌圈大小的比较,结果发现,用70%的硫酸铵沉淀发酵上清液效果最好。
文献报道的凝胶过滤层析中使用的层析柱多为填充柱,填充过程中难免产生气泡,存在填料不紧凑、比表面积小等问题,从而导致分离效果不佳,本文采用未经任何修饰的硅胶填充的固相萃取小柱进行层析,该柱填料内径小且被高度压缩,大大增加了被分离液体与填料的接触面积,通过比较层析前后抑菌圈的变化,发现该方法可行性较强,而且操作步骤少,有利于抗菌物质的保值。
在精制阶段要使细菌素纯度达到99%,大多采用反相高效液相色谱进行纯化[19]。本研究中层析液分别经制备型和分析型高效液相色谱分离,最终得到了吸收峰在220 nm左右的纯物质。
3.2 细菌素蛋白质含量的测定
对细菌素蛋白质含量的测定多采用考马斯亮蓝法,本研究参照文献[20]的方法测定纯化液的蛋白质含量,经测定该抗菌物质的蛋白质含量为452 μg/mL。不同的细菌素蛋白质含量不尽相同,陈丽园等[21]对一株可以抑制鸡白痢沙门氏菌的乳酸乳球菌蛋白质含量进行了测定,发现其含量在0.75~1.52 mg/mL之间。刘文丽等[22]对一株屎肠球菌Y31进行了系统研究,发现原发酵液蛋白质浓度为0.60 mg/mL。贾丽艳等[23]分别测定一株枯草芽孢杆菌发酵液、硫酸铵沉淀液及酸沉淀液蛋白质含量,分别为0.141 g/L、0.106 g/L、0.123 g/L。本研究中发现的细菌素蛋白质含量介于文献报道的数据之间。
4 结论
通过对抗菌物质进行粗分离-中度纯化-精制,结果发现,用70%的硫酸铵沉淀发酵上清液效果最好,未经任何修饰的硅胶填充的固相萃取小柱具有很好的层析效果,层析液经两步高效液相色谱分离,最终得到了吸收峰在220 nm左右的纯物质,该抗菌物质的蛋白质含量为452 μg/mL。

