高效液相色谱法快速测定白酒中8种吡嗪类化合物
龙四红,廖妍俨*,孙 棣,陈学航,黄家岭,李红洲,梁桂娟
(贵州省产品质量检验检测院 国家酒类及加工食品质量监督检验中心,贵州 贵阳 550016)
吡嗪是一种1,4位含氮类的六元杂环化合物,它的衍生物广泛存在于天然和发酵食品中[1-2]。近年来对白酒中风味物质的研究发现,虽然吡嗪类化合物在白酒中的含量甚微,但其具有风味阈值低,香气透散性好,并对其他香味物质有明显的烘托叠加作用等特点,对白酒的风味起着重要的作用[3-4]。尤其是白酒中的四甲基吡嗪(川芎嗪)由美拉德反应生成,在制曲和堆积发酵的过程中产生,经蒸馏带入酒中,具有扩张血管、改善微循环及抑制血小板集聚等作用,赋予中国白酒健康功能[5-6]。所以对白酒中吡嗪类化合物的分析检测显得尤为重要。
目前国内外对吡嗪类化合物的分离方法主要有液液萃取(liquid-liquid extraction,LLE)、固相微萃取(solid phase microextraction,SPME)[7-8]、顶空固相微萃取(headspace solidphasemicroextraction,HS-SPME)[9-10]、离子交换(ionexchange,IEX)和超临界萃取(supercritical fluid extraction,SFE)等[11],检测方法主要有气相色谱(gas chromatography,GC)法[12]、气质联用(gas chromatography-mass spectrometry,GC-MS)法[13-15]和气相色谱氮磷检测器(gas chromatography-nitrogen phosphorusdetector,GC-NPD)等[16-17]。王莉等[18]建立了一种利用气相色谱-质谱-选择离子扫描(gas chromatography-mass spectrometry-selectiveionmonitoring,GC-MS-SIM)联用技术,该方法只定量分析了白酒中4种重要化合物;张艳红等[19]采用顶空固相微萃取与气相色谱-火焰热离子检测器(solidphase microextraction-gas chromatography-flame thermionic detector,SPME-GC-FTD)相结合的方法,定量了8种吡嗪类化合物;孙棣等[20]采用液相色谱-质谱联用法快速测定酱香型白酒中的8种吡嗪类化合物。以上方法需要大量的有机试剂,样品用量大,且步骤过于繁琐,预处理过程中被分析物损失较大。白酒中吡嗪的高效液相色谱-荧光检测法(high performance liquid chromatography-fluorescence detection,HPLC-FLD)尚鲜见报道。
本研究建立一种高效液相色谱(HPLC)快速测定白酒中8种吡嗪类化合物含量的方法,并对该方法进行方法学考察,并对高效液相色谱(HPLC)条件优化、样品前处理方法研究,采用高效液相色谱(HPLC)仪对白酒样品中吡嗪类化合物进行检测,旨在得到检测白酒中8种吡嗪类化合物的快速、有效方法,该方法建立对白酒中吡嗪类化合物的评价有重要的现实意义。
1 材料与方法
1.1 材料与试剂
白酒样品:某白酒生产企业提供。
2-甲基吡嗪(纯度>99%)、2,5-二甲基吡嗪(纯度>98%)、2,6-二甲基吡嗪(纯度98%)、2,3-二甲基吡嗪(纯度99%)、2-乙基-6-甲基吡嗪(纯度95%)、2,3,5-三甲基吡嗪(纯度>99%)、2,3,5,6-四甲基吡嗪(纯度>98%):上海安谱科学仪器有限公司;2,3-二甲基-5-乙基吡嗪(纯度>98%):山东省滕州市华东生物科技有限公司。其他试剂均为国产分析纯或色谱纯。
1.2 仪器与设备
Aglient-1260高效液相色谱仪(配有光电二极管阵列检测器(diode-array detector,DAD)和荧光检测器(FLD)):美国安捷伦公司;TurboVap LV氮吹仪:瑞典Biotage公司;EYELA NYC-2100旋转蒸发仪:东京理化器械株式会社;Milli-Q Academic超纯水系统:密理博(中国)有限公司。
1.3 试验方法
1.3.1 高效液相色谱分析条件
流动相由流动相A和流动相B组成,流动相A:乙腈;流动相B:0.1%磷酸水溶液(pH=2.1);梯度洗脱流动相设置见表1。Phenomenon Gemini 5μ C6-Phenyl 110A色谱柱(250 mm×4.6 mm);柱温:30 ℃;流速:1 mL/min;进样量:10 μL;荧光检测器条件:激发波长280 nm,发射波长348 nm。

表1 梯度洗脱条件Table 1 Gradient elution conditions
1.3.2 对照品溶液的制备
分别精确称取2-甲基吡嗪、2,5-二甲基吡嗪、2,6-二甲基吡嗪、2,3-二甲基吡嗪、2-乙基-6-甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪、2,3-二甲基-5-乙基吡嗪对照品各100 mg,用乙醇溶解定容,得质量浓度为10 mg/mL的标准储备液,将标准溶液用蒸馏水分别稀释至0.1 μg/mL、0.2 μg/mL、0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、5.0 μg/mL,用于HPLC分析。
1.3.3 样品前处理
取白酒样品10 mL于具塞50 mL离心管中,用12 mol/L NaOH调pH为12,再用1 mol/L NaOH调pH为14,加适量NaCl使其饱和,15 mL乙醚振荡萃取15 min,重复提取2次,收集乙醚层,70 ℃水浴蒸发至剩余约0.5 mL,再以纯水定容至1 mL,过0.45 μm滤膜后用于HPLC进样分析。
1.3.4 方法学考察
(1)精密度试验
将2 μg/mL的混标连续进样6次,按1.3.1色谱条件测定8种吡嗪类化合物峰面积,分别计算结果相对标准偏差(relative standard deviation,RSD)。
(2)重复性试验
精密称取同一份白酒样品6份,按1.3.3的方法进行前处理,进样10 μL,测定8种吡嗪类化合物峰面积,计算结果相对标准偏差(RSD)。
(3)加标回收率试验
用无水乙醇配制体积分数为53%的乙醇溶液,作为空白酒样,加入不同质量浓度的吡嗪标准品进行加标回收试验,根据白酒中8种吡嗪化合物含量的高低,其中2-甲基吡嗪、2,3-二甲基吡嗪、2,5-二甲基吡嗪分别添加0.1 mg/kg、0.2 mg/kg、0.5 mg/kg三个不同水平质量浓度,另外5种吡嗪分别添加0.5 mg/kg、1.0 mg/kg、2.0 mg/kg三个不同水平质量浓度。
2 结果与分析
2.1 高效液相色谱条件优化
2.1.1 色谱柱的选择
首先选择了实验室液相色谱分析常用的Agilent ZORBAX Extend-C18色谱柱(2.1 mm×50 mm,3.5 μm)、Agilent ZORBAX SB-C8色谱柱(4.6 mm×100 mm,3.5 μm),因为分析的8种吡嗪类化合物均为烷基取代化合物,其中2,3-二甲基吡嗪、2,5-二甲基吡嗪、2,6-二甲基吡嗪为同分异构体,在C18、C8色谱柱上的保留时间非常接近。经多次尝试不同厂家不同型号的液相色谱柱后,发现菲罗门苯基色谱柱Gemini 5 μ C6-Phenyl 110A(250 mm×4.6 mm),使用了特殊的硅胶-有机层作为填料,具有增加碱性化合物保留和pH适应范围广(pH 1~12)功能,与吡嗪为弱碱性化合物的特点相适应,也满足流动相pH较低的条件。因此,选择菲罗门苯基色谱柱Gemini 5 μ C6-Phenyl 110A(250 mm×4.6 mm)。
2.1.2 检测器的选择
由图1可知,采用DAD检测器,在波长275 nm处测试8种吡嗪类化合物的对照品溶液均能得到较好的响应和较低的检出限,但在测试样品过程中,发现有一个很大的干扰峰,主要是由于二极管阵列检测器选择性较差,且白酒中含有大量的醇类、酯类、酚类等物质,这些物质大多都有紫外吸收,因此出现了干扰峰。
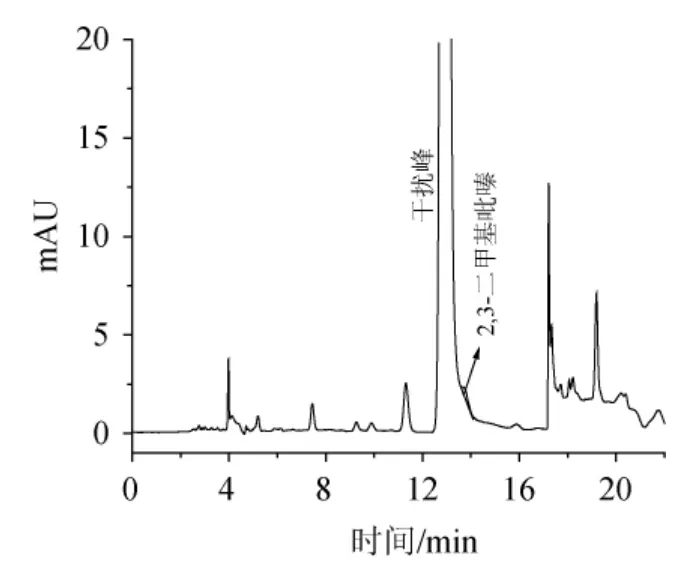
图1 采用二极管阵列检测器时样品色谱图Fig.1 Chromatogram of sample by diode array detection
由图2可知,在改用FLD检测器后该干扰峰变低且分离效果好。因此,最终确定采用FLD检测器,激发波长280 nm,发射波长348 nm。

图2 采用荧光检测器时样品色谱图Fig.2 Chromatogram of sample by fluoressence detector
2.1.3 流动相的选择
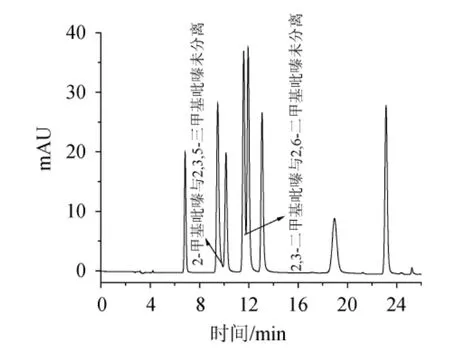
图3 乙腈-水(5∶95)为流动相时8种吡嗪类化合物标液色谱图Fig.3 Chromatogram of 8 pyrazine compounds standard solution using acetonitrile-water (5∶95) as mobile phase
为得到简单易得,分离度高,分析时间短的流动相系统,分别对甲醇-水(10∶90,V/V)、甲醇-缓冲盐(乙酸铵)(5∶95,V/V)、乙腈-水(5∶95,V/V)、乙腈-缓冲盐(乙酸铵)(5∶95,V/V)、甲醇-手性添加剂(β-环糊精)(10∶90,V/V)、乙腈-手性添加剂(β-环糊精)(10∶90,V/V)等不同的流动相系统进行了多次摸索,结果见图3。由图3可知,8种吡嗪类化合物在乙腈-水(5∶95,V/V)系统中分离效果良好。因此,采用乙腈-水(5∶95,V/V)系统作为流动相。
2.1.4 流动相中pH值的确定
在用液相色谱柱进行吡嗪类化合物的分离时,发现吡嗪类化合物对流动相的pH值很敏感。在乙腈-水(5∶95,V/V)的流动相系统中,加入0.1%的磷酸溶液调节流动相pH值,在pH值为1.9时,吡嗪类物质出峰时间较早,峰形较好,但2,3-二甲基吡嗪和2,6-二甲基吡嗪不能完全分离;pH上升到2.1时,8种吡嗪能得到良好的分离效果(见图4);当pH上升至2.2时,2,5-二甲基吡嗪和2,6-二甲基吡嗪出现包裹现象且与2,3-二甲基吡嗪不能完全分离。因此,选择流动相pH值为2.1。

图4 乙腈-水(5∶95)为流动相在pH值为2.1时8种吡嗪类化合物标液色谱图Fig.4 Chromatogram of 8 pyrazine compounds standard solution using acetonitrile-water (5∶95) as mobile phase at pH 2.1
2.1.5 流动相流速的选择
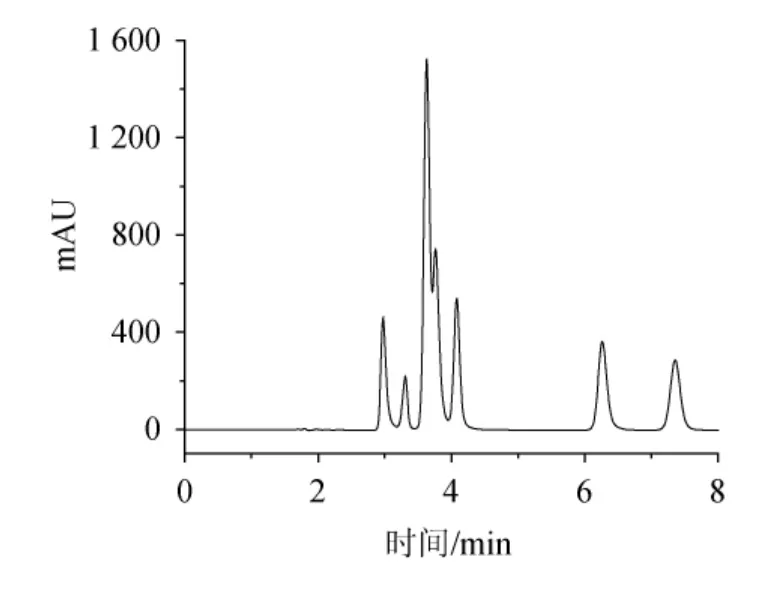
图5 流速为1.0 mL/min时8种吡嗪化合物色谱图Fig.5 Chromatogram of 8 pyrazine compounds at a flow rate of 1.0 ml/min
设置柱温30 ℃,以乙腈-水(pH 2.1)溶液为流动相,考察流速分别为0.5 mL/min、0.8 mL/min、1.0 mL/min、1.2 mL/min、1.5mL/min时的分离情况,发现流速为1.0mL/min的分析效果良好(见图5)。流速越低,分析时间延长,峰形变差;随着流速的升高,分析时间明显缩短,但影响分离度,综合分离度和分析时间。因此,选择流速为1.0 mL/min。
2.1.6 柱温的选择
在流速为1.0 mL/min时,分别设置柱温为25 ℃、30 ℃、35 ℃、40 ℃,发现8种吡嗪类物质的分离效果没有明显区别。因此,设置柱温为常用的30 ℃。
综上,优化的HPLC色谱条件为:检测器为FLD,色谱柱为Phenomenon Gemini 5 μ C6-Phenyl 110A(250 mm×4.6 mm);柱温30 ℃,流动相A为乙腈,B为%0.1磷酸水溶液(pH=2.1),梯度洗脱;流速为1 mL/min。标准品及样品的HPLC分析色谱图分别见图6。由图6可知,在此优化色谱条件下,标准品及样品吡嗪类物质分离良好。
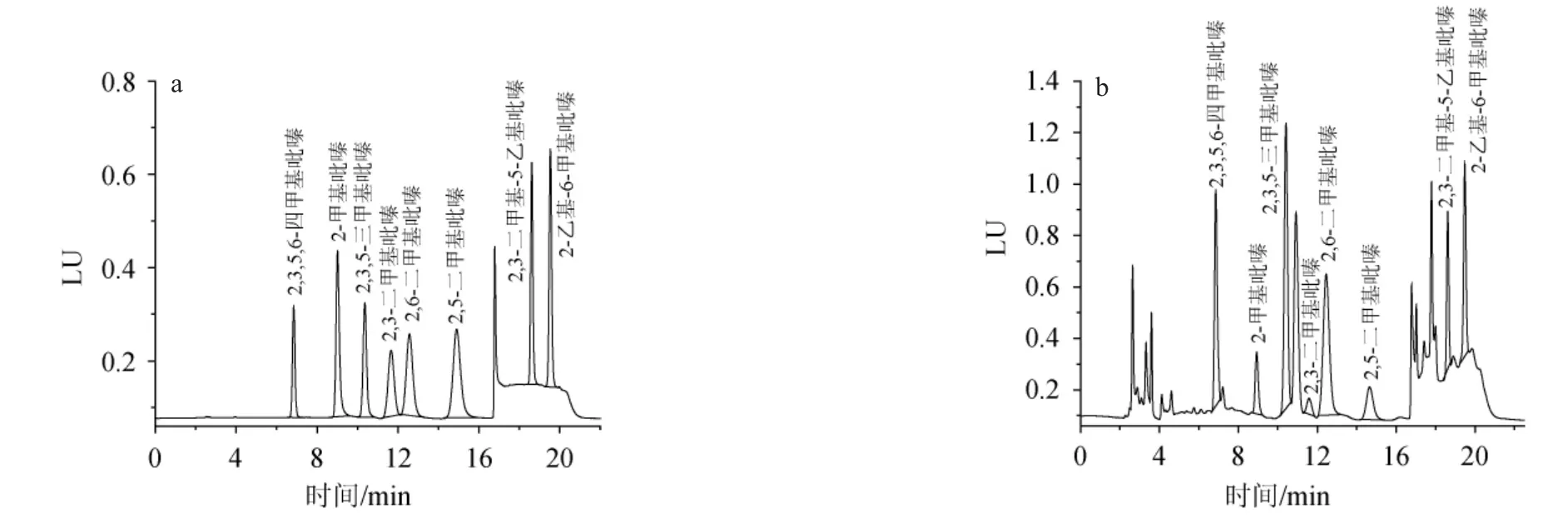
图6 8种吡嗪类物质标准品(a)及白酒样品(b)的HPLC色谱图Fig.6 HPLC chromatogram of 8 pyrazine compounds of standards (a) and Baijiu samples (b)
2.2 样品前处理方法研究
为建立回收率高,成本低,操作简单,重现性好的前处理方法,进行了3种方式前处理方法研究,结果见表2。

表2 样品不同前处理方法优缺点的比较Table 2 Comparison of advantages and disadvantages by different sample pretreatment methods
由表2可知,方法一采用直接蒸发浓缩的方法,前处理虽然简单,但不能有效去除白酒中的酸、酯、醇等物质的干扰,且不能对目标化合物进行有效富集,回收率较低。方法二采用的是将样品先酸化,浓缩后进行液-液萃取,再碱化的步骤,目的是先使样品中的目标化合物呈离子化,再用有机溶剂萃取掉样品中的酸、酯、醇等干扰物质,但此方法耗时长,有机溶剂消耗大,操作复杂,回收率不高。方法三是在碱性条件使样品中的吡嗪类物质更好的溶解在乙醇中,再用乙醚将样品中的吡嗪萃取出来,经过无水硫酸钠干燥后,不经过旋转蒸发器(减少旋蒸过程的损失),直接用离心管在70 ℃的水浴条件下将样品挥发至约0.5 mL,再用纯水定容至1 mL。
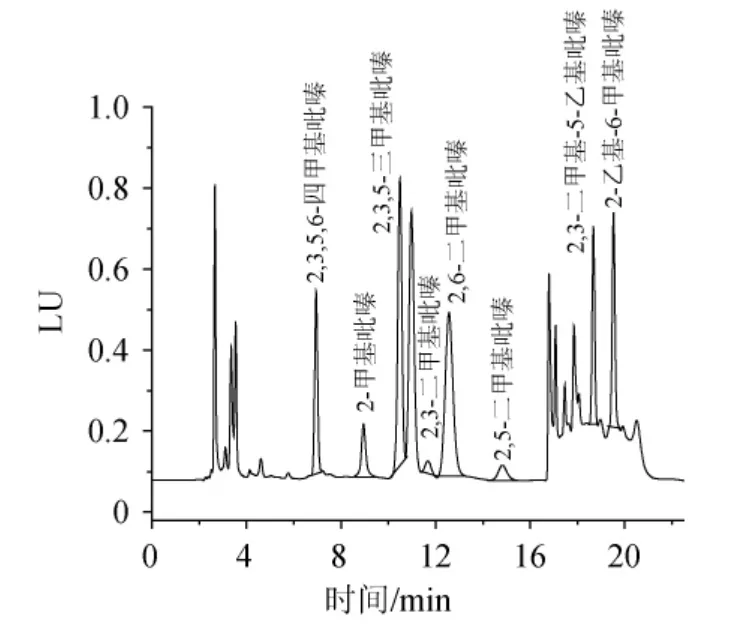
图7 按方法三前处理白酒样品中8种吡嗪类物质色谱图Fig.7 Chromatogram of 8 pyrazine compounds in Baijiu samples according to pretreatment method 3
由图7可知,方法三前处理过程得到分析样品具有干扰物质少,回收率高的特点,平均回收率可达到86%以上。因此,选择方法三作为酒样前处理方法。
2.3 标准曲线线性方程、线性范围、相关系数和检出限
将配制好的标准溶液按最佳色谱条件进样分析,以标准溶液质量浓度(X)为横坐标,峰面积(Y)为横坐标,绘制标准曲线,得到8种吡嗪物质的标准曲线线性方程、线性范围、相关系数见表3。

表3 8种吡嗪化合物的线性方程、线性范围、相关系数及检出限Table 3 Linear equation,linear range,correlation coefficient and limit of detection of 8 pyrazine compounds
由表3可知,在0.5~5.0 μg/mL质量浓度范围内具有良好的线性关系,线性相关系数R2均在0.99以上,可满足准确定量的要求。以S/N=3确定检出限(limit of detection,LOD),其中2,3,5,6-四甲基吡嗪、2,3,5-三甲基吡嗪、2-乙基-6甲基吡嗪的LOD均为0.10 μg/mL、2-甲基吡嗪的LOD为0.05 μg/mL、2,3-二甲基吡嗪LOD为0.15 μg/mL、2,5-二甲基吡嗪的LOD为0.24 μg/mL、2,6-二甲基吡嗪、2,3-二甲基-5-乙基吡嗪的LOD为0.13 μg/mL。
2.4 精密度试验
将2 μg/mL的混标按2.1确定的色谱条件连续进样6次,计算RSD,结果见表4。
由表4可知,2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪、2,3-二甲基-5-乙基吡嗪、2-乙基-6甲基吡嗪、2,6-二甲基吡嗪、2,3-二甲吡嗪、2,5-二甲基吡嗪和2-甲基吡嗪的精密度试验结果的RSD范围均在1.04%~2.49%之间,表明该方法的精密度良好。
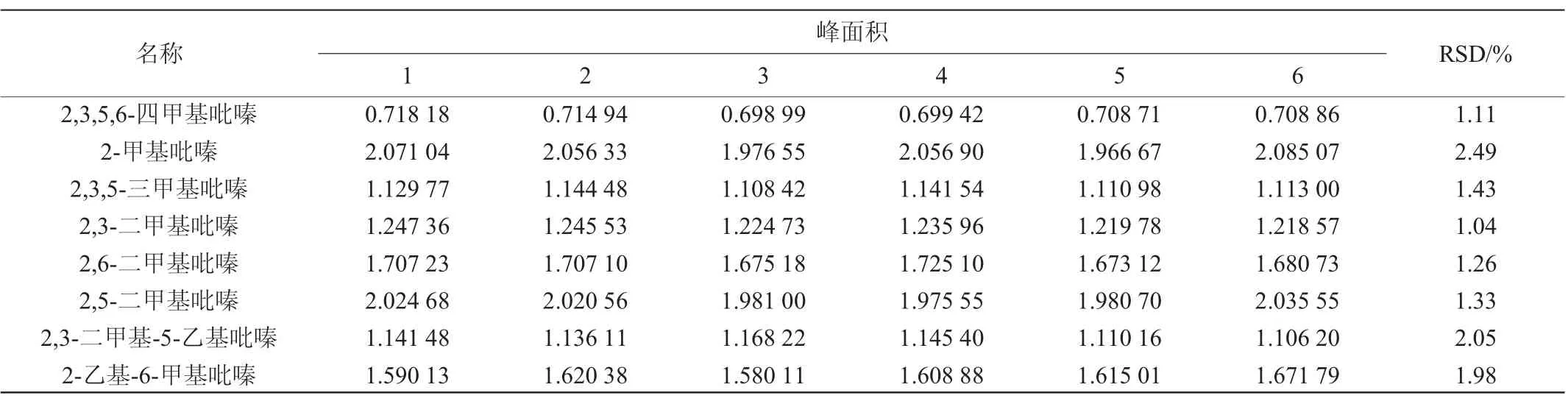
表4 8种吡嗪化合物分析的精密度试验结果Table 4 Results of the precision experiments of 8 pyrazine compounds analysis
2.5 重复性试验
精密称取同一份白酒样品6份,按2.2确定的前处理方法处理样品后,取10 μL进样,根据HPLC的分析所得峰面积分别计算RSD,结果见表5。

表5 8种吡嗪化合物的重复性试验结果Table 5 Results of the reproducibility experiments of 8 pyrazine compounds
由表5可知,得到2,3,5,6-四甲基吡嗪、2-甲基吡嗪、2,3,5-三甲基吡嗪、2,3-二甲吡嗪、2,6-二甲基吡嗪、2,5-二甲基吡嗪、2,3-二甲基-5-乙基吡嗪、和2-乙基-6甲基吡嗪的RSD分别为3.06%、2.78%、2.49%、2.62%、1.82%、2.71%、3.83%、1.98%。结果表明,该方法的重复性良好。
2.6 加标回收率试验
加标回收率及RSD结果见表6。由表6可知,8种吡嗪类物质的平均回收率在86.7%~99.0%之间,表明该方法的准确度高,因而使用本研究优化的色谱条件测定白酒中8种吡嗪时可以满足试验要求。

表6 8种吡嗪化合物的加标回收率结果Table 6 Results of the standard recovery of 8 pyrazine compounds
2.7 部分白酒样品中吡嗪类物质的含量测定
用所建立的方法对31个具有代表性的酒样中吡嗪化合物含量进行了测定,结果见表7。
由表7可知,四甲基吡嗪在21个酒样中含量排在第一位,在7个酒样中含量排在第二位,在3个酒样中含量排在第三位;三甲基吡嗪在18个酒样中含量排在第二位,在7个酒样中含量排在第一位,在6个酒样中含量排在第三位;2,6-二甲基吡嗪在31个酒样中排在前三位的占30个。结果表明,该方法可以用于白酒中8中吡嗪物质的检测。
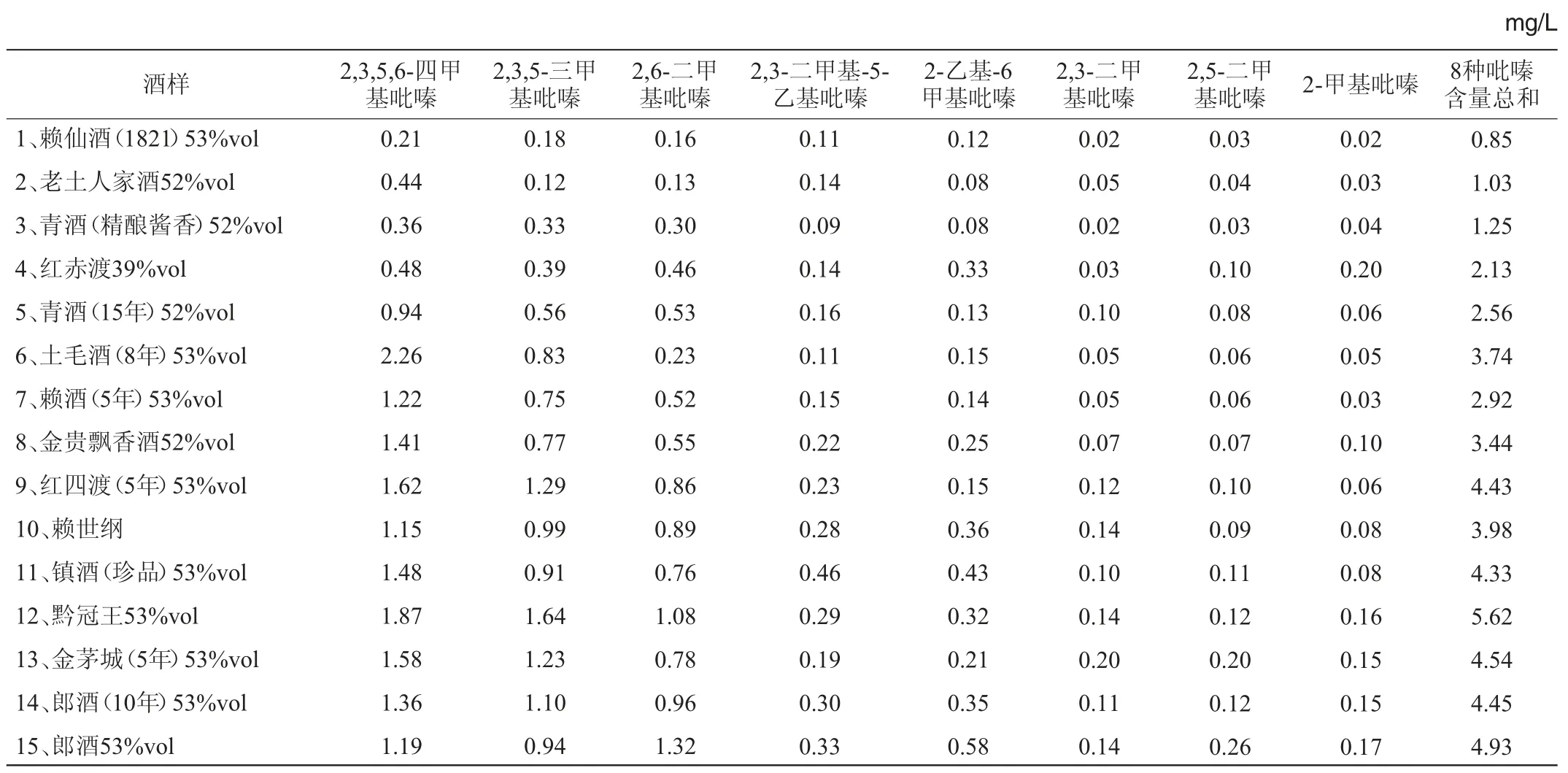
表7 白酒样品中吡嗪化合物的含量测定结果Table 7 Results of pyrazine compounds contents in Baijiu samples
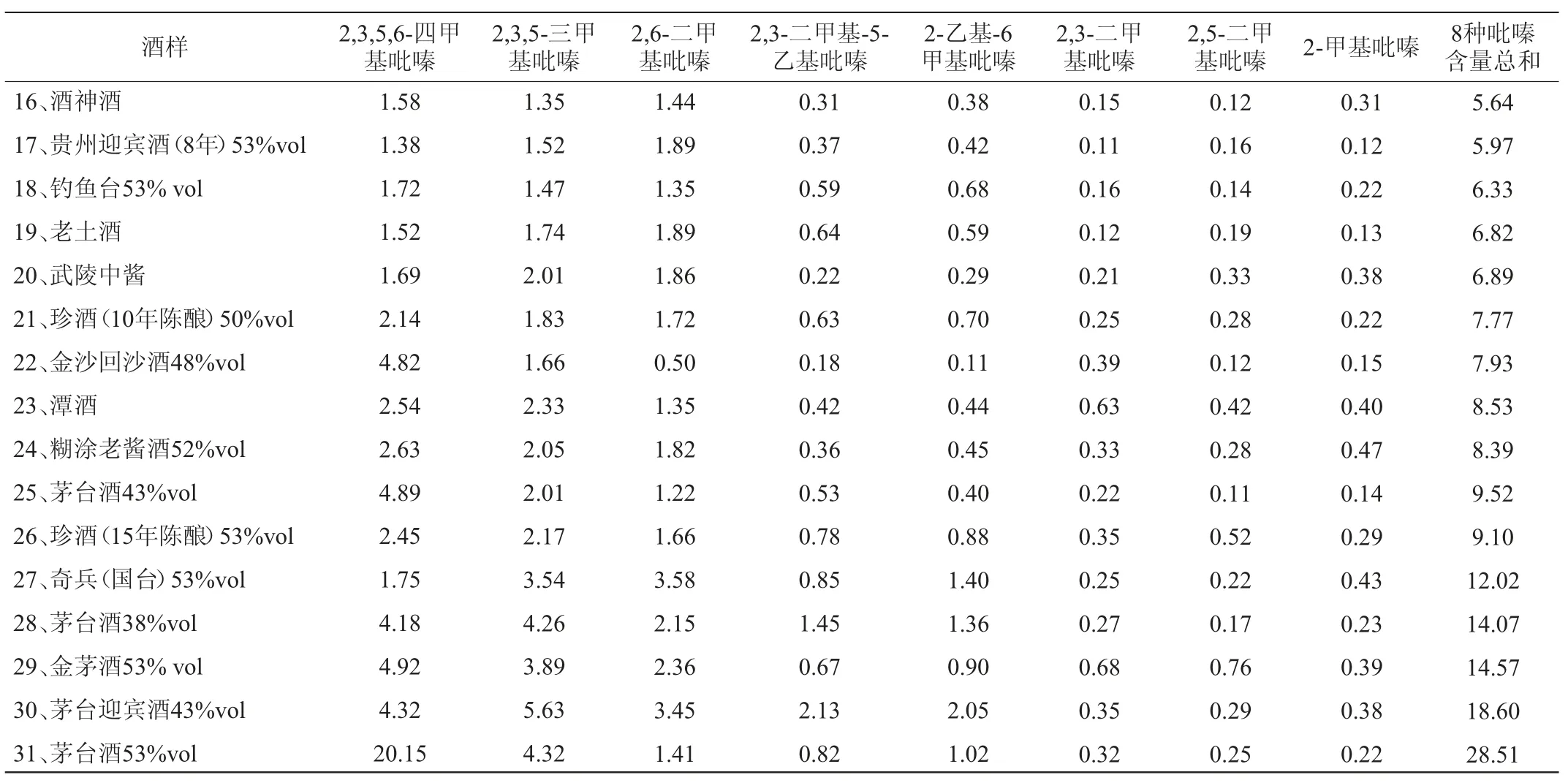
续表
3 结论
通过高效液相色谱试验条件优化、样品前处理方法研究,建立了高效液相色谱-荧光检测测定白酒中8种吡嗪类化合物含量的方法,最佳色谱条件为Phenomenon Gemini 5 μ C6-Phenyl 110A色谱柱(250 mm×4.6 mm);流动相A为乙腈,B为0.1%磷酸水溶液(pH=2.1),梯度洗脱;流速为1.0 mL/min;荧光检测器条件:激发波长280 nm,发射波长348 nm。该方法对8种吡嗪类化合物的精密度、重复性及加标回收率试验结果相对标准偏差(RSD)分别为1.04%~2.49%及1.82%~3.83%,样品加标回收率为86.7%~99.0%,检出限为0.05~0.24 μg/mL。该方法准确度高、精密度好,操作简便,成本低,可用于白酒中吡嗪类化合物的日常检测。

