纳米铁锰氧化物对硒Se(IV)的吸附研究
刘宏芳,连夏雨,张静慧
(太原科技大学 环境与安全学院,山西 太原 030024)
0 引 言
硒(Se)是人体内必需微量元素之一[1],在自然界中分布广泛,但是硒元素对人体有益的浓度范围非常窄.天然水体中硒的浓度一般不超过10 μg/L[2],当水中硒浓度超过50 μg/L时,饮食即成为人和动物摄入硒的主要途径[3].研究表明,硒缺乏会造成近视、白内障、骨骼肌萎缩、心肌受损等疾病,过量则会导致人体神经系统功能紊乱、发育迟缓、胚胎畸形、细胞癌变等[4].调查表明,部分地区土壤和水体中硒元素已经出现了不同程度的超标现象,其在生态环境中的化学行为已经受到研究人员的高度重视[5-9].研究发现,硒的环境行为及生物毒性与其在环境中的存在形态密切相关.Se(IV)毒性强,随水迁移能力强,易在生物体内富集,对生态环境和人体的威胁更大.因此,如何快速、有效地去除环境中Se(IV)成为亟待解决的环境问题之一.
目前,对于土壤和水体中的Se(IV)污染的治理方法主要有离子交换法、反渗透法、共沉淀法、生物修复法、吸附法等[10].与其它方法相比,吸附法具有操作简便、成本低廉、去除效率高、可再生等优点.研究表明,铁锰金属氧化物能够通过表面反应或静电吸附来去除水体中的污染物,铁锰金属氧化物具有较强的吸附选择性[11],对Se(IV)、Cr( Ⅵ)、P(V)等阴离子具有较强的吸附能力[12].与天然铁、锰矿相比,实验室制备的纳米铁锰氧化物颗粒具有更大的比表面积和更高的反应活性[13-14],在土壤和水体污染治理中具有广阔的应用前景.
本文探究了合成的纳米铁锰氧化物对水溶液中Se(IV)的去除效果,考察了初始浓度和温度对去除效果的影响,并利用吸附动力学和吸附等温线模型对数据进行拟合,探讨了纳米铁锰氧化物对Se(IV)的吸附机理.
1 实验部分
1.1 试剂与仪器
本实验所用试剂和设备分别见表1和表 2.

表1 实验试剂Tab.1 The experimental reagents

表2 实验仪器Tab.2 The main instrument equipment
1.2 纳米铁锰氧化物制备
采用液相还原法制备纳米铁锰氧化物溶液.在室温下,量取浓度为1.0690mg/mL的硫酸亚铁溶液130 mL,置于200 r/min的摇床上,然后向该硫酸亚铁溶液中滴加浓度为2.6500mg/mL的高锰酸钾溶液10 mL,再用4 mol/L氢氧化钠溶液调节pH至6.5±0.2,继续振荡1 h后静置2 h,离心制得实验所需纳米材料.
1.3 实验方法
称取一定量的纳米铁锰氧化物加入到Se(IV)溶液中,以200 r/min转速振荡吸附5 h,间隔取样,离心后用ICP-OES测定上清液中剩余硒的浓度.本研究主要利用批实验探讨了初始浓度和温度对纳米铁锰氧化物材料吸附硒的影响.
2 结果与讨论
2.1 初始浓度对纳米铁锰氧化物吸附Se(IV)的影响
保持温度为25℃,称取0.1000g 纳米铁锰氧化物分别加入到浓度为5 mg/L,10 mg/L,20 mg/L,30 mg/L,40 mg/L,体积为250 mL的 Se(IV)溶液中,以200 r/min转速不间断振荡5 h,按设定间隔取样,离心静置后测上清液剩余 Se(IV)浓度,结果如图1所示.

图1 纳米铁锰氧化物对不同初始浓度Se(IV)溶液的吸附曲线Fig.1 Adsorption curves of Nano-Fe-Mn oxides on Se(IV) solutions with different initial concentrations
由图1可知,反应进行5 h后吸附已经完全达到平衡.在实验浓度范围内,初始浓度越低,到达吸附平衡点的曲线越陡,去除率越高,吸附越快.这是因为在纳米铁锰氧化物使用量一定时,吸附容量一定,Se(IV)质量浓度越低,吸附位点相对越多,吸附速率快,随着Se(IV)质量浓度增大,纳米铁锰氧化物吸附容量和位点相对不足,从而使吸附速率下降[15].实验表明,0.1000g铁锰材料对Se(IV)的去除效率可达90%以上.
2.2 温度对纳米铁锰氧化物吸附Se(IV)的影响
在温度为25 ℃,35 ℃和45 ℃条件下,称取 0.1000g 纳米铁锰氧化物加入到浓度为40 mg/L,体积为250 mL的Se(IV)溶液中,除反应温度不同外,其他反应条件同上.Se(IV)浓度随时间变化情况如图2所示.

图2 不同温度下纳米铁锰氧化物平衡吸附量随Se(IV)初始浓度变化曲线Fig.2 The curve of equilibrium adsorption amount of nano-Fe-Mn oxide with initial Se(IV) concentration at different temperatures
由图2可知,温度从25 ℃升高到35 ℃时,纳米铁锰氧化物对Se(IV)的吸附量从80.8330mg/g 增加到84.3700mg/g,吸附量的增幅为4.38%;温度上升到45 ℃时,其吸附量增加到84.6996 mg/g,与35 ℃时的平衡吸附量相比,45 ℃时的平衡吸附量增幅只有0.39%,增幅极小.由实验结果可知,吸附量会随着温度升高而增加,反应前30 min内吸附速率较快,反应为吸热反应,升高温度有利于加快反应速率[16].
2.3 纳米铁锰氧化物吸附Se(IV)的吸附动力学
吸附动力学方程如下:
Lagergren准一级动力学方程为
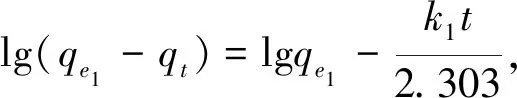
(1)
Ho准二级动力学方程为
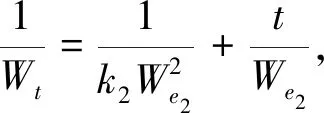
(2)
式中:qe1为平衡时的吸附量;qt为t时间的吸附量;k1,k2为准一级、准二级动力学吸附速率常数;Wt为吸附量;We1,We2为准一级、准二级动力学平衡吸附量.
取Se(IV)的实验浓度中最小浓度5 mg/L和最大浓度40 mg/L的实验数据做吸附动力学模拟拟合.准一级和准二级动力学拟合结果如图 3~图6和表 3(R2>0.995)所示.可以明显看出准二级动力学预测的平衡吸附量和实验结果接近,说明纳米铁锰氧化物吸附Se(IV)的过程符合二级动力学方程,吸附过程中化学吸附占有主导地位.

图3 CSe=5 mg/L的准一级动力学拟合图Fig.3 Quasi first order dynamic fitting when CSe=5 mg/L

图4 CSe=5 mg/L的准二级动力学拟合图Fig.4 Quasi second order dynamic fitting when CSe=5 mg/L

图5 CSe=40 mg/L的准一级动力学拟合图Fig.5 Quasi first order dynamic fitting when CSe=40 mg/L
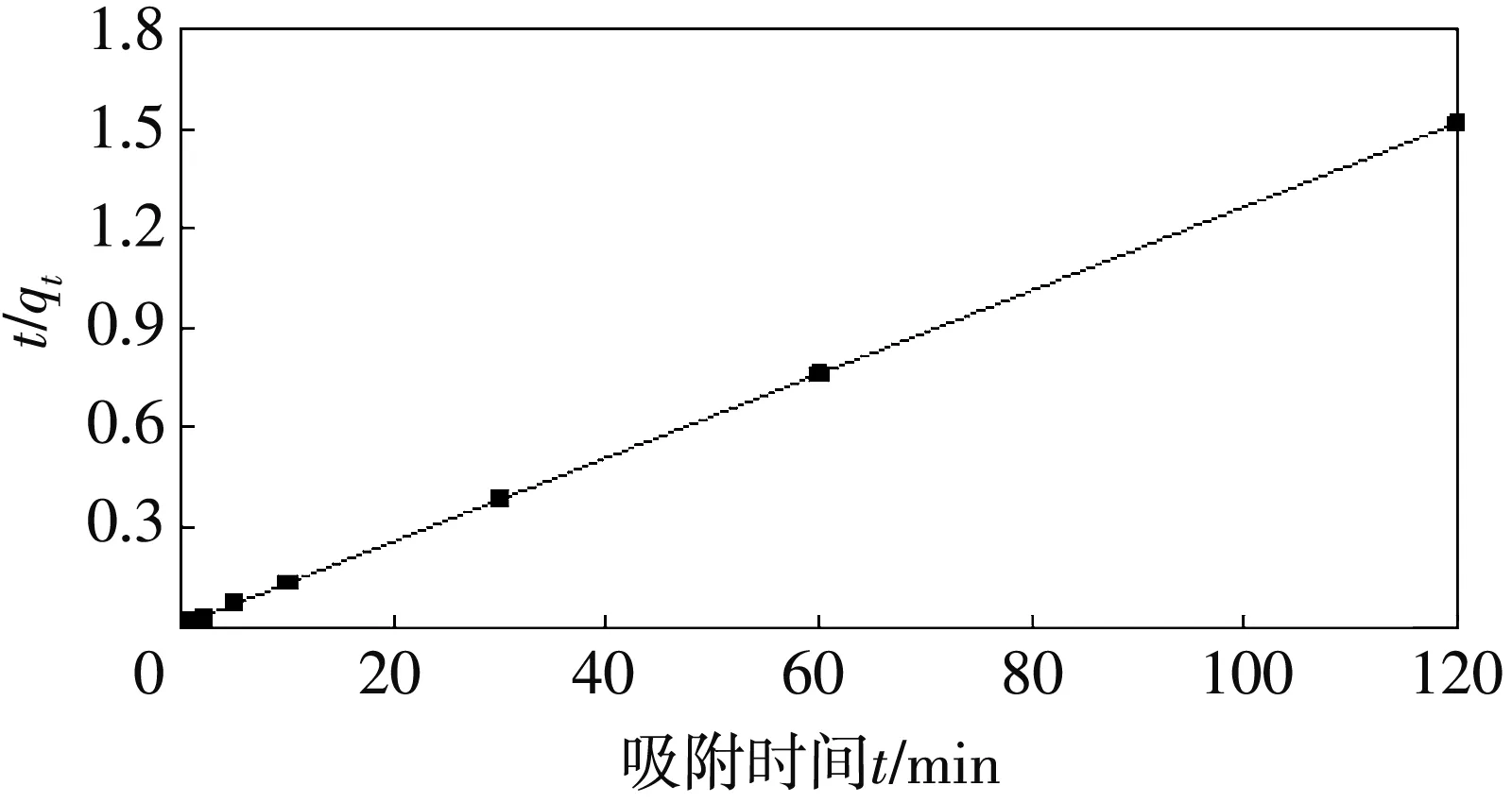
图6 CSe=40 mg/L的准二级动力学拟合图Fig.6 Quasi second order dynamic fitting when CSe=40 mg/L

表3 CSe=5 mg/L,40 mg/L的吸附动力学拟合参数Tab.3 Adsorption kinetic fitting parameters for CSe=5 mg/L and40mg/L
2.4 吸附等温线
称取0.1000g纳米铁锰氧化物投加到250 mL 浓度为5 mg/L~40 mg/L的Se(IV)溶液中,保持溶液体积不变,反应过程分别在25 ℃,35 ℃和45 ℃的温度下进行,其他反应条件同上.用Langmuir单层吸附方程和Freundlich经验方程对吸附过程进行拟合.
Freundlich 型吸附等温式
G=kC1/n,
(3)
lgG=lgk+1/n(lgC).
(4)
Langmuir型吸附等温式

(5)

(6)
式(3)为Freundlich 型等温式,式(4)为Freundlich 型等温式的变形形式,以lgG对lgC作图可得一直线,lgk为截距,其中G为颗粒物表面上的吸附量;C为溶液中溶质的平衡浓度;k为分配系数;n为Freundlich常数.
式(5)为Langmuir型等温式,式(6)为Langmuir型等温式的变形形式,以1/G对1/C作图同样可得一直线,G0为单位表面上达到饱和时间时的最大吸附量;A为常数.
Freundlich 型和Langmuir型等温式在不同温度下线性拟合曲线的结果如图 7~图12和表4所示.

表4 不同温度下Langmuir和Freundlich的吸附等温线常数和相关系数Tab.4 Langmuir and Freundlich adsorption isotherm constants and correlation coefficients at different temperatures
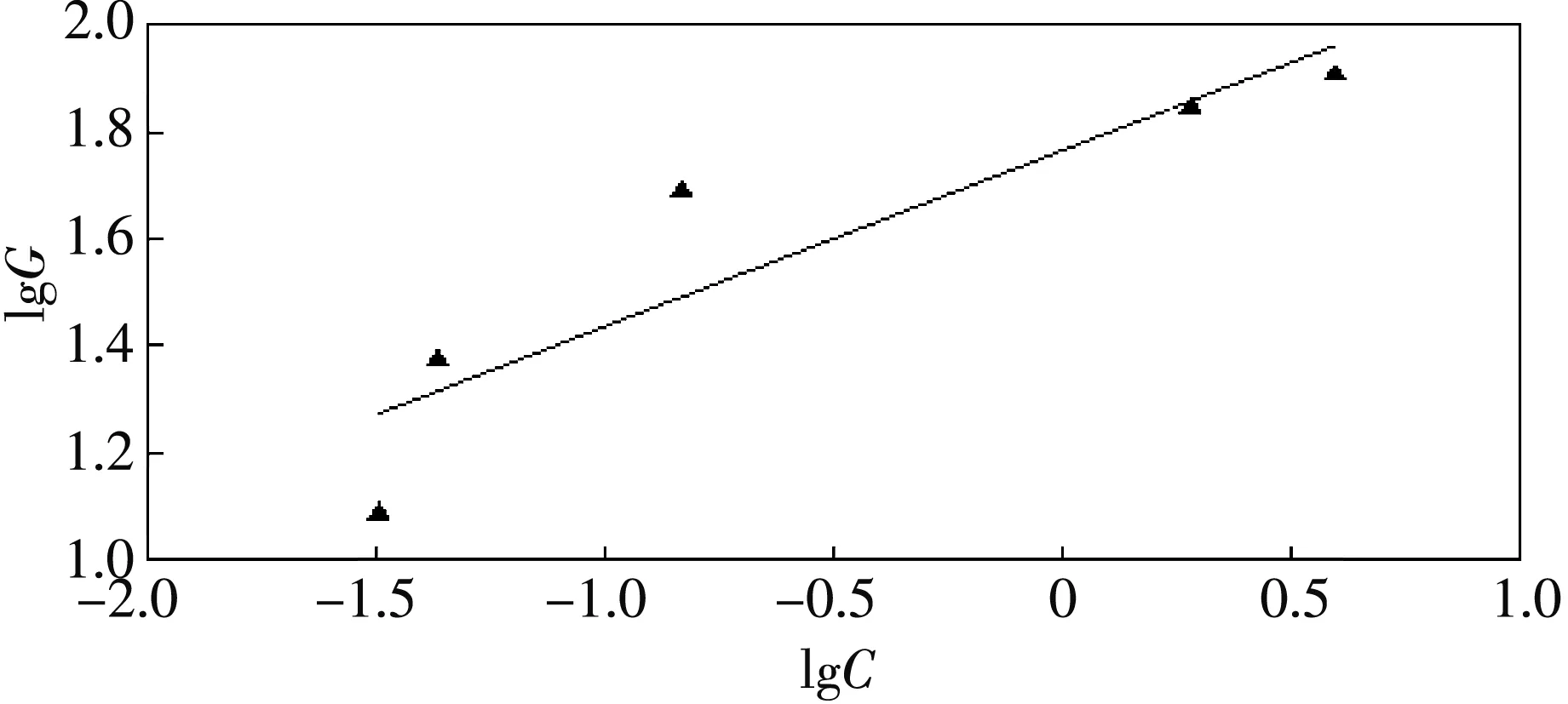
图7 25 ℃ Freundlich线性拟合曲线Fig.7 Freundlich linear fitting curve at25℃ Fig

图8 25 ℃ Langmuir线性拟合曲线Fig.8 Langmuir linear fitting curve at25℃

图9 35 ℃ Freundlich线性拟合曲线Fig.9 Freundlich linear fitting curve at35℃

图10 35 ℃ Langmuir线性拟合曲线Fig.10 Langmuir linear fitting curve at35℃
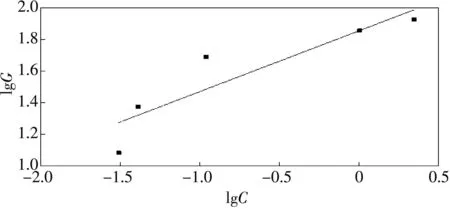
图11 45 ℃ Freundlich线性拟合曲线Fig.11 Freundlich linear fitting curve at45℃

图12 45 ℃ Langmuir线性拟合曲线Fig.12 Langmuir linear fitting curve at45℃
由Freundlich 型和Langmuir型等温线线性拟合回归分析可得,在所有温度下,Langmuir型等温式的相关系数R2均大于Freundlich型的R2,可知实验数据与Langmuir型拟合度更高,Langmuir型等温式对实验数据可以更好地拟合;且G0随温度的增高而增大,说明纳米铁锰氧化物吸附Se(IV)是吸热反应.Freundlich型吸附等温式在25 ℃,35 ℃,45 ℃时拟合后得到的1/n分别为0.328 1,0.371 9和0.385 5,在0.1~0.5的易吸附范围[17],说明纳米铁锰氧化物为易吸附性吸附剂,因此可以有效去除水溶液中的Se(IV).
3 结 论
以液相还原法制备的纳米铁锰氧化物具有更大的比表面积和更高的反应活性.动力学实验表明,在5 h的反应时间内,实验所用量的铁锰材料对Se(IV)的吸附量达到39 mg/L以上,去除效率可达90% 以上.本文主要结论如下:
1) 相同实验条件下,纳米铁锰氧化物对水溶液中Se(IV)的吸附速率较快,5 h后可达到吸附平衡.初始浓度越低,纳米铁锰氧化物对Se(IV)去除率越高,吸附速率越快.
2) 反应温度在25 ℃~45 ℃之间时,温度变化对纳米铁锰氧化物吸附Se(IV)有一定影响,在反应前30 min内会提高吸附率.不同温度下Langmuir方程拟合出的相关系数在0.864 8~0.9201之间,拟合计算得最大吸附量分别为102.040 8,133.333 3,127.877 2.说明纳米铁锰氧化物吸附Se(IV)是吸热过程,升高温度有利于提高吸附量.
3) 相同实验条件下,铁锰纳米材料对Se(IV)的吸附过程符合二级动力学过程,吸附过程中化学吸附占主导地位.

