FAM83蛋白调控肿瘤发生机制及临床应用研究进展
刘南茜, 陈兴珍 , 周策凡, 唐景峰
(1.湖北工业大学 生物工程与食品学院,武汉 430068;2.湖北工业大学 国家外专局/教育部细胞调控与分子药物学科创新“111”引智基地,武汉 430068)
1 FAM83蛋白家族成员及结构特点
FAM83蛋白家族(序列相似性家族83)有8个基因成员,它们位于染色体不同的基因组位点,根据其N末端--未知功能域(DUF1669)的保守性进行分类(图 1),命名为FAM83A-H。在DUF1669结构域之外,家族成员之间没有检测到相似的序列,且每个FAM83家族成员的C端由非球形无序序列组成[1]。
图1 DUF1669结构域晶体结构图(10.2210/pdb4URJ/pdb)
从进化上讲,原始生物(如果蝇、酿酒酵母和秀丽隐杆线虫)中没有FAM83基因的同源物或直系同源物,但所有有颚的脊椎动物都编码FAM83基因[2]。虽然所有FAM83成员在DUF1669之外没有任何重要的同源性,并且大小差异很大,介于434~1 187个氨基酸之间(图 2),但它们在癌症中的表达均显著增加。Fulcher等[3]报道所有FAM83蛋白通过DUF1669结构域与CK1(酪蛋白激酶1)结合,并参与同工酶调节。FAM83A、FAM83B、FAM83D和FAM83F过度表达能够激活MAPK信号,同时DUF1669结构域对于FAM83A,FAM83B和FAM83F与RAF1的相互作用是必需的[4-7],提示FAM83蛋白家族极有可能通过DUF1699结构域发挥细胞调控作用。
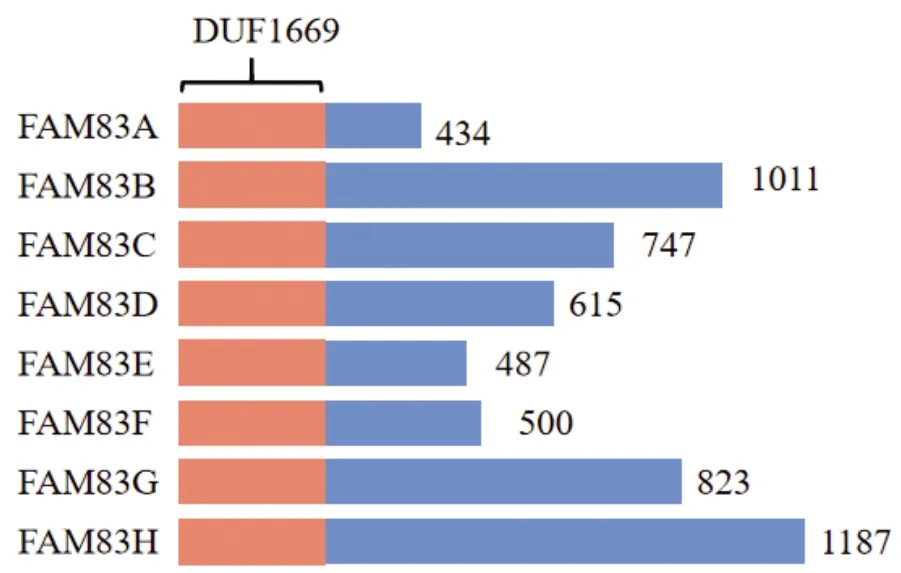
图 2 FAM83A-H结构示意图
肿瘤细胞的共同特征之一是通过调节细胞骨架成分来进行侵略性迁移,从而促进恶性肿瘤细胞迁移和侵袭,而FAM83家族成员中大多能促进肿瘤的发生。最近有文献报道,在乳腺癌细胞中FAM83A过表达并促进细胞增殖、迁移和侵袭[6, 8]。李景攀等[9]报道沉默FAM83A可抑制非小细胞肺癌细胞的增殖、迁移和侵袭, 并抑制裸鼠体内肿瘤的生长。朱宏涛[10]团队发现FAM83D在卵巢癌组织中高表达且影响细胞自噬、增殖和侵袭能力。Wang等[7]报道FAM83D能够激活MEK/ERK 信号通路并促进细胞周期进程进入S期从而促进肝癌细胞增殖。Kim等[11]报道MYC(致癌基因)可以与FAM83H的启动子结合并促进FAM83H的转录,使FAM83H表达增加,从而促进肝癌细胞的迁移和侵袭。Cummins等[12]报道FAM83G与CD2AP相互作用可以调节细胞骨架机制和细胞迁移。Cipriano等[13]报道在膀胱癌和卵巢癌中FAM83C和E表达升高,并且促进人乳腺上皮细胞转化。
本文重点阐述FAM83蛋白在肿瘤细胞内异常表达的调控因素、促成肿瘤发生的潜在机制及其在癌症临床治疗中的作用。
2 FAM83异常表达及功能活性调控
2.1 非编码微小RNA(MicroRNA,miRNA)
miRNAs是一类由内源基因编码的长度为21~28个核苷酸的非编码单链RNA,通过转录后降解或抑制靶基因的表达而参与组织细胞的多种病理及生理过程[14]。近年来,越来越多的miRNAs在FAM83蛋白家族的异常表达调控中起重要作用。Yang等[15]研究发现miR-455-3p能够通过下调FAM83F而发挥抑癌作用,低miR-455-3p表达的患者比高miR-455-3p表达的患者生存时间更短。在肺腺癌细胞中,miR-1827靶向FAM83F和MYC从而抑制肺腺癌的发生发展[16]。与FAM83F相似,FAM83D的转录受miR-210调节[17]。在缺氧条件下,miR-210能够与一组有丝分裂相关基因(PLK1、CDC25B、BUB1B和Cyclin-F)一起协同减少FAM83D的表达[18]。刘志为等[19]报道miR-495能与FAM83D的3′-UTR特异性结合,调控FAM83D的表达,从而抑制结直肠癌细胞的增殖和迁移。于凤芹等[20]报道过表达MiR-3182或抑制FAM83A表达能够减少Bcl-2(B淋巴细胞瘤-2基因)的表达,增加Bax(Bcl-2基因家族中细胞凋亡促进基因)的表达,进而增强细胞放射敏感性。这说明miRNAs通过调控FAM83蛋白表达从而影响肿瘤细胞的功能。
2.2 蛋白质修饰作用
蛋白质修饰(蛋白质的翻译后修饰)是前体蛋白具有生物活性的重要步骤。在细胞中存在着多种翻译后修饰,如蛋白质的糖基化、甲基化、磷酸化、泛素化、棕榈酰化和乙酰化等[21]。Weimann等[22]研究发现FAM83D受PRMT-1(I型精氨酸甲基转移酶)翻译后调控,该酶以FAM83D精氨酸甲基化为靶标,并增加FAM83D蛋白的表达或促进FAM83D与其他蛋白的相互作用。Bozatzi等[23]报道CK1α通过磷酸化FAM83G来增加它的蛋白水平。同时,FAM83G与CK1α存在相互作用并协同影响Wnt信号通路[23]。另一个与CK1α蛋白相关的FAM83家族成员是FAM83H,通过免疫共聚焦发现FAM83H和CK1α都定位在细胞核上,CK1的蛋白质水平受FAM83H调节。在结直肠癌细胞中稳定表达FAM83H,CK1α、δ和ε的蛋白质水平均增加,但CK1α的mRNA水平没有增加,这表明CK1的表达增加是通过转录后机制。这些结果表明CK1通过与FAM83H结合而稳定[24]。可见CK1参与FAM83蛋白家族蛋白质的翻译后修饰机制。
3 FAM83家族与信号调控
信号通路是复杂和相互联系的网络,它们共同作用以调控细胞功能。FAM83蛋白家族成员被证实与C-RAF和CK1α等直接结合,通过一系列信号传递,最终影响MAPK信号通路、Wnt信号通路和TGF-β信号通路等。
3.1 FAM83调控MAPK信号通路
MAPKs是一类丝氨酸/苏氨酸蛋白激酶。最早发现经典的 RAS/RAF/MAPK信号通路参与各种生长因子、细胞因子、丝裂原,以及激素受体活化后的信号转导,促进血管内皮细胞增殖和新血管生成,新血管生成后可为肿瘤提供更多的营养,加速肿瘤的生长,促进癌细胞的扩散[25]。
最近有文献报道,FAM83A能促进RAS/RAF/MEK/ERK和PI3K/AKT/mTOR等信号通路,并作用于MAPK上游以及EGFR下游,可以与C-RAF和PI3K p85亚基发生相互作用并促进其磷酸化水平[6]。干扰FAM83A导致p-ERK和p-AKT磷酸化水平的降低,并抑制PI3K信号传导,进而影响乳腺癌细胞的生长,增加细胞凋亡[8]。Cipriano等[4, 13, 26]报道FAM83A-E可以驱动人乳腺上皮细胞转化,并且FAM83A和FAM83B是通过激活MAPK和PI3K/AKT信号实现转化。与FAM83A一样,FAM83B也位于MEK的上游发挥功能,它可以与C-RAF结合并增加C-RAF在细胞膜上的定位来刺激MAPK信号[4]。FAM83B表达升高导致MAPK和mTOR信号异常,同时能够赋予TKI(EGFR酪氨酸激酶抑制剂)抗性并且降低AG1478(RAF激酶抑制剂I)的敏感性[4]。干扰FAM83B后,C-RAF、PI3K和AKT定位到细胞膜的能力降低,同时,减弱ERK1/2和AKT磷酸化水平,从而抑制细胞生长[4]。同样,FAM83D被报道也可以激活MEK/ERK信号通路[7]。它能够通过与FBXW7(肿瘤抑制因子)相互作用并影响其表达,FBXW7是c-Myc、mTOR和C-Jun表达的抑制剂[27],因此,过表达FAM83D能促进这些下游癌基因的表达,有助于其驱动转化的能力。同时,干扰FAM83A或FAM83D,抑制ERK磷酸化水平。因此,FAM83A、FAM83B和FAM83D是肿瘤细胞中维持异常C-RAF/MAPK活化的重要中介[13]。以上结果表明FAM83蛋白家族在MAPK和PI3K/AKT信号通路中发挥重要的作用(图 3)。

图3 FAM83蛋白与MAPK信号通路调控关系
3.2 FAM83调控Wnt/β-catenin和TGF-β信号通路
Wnt信号通路是动物细胞内高度保守的信号通路,其中,包含β-catenin的 Wnt通路被称为经典Wnt信号通路,又叫Wnt/β-catenin信号通路,它参与调控胚胎早期发育、成体组织稳态维持、干细胞自我更新、细胞分裂,以及肿瘤发生发展等多种生物学过程[28]。接下来,探讨FAM83蛋白家族对经典Wnt信号通路的调控作用。
FAM83B不仅可以激活MAPK和PI3K/AKT/mTOR信号,而且也能参与癌症相关的Wnt信号通路。Hilger等[29]报道FAM83B是Axin1和APC的新型相互作用伴侣,这种相互作用可能与Wnt信号通路相关。Bozatzi等[23]报道Fam83G是Wnt信号通路的新型介体,它可以和β-catenin降解复合体中的Axin1、CK1α和GSK3β形成坚固的复合物,促进CK1α和GSK3β磷酸化并积累活性β-catenin,进而激活Wnt信号。所有FAM83家族成员都可以与CK1α发生相互作用,这表明其他FAM83家族成员可以与CK1复合物一起发挥作用,并以协同方式调控Wnt/β-catenin信号通路[3, 23]。Wnt和TGF-β信号通路对癌症的发展具有协同促进作用。TGF-β信号通路根据配体分子激活不同的信号分子可以分为TGF-β/Activin/Nodal和BMP/GDF/MIS两个亚家族通路,调节细胞的生长、发育和凋亡,在肿瘤的发展期会促进恶性肿瘤的侵袭和转移[30]。通过质谱分析,Brown等[31]发现FAM83G是Smad2和Smad3相互作用蛋白,并证明FAM83G能够参与TGF-β信号通路的调控。与FAM83G相似,干扰FAM83A不仅可以抑制Wnt/β-catenin,还能够阻止TGF-β信号通路的激活,进而降低肿瘤细胞的致瘤性。过表达FAM83A,细胞核内β-catenin数量和磷酸化的Smad3表达量显著升高,说明FAM83A能够同时调控Wnt/β-catenin和TGF-β信号通路[32](图 4)。
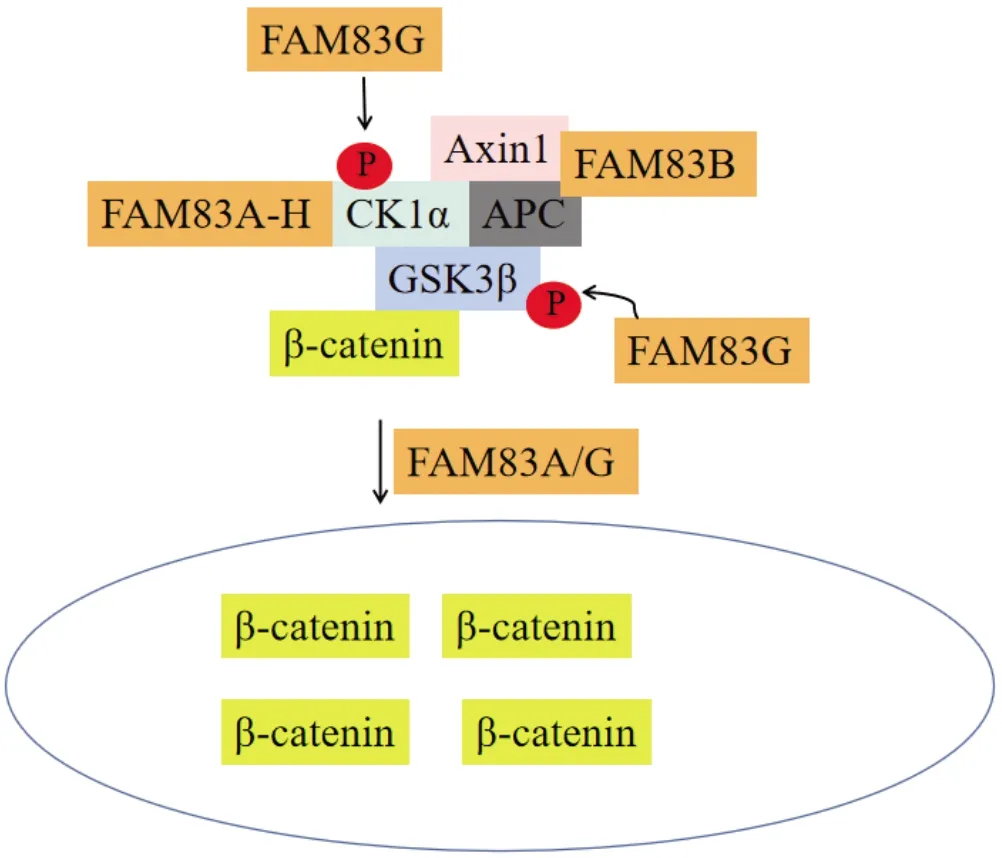
图4 FAM83蛋白与Wnt信号通路调控关系
4 FAM83家族在肿瘤诊断与治疗方面的应用
4.1 分子marker诊断
对人类肿瘤样本分析表明,多数FAM83家族成员在癌症中高表达,并与特定的癌症亚型相关,这表明FAM83蛋白成员能够成为某种特定癌症治疗的新靶标。研究发现,FAM83A是一类肿瘤特异性抗原,在肺癌、乳腺癌、胰腺癌、膀胱癌和卵巢癌中均高表达,而在正常组织中不表达,并且其表达量高低与癌症患者总体生存率和无病生存率显著相关[13, 32]。已发表的临床数据表明,FAM83A表达越高,乳腺癌患者预后越差[6]。同样,FAM83B在乳腺癌、膀胱癌、睾丸癌、卵巢癌、甲状腺癌和肺癌中高表达[4],且FAM83B的高表达与肺鳞癌患者的无病生存期差有关[33]。Cai等[34]对362例患者样本进行qPCR 定量分析FAM83A和FAM83B表达,研究发现FAM83A和FAM83B可以作为非小细胞肺癌的预后生物标志物和潜在的新治疗靶标。同时FAM83D被报道与乳腺癌和肝癌预后不良有关[7, 27]。Huang等[18]报道在胃癌细胞中FAM83D过表达可以增强细胞的增殖、循环进程、迁移、侵袭,可以说FAM83D是胃癌的预后生物标志物。在肺腺癌中,MYC和FAM83F均过表达,其高表达与肺腺癌的进展及患者预后不良显著相关[16]。Kim等[11]报道FAM83H在肝癌细胞中高表达,并且它的高表达预示肝癌患者的较短生存期,它能诱导CCND1(细胞周期蛋白D1)和CCNE1(细胞周期蛋白E1)的表达,并抑制P53(人体抑癌基因)的表达,从而影响肝癌细胞的增殖和侵袭。因此,FAM83H可能是肝癌患者不良的预后指标。
4.2 肿瘤耐药
肿瘤耐药对癌症发病率和死亡率具有相当重要的意义,它有许多药物类别(如细胞毒性、免疫调节剂和激素药物)[35]。FAM83A除了可以作为生物标志物外,还是TKI的抑制剂。FAM83A可以抑制TKI活性,使肿瘤细胞即使存在EGFR-TKI,激活EGFR下游MAPK和PI3K/AKT/mTOR信号,保持肿瘤细胞恶性表型[36]。将过表达EGFR的肿瘤细胞注入小鼠体内并用EGFR抑制剂治疗,内源性FAM83A表达和DNA拷贝数均增加,使存活的肿瘤细胞具有抗性。FAM83A除了在TKI抗药性中发挥作用,还赋予对曲妥珠单抗的抗性。曲妥珠单抗是用于治疗乳腺癌的单克隆抗体[2]。干扰FAM83A后使这些细胞对曲妥珠单抗重新敏感[7]。FAM83A还赋予对拉帕替尼和吉西他滨的抗性,表明FAM83A在肿瘤耐药性起重要作用。类似FAM83A,在乳腺癌细胞中FAM83B可以促进异常信号传导和对EGFR-TKI的耐药性[4]。此外,FAM83B转化的细胞对PI3K、AKT和mTOR靶向疗法的敏感性较低[26]。与之前确定FAM83A和FAM83B在肿瘤耐药中的作用相似,在胰腺癌中插入诱变筛选埃洛替尼耐药性基因,发现一个与FAM83H共享染色体的位点LOC100128338,这表明FAM83H可能在胰腺癌靶向治疗中存在耐药性[37]。Fuziwara等[5]报道,与对照组相比,高表达FAM83F的细胞对阿霉素的细胞毒性作用具有更强的抗性,凋亡细胞的数量更少。同时鉴于FAM83D能够通过激活mTOR来调节肿瘤发生,因此FAM83D可以作为靶标预测患者对雷帕霉素的反应[35]。
5 结论与展望
虽然我们还不能确定每个FAM83成员的DUF1669结构域和它们不同的C端序列的功能,但未来的工作应结合使用FAM83蛋白C端交换/缺失突变体细胞进行详细的生物信息学分析。虽然尚不清楚多种FAM83蛋白在肿瘤细胞中上调的原因,但每种FAM83蛋白在致癌信号中可能起不同的作用。未来的研究将鉴定每个FAM83蛋白的独特功能,以及开发新的策略来靶向治疗。
大多数人类蛋白质组分析表明,相对于其他原癌基因(如EGFR和RAS),FAM83成员在体内的表达水平较高。迄今为止,已发表的发现主要使用非转化和癌细胞系的过表达和RNAi方法。目前,仅存在一种敲除FAM83H基因的C57BL/6小鼠,但在出生后两周死亡[38]。未来研究重点可能是开发其他FAM83蛋白的基因敲除或转基因模型。这样的动物模型将为每个FAM83成员在正常发育和体内平衡提供实用的遗传证据。
FAM83蛋白是某些癌症的潜在生物标志物,并且FAM83成员的表达可以为治疗策略提供参考[36],并预测癌症患者存活时长[1]。未来将探究每个FAM83蛋白的独特功能,以及开发新的策略来治疗靶向FAM83蛋白的保守和独特致癌性。

