非经典模式生物
——耐格里阿米巴研究进展
徐嘉曦,杨清林,魏泽林,徐国良
(中国科学院 分子细胞科学卓越创新中心,上海 200031)
真核生物最早出现在10亿年前,并依赖其复杂的代谢途径、信号转导通路与增殖分裂调控等生物学机制占据了地球生态圈的各个角落。因为进化的保守性,生物在基本的生命活动机制上具有相似性,所以利用生物复杂性较低和进化地位较低的物种研究发育与进化的共同规律是可行的。在具有不同进化地位的生物中所发现的共同的形态特征与机制,往往代表着发育与细胞活动的普遍原理,而对于这些生物的研究也有助于我们理解生命活动规律的普适性和同一性。常用的模式生物如大肠杆菌、果蝇、拟南芥、斑马鱼和小鼠等,因为其生物特征具有代表性、生活世代短、背景清楚和易于实验操作等优点被广泛应用于生命科学研究。随着科学技术水平的进步以及研究领域的拓展,越来越多细分领域被拓展并给我们带来了令人惊喜的发现,如对涡虫和蝾螈再生领域的研究、鸡胚胎发育的研究、杀人鱼衰老和假死的研究、阿米巴细胞骨架重排调控的研究等。
阿米巴(Amoeba)广泛分布在世界各地淡水和湿地中,并被发现与鱼类等淡水生物密切相关。阿米巴中,耐格里阿米巴(Naegleriaspp.)为一个属的统称,而其下的Naegleriagruberi是该属的一个代表性物种,它能够在实验室体系下培养并进行相关研究[1]。本文以耐格里阿米巴作为主要介绍对象。它最广为人知的特点在于能够进行3种形态的切换,包括能够进行有丝分裂的阿米巴形态、短暂的不能分裂的鞭毛体形态(Flagellate)和休眠的胞囊状态(Cyst),见图1。由于从阿米巴形态转变到鞭毛体形态需要构建完整的微管骨架并组装基体(相当于中心粒)和鞭毛,所以耐格里阿米巴被广泛用于研究微管的生物学合成与组装以及基体的从头合成,Fulton等[2-3]研究发现耐格里阿米巴有55个中心粒合成相关的基因,并在分化的早期就开始大量表达,而82个鞭毛合成相关的基因随后开始表达。Naegleriagruberi以捕食细菌为食,没有寄生性,但其近属亲缘物种福氏耐格里阿米巴(Naegleriafowleri)能够入侵人脑产生致命性脑膜炎。当然福氏阿米巴也并不是专性寄生虫,在通常情况下它们依然以细菌为食物来源[1,4]。对于耐格里阿米巴的深入研究,或许能够解开福氏阿米巴和其他寄生虫入侵机制和宿主内寄生机制的谜题。
单细胞真核生物运动主要依赖于爬行和游动,这两种运动模式的结构基础来源于两个保守的细胞骨架系统:细胞的爬行运动来源于肌动蛋白网络的动态变化,而细胞的鞭毛游动则来源于微管的相对滑动。在阿米巴生命周期中,它主要呈现的是利用肌动蛋白网络爬行的阿米巴形态。在遇到低渗环境和机械振荡时,它会缩回伪足并转变成具有两到四根鞭毛的椭圆球状鞭毛体。该过程伴随着肌动蛋白网络结构的解聚和微管复合物的重新组装,在28 ℃下整个过程只需要不到 60 min,其中几乎100%的群体能够在几分钟内从没有中心粒过渡到有两个中心粒,能够在这两种形式之间随意快速地转换,使得耐格里阿米巴成为了解这两种细胞运动的基本模型[5-7]。值得注意的是,在阿米巴状态下除了有丝分裂几乎所有的细胞功能都能在没有微管的情况下实现,包括120 μm/min的速度爬行。就目前而言,耐格里阿米巴是已知的爬行速度最快的单细胞,至少是鱼类角化细胞、盘基网柄菌和人类中性粒细胞的两倍。来自于其他生物体的微管蛋白抑制剂研究表明这一细胞快速迁移可能不需要微管,而耐格里阿米巴的生物学行为更为这一假说提供了相关的生物学证据[8]。从阿米巴状态分化到鞭毛体状态涉及重新组装一个完整的微管骨架,包括两个基体、两到四根鞭毛和整个皮层的微管阵列的组装,以及新的微管细胞骨架与先前存在的肌动蛋白骨架之间的协调。在分子层面上,分化过程也涉及在60~90 min内转录和翻译包括微管在内的所有细胞骨架成分。该分化过程很容易同步,90%以上的细胞5~10 min能够重新组装基体,而哺乳动物细胞需要24 h才能重新组装中心粒[9-10]。目前由于不能对该物种进行遗传水平操作以及相关基因操作,这给后续研究带来十分大的困扰。2010年,耐格里阿米巴的全基因组测序给研究早期真核生物的进化提供了新的视角,并为阿米巴生物学研究开辟了意想不到的途径,这或许能够使得耐格里阿米巴从非经典模式生物转变为热门的经典模式生物。
1 耐格里阿米巴的分化
1957年,Waddington提出假说:在正常情况下,干细胞按照预定的程序分化形成终末端已分化的细胞,但在特定的情况下,细胞也可以通过重编程重新进入未分化的状态或者转分化为另一类型细胞[11]。分化并不是多细胞生物所特有的,严格意义上多细胞真核生物的分化来自于单细胞真核生物分化的继承。早在10亿年前,单细胞真核生物诞生之初,分化就开始了。在单细胞真核生物生活史中,不同阶段下的形态结构、生命活动以及功能是不一样的。疟原虫在按蚊体内以子孢子形式存在于按蚊的唾液里面,随着按蚊叮咬病人注射入血液中,在肝脏中变成裂殖体,最后入侵红细胞又会变成环状体[12]。耐格里阿米巴生活史包括阿米巴形态、鞭毛体和胞囊等3个阶段,对应着3种完全不同的细胞形态[图1(a)]。其中,从阿米巴形态变为鞭毛体形态的过程被称为分化(differentiation)或转化(transformation),可以在低渗溶液和振荡条件下被诱导发生,且整个过程快速而均一。当分化环境温度为28 ℃时,30 min左右鞭毛体形态开始出现,60 min左右即有90%以上的细胞进入鞭毛体形态,在实验条件下鞭毛体形态维持30 min左右就会缓慢地变回阿米巴形态[图1(b)]。鞭毛体是一个短暂而不稳定的细胞状态,在诱导后会自发返回阿米巴形态,且在该阶段不能进食和细胞分裂[1]。
在食物匮乏的情况下,阿米巴形态可以缓慢变化,在细胞周围分泌形成一层坚硬的胞囊壁,以胞囊形态度过艰难的环境。而在环境中存在水和食物时,细胞又可以从胞囊壁中萌发,重新形成阿米巴。在所有3种细胞形态中,只有阿米巴形态能进食细菌,并通过有丝分裂进行增殖[图1(a)]。
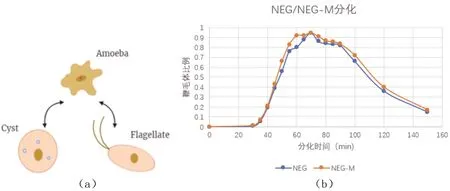
(a)表示耐格里阿米巴生活史不同阶段的3个不同形态和相互转化关系,图中箭头表示移动方向;阿米巴状态和鞭毛体状态下能够移动,胞囊状态不能移动,但可通过胞囊孔感知外界环境。(b)实验结果,分化条件:2 mmol/L Tris pH 7.4,密度1.4×106个/mL(NEG), 0.7×106个/mL(NEG-M),温度28 ℃,摇床转速:87 r/min;NEG-M是二倍化的NEG,可以在液体培养基中生长,无需细菌为食
当耐格里阿米巴开始分化时,它们停止阿米巴形态下的运动并聚集起来。一对短鞭毛首先开始出现在球形细胞上并继续伸长,直到长度达到大约15 μm,同时细胞由球形变为细长[1,13]。这一生物学过程涉及了肌动蛋白纤维的重排、细胞质微管的生物学合成与组装以及基体的合成,等等[9-10]。耐格里阿米巴可以维持鞭毛体形态几分钟、几个小时或者几天,这取决于实验条件,最终它还是会回到阿米巴形态。在逆转过程中,鞭毛体失去了它的规则形状,变成了带有鞭毛的变形虫随后鞭毛停止移动,进而被吸收到细胞体中。在这种分化过程中,DNA合成会停止,有丝分裂也不会进行,但是细胞可以继续进行RNA和蛋白质合成。已知的几个会引发分化的因素包括生长温度的降低,暴露于水环境、饥饿、低电解质浓度和振荡搅拌。尽管这些因素诱导其分化的机制尚不清楚,但是耐格里阿米巴能够感觉到刺激信号的强弱程度并决定是否完成分化。如果一个细胞被微弱的信号刺激,细胞仍然会启动分化过程,但这种分化会停止在一个特定的细胞状态,这个状态被称为保持点(hold point)。在保持点,细胞保持部分分化的状态,如果处于保持点的细胞在一定时间内收到额外的信号,它们又将继续分化。Fulton等[14]发现启动分化后的10 min和20 min是两个比较关键的保持点。
在耐格里阿米巴分化过程中,细胞在短时间内做出了重大改变,包括肌动蛋白纤维网络的重排与解聚、微管的生物学合成与组装、鞭毛的形成、细胞形态的改变、基体的重新合成和相关控制信号的转导,而这一切都在短短的60 min内就完成了。它是如何在短时间内协调内部遗传机制对这一环境刺激作出适应性改变,这深深吸引了相关研究学者的兴趣。Han等[15]指出α-微管蛋白、β-微管蛋白、鞭毛钙调蛋白和1类mRNA,在转录启动后会立即在分化细胞的外围共同定位。当50%的细胞处于鞭毛体状态时,这些mRNA则出现在细胞鞭毛生长的基底部。在鞭毛和细胞质微管的伸长过程中,这些mRNA移动到鞭毛细胞的后端,然后消失。在分化开始时,添加细胞松弛素D会抑制这些mRNA的共定位。这种处理并不影响mRNA的瞬时积累和翻译,但它们却抑制了鞭毛的形成[15-16]。另外还有研究发现,γ-微管蛋白、NgSAS6和NgPlk4与微管蛋白mRNAs共同定位也依赖于肌动蛋白。这些数据表明,这些mRNAs在同一点的定位和翻译是基体和鞭毛快速形成的重要基础[17]。Fulton等[18]通过对上述4类蛋白mRNA的Southern Blot发现,这4类mRNA表达量随时间变化十分一致,即都在分化后的40 min到达高峰,随后缓慢降低且表达量高低也呈现高度一致。随后,作者在这4类基因的启动子上游区域发现了一段保守回文序列,这段12核苷酸序列是5′-TTTGGCGCCAAA-3′,不同基因这段序列会有一到两个核苷酸差异。他们推测这段回文序列可能是某个潜在的蛋白结合位点,用于调控这类基因的协同表达。通过回文序列调控基因的协同表达常见于原核生物如半乳糖操纵子,是否在真核生物上存在还没有被证明。这可能是耐格里阿米巴能够在短时间内从阿米巴形态转变为鞭毛体形态的重要原因和依据。
2 耐格里阿米巴基因组结构及进化地位
2.1 耐格里阿米巴基因组
耐格里阿米巴包含15 727个基因,基因组由14 kb染色体外质粒(NCBI accession AB298288.1)、50 kb线粒体基因组(GenBank accession AF288092.1)以及线性核染色体组成。脉冲凝胶电泳分析表明,耐格里阿米巴至少有12条染色体,大小在0.7到6.5 Mb之间,共计约42 Mb,其中重复序列仅占5.1%。它整个基因组的GC含量为33%,其中人类是41%而衣藻高达64%。由于其基因组只有约42 Mb却编码15 727个基因,这表明它绝大部分都是编码序列并且相对于复杂的真核生物来说没有过多的重复序列以及冗余序列。平均每个基因的内含子(intron)数量是0.7,很多基因没有内含子或者只有一个内含子,而人类平均每个基因却有高达7.8个内含子。这些特征总体来说表明阿米巴的基因组在进化上还处于很原始的地位[19-20]。
2.2 耐格里阿米巴线粒体基因组
耐格里阿米巴线粒体基因组大小约50 kb,在单个环形的基因组上包含49 843个碱基对,编码67个蛋白质。相对于其他原生生物,它具有更多编码线粒体复合物Ⅰ亚基的基因,同时它还含有编码细胞色素c和tRNA的基因,这些特征表明在线粒体功能上耐格里阿米巴具有一定的复杂性。最后,耐格里阿米巴被报道为植物界以外第一个含有参与植物细胞RNA编辑的DYW型五肽重复序列(PPR)同源蛋白的生物体[21],线粒体基因组序列分析没有直接表明RNA编辑和反式剪接对于线粒体基因表达具有必要性。根据与其他真核细胞的相似性研究,耐格里阿米巴也含有大量非DYW型PPR蛋白。因此,其线粒体基因组序列既有教科书式的基本代谢元素又加入了一些不同寻常的特征,总体上描绘了JEH(Jakobids-Euglenozoans-Heteroloboseans)类群生物线粒体复杂的进化图景。
2.3 耐格里阿米巴染色体外质粒
真核生物有多种方式维持rRNA的高表达,如人类基因组上有多个rRNA(核糖体RNA)的基因拷贝,而耐格里阿米巴在染色体上并没有发现任何rRNA基因。Clark等[22]发现在染色体外的核仁结构区存在着大约14 kb大小的环形质粒,质粒拷贝数在4 000左右,每个质粒均携带一份18 s、5.8 s和28 s rRNA基因拷贝。这就意味着每个阿米巴细胞携带着4 000个拷贝的rRNA基因,这暗示其细胞内有丰富的蛋白表达和翻译体系。Mullican等利用中性二维凝胶电泳的方式发现了质粒的复制起始位点定位在一段2.1 kb的序列内。其结果表明,rDNA质粒的复制是通过θ型复制模式而不是通过滚动循环模式(Rolling circle mode)从单个原点复制,而且G-四链体元件和重复序列这些DNA复制源的特征序列也在该片段附近。另外,这个质粒还有两个功能未知的开放阅读框,其中一个编码173个氨基酸,与任何其他已知蛋白序列没有相似性,另外一个编码376个氨基酸,与归巢核酸内切酶有一定同源性[23]。
3 耐格里阿米巴信号转导和代谢的多样性
3.1 耐格里阿米巴代谢多样性
像许多真核微生物一样,耐格里阿米巴通过Krebs循环和支链线粒体呼吸链氧化葡萄糖、各种氨基酸和脂肪酸。然而耐格里阿米巴也同时具有复杂的无氧代谢能力,包括:底物水平磷酸化,常见于微需氧真核生物如贾第鞭毛虫和毛滴虫;使用延胡索酸作为最终电子受体的能力;编码铁氢还原酶及相关成熟系统[24]。耐格里阿米巴的有氧和无氧代谢能力与另外一种土壤和池塘居住的生物衣藻十分相似,这些原生生物可能利用他们的代谢灵活性来适应泥泞环境中常见的间歇性缺氧环境[25]。令人惊讶的是,除了整套铁氢还原酶之外,这些蛋白N-末端有线粒体转运肽,这表明耐格里阿米巴的线粒体具有产生氢气的功能。由于铁氢还原酶是一种氧气敏感性酶,这说明在有氧条件下它们正常进行TCA循环,在缺氧的条件下它们能够通过产生氢气进行能量代谢。这一发现为线粒体起源的氢假说提供了新的支持,即线粒体的内共生祖先同时具有厌氧和需氧途径。在真核生物适应有氧或无氧生态位的过程中,这些途径被选择性地丢失,导致只能进行TCA循环的线粒体或氢生物小体的形成。然而迄今为止,在任何当代真核生物中还没有发现同时具有这两种代谢方式的线粒体[26-27]。
3.2 耐格里阿米巴信号转导的多样性
耐格里阿米巴基因组大小只有41 Mb,但是却编码多达15 727个基因,这些基因编码了一系列广泛的信号转导蛋白,进而造就了耐格里阿米巴复杂的生物学行为,包括3种形态的切换及分化、外界环境的感知、丰富的级联信号转导通路甚至寄生等。举例来说,耐格里阿米巴有30种推测的组氨酸激酶和6种相应的受体蛋白,然而这在布氏锥虫和内寄生性阿米巴中是不存在的。它还有近300种G蛋白偶联受体和相关信号通路蛋白,这在贾第鞭毛虫和布鲁氏杆菌中是缺失的[28-29]。许多生物体通过膜结合的腺苷酸/鸟苷酸环化酶来感知外界环境,耐格里阿米巴至少含有108个环化酶,这几乎是人类基因组中发现的2倍(环化酶如此丰富的原因依然令人费解)。此外,耐格里阿米巴基因组中近一半的蛋白含有PAS信号感知区域,4个与NIT结构域配对,这些区域则是被细菌用来检测硝酸盐和亚硝酸盐浓度的[30]。其中4种环化酶也有BLUF结构域,是眼虫产生光响应行为的结构域组合,可能耐格里阿米巴有细微的光响应行为或者使用BLUF结构域进行氧化还原感应[31]。总体来说,耐格里阿米巴丰富的组氨酸激酶、G蛋白偶联受体、腺苷酸/鸟苷酸环化酶、GTP激酶等可以参与丰富的信号转导,这是它适应各种不同环境以及感知外界变化的结果,也是它丰富又复杂的生物学行为的基础(图2)。
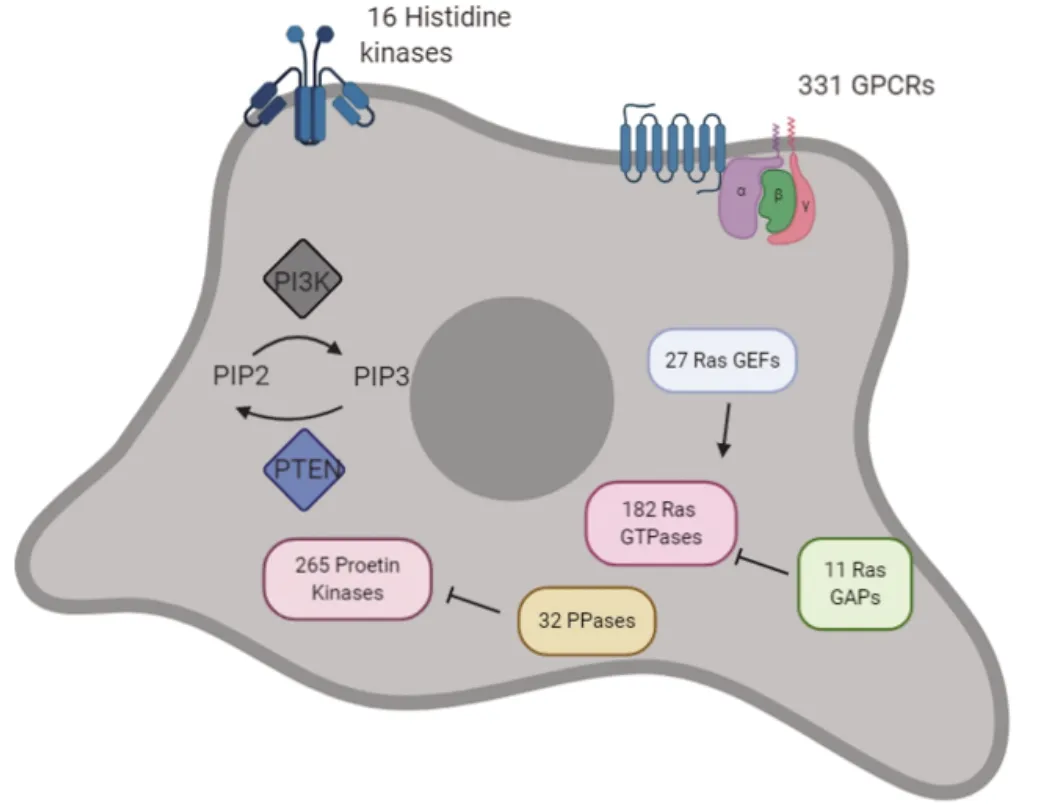
组氨酸激酶和G蛋白偶联受体在多数寄生虫中缺失,而在耐格里阿米巴中特有。Histidine kinases:组氨酸激酶;GPCRs:G蛋白偶联受体;Second messengers:第二信使;PIP2:磷脂酰肌醇二磷酸;PIP3:磷脂酰肌醇三磷酸;PTEN:磷酸脂酶;Ras GTPases: Ras GTP酶
4 耐格里阿米巴进化地位
10亿年前所有的真核生物都有一个共同祖先,随后在进化上它们至少分化为6个主要类群,耐格里阿米巴是JEH(Jakobids-euglenozoans-heteroloboseans)类群生物的一个代表,在进化树上较为靠近真核生物最近的共同祖先(Last common eukaryotic ancestor,LCEA)(图3)。这种进化的古老特征还体现在该物种拥有较为原始的有丝分裂方式——原有丝分裂(Promitosis),分裂过程中核膜和核仁都不解体消失,其中核仁在分裂后期和末期会移动到两级并形成被称为中间体(Interzonal body)的结构[1]。JEH类群生物代表性的3个类群是眼虫、锥虫和阿米巴,其中多数是具有寄生性的如布氏锥虫、阴道毛滴虫和福氏耐格里阿米巴。而Naegleriagruberi没有寄生性,这为研究寄生虫寄生机制提供了方便性。在寄生虫的生活史中也常常伴随着形态和结构功能的转变,以适应不同宿主体内的环境。耐格里阿米巴基因组测序的完成,首次允许比较这6个主要真核生物类群非还原基因组的完整序列。分析表明,真核生物的共同祖先拥有超过4 000个基因,这些基因仍然存在于现存的真核生物中,其中40%是真核生物谱系中的新基因,因为它们在古生菌或细菌中没有可识别的同源物。许多真核特异性的祖先基因家族至今还没有明确的功能。这些基因序列可能是早期真核生物在进化上适应的特征序列,包括大量内含子、复杂的DNA和RNA代谢、广泛的代谢和信号通路以及变形和鞭毛运动[19]。

Last common eukaryotic ancestor:真核生物最近共同祖先;红色加粗表示耐格里阿米巴;黑色加粗表示研究较多的单细胞真核生物与耐格里阿米巴在进化上的亲缘关系
5 小结与展望
耐格里阿米巴作为非经典模式生物目前还不能进行遗传水平操作和基因编辑,这极大地限制了相关生物学研究。但是它作为原始真核生物共同祖先最具代表性的一群JEH,身上同时具有原始与进化的特征,又由于其生活的环境多样性以及可能接受多种外界信号刺激,它本身呈现出复杂的生物学功能和对外界环境刺激的敏感性。如在28 ℃的条件下,在30 min时间点就检测到了鞭毛体的存在。另外,在阿米巴状态下被UV照射10 s左右,它就会收缩伪足形成椭圆球状体,这可能是因为它体内存在UV等电磁波的受体,或者UV产生的某些损伤被它感受到了。对于重要的最基本的生命活动,生物都具有高度保守性,通过这一保守性可以发现某些生物学功能进化规律和研究生物的进化。由此可见,耐格里阿米巴作为沟通原核生物与真核生物的桥梁,在其身上或许会有很多令人意外的发现。例如对阿米巴是如何感知外界环境变化并分化的,已经发现耐格里阿米巴有着丰富的组氨酸激酶、G蛋白偶联受体和腺苷酸/鸟苷酸环化酶,这些蛋白组成了丰富而又迅捷的信号转导级联网络,为阿米巴在短时间内完成分化提供了基础[13]。研究发现在阿米巴中,参与分化的相关基因能够通过利用肌动蛋白纤维网络共定位在基体附近,这样能够维持基因的持续转录和翻译。除此之外,这些基因前面的回文序列可能类似于通过操纵子一样的调控机制,使得这些基因的mRNA协同表达,为其快速分化提供帮助[31]。这一复杂分化调控机制使得耐格里阿米巴仅在60 min内就能够完成分化这一过程,而在多细胞真核生物中的细胞分化,如造血干细胞的分化等往往需要几天的时间。也可以看到,阿米巴拥有经典的染色体,但是在核仁区域内部是大约4 000个拷贝的rDNA质粒,负责快速产生大量18 s RNA、5.8 s RNA和28 s RNA,这些RNA最终将组装形成为数众多的核糖体用于蛋白的表达翻译[15-16]。耐格里阿米巴的rDNA有大约4 000个拷贝,可以通过裂解核膜分离核仁来得到rDNA,将它改造成为一个穿梭质粒从而启动外源基因在阿米巴上的表达。由于耐格里阿米巴生活在滩涂淤泥和水环境里,常常是无氧或者缺氧的,那么拥有无氧代谢能力是十分重要的,这里它展现出原始的一面,在线粒体内部通过铁氢还原酶在缺氧环境下直接将质子还原形成氢气。同样衣藻也能够产氢,但它是通过叶绿体产氢,而耐格里阿米巴则是通过线粒体来完成。迄今为止,除阿米巴之外,在任何当代真核生物中还没有发现同时具有这两种代谢方式的线粒体[26-27]。
分化往往伴随着全基因甲基化水平的改变。以小鼠胚胎发育就经历两次大规模全基因甲基化重排,癌细胞的上皮间充质转化也呈现不同的全基因组甲基化图谱[32-33]。那么在耐格里阿米巴分化过程中,是否有全基因组甲基化水平的变化呢?DNA甲基化的建立与擦除主要与DNMT1(DNA(cytosine-5)-methyltransferase1)和TET(Ten-eleven translocation methylcytosine dioxygenase)蛋白有关,其中TET蛋白负责DNA甲基化的擦除。通过同源序列比对,研究者发现耐格里阿米巴有8个TET同源蛋白。2014年程晓东实验室解析出NgTET1的结构,该蛋白的酶活催化结构域在耐格里阿米巴和哺乳动物之间是保守的。然而为什么耐格里阿米巴需要如此多的TET同源蛋白存在,以及这些TET蛋白在该物种中是否发挥着其他的功能引起了众多科研工作者的兴趣[34]。另外,衣藻的TET同源蛋白CMD1能够在衣藻基因组DNA上产生5gmC修饰,这一修饰对于衣藻的强光感应调节尤为重要[35]。这说明在进化上TET蛋白家族曾经发挥着不同的功能,目前在耐格里阿米巴身上还没有相关研究。值得一提的是:耐格里阿米巴在实验体系下没有发现有性生殖的现象,但在其基因组中存在减数分裂所需的所有基因。这些减数分裂基因都具有较高的表达,且部分基因在分化过程中有明显的上调,比如Hop1/2、Msh4/5等基因。如果它没有有性生殖,那这些减数分裂基因的功能是什么?如果有有性生殖,那它的有性生殖方式会不会比较特殊,导致至今尚未发现?相信二代三代测序技术的发展以及针对DNA修饰的测序将会给探索表观遗传调控带来新的突破。另外,以Cas9蛋白为基础的基因编辑技术可能能够首次实现阿米巴的遗传水平操作,能够在DNA分子水平研究阿米巴的生物学特征和功能。
耐格里阿米巴属于单细胞真核生物,易于研究和培养,在进化地位上既有早期真核生物的原始特征又有现代真核生物的特征,它的分化具有高度同步性和一致性,潜在丰富的DNA修饰蛋白又暗示着它的DNA修饰调节多样性。线粒体同时具有无氧代谢和有氧代谢的功能。另外,它的基因组中包含有性生殖相关基因,但目前在实验室条件下还没有发现它能发生有性生殖。总之,耐格里阿米巴有诸多令人感兴趣的地方,还有待进一步发掘。

