紫红曲霉鉴定及两阶段培养产多糖条件优化
余慧菁 蒋咏梅 章文贤




摘 要:采用形态学特征及ITS序列分析对已筛选的菌株进行鉴定。为优化振荡静置两阶段培养红曲霉产胞内多糖的条件,分别测定了摇瓶过程中菌丝球数量、发酵液黏度、pH和残糖含量,以及静置培养中菌丝体生物量、内多糖的含量和产量。结果表明:紫红曲霉在振荡培养3 d后再静置培养6 d的条件下,菌丝球大小适中,生物量较高,发酵液黏度低,传质效果好,pH中性,红曲霉内多糖含量和产量均达到最高值,分别为18.9 mg·g-1和138.9 mg·L-1。
关键词:紫红曲霉;内多糖;液态静置发酵;工艺条件
中图分类号:TQ 925.1 文献标志码:A 文章编号:0253-2301(2021)12-0032-06
DOI: 10.13651/j.cnki.fjnykj.2021.12.006
Identification of Monascus Purpureus and Optimization of the Conditions forPolysaccharide Production in the Two-stage Culture
YU Hui-jing1, JIANG Yong-mei1, ZHANG Wen-xian1,2*
(1. College of Life Science, Fujian Normal University, Fuzhou, Fujian 350117, China; 2. Engineering Research
Center of Ministry of Education of Industrial Microbiology, Fuzhou, Fujian 350117, China)
Abstract: The morphological characteristics and ITS sequence analysis were used to identify the screened strains. In order to optimize the conditions for the production of intracellular polysaccharides from Monascus in the two stages of oscillating and static culture, the number of mycelium pellets, the viscosity of fermentation broth, pH and the content of residual sugar during the process of shake flask were determined, as well as the biomass of mycelia, the content and yield of intracellular polysaccharides in the static culture. The results showed that under the conditions of oscillating culture for 3 d and then static culture for 6 d, Monascus purpureus had moderate size of mycelium pellets, high biomass, low viscosity of fermentation broth, good mass transfer effect and neutral pH. The content and yield of intracellular polysaccharides in Monascus reached the highest values, which were 18.9 mg·g-1and 138.9 mg·g-1, respectively.
Key words: Monascus purpureus; Intracellular polysaccharides; Liquid static fermentation; Process conditions
红曲霉,在分类学上被划分为半子囊菌,属于子囊菌类的丝状真菌。目前为止,已经确定了大约20個菌株[1]。由红曲霉发酵制成的中药红曲药食同源,具有健脾消食,活血化瘀,以及降血糖、降血脂、降血压的功效[2]。据报道,红曲霉中含有多种次级代谢产物,如莫纳克林K、红曲色素、γ-氨基丁酸、红曲多糖等[3],在食品、医药、化工方面均有广泛的应用[4]。
近年来,大量研究发现红曲多糖具有抗肿瘤、抗氧化、增强免疫力等生物学活性[5],因此国内外很多学者对其进行了系列研究。蒋汶等[6]采用紫外结合常压室温等离子体复合诱变方法对红曲霉菌株进行诱变,筛选出比原始菌株产外多糖能力强且具有良好遗传稳定性的突变菌株。伍健萍等[7]调整了红曲霉液态发酵产胞外多糖的条件,得到适合产胞外多糖的培养基配方。李月婵等[8]对红曲霉液态发酵生产胞外多糖的培养基组成和培养条件进行优化,并初步研究了其抗氧化性和抑菌性。2014年,汪鹏荣等[9]通过Box-Behnken设计优化胞内多糖的提取条件。2021年,Wang等[10]在碱性条件下从红曲菌丝体中提取胞内多糖,成功将其分离为4个亚组分,并对其进行系统描述。以上研究大多集中于胞外多糖的工艺优化,对胞内多糖的研究较少。然而,研究表明,红曲霉胞内多糖同样含有抗氧化、抗肿瘤和提高免疫力的作用。
目前主要采用液体振荡发酵法培养红曲霉,尚未有人探究过振荡结合静置的两阶段培养方式。有报道表明,两阶段培养法广泛应用于灵芝菌丝体的培养,并有效地提高了灵芝酸的含量[11]。因此,本试验以紫红曲霉为材料,采用液态深层摇瓶-静置两阶段培养方式合成红曲胞内多糖,通过分析培养过程中的相关指标的变化,确定紫红曲霉产生胞内多糖的最佳培养条件,以期为红曲内多糖的开发利用提供数据参考。
1 材料与方法
1.1 试验材料及试验药剂
试验材料为红曲米(购自福建省大田县)。试验药剂主要有:葡萄糖、琼脂、七水硫酸镁、磷酸二氢钾、维生素B1、蛋白胨、酵母精粉、5%苯酚、浓硫酸。
1.2 试验主要仪器
恒温恒湿箱、恒温振荡培养箱、超净工作台、恒温数显水浴锅、高压蒸汽灭菌锅、奥式粘度计、pH计、电鼓风干燥箱、生物传感分析仪、电子分析天平、涡旋混合器、紫外可见分光光度计。
1.3 培养基的配制
1.3.1 PDA固体培养基 马铃薯200 g,葡萄糖20 g,琼脂20 g,七水硫酸镁1.5 g,磷酸二氢钾3 g,维生素B1 0.05 g,去离子水1 L,自然pH,121℃灭菌20 min。
1.3.2 种子培养基 葡萄糖 35 g,蛋白胨5 g,酵母精粉2.5 g,七水硫酸镁0.5 g,磷酸二氢钾1 g,维生素B1 0.05 g,去离子水1 L,自然pH,121℃灭菌20 min。
1.3.3 深层液体发酵培养基 葡萄糖35 g,蛋白胨5 g,酵母精粉 5 g,七水硫酸镁0.5 g,磷酸二氢钾1 g,维生素B1 0.05 g,去离子水1 L,自然pH,121℃灭菌20 min。1.4 培养方法
1.4.1 菌株分离 取5 g红曲米在无菌超净台中研磨成粉,加入45 mL无菌水,充分摇匀。梯度稀释至10-1、10-2、10-3、10-4倍[12],涂布分离于 PDA平板,30℃培养2~
6 d,待长出白色菌丝。用接种环挑取白色菌丝,在平板上划线[13],直到早期产生白色菌落,后期为红色或紫色的单菌落,再纯化培养[14]。
1.4.2 菌株活化 接种环挑取菌种至斜面培养基,30℃恒温培养6~7 d,待菌丝长满斜面。
1.4.3 一级种子液体培养 移液枪吸取10 mL无菌水加入长满菌丝的斜面,接种铲刮下白色菌丝倒入40 mL一级种子培养基中,恒温摇床(30℃、120 r·min-1)培养2 d。
1.4.4 二级种子液體培养 培养2 d的一级种子液倒入灭菌的装有玻璃珠的锥形瓶中,振荡打碎菌丝,吸取5 mL菌丝液至45 mL二级种子培养基中,30℃、120 r·min-1摇瓶培养1 d。
1.4.5 液体深层发酵培养 二级种子液菌丝打碎后,以10%的接种量接入180 mL的液体培养基,30℃、120 r·min-1振荡培养。
1.4.6 液体静置培养 深层发酵培养结束,倒入培养皿置于恒温培养箱30℃培养。
1.5 测定方法
1.5.1 红曲霉菌株鉴定 菌株测序得到ITS序列。将该序列与NCBI数据库上红曲霉的序列进行比对,选择同源性较高的序列用MEGA 6按照邻接法构建系统发育树,经Bootstrap重复构建循环1000次[15]。系统发育树按比例绘制,其分支长度与用来推断系统发育树的进化距离的单位相同。进化距离用Kimura双参数方法计算,以每个位点碱基替换的数量为单位。
1.5.2 菌丝球数量测定 移液器吸取10 mL深层发酵液,稀释并计数。
1.5.3 发酵液黏度的测定 采用奥式粘度计测定。
1.5.4 pH和残糖的测定 采用PHS3C型pH计测定pH;采用生物传感分析仪测定残糖含量。
1.5.5 生物量测定 静置培养后过滤菌丝体,蒸馏水洗涤3次。50℃烘干至恒重,天平称重,每个条件取3个平行。
生物量=菌丝干重/0.035
1.5.6 胞内多糖的测定 烘干的菌丝研磨成粉,取1 g粉末加入1 mL 1 mol·L-1的NaOH溶液,充分震荡,60℃水浴1 h,10000 r·min-1离心10 min,上清液即为多糖样品。取0.5 mL稀释400倍的多糖样品,加入0.75 mL 5%苯酚溶液和3.75 mL浓硫酸,混匀,室温静置30 min,490 nm测吸光值。以葡萄糖为标准品,用同等方法绘制标准曲线,得到标准曲线y=7.21248x-0.00133,将样品吸光值代入标曲,可以计算出多糖含量。
2 结果与分析
2.1 红曲霉的鉴定
2.1.1 红曲霉的菌落特征 红曲霉菌落初期为白色,7 d培养后,颜色逐渐变为橙色、红色或黄色。菌落形状主要呈绒毯状和皮膜状,大多有放射状的沟纹。
2.1.2 红曲霉的分子鉴定 由图1的系统发育树可知亲缘相近程度,本试验的红曲霉Y1菌株与M.rutilus、M.aurantiacus和M.purpureus聚类在同一支,且与M.purpureus最接近,表明它是M.purpureus。
2.2 不同深层发酵时间对红曲霉菌丝球的影响
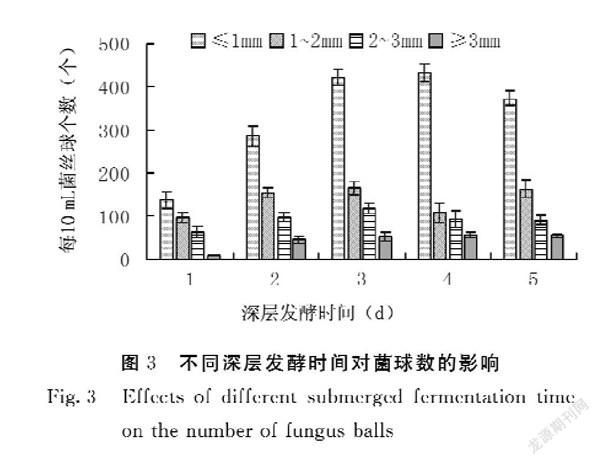
考察了深层发酵时间对紫红曲霉的胞内多糖合成的影响,结果发现(图2),随着振荡培养时间的延长,菌丝球形态也发生了明显的变化。第1 d菌丝球直径小,密度低,成球发育不充分;第2 d密度增加,菌丝球形状不规则,成球松散,着色浅;第3 d菌丝球生长旺盛,菌丝长度和密度都增加,着色较深,颗粒饱满紧实;第4 d菌丝球仍然比较致密,球形规则,但着色开始变浅;第5 d边缘菌丝开始散乱,整体不够圆润,着色浅。结合菌球数的结果(图3)可知,随着深层发酵时间的延长,菌丝球个数大致呈现上升后降低的趋势。深层发酵时间越长,菌丝球数量越密集,第3 d和第4 d相差不是很大。
2.3 不同深层发酵时间对紫红曲霉发酵液黏度的影响
由图4可知,随着深层发酵时间的延长,发酵液黏度先降低后逐渐升高,第3 d黏度值较低。发酵过程中,菌丝的黏附和聚集会影响菌丝与氧的交换、营养物和代谢废物的传质效率,从而降低细胞生长速度和代谢产物的合成效率。
2.4 不同深层发酵时间对红曲霉发酵液pH和残糖的影响
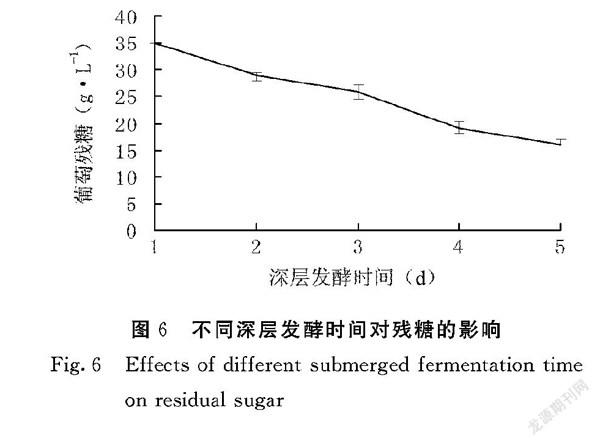
由图5可知,在深层发酵培养红曲霉的5 d中,pH呈现从酸性到中性的转变。原因可能是由于红曲霉在发酵过程中产生的次生代谢产物所致。由图6可知,在发酵过程中,葡萄糖含量逐渐下降,这表明紫红曲霉在利用葡萄糖用于自身生长,5 d内葡萄糖从最初的35 g·L-1下降到16 g·L-1。
2.5 不同深层发酵时间对红曲霉生物量的影响
由图7可知,深层发酵第3 d整体的生物量更高。转移到静置培养后,紫红曲菌丝体干重随时间的增加而增加。前6 d生物量增长最快,随后减缓,最高生长速度达1.14 g·L-1·d-1。
2.6 静置培养时间对胞内多糖含量及产量的影响
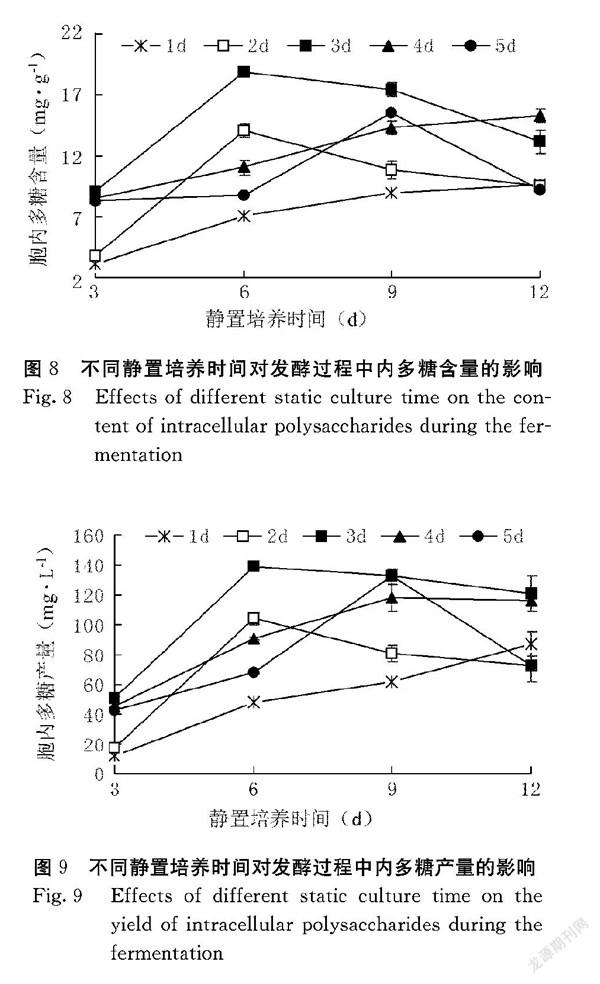
由图8、图9可知,红曲霉的内多糖含量和产量均呈先上升后下降的趋势。从整体看,深层发酵第3 d,内多糖的含量和产量明显高于其他。培养的前6 d,随着静置培养时间的增加,多糖的含量也随之增加,深层发酵培养3 d接着静置培养6 d时多糖含量最高,达18.9 mg·g-1,产量为138.9 mg·L-1;随着静置培养时间的延长,多糖的含量和产率逐渐降低。结果表明,静置培养6 d是获得红曲霉多糖的最佳时间。
3 讨论与结论
本试验结果显示,液体深层摇瓶发酵第3 d,菌丝生长旺盛,呈大小适中的球状,此时发酵液黏度较低,传质效果好,pH适中,有利于后续产物的积累。深层发酵3 d后转移至静置培养,6 d时胞内多糖产量最高。随着时间延长,产量开始下降,原因可能是营养物质缺乏导致。液体深层发酵过程中,菌丝体形态和生理特性的变化会导致发酵液的黏度发生改变,从而影响营养物质和氧气的溶解、传递和分布[16],最终对发酵产物的积累产生较大作用[17]。丝状真菌的生长条件可人为控制,菌丝形态随着培养条件的不同而变化,一般呈絮状、团状和球状3种[18],探究最佳培养时间对红曲霉内多糖的产量至关重要。
本研究先从红曲米中分离出红曲霉,经鉴定此菌株为紫红曲霉,再采用液态摇瓶静置两阶段法进行培养。通过测定红曲霉发酵过程中的黏度、pH、残糖,确定了红曲霉产胞内多糖的最佳深层发酵时间和静置培养时间。当深层发酵时间为3 d,静置培养时间为6 d时,红曲多糖的含量和产量均达到最高,分别为18.9 mg·g-1和138.9 mg·L-1。由此可知,用液态摇瓶静置两阶段法生产红曲胞内多糖是一种有成效的方法。
参考文献:
[1]FUKAMIH,HIGA Y K,HISANO T,et al.A Review of Red Yeast Rice,a Traditional Fermented Food in Japan and East Asia:Its Characteristic Ingredients and Application in the Maintenance and Improvement of Health in Lipid Metabolism and the Circulatory System[J].Molecules,2021,26(6):1619.
[2]汪鵬荣.一株高产胞外多糖红曲霉发酵和提取工艺及抗氧化活性研究[D].金华:浙江师范大学,2012.
[3]刘毅,宁正祥.红曲霉发酵产物的保健作用及应用[J].广州食品工业科技,1999(2):1-4.
[4]伍健萍.红曲霉发酵多糖条件及抗氧化活性的初步研究[D].天津:天津科技大学,2012.
[5]杨晓暾.功能性红曲菌丝体的液态发酵制取方法[J].酿酒科技,2019(11):35-38.
[6]蒋汶,张庆庆,汤文晶,等.紫外等离子体复合诱变红曲霉产胞外多糖[J].食品与发酵工业,2016,42(1):64-69.
[7]伍健萍,王昌禄,陈勉华,等.红曲霉液态发酵多糖工艺条件的优化[J].北京工商大学学报(自然科学版),2012,30(6):57-62.
[8]李月婵,张子祎,魏学源,等.红曲霉产胞外多糖的条件优化及功效活性的初步检测[J].天津农学院学报,2020,27(2):79-83.
[9]WANG P G,CHEN D F,JIANG D H,et al.Alkali extraction and in vitro antioxidant activity of Monascusmycelium polysaccharides[J].Food Sci Technol,2014,51(7):1251-1259.
[10]WANG N F,WU Y,JIA G G,etal.Structural characterization and immunomodulatory activity of mycelium polysaccharide from liquid fermentation of Monascuspurpureus (Hong Qu)[J].Carbohydrate Polymers,2021,262:117945.
[11]丁延青.气相氧对采后灵芝代谢调控的影响[D].福州:福建师范大学,2019.
[12]雷帮星,税小波,杨国彬,等.红曲霉的分离及其红曲米的生产[J].贵州化工,2005(1):20-22.
[13]孙艳君.红曲中红曲菌的分离、鉴定及产色素的研究[D].武汉:武汉工业学院,2011.
[14]毛瑞丰,楚文靖,王瑞恒,等.红曲米中七株红曲霉纯培养的分离鉴定[J].广西轻工业,2006(6):9-10,21.
[15]DAI WH,SHAO Y C,CHEN F S.Production of Monacolin K in Monascuspilosus:Comparison between Industrial Strains and Analysis of Its Gene Clusters[J]. Microorganisms,2021,9(4):747.
[16]LIU Y,LIAO W,CHEN SL,Study of pellet formation of filamentous fungi Rhizopus oryzae using a multiple logistic regression model[J].Biotechnology and Bioengineering,2008,99(1):117-128.
[17]WUCHERPFENNIG T,KIEP K A,DRIOUCH H,et al.Chapter 4morphology and rheology in filamentous cultivations[J].Advances in Applied Microbiology,2010,72:89-136.
[18]CAO NJ,DU JX,CHENG S,et al.Production of L-lactic acid by Rhizopus oryzae in a bubble columnfermenter[J].Appliedbiochemistry&biotechnology,1998,70(72):323-329.
(责任编辑:柯文辉)
收稿日期:2021-10-10
作者简介:余慧菁,女,1997年生,硕士,主要从事红曲霉发酵方向研究。
通信作者:章文贤,男,1972年生,副教授,主要从事真菌次生代谢产物合成调控研究(E-mail:wxzhang@fjnu.edu.cn)。
基金项目:福建省自然科学基金项目(2017J01624)。

