BSA 荧光探针对醋氯芬酸含量的测定及相互作用的研究*
王艳妮,马红燕,王文山
(延安大学 化学与化工学院 陕西省反应工程重点实验室,陕西 延安 716000)
醋氯芬酸(Aceclofenac,ACF)是目前常用的口服非甾体抗炎药(NSAID)之一,具有显著的抗炎、镇痛作用,在治疗术后疼痛,类风湿性关节炎和骨关节炎方面有明显的疗效[1],与其他非甾体抗炎药物相比,ACF 具有抗炎作用好、胃肠道不良反应发生率低等优点。为了保证ACF 在临床上的安全性和有效性,避免长期服用导致含量过高而引起副反应,因此,建立一种快速、简单的测定方法很重要。
目前,国内对ACF 含量的测定主要采用高效液相色谱法,随着技术的成熟,电化学方法[2]、气相色谱法[3]、紫外分光光度法[4,5]也相继出现,但荧光法测定却鲜少报道。牛血清白蛋白(BSA)是动物血浆中含量最丰富的功能蛋白,与人血清白蛋白(HSA)有高度的相似性和同源性,因此,常被用来研究药物分子和血清蛋白的相互作用[6]。实验发现ACF 对BSA的内源性荧光有线性猝灭作用,基于此,建立了测定ACF 的新方法。进一步探讨了二者的作用机理,为后续研究ACF 在人体的运输过程提供了数据参考。
1 实验部分
1.1 仪器与试剂
日本日立F-4500 荧光光度计;美国安捷伦8453紫外-可见分光光度计。
3.35×10-3g·mL-1BSA 标准溶液 准确称取1.6750g 牛血清白蛋白标准品,超纯水溶解定容至500mL 容量瓶;
3.5×10-4g·mL-1ACF 标准溶液 准确称取0.0350g 醋氯芬酸标准品,用热的超纯水溶解后定容至100mL 容量瓶,使用时稀释至所需浓度;
3.0×10-3mol·L-1HCl 溶液。
所用试剂均为分析纯,配置好后于冰箱4℃保存,水为UP 超纯水(实验室自制)。
1.2 实验方法
25℃下,于5 支25mL 比色管中分别加入4.00mL的HCl 溶液和1.00mL 的BSA 标准液,一份做试剂空白,其余比色管加入不同浓度梯度的ACF 溶液,每次增加浓度为2.8×10-7g·mL-1。充分摇匀后,室温下静置15min 进行测定。采用1cm 石英比色皿,激发狭缝和发射狭缝均为5.0nm,以283.0nm 为最佳激发波长,扫描300~450nm 范围内的荧光发射光谱图。以ACF 的浓度为0g·mL-1作为参照组,荧光强度记为F0,并计算ΔF。293K、310K 下测定与上述方法一致。
2 结果与讨论
2.1 ACF 的测定
2.1.1 荧光光谱图
由图 1、2 可知,在 3.0×10-3mol·L-1的 HCl 溶液中,BSA 的最佳发射波长为338.0nm,较中性条件下蓝移了6nm。而ACF 的加入使得BSA 338.0nm 处的荧光峰明显降低,且随着ACF 浓度的不断增加,BSA 的荧光强度逐渐降低,说明ACF 和BSA 发生了结合反应从而诱导其内源性荧光猝灭。实验发现ACF 在一定浓度范围内与体系的ΔF 值呈良好的线性关系,因此,可用于ACF 含量的测定。

图1 激发光谱Fig.1 Excitation spectrum

图2 发射光谱Fig.2 Emission spectrum注:1-5cACF=0,1.4×10-7,4.2×10-7,7.0×10-7,9.8×10-7g·mL-1;cBSA=1.34×10-4g·mL-1
2.1.2 缓冲体系pH 值、种类及用量的选择
固定BSA 和ACF 的测试浓度,研究了不同程度的缓冲液对BSA-ACF 体系的影响,结果见图3。

图3 pH 值对体系的影响Fig.3 Influence of pH on system
由图 3 表明,pH 值在 3.30 左右体系的 ΔF 值最大。于此考察了同一pH 值下邻苯二甲酸-HCl、柠檬酸-Na2HPO4、柠檬酸钠-柠檬酸、B-R 等缓冲介质及3.0×10-3mol·L-1HCl 对 ΔF 的影响,结果表明在 3.0×10-3mol·L-1HCl 溶液中体系的 ΔF 值最大,且最佳用量为4.00mL。
2.1.3 BSA 用量的选择
实验研究了不同用量的BSA 对体系ΔF 值的影响,结果见图4。
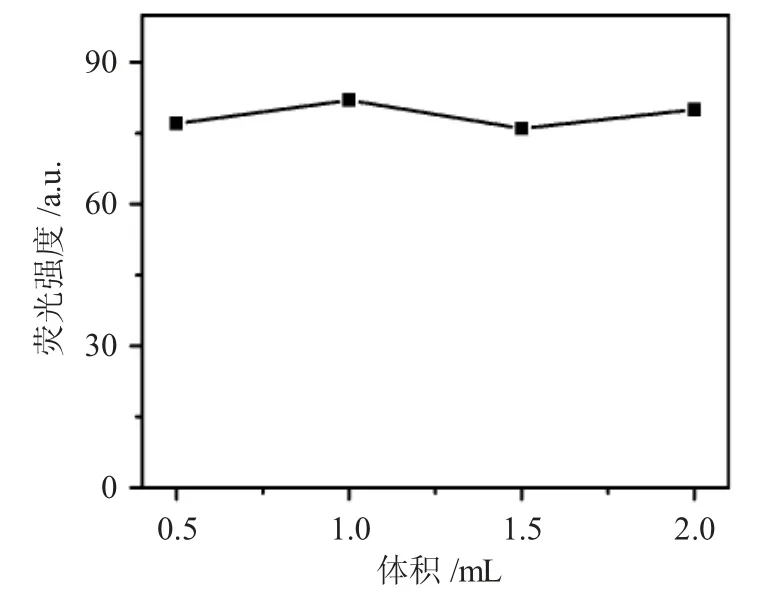
图4 BSA 用量对ΔF 的影响Fig.4 Effect of BSA on ΔF
由图 4 结果表明,当 BSA 用量在 0.5~2.0mL 时体系的ΔF 值最大且基本不变,但兼顾灵敏度和线性范围考虑,本实验选择加入BSA 溶液1.00mL,最终测试浓度为 1.34×10-4g·mL-1。
2.1.4 增敏剂的选择 为了提高检测灵敏度,试验了一系列的金属离子和表面活性剂对ACF 的协同作用,例如 Cu2+,Ba2+,Ca2+,Mg2+,Mn2+,Zn2+、CTMAB、Tween-80、DTAB、β-CD、SDBS 等对体系的影响,结果表明,上述离子和表面活性剂均对BSA-ACF 体系的ΔF 值无明显增敏作用,因此,本实验不加入任何增敏剂。
2.1.5 稳定性的测定 按照实验步骤配置好溶液、充分摇匀,每5min 测定一次荧光强度。结果表明静置15min 后反应完全并且ΔF 值达到最大,且体系在10h 内无明显波动情况,说明该体系比较稳定。
2.1.6 共存物质干扰 以相对误差不高于±5%为限,研究了实验过程中和实际样品中可能存在物质的干扰情况。当 ACF 浓度为 4.2×10-7g·mL-1时,1000倍的 K+、Al3+、Ca2+、Zn2+、葡萄糖、果糖、蔗糖,500 倍的Cu2+、Mn2+,250 倍的 Mg2+,5 倍的 Fe3+不产生干扰。
2.1.7 精密度、检出限及线性范围的确定 在优化的条件下,ACF 溶液浓度在 1.4×10-8~0.99×10-6g·mL-1范围内与体系的荧光强度ΔF 值呈良好的线性关系,线性回归方程为 ΔF=3.0×108c(g·mL-1)+12.1,R2为 0.9925。对浓度为 2.8×10-7g·mL-1的 ACF 溶液平行测定5 次,其相对标准偏差为0.43%。根据IUPAC规定,以 3S0/S 计算,方法检出限(S/N=3)为1.1×10-8g·mL-1。
2.1.8 样品测定 随机抽取同一批号的醋氯芬酸8片,准确称取其质量,研细后称取适量粉末,用超纯水加热溶解并超声15min,最后定容至250mL 容量瓶中,摇匀,干过滤,弃去初滤液,移取一定量续滤液,按照实验方法测定,并进行加标回收实验,结果见表1。

表1 样品测定及回收率实验(n=5)Tab.1 Determination results of ACF in samples and recovery of the method(n=5)
2.2 作用机理的研究
2.2.1 猝灭方式的判断 参考斯特恩-沃尔默方程:

式中 F、F0:有无猝灭剂时 BSA 的荧光强度;KSV:猝灭常数;Kq:双分子猝灭过程速率常数;[Q]:猝灭剂的浓度;τ0:无猝灭剂时生物大分子的平均寿命。
测定不同ACF 浓度下的F0/F 值,以F0/F 对[Q]作图得出:293K 下,方程为 y=1.18×105x+0.963,r=0.9913;310K 下,方程为 y=1.40×105x+0.960,r=0.9991;根据方程得到的猝灭常数KSV由1.18×105逐渐增加至1.40×105L·mol-1,说明二者反应形成了复合物且猝灭方式为动态猝灭。但Kq的数量级为1013,猝灭方式似乎为静态猝灭,考虑到离子强度是影响KSV的主要因素[8],因此Kq的增大有可能是离子强度影响的结果,所以初步认为ACF-BSA 体系的猝灭过程为动态猝灭。
2.2.2 结合常数和结合位点数的计算 由lg [(F0-F)/F]= lgKA+nlg[Q]可求出表观结合常数KA和结合位点数n:
以lg[(F0-F)/F]对lg[Q]作图,拟合出不同ACF 浓度下的双对数曲线:293K 下,方程为y=1.064x+5.36,r=0.9977;310K 下,方程为 y=1.134x+5.84,r=0.9980;可以看出,ACF 和BSA 的结合位点数分别为1.06和1.13,总体接近于1,表明ACF 在BSA 上只有一个结合位点。通过计算得出KA分别为2.29×105和6.92×105L·mol-1,数量级均达到 105,随着温度的升高逐渐增大,揭示了二者的结合力不断增强,即ACF能够很好的与蛋白质发生结合,从而在体内起到运输和储存的作用。
2.2.3 作用力的判断 有机小分子和蛋白质大分子发生反应主要通过各种作用力相结合,类型有:疏水作用力(ΔH>0,ΔS>0),氢键和范德华力(ΔH<0,ΔS<0),静电引力(ΔH<0,ΔS>0),参考范特霍夫方程[9]:

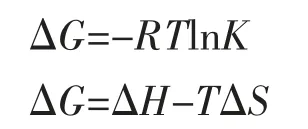
计算出ACF 和BSA 之间的热力学参数,见表2。

表2 ACF-BSA 的猝灭常数、结合常数,结合位点数和热力学参数Tab.2 Quenching constants, binding constants, binding sites and thermodynamics parameters of BSA-ACF
ΔH>0,ΔS>0 说明二者通过疏水作用力相结合,即ACF 进入到BSA 的疏水腔内部是通过疏水作用力完成的,ΔH>0,ΔG<0 说明该反应放热、自发正向进行[10]。
2.2.4 结合位置的确定 由表2 可知ACF 和BSA反应形成复合物时存在一个结合位点,而在BSA 的疏水亚结构域中,含有两个能和药物分子结合的位点(ⅡA 和ⅢA)。ⅡA 位点同时含有 Trp 和 Tyr 两种氨基酸残基,而ⅢA 只含有Tyr 一种发荧光的残基。当激发波长为283nm 时,可同时激发BSA 的Trp 和Tyr 残基的荧光,当激发波长为295nm 时,仅激发Tyr 残基的荧光[11]。因此,欲探究ACF 和BSA 发生反应时两种氨基酸的参与情况及二者具体的结合位置,本实验对比了不同激发波长下(283nm 和295nm)ACF 对BSA 的荧光猝灭程度,计算出不同浓度下的F/F0值。

图5 ACF 与BSA 作用的相对荧光猝灭曲线Fig.5 Fluorescence quenching curves of ACF-BSA
由图5 可知,当激发波长分别为283 和295nm时,ACF 和BSA 的相对猝灭曲线没有发生重叠,且以283nm 为激发波长的荧光猝灭程度比295 nm 激发的猝灭程度大,表明两种氨基酸残基均参与了猝灭过程,也进一步确定ACF 主要和BSA 的ⅡA 位点发生结合。
2.2.5 紫外吸收光谱 静态猝灭是药物分子与BSA在基态生成了不发光的配合物,从而引起BSA 的紫外吸收光谱的变化,而动态猝灭不影响紫外吸收光谱的变化。实验于8453 型紫外-可见分光光度计上分别测定BSA 及BSA-ACF 的紫外吸收光谱图,发现最大吸收波长和峰型均没有发生变化。进一步揭示了ACF 和BSA 的猝灭过程为动态猝灭。
2.2.6 同步荧光分析 同步荧光法可以探究ACF对BSA 的Trp 残基和Tyr 残基的影响,因此,同步荧光光谱也可以作为判断结合位点的手段。Δλ=15nm时为Tyr 残基的光谱特征,Δλ=60nm 时为Trp 残基的光谱特征。

图6 BSA-ACF 的同步荧光光谱图Fig.6 Synchronous fluorescence spectra of BSA-ACF system
由图6 可知,随着ACF 浓度的增大,Trp 和Tyr残基的荧光强度均逐渐降低,但峰位置没有发生明显变化,表明两种氨基酸残基均参加了结合反应,与位点判断实验相互印证。相比较体系在Δλ=60nm 的猝灭程度比Δλ=15nm 的猝灭程度大,证明Trp 对BSA 的荧光猝灭贡献大于Tyr 残基,即ACF 主要与BSA 的 Trp 残基结合。
3 结论
在酸性条件下,利用荧光光谱法测定出不同浓度ACF 对BSA 荧光强度的影响,提出了定量测定ACF 的荧光新方法。温度影响的研究表明,ACF 以动态方式猝灭了BSA 的荧光,结合常数为105数量级,即二者有很强的相互作用;热力学参数表明二者主要靠疏水作用力自发结合形成复合物;同步荧光法和位点实验证明只有一个结合位点,且主要位于BSA 的ⅡA 亚结构域中。该研究为进一步了解ACF在体内的储存、运输提供了数据参考,为测定ACF含量提供了新方法。

