基于Chem-E-Car 竞赛的化工小车动力系统和控制系统概述*
余洪洋,温 涛,王子恒,喻卓阳,肖作安,占 丹
(湖北文理学院食品科学技术学院·化学工程学院,湖北 襄阳441053)
1 引言
为了锻炼和提高化学工程专业学生的实践能力和创新思维,培养大学生的自主学习和团队协作能力,由美国化工学会开展的面向世界大学生的一项运用化学工程技能的竞赛——Chem-E-Car 竞赛在多个国家开展,作为分赛区的中国赛区也已经连续成功举办多次竞赛,受到国内越来越多高校的关注和重视。此项竞赛要求本科专业的学生自主设计并制造一款以化学反应为基础提供动力(动力系统)的化工能源小车,并且在一定的负载下能够行驶一定的距离后达到精准控制(控制系统)[1]。
化工能源小车的设计要求运用化学反应来驱动和停止,旨在利用化学方法来替代能源消耗,在一定程度上能够有效减缓能源消耗,而且化工能源小车的设计制造包含化学、物理、机械、美工等专业知识,涉及内容较多,覆盖面较广,具有一定的挑战性、趣味性,能够激发在校大学生的兴趣,提高其动手操作能力[2]。
本文以Chem-E-Car 竞赛为背景,结合近年来国内外各高校的参赛情况就动力系统和控制系统进行分析总结。
2 动力系统
动力系统作为小车的动力来源,是其最重要的部分之一,因此,如何选择动力源也是研究这个比赛的核心问题。众所周知,生活中有各种各样的能量存在形式,比如风能、光能、化学能、热能等,参照比赛规则可以选择风能,将化学反应产生的气体进行压缩释放,从而推动小车前进;光能,用太阳能电池板将光能转化为电能输出到电动机上从而推动小车;化学能,可以采用化学电池,用化学电池所产生的电能转化为机械能推动小车;热能,可以用内燃机燃烧化学反应所生成的化学燃料例如乙醇等,将热能转换为机械能从而推动小车。风能形式的小车中对气体加压有一定的不安全性,无法对小车做到精准控制。2001 年,墨尔本Chem-E-Car竞赛上,新加坡大学队就采用双氧水催化分解产生氧气,气体通过车子后面的管道排放出来而推动小车前进(“火箭式”小车)。气体排完后,小车就自动停止,但这类设计由于安全等因素目前已经被禁止参赛;热能形式的小车在2003 年也被设计过,澳大利亚Aldelaide 的大学生设计使用汽油发动机作为动力源使小车运行,通过控制发动机燃烧消耗空气的量来使小车停止。他们将一个塑料袋充入一定量的空气,当空气燃烧完毕,小车自动停止[3]。但是出于对安全方面的考虑以及比赛规则的限制,越来越多的参赛队伍不约而同地采取化学电池作为动力系统的小车,即依靠电化学电池推动电动马达从而实现化工小车前进,这种形式的动力系统具有输出稳定、安全、高效、环保等等优点[4]。
2.1 燃料电池
自20 世纪60 年代中期碱性燃料电池(AFC)首次用于NASA 空间计划以来,燃料电池已成为国际上研究开发的热点之一。现如今新能源汽车的普及,化学燃料电池作出了不可磨灭的贡献。将化学燃料电池应用在化工小车上也是一种大胆的设想与实践。美国Dayton 大学化学工程专业学生在2003 年AIChE 比赛上,设计了以氢气为燃料的燃料电池化工小车[4]。
2018 年中国大学生Chem-E-Car 竞赛上中北大学参赛队伍设计出了一种以H2O2的酸性溶液与NaBH4的碱性溶液构成的全液态燃料电池(DBHFC)。硼氢化钠有储氢效率高、无毒、不可燃、便于储藏运输等优势,是燃料电池理想的储氢材料,H2O2作为燃料电池的氧化剂,比氧气还原容易得多,还可以获得更高的输出功率密度。
其化学反应方程式如下:
正极:BH4-+8OH-=BO2-+6H2O+8e-
负极:4H2O2+8H++8e-=8H2O
在同届比赛中大连理工大学(盘锦)校区参赛团队以氢氧燃料电池为动力系统。氢氧燃料电池,氢氧燃料电池具备是当今世界上最清洁的能源电池,它反应过程中只消耗氢气和氧气生成产物是水。整个反应过程中由于有氢气的参与,所以又独立设计了一套制备氢气的系统供燃料电池提供氢气,整套电池系统能够稳定的输出电压,使小车能够平稳地运行。其化学反应方程式如下:
正极上:H2=2H++2e-
负极上:1/2O2+2H++2e-=H2O
全反应:1/2O2+H2=H2O
其电池电动势E=1.229 V
制氢系统:Zn+H2SO4=ZnSO4+H2↑
2.2 锌(镁、铝)-空气电池
锌(镁、铝)-空气系统作为最受欢迎的一套动力系统,具有稳定高效的优点。在2018 和2019 两届中国大学生Chem-E-Car 竞赛上被清华大学、上海交通大学、大连理工大学、西北大学、中南大学、西安交通大学、北京化工大学等25 所高校采用。2019 年竞赛中四川大学将铝-空气电池的电解质溶液改为固体凝胶电解质层,有效减缓浓差极化,也避免出现电解液漏液的现象。天津大学采用液流式铝空电池,增加一套循环系统,维持电池内部温度和浓度的稳定。同样在2019 年竞赛中西北大学凭借锌-空气电池动力系统取得第一,并打破比赛记录。以锌-空气电池为例,其对应的化学反应为:
正极:1/2O2+H2O+2e-→2OH-
负极:Zn+4OH--2e-→Zn(OH)42-
总反应:Zn+1/2O2+H2O+2OH-→Zn(OH)42-
其电池电动势E=1.4 V
这种电池单组所产生的电压在1.4 V 左右,相当于1 节干电池的电压。由于电池体积小可以将电池串联起来,做成电池组,其电压可以根据实际需要进行调整。
2.3 其他电池
除了上述的燃料电池,锌(镁、铝)-空气电池,在比赛中也出现了一些其他的化学电池动力源。2018 年中国大学生Chem-E-Car 竞赛上华南理工大学采用Pb-PbO2硫酸体系电池,也就是人们所熟知的铅蓄电池。这种电池技术成熟,但是制作成本大,且原料对环境有着一定的影响。
常州大学团队采用水系锂离子液流电池。其化学反应方程式如下:
正极:Zn2++2e-=Zn
负极:LiMn2O4=xLi++xe-+Li1-xMn2O4
总反应:LiMn2O4+x/2 Zn2+=xLi++x/2 Zn+Li1-xMn2O
其电池电动势E≈1.25 V
在比赛上往往各支参赛队伍的动力系统大致相同,因此大赛对创新的渴望度很高,在2019 年中国大学生Chem-ECar 竞赛上我们看到有些参赛队伍设计出了新型电池,例如大连理工大学和中国石油大学的碱性锌锰电池。这种电池具有较高的放电性能,碱性锌锰电池的容量和放电时间是同等型号普通电池的3~7 倍,低温性能两者差距更大,碱性锌锰电池更耐低温,而且更适合用于大电流放电和要求工作电压比较稳定的用电场合,而且其内阻小(约0.25 Ω),能在重负荷下连续工作同时维持较高的稳定电压。其化学反应方程式如下:
正极:Zn+2OH-=Zn(OH)2+2e-;
Zn(OH)2+2OH-=[Zn(OH)4]2-
负极:MnO2+H2O+e-=MnOOH+OH-;
MnOOH+H2O+e-=Mn(OH)2+OH-
总反应:Zn+2H2O+MnO2+2OH-=Mn(OH)2+[Zn(OH)4]2-
其电池电动势E≈1.52 V
2.4 温差发电机
除了原电池外,也可以通过其他化学反应设计并制造动力系统。比如在印度地区的Chem-E-Car 竞赛中利用塞贝克效应制作温差发电机。塞贝克效应又称作第一热电效应,在温度梯度下导体内的载流子从热端向冷端运动,并在冷端堆积,从而在材料内部形成电势差,同时在该电势差作用下产生一个反向电荷流,当热运动的电荷流与内部电场达到动态平衡时,半导体两端形成稳定的温差电动势。他们的热端采用硫酸与氢氧化钠的中和反应,而冷端采用干冰与丙酮的混合物。
无论采用哪种动力系统都要遵循一个原则:对于一个或多个化学反应,利用所学的专业知识将化学能转化为能够驱动前进的能量方式,并且要稳定、安全、无危害,还要不断优化动力系统,通过安全审查。
3 控制系统
控制系统即刹车系统,根据比赛要求控制系统同样要涉及到化学反应,但不可以用任何机械或电子计时装置使化学反应停止或车停止。因此,国内外各高校凭借比赛规则展开自己的理解,通过化学反应利用温度、颜色、压力等变化,再与发光二极管、传感器、继电器、电阻、单片机等电子元器件相结合,控制整个电路中电流的变化,从而做到精准控制。
3.1 碘钟反应
碘钟反应是一种化学振荡反应,同时也是一种变色反应。在反应中将两种或三种溶液混合在一起,几秒钟后溶液变为靛蓝色。利用一个快速反应或一系列快速反应组合,通过指示剂来显示某一反应物已消耗完毕。此类反应与生命钟相似,故称为“碘钟反应”。2005 年在Monash 大学举办Chem-E-Car 的竞赛中,有支参赛队伍首次采用碘钟反应作为控制系统,原理是让发光装置的光线穿过透明反应容器照射到光敏电阻上,通过光敏电阻感受到的光强变化来改变电阻,从而来控制反应的开关。反应刚开始时,光敏电阻接收大量的光照,此时电阻很小,整个小车的电路是个通路。随着反应的进行,透明容器内的碘钟反应由初始的透明逐渐变为反应终止时的深色,此时发光装置的光线无法穿透反应容器,光敏电阻无法接收光照阻值变得很大,这时整个小车的电路就变成了断路,小车停止。因此精确控制反应物浓度就能控制化工小车碘钟反应的变色时间,也就是小车的行驶时间,从而让小车在终点线停下来[5]。
由于碘钟反应现象明显,操作简单安全,因此被国内外各高校广泛运用,特别是碘酸盐型碘钟反应、过硫酸盐型碘钟反应和VC(维生素C)型碘钟反应应用最广泛。下面介绍几种典型的碘钟反应原理。
3.1.1 过氧化氢型碘钟反应
向硫酸酸化的过氧化氢溶液中加入碘化钾、硫代硫酸钠和淀粉的混合溶液。这个过程的碘钟颜色变化由深色变为透明再变成黑色,此时在体系中存在2 个主要反应,化学方程式为:
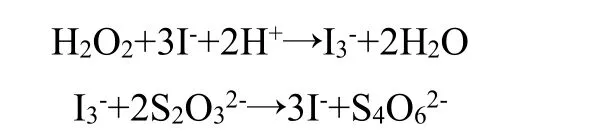
3.1.2 碘酸盐型碘钟反应
向硫酸酸化的碘酸盐中加入亚硫酸氢钠和少量的淀粉,此时体系中存在:
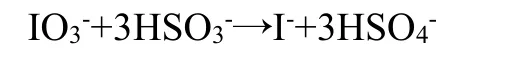
之后过量的碘酸根离子与碘离子发生归中反应:
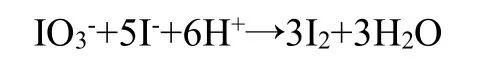
接着亚硫酸氢钠将生成的碘还原:
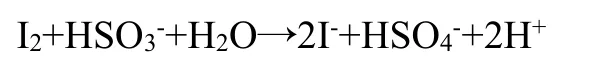
3.1.3 过硫酸盐型碘钟反应
绝大多数参赛队伍选择了过硫酸盐型碘钟作为控制系统,通过过硫酸钾、过硫酸钠或过硫酸铵将碘离子氧化成碘单质。加入硫代硫酸钠可以将碘单质还原回碘离子,整个变色过程由透明到深色。化学方程式如下:
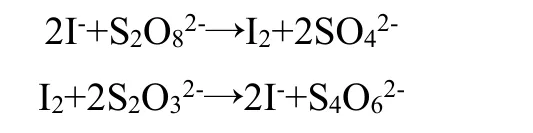
3.1.4 氯酸盐型碘钟反应
氯酸盐型碘钟反应在竞赛中很少被采用,通过将卢戈氏碘液、氯酸钠和高氯酸混合,反应原理为:
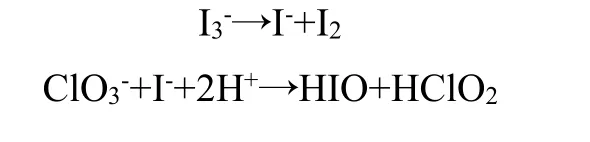
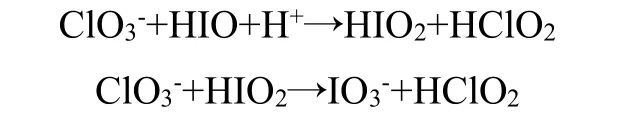
3.1.5 VC 型碘钟反应
过氧化氢和碘化钾反应较慢,而VC 和碘单质反应较快,碘单质一旦生成,将立即被VC 还原,直到VC 消耗完成后,碘单质开始积累,与水溶性淀粉反应,溶液颜色加深,反应方程式如下:
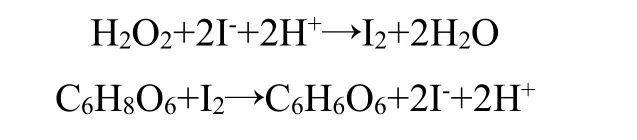
不同的碘钟反应有着不同的变色机理,因此要根据其光敏电阻类型来选择,通过大量的实验来确定反应物浓度,从而控制变色时间。能够精准地控制变色时间就能够精准地控制小车行驶的时间。
3.2 B-Z 振荡反应
除碘钟反应这一振荡反应外,B-Z 振荡反应在2019 年中国Chem-E-Car 竞赛中受到华东理工大学的青睐,通过电极检测电位的周期性变化,并记录周期数量,当达到电路板预设程序所指定的震荡次数后,切断电路使小车停止。
3.3 荧光反应
通过改变过氧化氢的浓度进而改变荧光物质发光衰退时间,再利用光线传感器光强变化改变光敏电阻的阻值,从而改变电路中电流的大小使小车停止。
3.4 其他控制系统
除了以上几种控制系统外,也有高校利用溶断机制、压力变化、短路等方法设计自己的控制系统。
溶断机制是根据“保险丝”演化而来,通过改变酸浓度来改变酸溶断金属丝所需要的时间,进而控制小车的停止。在2018 年中国大学生Chem-E-Car 竞赛中太原理工大学用稀硫酸溶解镁条,当镁条不和溶液液面接触时,电路断开,小车停止运行。同样利用稀硫酸和镁条反应,浙江大学利用反应产生的气体使定容容器内的压力发生变化,通过改变酸的浓度改变气体产生的量,当生成一定量的气体后,触发压力传感器切断电路[3]。
2019 年广州大学利用短路原理实现对小车的控制。将两根相距一定距离的不锈钢棒放在一定浓度的硫酸铜溶液中,使其发生置换反应,当置换出的铜将两根不锈钢棒联通时,使电路发生短路,电流不经过马达,小车停止。
2003 年澳大利亚Monash 大学用自制的以铂为电极的干电池来控制化工小车。在铂电极上预先镀上铜,小车在前进过程中铂电极上的铜在电解液中被氧化,当铜完全氧化时电阻突然增大、电流减小,小车停止前进。
从历届参赛作品来看,大多参赛队伍选择激光灯形式的碘钟反应作为化工小车的控制系统,因为其化学反应的稳定性、变色的灵敏性及可控性得到大家的青睐。在比赛中好的东西往往会被大家借鉴模仿,通过模仿会呈现更完美更准确的碘钟反应控制系统。相信通过参赛队伍们的不断努力,未来将会有更新颖更高效的控制系统呈现在我们面前。
4 总结
动力系统和控制系统多种多样,不同的参赛队伍根据自身情况设计并制造不同的动力系统和控制系统,将自己的所学所见运用到实际学习生活中,在原有的基础上不断创新发展,研究创造出更多新颖独特的方案体系。随着Chem-E-Car竞赛的发展,越来越多的高校学生参与到其中,实现“学中做,做中学”,激发学生学习的积极性,也培养了他们的团队合作精神和研究创新的能力[6]。

