3种植物生长调节剂对不同干旱胁迫下巨菌草光合指标的影响
李苏涛,陈思齐,李 妍,史文娇,苏德伟,林 辉,罗海凌,周 晶
(1.福建农林大学动物科学学院(蜂学学院), 福建 福州 350002;2.福建农林大学国家菌草工程技术研究中心, 福建 福州 350002)
水分是植物生长的必要条件,与植物生产力相关,对植物光合作用具有重要影响[1]。干旱对植物的影响大都表现在植物形态[2]、光合特性[3]、叶绿素荧光特性[4]、渗透调节物质[5]、抗氧化系统[6]、内源激素[7]、诱导基因表达[8]等方面。
干旱胁迫能够诱导气孔关闭,阻碍气体交换,减弱植物光合作用,从而抑制植物的生长发育。在干旱环境中植物的光合作用会减弱,净光合速率(net photosynthesis, Pn)降低。同时,植物会进行气孔调节,引起气孔导度(stomatal conductance, Gs)、蒸腾速率(transpiration, Tr)的下降。水分利用效率(wateruse efficiency, WUE)作为Pn与Tr的比值,其变化与Pn和Tr相关。不同植物的WUE 在干旱胁迫下呈现不同趋势,一般来说植物在干旱下WUE 会降低,而抗旱性强的植物的WUE 可能会随着干旱程度的增加先上升再下降。这在高粱(Sorghum bicolor)[9]、杨树(Populus)[10]、草地早熟禾(Poa pratensis)[11]、小麦(Triticum aestivum)[12-13]、绿洲(Arundosp.)[14]等植物中已有报道。
为了增强植物在干旱环境下的适应力,可采用外源喷施植物生长调节剂的方法。植物生长调节剂能调节气孔的关闭,降低蒸腾速率,减少水分的流失[9,11]。叶绿素是植物光合作用的基础,其含量的多少与光合反应强度紧密相关。干旱胁迫下,植物叶片中叶绿素含量下降,叶绿体结构被破坏。而植物生长调节剂能够延缓叶片中叶绿素降解速度,减轻干旱对叶绿体的破坏程度。玉米素(zeatin,ZT)作为常见的细胞分裂素,能促进细胞的分裂,延缓植物叶片中叶绿素的降解,从而缓解干旱对植物的损伤。此外,植物处于干旱环境下会产生大量活性氧,细胞膜发生脂质过氧化反应,膜系统受到氧化伤害,导致植物组织受伤。超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)是参与植物抗旱的抗氧化酶。植物生长调节剂能够通过增强抗氧化酶的活性、增加脯氨酸含量来减少脂质过氧化作用,降低过氧化产物丙二醛(malondialdehyde, MDA)的含量以增强植物抗旱性[15-17]。外源喷施茉莉酸甲酯(methyl jasmonate,MeJA)可以增强植物的抗氧化性和渗透调节能力,并通过关闭气孔减少水分的损失,从而缓解干旱胁迫对植物的伤害,提高其抗旱性。MeJA 在黑麦草(Lolium perenne)[18]、拟南芥(Arabidopsis thaliana)[19]、烟 草(Nicotiana tabacum)[20]、狭 叶 黄 芩(Scutellaria regeliana)[15]等植物中取得了较好的成果。3-吲哚乙酸(3-Indoleacetic acid, IAA)作为促进植物生长发育的重要内源植物生长调节剂,干旱胁迫会通过影响IAA 的合成和运输过程从而改变IAA 在植物体内的分布。有研究表明,外源喷施IAA 可以使植物提前发育成熟,进而减少因干旱胁迫而产生的伤害[21]。
外源喷施的植物生长调节剂通过气孔进入植物体内,作为信号分子进行长距离的信号转导以及植物之间的信息交流,从而诱导植物产生防御响应,减轻植物光合器官受到的伤害,促进植物光合作用,Pn、Tr、Gs和WUE 也会产生相应的变化。董桃杏等[22]发现干旱胁迫下外源MeJA 处理可显著提高水稻(Oryza sativa)幼苗的Tr、Gs、胞间CO2浓度、叶绿素含量等,提高水稻幼苗的抗旱性。马超等[23]对干旱胁迫下小麦喷施MeJA,发现MeJA 能诱导叶片气孔适当关闭,减少了水分的散失,因而显著提高了叶片Pn、Tr和WUE。但不同浓度的植物生长调节剂对Pn、Tr、Gs和WUE 的影响不相同。金微微等[20]对干旱胁迫初期烟草幼苗喷施0.2 和0.5 mmol·L-1的外源MeJA 后,烟草幼苗Pn、Tr、Gs均显著高于对照组,而1 mmol·L-1MeJA 处理Pn、Tr、Gs无明显变化甚至有所降低。许喆等[24]研究表明,黑麦草在轻度和中度干旱胁迫下喷施0、200 和500 μmol·L-1脱落酸(abscisic acid,ABA),其中200 μmol·L-1ABA 的WUE 相比对照提高,而500 μmol·L-1降低。以上结果表明植物生长调节剂在适宜浓度下能促进Pn、Tr、Gs和WUE,超过一定浓度时则抑制。
巨菌草(Pennisetum giganteum)是禾本科、狼尾草属植物,属于典型的C4植物,其光合利用率高,生长速度快,适合在我国多个地区生长和人工栽植,产量可达254.24 t·hm-2[25]。巨菌草根系发达,分蘖能力强,是一种理想的生态治理修复草种[26]。目前有研究对巨菌草幼苗的叶和根进行转录组功能测序,揭示叶和根的主要转录因子家族[27]。对不同土培干旱和复水条件下巨菌草进行光合指标的测定和高通量测序,测定光合指标发现,与对照相比,干旱胁迫7 和14 d 巨菌草的 Pn、Tr和Gs均显著降低,而WUE 在干旱胁迫7 d 时上升,在干旱胁迫14 d 时下降且显著低于对照,高通量测序则报道了巨菌草干旱、复水相关基因的转录组数据[28]。艾育芳等[16]通过研究干旱下巨菌草幼苗水分和渗透调节物质的变化,发现巨菌草幼苗含水量呈下降趋势,而游离氨基酸和脯氨酸则表现出显著上升趋势。但目前暂未发现植物生长调节剂对巨菌草响应干旱胁迫的研究。因此,本研究以巨菌草幼苗为研究对象,探讨施加外源MeJA、IAA、ZT 对干旱胁迫下巨菌草光合指标的影响,以期找到MeJA、IAA、ZT 的最佳影响浓度和最佳影响时段,为后续巨菌草响应干旱胁迫的机理提供参考。
1 材料与方法
1.1 试验材料
试验材料选用福建农林大学菌草技术研究中心带有饱满侧芽的巨菌草。2020 年11 月将巨菌草种在水培盘中,每个水培盘中装蒸馏水至水位浸没芽的根部,在温度为(25 ± 5) ℃的温室大棚进行培养。每个处理选取3 株长势一致的巨菌草进行PEG 胁迫试验。
1.2 试验方法
1.2.1 光合作用参数测定
本试验采用CIRAS-3 便携式光合仪(PP-Systems Company,Amesbury,MA01913,USA)在 温 室 温 度(25 ± 1) ℃的环境下进行测量。设置CO2浓度为390 μmol·mol-1,光合有效辐射为1 200 μmol·(m2·s)-1,空气相对湿度为75%。在此设定条件下测定不同处理 下 巨 菌 草 叶 片 的 净 光 合 速 率[Pn, μmol·(m2·s)-1]、蒸腾速率[Tr, mol·(m2·s)-1]、气孔导度[Gs, μmol·(m2·s)-1]和水分利用效率(WUE, mmol·mol-1)。不同处理每个指标测定3 次。
1.2.2 试验材料处理
为探究不同浓度植物生长调节剂对干旱胁迫下巨菌草光合特性的影响,以期得到最佳MeJA、IAA、ZT 浓度。以15%的PEG-6000 溶液模拟干旱胁迫试验,胁迫时长为0、12、24、36 和48 h,共5 个处理组,其中0 h 记为对照组。参考忽雪琦等[29]、周宇飞等[30]和戴晓琴[31]的方法研究外源喷施MeJA、IAA 和ZT的浓度。用蒸馏水将MeJA 配制成浓度梯度为15、20、25、30 和35 μmol·L-1的溶液,IAA 配制成浓度梯度为510、540、570、600 和630 μmol·L-1的溶液,ZT配制成浓度梯度为2、4、6、8 和10 μmol·L-1的溶液,以加蒸馏水为对照。于09:00 - 11:00 测量Pn、Tr、Gs和WUE。后续以得到的最佳MeJA、IAA、ZT 浓度进行不同干旱胁迫程度不同时段下对巨菌草光合特性影响的研究,以期找到MeJA、IAA、ZT 的最佳影响时段。仍以15%的PEG-6000 溶液模拟干旱胁迫试验,胁迫时长为0、12、24、36 和48 h,共5 个处 理 组。分 别 喷 施25、510 和6 μmol·L-1的MeJA、IAA 和ZT,在 喷 施 后0、1、4、8 和24 h 时 测 量Pn、Tr、Gs和WUE。上述试验均采用叶面喷施法对巨菌草叶片进行正反两面均匀喷施,喷施剂量均为3 mL,每个处理3 个重复,植物生长调节剂自然风干后将不同处理的巨菌草分开放置。
1.3 数据统计与处理方法
采用SPSS 22.0 软件对数据进行统计分析,采用平均值和标准误表示测定结果,分别对干旱胁迫下不同浓度植物生长调节剂处理和同一胁迫程度不同时段的结果进行单因素方差分析(One-way ANOVA)检验差异的显著性(P< 0.05);采用Excel 2019 制图。
2 结果与分析
2.1 干旱胁迫对巨菌草光合特性的影响
干旱胁迫48 h,巨菌草叶片与对照相比出现萎蔫变黄,严重抑制其光合作用的进行(图1)。干旱胁迫对未喷施植物生长调节剂的巨菌草的Pn、Tr、Gs和WUE 影响较大(图2)。Pn、Tr、Gs呈现出相似的趋势,随着干旱程度的加深先短暂上升再下降。在重度干旱胁迫下,即干旱胁迫48 h 时,Pn、Tr、Gs均显著低于对照(P< 0.05),与对照相比分别下降了77.11%、47.87%和57.76%。而WUE 随着干旱程度的加深,总体呈下降趋势,后期有小幅度的上升。但在干旱胁迫48 h 时WUE 仍显著低于对照,与对照相比下降了56.02%。

图1 干旱胁迫对巨菌草生长的影响Figure 1 Effects of drought stress on the growth of giant juncao
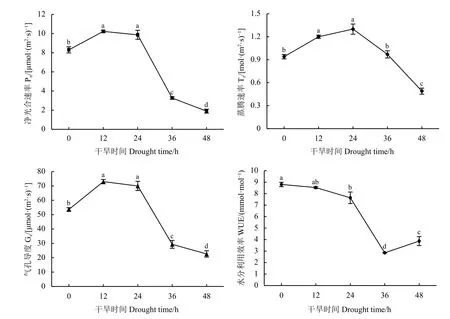
图2 干旱胁迫对巨菌草净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)的影响Figure 2 Effects of drought stress on the Pn, Tr, Gs, an WUE of giant juncao不同小写字母表示不同干旱胁迫时间之间差异显著(P < 0.05);下图同。
2.2 不同浓度植物生长调节剂对干旱胁迫下巨菌草光合特性的影响
2.2.1 MeJA 对干旱胁迫下巨菌草光合特性的影响
未 进 行 胁 迫 时(0 h),15、20、25 μmol·L-1MeJA浓 度 下 的Pn显 著 高 于 对 照(P< 0.05) (图3)。胁 迫48 h 时,所有浓度下的Pn显著高于对照(P< 0.05),且Pn随MeJA 浓 度 增 加 呈 峰 状,25 μmol·L-1时Pn达到最大。WUE 在未进行胁迫时随MeJA 浓度增加呈峰状,25 μmol·L-1时WUE 达到最大且 显著高于对照(P< 0.05);胁迫36、48 h 时,所有浓度下的WUE 显 著 高 于 对 照(P< 0.05)。Tr与Gs在 整 个 干旱过程的变化趋势相似,未进行胁迫时,15、20 μmol·L-1MeJA 浓 度 下 的Tr、Gs显 著 高 于 对 照(P<0.05);胁迫48 h 时,Tr、Gs随MeJA 浓度增加呈峰状,25 μmol·L-1时Tr、Gs达 到 最 大 且 显 著 高 于 对照(P< 0.05)。
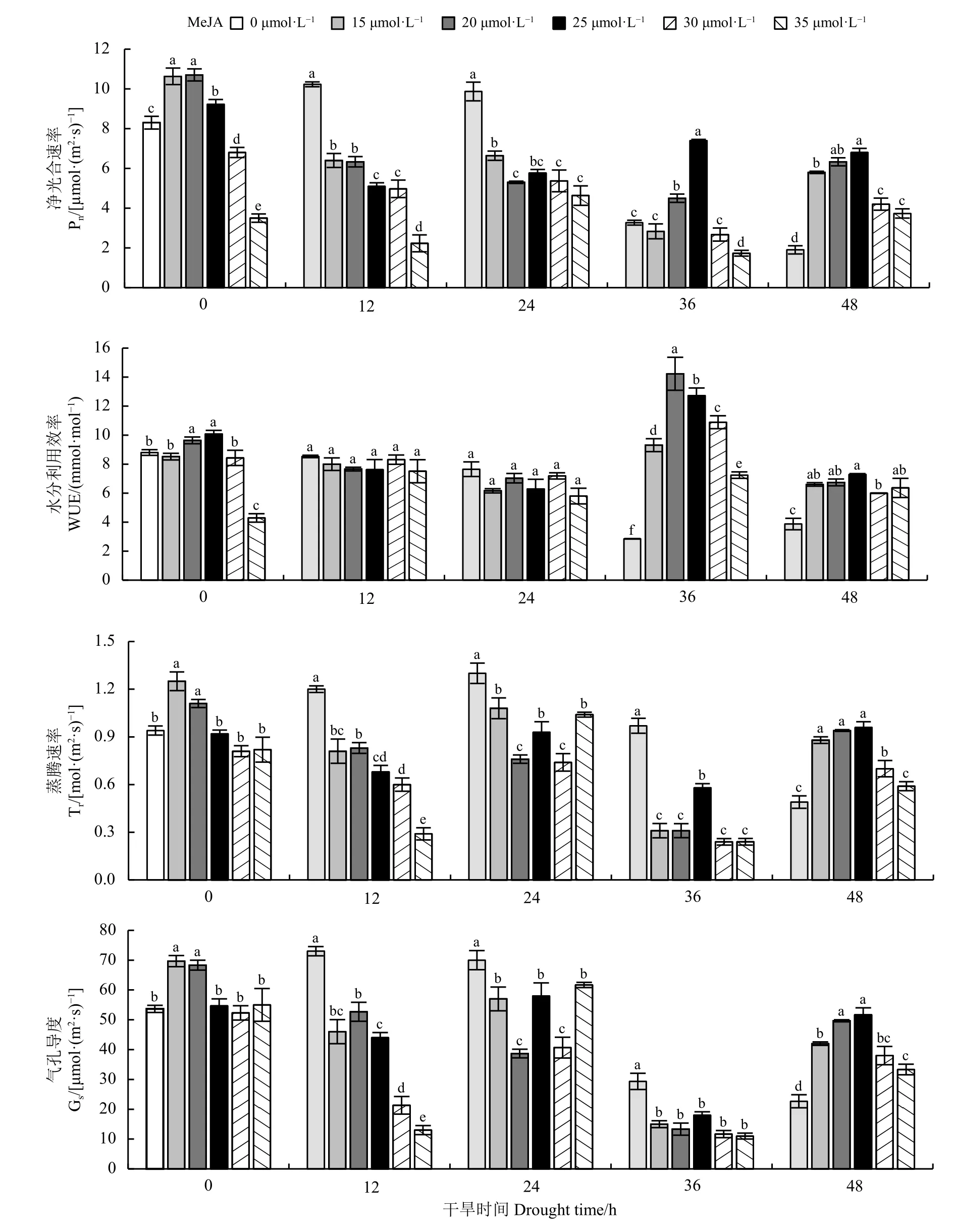
图3 不同浓度MeJA 对干旱胁迫下巨菌草净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)的影响Figure 3 Effects of different concentrations of methyl jasmonate on the Pn , Tr , Gs ,and WUE of giant juncao under drought stress
因WUE 为Pn与Tr的比值,其变化易受两者变化所影响。因此确定MeJA 的最佳浓度时主要考虑其对Pn、Tr和Gs的影响。在胁迫48 h,多数MeJA浓度下的Pn、Tr和Gs显著高于对照(P< 0.05),因此MeJA 对Pn、Tr和Gs的正向调节主要是在胁迫48 h。其中25 μmol·L-1时Pn、Tr和Gs达到最大,因此本试验条件下MeJA 的最佳浓度为25 μmol·L-1。
2.2.2 IAA 对干旱胁迫下巨菌草光合特性的影响
在未进行胁迫和胁迫48 h 时,所有IAA 浓度下的Pn显著高于对照(P< 0.05);未进行胁迫时Pn随IAA 浓度增加呈谷状,而在胁迫48 h 随IAA 浓度增加而下降,但均在510 μmol·L-1时达到最大(图4)。在整个干旱胁迫过程中,适宜浓度的IAA 对WUE 有不同程度的改善作用,尤其是胁迫24 h、48 h的600 和630 μmol·L-1的WUE 显 著 高 于 对 照(P<0.05) (图4)。Tr与Gs在整个干旱过程的变化趋势整体上一致,在胁迫12、24、36 h时,IAA 对Tr、Gs表现出抑制作用;胁迫48 h,Tr、Gs随IAA 浓度增加而降低,510 μmol·L-1时Tr、Gs最大且显著高于对照(P<0.05),可见浓度超过一定值会抑制Tr、Gs。本研究中,AA 浓度为630 μmol·L-1时的Tr、Gs显著低于对照(图4)。
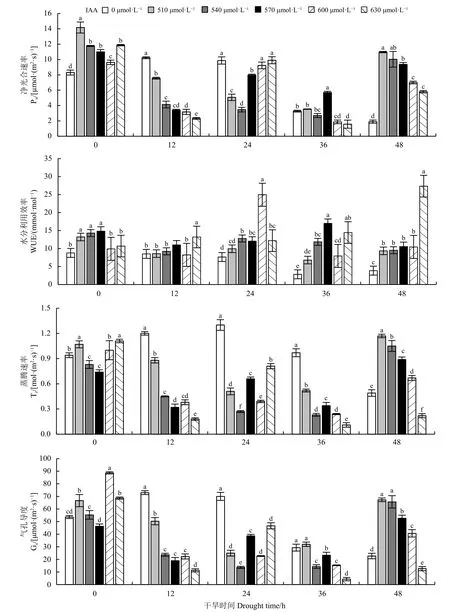
图4 不同浓度IAA 对干旱胁迫下巨菌草净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)的影响Figure 4 Effects of different concentrations of 3-indoleacetic acid on the Pn , Tr , Gs , and WUE of giant juncao under drought stress
与MeJA 一样,在优先考虑IAA 对Pn、Tr和Gs的影响时发现,在胁迫48 h,多数IAA 浓度下的Pn、Tr和Gs显著高于对照(P< 0.05),因此IAA 对Pn、Tr和Gs正向调节主要是在胁迫48 h。但Pn、Tr和Gs随IAA 浓度的增加而降低,510 μmol·L-1时值最大且显著高于对照,因此本研究中最佳IAA 的浓度为510 μmol·L-1。
2.2.3 ZT 对干旱胁迫下巨菌草光合特性的影响
未进行胁迫时,所有浓度下的Pn显著高于对照(P< 0.05),且Pn整体上随ZT 浓度增加呈峰状,8 μmol·L-1时最大(图5)。胁迫48 h,Pn随ZT 浓度增加而增加,除2 μmol·L-1外,其余浓度下的Pn显著高于对照(P< 0.05)。在整个干旱胁迫过程中,适宜浓度的ZT 对WUE 有不同程度的改善作用。胁迫0、12、24、36、48 h,浓度依次为8、6、8、8、10 μmol·L-1时WUE 达到最大且显著高于对照(P< 0.05)。在未进行胁迫和胁迫48 h 时Tr、Gs的变化趋势相似,其余时段存在一定的差异;未进行胁迫时,Tr、Gs随ZT 浓度增加呈谷状,除8 μmol·L-1外,其余浓度下的Tr、Gs显著高于对照;胁迫48 h 时,ZT 对Tr、Gs影响则为峰状,6 μmol·L-1时Tr、Gs达到最大且显著高于对照(P< 0.05)。
与MeJA 和IAA 相同,在确定ZT 的最佳浓度时更看重其对Pn、Tr和Gs的影响。本研究中ZT 的主要调节作用在未进行胁迫和胁迫48 h。未进行胁迫时,Pn随ZT 浓度增加呈峰状,8 μmol·L-1时Pn达到最大;而Tr、Gs随ZT 浓度增加呈谷状,在8 μmol·L-1时最小。胁迫48 h 时,Pn随ZT 浓度增加而增加;Tr、Gs则 随 浓 度 增 加 呈 峰 状,在6 μmol·L-1时Tr、Gs达 到 最 大(图5)。因 胁 迫48 h 下6 μmol·L-1和8 μmol·L-1的Pn值无显著差异(P> 0.05),且6 μmol·L-1时Pn、Tr、Gs均显著高于对照,因此本研究中ZT 的最佳浓度为6 μmol·L-1。
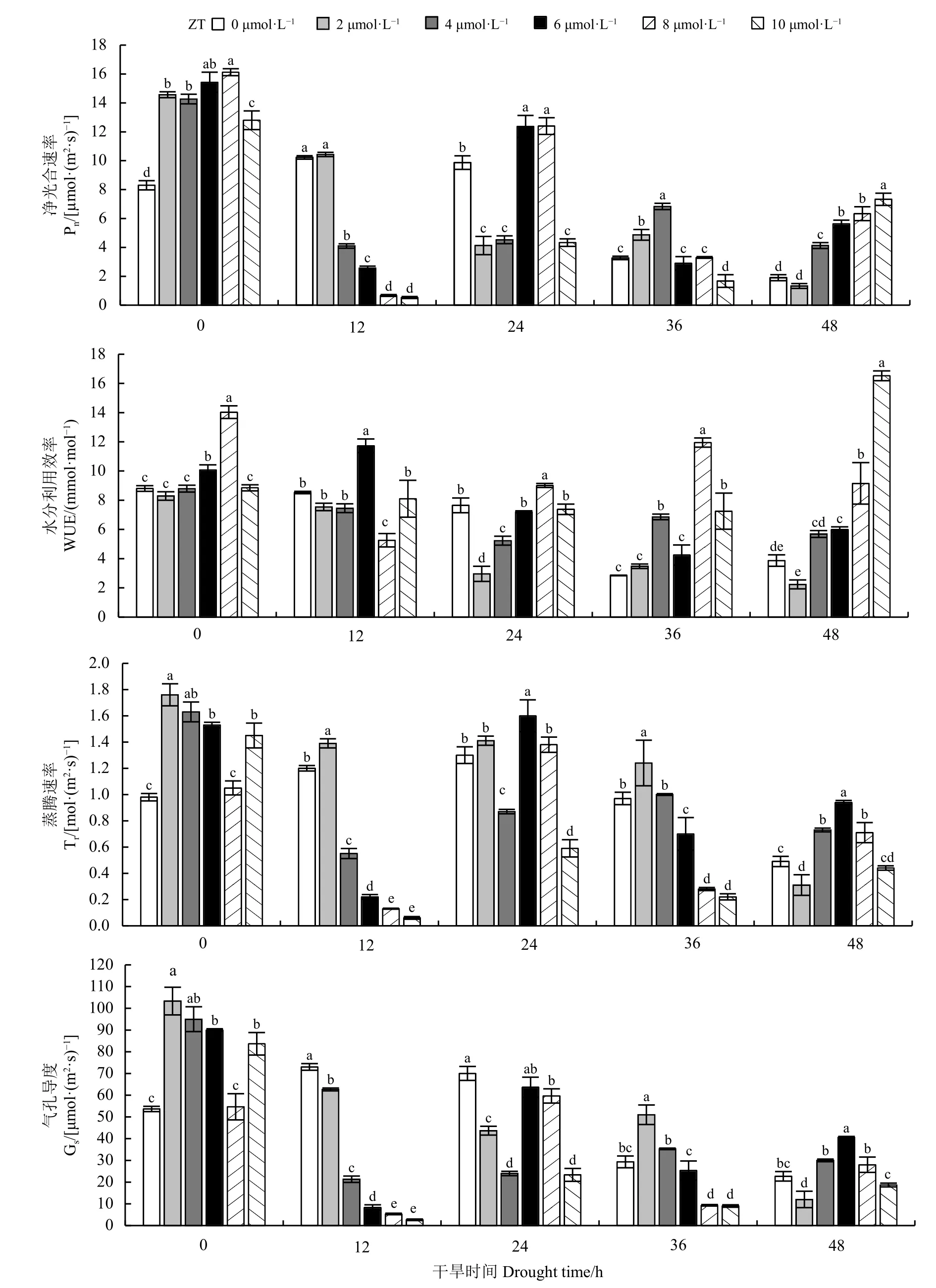
图5 不同浓度ZT 对干旱胁迫下巨菌草净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)的影响Figure 5 Effects of different concentrations of zeatin on the Pn , Tr , Gs ,and WUE of giant juncao under drought stress
2.3 植物生长调节剂对不同干旱条件不同时段巨菌草光合特性的影响
2.3.1 MeJA 对不同干旱条件不同时段巨菌草光合特性的影响
干旱胁迫36、48 h 在喷施后8 h 时Pn达到最大且显著高于对照(P< 0.05) (表1)。WUE 在胁迫12、36、48 h 分别在喷施后1、4、8 h 时达到最大且显著高于对照(P< 0.05)。Tr、Gs整体变化趋势相似,胁迫24 h在喷施后24 h 时Tr达到最大且显著高于对照(P<0.05),而Gs在喷施后8 h 时达到最大且显著高于对照(P< 0.05);胁迫36 h 在喷施后8 h时Tr、Gs达到最大且显著高于对照(P< 0.05);胁迫48 h 在喷施后24 h时Tr、Gs达到最大且显著高于对照(P< 0.05) 。因WUE 易受Pn和Tr变化而变化,优先考虑MeJA 对Pn、Tr和Gs影响变化趋势,可知MeJA 对干旱下巨菌草光合指标的最佳影响时段为喷施后的后半段时间,即8~24 h。
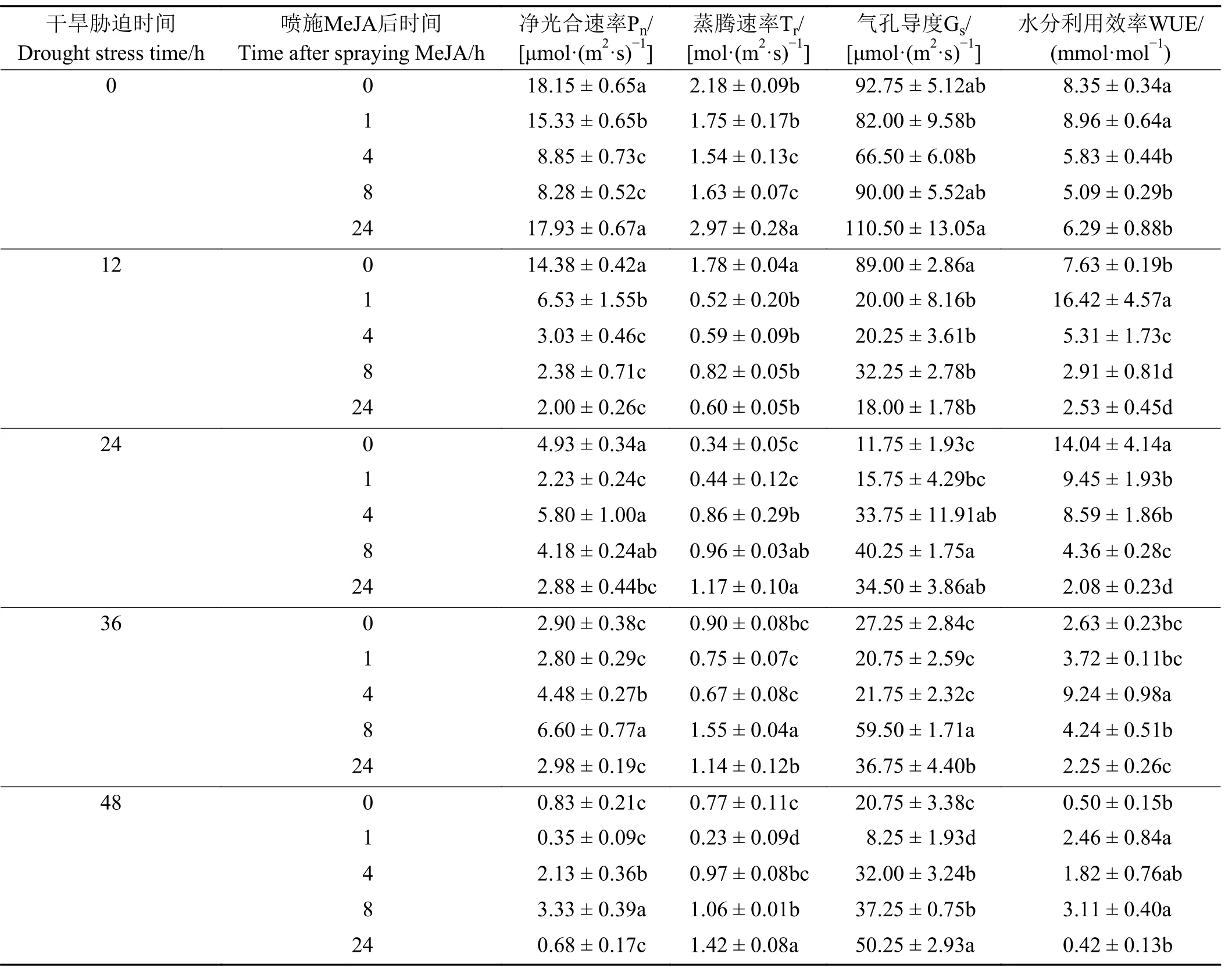
表1 喷施MeJA 对巨菌草在不同干旱条件不同时段净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)的影响Table 1 Effects of Pn、Tr、Gs and WUE of giant juncao sprayed with methyl jasmonate at different periods of different drought conditions
2.3.2 IAA 对不同干旱条件不同时段巨菌草光合特性的影响
胁迫12 h 在喷施后1 h 时Pn达到最大且显著高于对照(P< 0.05);胁迫24、36 h 在喷施后4 h 时Pn达到最大且显著高于对照(表2)。WUE 在胁迫0、12、24、36、48 h依次在喷施后8、4、8、4、1 h 时达到最大且显著高于对照。Tr、Gs的整体变化趋势相似,胁迫24 h 在喷施后4 h时Tr达到最大且显著高于对照,而Gs在喷施后8 h 时达到最大且显著高于对照;胁迫36 h 在喷施后1 h 时Tr、Gs达到最大且显著高于对照。结合不同胁迫程度不同时段下Pn、Tr、Gs和WUE 变化趋势,可知IAA 对干旱胁迫下巨菌草光合指标的影响主要是喷施后的前半段时间,即1~8 h。
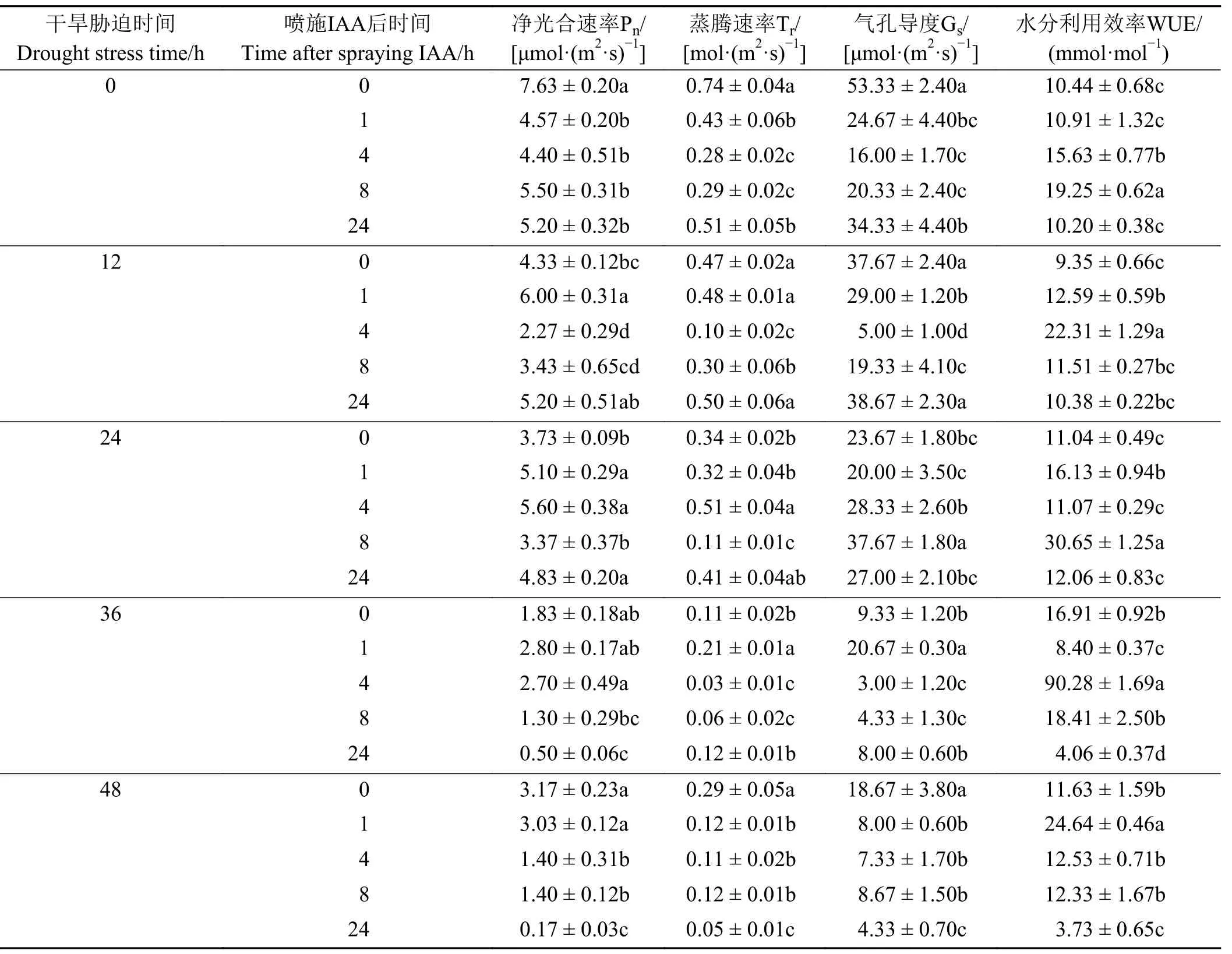
表2 喷施IAA 对巨菌草在不同干旱条件不同时段净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)的影响Table 2 Effects of Pn、Tr、Gs and WUE of giant juncao sprayed with 3-indoleacetic acid at different periods of different drought conditions
2.3.3 ZT 对不同干旱条件不同时段巨菌草光合特性的影响
胁迫12、24、36、48 h 在喷施后1、4、8、8 h 时Pn达 到 最 大 且 显 著 高 于 对 照(P< 0.05) (表3)。WUE 在不同干旱程度的适宜时段下均有提高作用。胁迫0、12、24、36、48 h 依次在喷施后的1、1、4、8、4 h 时WUE 达到最大且显著高于对照。Tr、Gs整体变化趋势相似,胁迫24 h 在喷施后8 h 时Tr、Gs达到最大且显著高于对照;胁迫36 h 在喷施后1 h时Tr、Gs达到最大且显著高于对照。结合不同胁迫程度不同时段下Pn、Tr、Gs和WUE 变化趋势,表明ZT 对干旱胁迫下巨菌草光合指标的影响主要是喷施后的前半段时间,即1~8 h。
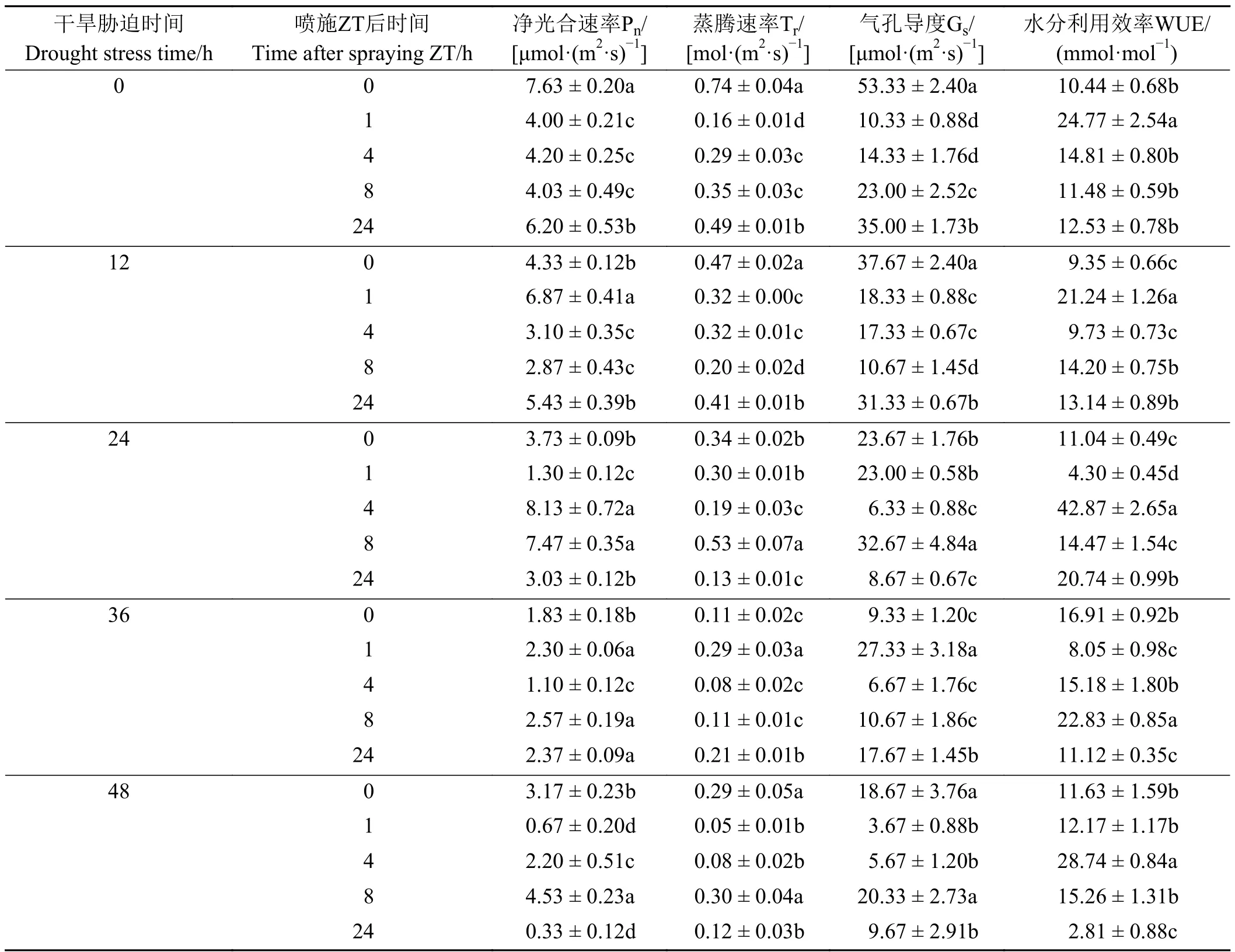
表3 喷施ZT 对巨菌草在不同干旱条件的不同时段净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)的影响Table 3 Effects of Pn、Tr、Gs and WUE of giant juncao sprayed with zeatin at different periods of different drought conditions
3 讨论与结论
植物处于干旱环境中,通过调节光合速率、光合作用运转机制及光合作用途径等方式,更好地适应干旱环境。但长时间处于干旱环境下植物会进一步关闭气孔,严重阻碍气体交换,抑制光合作用,从而影响植物生长发育。叶片是植物进行光合作用、蒸腾作用的主要器官,也是感应外界环境变化的敏感器官[32-33]。气孔是植物与外界进行水气交换的通道,其大小、数量、密度等均会对植物的光合作用与蒸腾作用产生影响[34]。干旱胁迫会导致植物关闭气孔,Gs下降,减弱植物的光合作用,导致植物Pn下降,进而引起Tr的下降。植物的光合作用对干旱环境较敏感,主要是通过Pn、Tr和Gs等指标来反映[35]。而WUE 为Pn与Tr的比值,也是常用来评价干旱环境下植物生长的综合性指标之一。在干旱胁迫处理下,如果Pn下降的幅度小于Tr,WUE 则会增加,反之则减少。
本研究中未喷施植物生长调节剂的巨菌草在干旱胁迫初期Pn、Tr、Gs均有短暂的上升趋势,说明轻度的干旱胁迫可能有利于刺激巨菌草的生长。叶片Gs的上升,使Tr上升,同时外界进入叶片的CO2量增加,从而Pn上升,干旱胁迫初期Gs的短暂上升是导致光合速率上升的主要原因,此时促进巨菌草光合作用的因素主要是气孔因素。随着胁迫程度的加深,叶片出于自身的保护和适应外界环境,会关闭气孔,Gs下降,Tr与Pn也随之下降。当巨菌草叶片出现萎蔫、变黄时,巨菌草维持正常生长所需的水分得不到满足,严重影响其正常生理功能的进行,阻碍了巨菌草的生长。此时巨菌草不仅会进一步关闭气孔减少水分的散失,而且因为严重缺水导致叶片光合器官受到损伤,巨菌草光合作用能力大大降低。此时巨菌草的Pn和Tr会大幅度下降。而本研究中,WUE 总体呈下降趋势,但在胁迫36 h 到48 h 会小幅度的上升,可能此时巨菌草为了适应外部环境,加强了对水分的利用以维持自身的生理需求,但此时的WUE 仍显著低于对照。综上,干旱胁迫会严重降低巨菌草光合作用能力。
通过对干旱胁迫下的巨菌草喷施MeJA、IAA和ZT,巨菌草的生长得到一定的缓解。MeJA 可通过提高干旱胁迫下植物叶片的气孔导度和减轻植物光合器官受到的伤害等方面,提高光合作用。本研究中MeJA 在胁迫48 h 时对光合指标的影响较大。胁迫48 h 时,Pn、Tr、Gs和WUE 随着MeJA 浓度增 加 整 体 上 呈 峰 状,浓 度 为25 μmol·L-1时 影 响 最大。说明适宜浓度的外源MeJA 对巨菌草光合作用的缓解效果更好。而MeJA 在不同时段下对光合指标的影响也不同,本研究中喷施MeJA 后的8~24 h效果最佳。究其原因可能是MeJA 在刚喷施时可通过调节气孔运动、延缓叶绿素降解等方面来提高光合作用能力,喷施一段时间后通过增强抗氧化酶活性、脯氨酸含量等来减轻因细胞膜发生脂质过氧化而受到的伤害,进一步减轻干旱下光合器官所受的伤害来提高巨菌草的光合作用能力。
IAA 作为植物体内一种普遍存在的内源生长素,干旱胁迫会影响其在植物体内的合成和运输过程从而改变IAA 在植物体内的分布。Sakata 等[36]对拟 南 芥(Arabidopsis thaliana)喷 施10-7mol·L-1浓 度的IAA 抑制了干旱对雄蕊和花粉的损伤,在大麦(Hordeum vulgare)花 期 外 源 喷 施10-6、 10-5、 10-4mol·L-1浓度的IAA 能够增加成熟花粉粒,进而提高大麦产量。郑艳冰等[37]对玉米(Zea mays)种子喷施不同浓度的IAA,发现30 mg·L-1的IAA 对玉米种子萌发和幼苗生长影响显著。李欣欣等[38]对大豆幼苗(Glycine max)喷施低浓度IAA,促进了大豆主根的伸长生长及侧根的发育。综上,外源喷施IAA 可以促进植物提前发育成熟,进而减少因干旱胁迫而产生的伤害。本研究中,干旱胁迫48 h,喷施510 μmol·L-1的外源IAA 后,巨菌草幼苗Pn、Tr和Gs均明显高于对照,而630 μmol·L-1处理下对Gs、Tr表现出抑制作用。说明IAA 的作用具有两重性,低浓度时促进,高浓度时抑制。此外,IAA 并不是通过单一途径参与植物干旱胁迫,而是通过直接或间接的方式与乙烯(ethylene)、ABA、水杨酸(salicylic acid,SA)等激素通路相互作用,形成复杂的调控网络[21];范晓荣和沈其荣等[39]研究发现ABA 和IAA 可同时参与控制水稻气孔的开闭。本研究中,IAA 对巨菌草光合指标影响的最佳时段为喷施后的1~8 h。究其原因可能是喷施IAA 后,影响了内源IAA 的合成和运输,进而改变其在巨菌草体内的分布,通过IAA 信号转导过程影响下游基因做出应对干旱的改变。此外,IAA 可以与ABA 等内源激素共同参与调控巨菌草对高温的响应,从而提高巨菌草的光合作用能力。
ZT 作为植物中常见的细胞分裂素,通过抑制生物膜电位,使植物表现出对高温环境、水分缺失等条件下的适应性。ZT 还能延缓叶绿素的降解,减慢植物呼吸作用,从而延缓植株衰老。已有研究表明ZT 能显著增强高羊茅(Festuca arundinacea)和黑麦草的抗旱性[40]。本研究中,干旱胁迫48 h,喷施6 μmol·L-1的 外 源ZT 后,巨 菌 草 幼 苗Pn、Tr、Gs和WUE 均明显高于对照,且在喷施ZT 后的1~8 h 影响最佳。究其原因可能是,ZT 作为常见的植物内源激素,可以促进巨菌草幼苗的渗透调节作用,使细胞的细胞膜在干旱下维持正常的渗透压。ZT 还可以对脯氨酸、MDA 的含量产生一定影响。外援喷施ZT 可以提高脯氨酸含量,脯氨酸含量的上升一方面可以降低细胞水势从而增强巨菌草的吸水能力,另一方面可以减少细胞膜发生脂质过氧化,减少过氧化产物MDA 的生成,从而减轻干旱对细胞膜的氧化损伤。此外ZT 还可以提高光系统Ⅰ、Ⅱ的电子传递能力[41],延缓体内叶绿素的降解,减缓植物呼吸作用,从而提高巨菌草在干旱下的光合作用能力。
综上所述,干旱胁迫会严重影响巨菌草的光合指标,阻碍巨菌草的正常生长,外在表现为叶片枯黄、萎蔫;内部表现为Pn、Tr、Gs和WUE 均显著降低。外源喷施MeJA、IAA、ZT 对干旱胁迫下巨菌草的Pn、Tr、Gs和WUE 具有调节作用,但不同浓度影响不同,且在不同胁迫程度不同时段影响也不同。本研究中,MeJA、IAA、ZT 对巨菌草光合指标影响的最佳浓度依次为25、510、6 μmol·L-1。MeJA 的最佳影响时段为喷施后的8~24 h,IAA 和ZT 为喷施后的1~8 h。本研究揭示了MeJA、IAA、ZT 如何影响干旱胁迫下巨菌草的光合指标,但可以发现MeJA、IAA、ZT 的调节作用会因其浓度、干旱胁迫程度和喷施的时段而不同,下一步研究可在本研究的最佳浓度和最佳时段的基础上设立浓度和时间梯度。此外可通过测量如叶绿素含量、胞间CO2浓度等指标进一步阐述MeJA、IAA、ZT 如何影响干旱下巨菌草的光合指标。而本研究尚未揭示MeJA、IAA、ZT 如何对巨菌草生理活动进行调控,因此需测定SOD、POD、CAT 等活性指标,以更加全面地揭示MeJA、IAA、ZT 对干旱下巨菌草生长的作用机理。

