有机酸活化硅酸盐矿物的研究进展
张晨阳 张志杰 林少敏 钟明峰 余亚玲 徐威

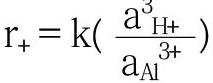
摘 要:活化硅酸盐矿物原料能够降低陶瓷的烧成温度,从而减少能耗。受植物吸硅现象启发,有机酸活化硅酸盐矿物被关注。本文总结了活化硅酸盐矿物研究现状及其机理,并综述了单一低分子量有机酸溶出硅酸盐矿物中骨架元素的机制,最后介绍本课题组相关研究成果,并对有机酸活化硅酸盐矿物的今后研究作了展望。
关键词:低分子量;有机酸;活化;硅酸盐矿物;
1 引 言
以陶瓷、水泥、玻璃为代表的建材行业是国民经济的支柱产业之一,对我国社会经济的快速发展起到了重要的支撑作用,然而该行业普遍存在能耗高、污染重等问题。在我国,工业部门煤炭消耗中,建材工业煤炭消耗占7.4%,废气排放占全国工业废气排放总量的18%[1-2]。铝硅酸盐矿物是建材行业的主要原料,铝硅酸盐矿物以硅氧四面体、铝氧四面体、铝氧八面体为结构单元[3],晶体结构中Si-O、Al-O键键能高达444.0 kJ/mol、317~402 kJ/mol,因此铝硅酸盐矿物在参与化学反应过程中通常需要在高温环境下打开Si-O和Al-O键,这是建材行业高能耗的内在原因。以陶瓷行业为例,在陶瓷生产中,平均能耗约为20000 kJ/kg,其中60%以上的能耗来自于烧成工序;据热平衡计算,陶瓷烧成温度从1400℃降低到1300℃,单位产品能耗可降低20%;从1300℃降到1200℃,单位产品能耗可降低11%以上[4]。因此降低烧成温度是节能减排的关键。
陶瓷材料的性能在很大程度上由其显微结构决定,而陶瓷显微结构形成过程中发生的主要物理化学变化是硅酸盐矿物的熔融、玻璃相和莫来石的生成、气孔的排除等。其中最核心的过程是玻璃相和莫来石的形成。通过配方的优化很容易生成玻璃相,因此降低陶瓷烧成温度的核心问题是如何在较低的温度下大量生成莫来石。活化硅酸盐原料是降低莫来石及其他建材产品烧成温度的常用方法之一,活化后的原料可有效降低硅酸盐结构完整性和有序性,使原料具有较高的反应活性。
2 活化硅酸盐矿物现状
硅酸盐矿物的活化手段主要有机械活化、热活化和酸活化。机械活化一般是利用机械能,通过微粒间碰撞等物理作用来破坏矿物中Si-O键,增加矿物的比表面积和表面缺陷,提高矿物的反应能力[9-10]。朱明曾报道利用行星球磨机粉磨水泥原料后,原料中晶体发生了晶格畸变、化学键断裂等过程,从而使得反应活性增大[11]。热活化则一般是在低于烧成温度下,对矿物原料进行预烧,使矿物由结构稳定且有序的晶态转变为长程无序的无定形态,从而增强原料的反应活性[12-13]。闫伟曾报道层状硅酸盐矿物绢云母热活化后,微观结构坍塌,晶格也产生了畸变,反应活性大大增强[14]。综上可知,机械活化和热活化对矿物具有一定的破坏效果,但两者能耗大,对设备要求高。
酸活化分无机酸活化和有机酸活化,研究表明高浓度无机酸能有效溶出硅酸盐矿物中金属阳离子,使矿物反应活性增加。无机酸对硅酸盐矿物的作用主要通过高浓度的氢离子来完成[15-19]。Steudel等曾报道,在80℃下,高浓度无机酸(1.0 M,5.0 M和10.0 M)对膨胀性黏土的溶解作用,矿物八面体中的Mg、Fe和Al元素通过质子交换作用被溶出,从而对矿物的结构产生了破坏[16]。Nguetnkam等研究发现,在盐酸和硫酸作用下,硅酸盐矿物的晶体结构中Al含量减少,然而硅酸盐矿物中Si的相对含量上升,表明无机酸对于Si的溶出效果有限,活化效果不明显[20]。无机酸活化过程中,所需浓度太大,废液处理繁琐,对环境不友好。因此,我们将目光投向了低分子量有機酸,一种在自然界广泛存在且易分解的有机酸,同时,对矿物具有一定的溶解作用。
生物学研究显示,生物为了从土壤中摄取维持生命生长和繁衍所需的矿物质,在岩石圈同生物圈的交界处时刻发生土壤矿物的溶解过程,在此过程中,低分子量有机酸发挥重要的作用。在地球化学研究中,人们一般选草酸、柠檬酸、乙酸、苹果酸等有机酸,来模拟自然界中硅酸盐矿物的溶解过程[21-26]。有机酸溶解硅酸盐矿物机理如下,一方面,氢离子通过质子交换作用,将矿物中层间或是孔洞中的金属阳离子置换出,即在酸性条件下,H+和矿物表面阳离子(Na+、K+、Ca2+)进行交换反应(以伊利石为例,见图1);另一方面,有机酸根阴离子吸附在矿物晶体中阳离子反应位点,通过极化作用将晶格中的阳离子溶出,致使矿物晶体结构被破坏[21]。有机酸根存在作用下,矿物的溶解速率存在下式的关系:
其中Rt表示矿物总溶出速率,而RH和RL分别表示氢离子促进溶出速率和有机酸根促进溶出速率[22]。
上述分析可见,有机酸具备破坏硅酸盐结构的能力,因此也具备活化硅酸盐的潜力。有趣的是,自然界中存在一类植物,能够在常温常压下从土壤中吸收大量的硅元素维持生命成长。
3 植物高效吸硅现象
硅在地壳中丰度为28.80%,仅次于氧,在生物地球化学过程中起着重要作用,每年仅陆地植物需从土壤中吸收的硅达到1.68×109~5.60×109 t[27]。硅在植物界的含量与分布是极不均匀的,不同物种间差别很大[28-32]。一般禾本科草类干物质中硅的浓度为豆科以及其他双子叶植物的10~20倍[27]。水稻是典型的喜硅植物,硅酸含量占叶片干重的15%~30%,稻秸秆灰分也含有10%~20%的硅[33-34]。每生产1000 kg稻谷大约要从土壤中吸收130 kg SiO2,按照现在亩产水稻的水平计算,每亩(667 m2)水稻一个生长季可吸收SiO2约65~130 kg[35]。
虽然土壤中二氧化硅占比高达50%以上,然而多数硅以难溶的矿物或化合物形式存在于土壤中,不能被植物吸收。同样以水稻为例,只有单硅酸形式的硅才能被吸收。然而,计算表明,土壤中的单硅酸远远不能满足水稻生长所需。按水稻生产浸水0.15 m计,每亩水稻田含水量约100 m3,自然界中发现的最高浓度的冷水中水溶性硅离子浓度约为10.84 mg/L,以此数计,每100 m3水中最高的水溶性硅含量约为1084 g[36]。此外,被土壤胶体所吸附的单硅酸也可以被植物吸收,水稻土中能被植物吸收的有效硅(以SiO2计)临界值为100 mg/kg土,高于此值水稻可以正常生长。假设水稻生产过程中,耕作层深度为0.15 m,耕作层土壤总体积约为100 m3/亩,水稻土容重约为1.1~1.4 g/cm3,以临界值计,耕作层内有效硅总量为11~14 kg,只能达到水稻吸硅总量的10%左右[37]。此外,水稻生长季中硅的吸收速度并非恒定,在两周的抽穗期间内,吸收的硅约占吸硅总量的60%以上,即此期间内土壤SiO2的供给必须大于470 mg/kg,远高于土壤有效硅含量[38]。可见,在水稻生长季,特别是抽穗期间,在土壤中的可溶性硅酸远远无法满足水稻需求的情形下,难溶性硅(主要为硅酸盐矿物)必然经历了大量且快速的分解,Si-O键被打断,以提供足够多的单硅酸,才能保证水稻的正常生长。
水稻根部微区环境被认为对土壤硅的溶出起主要作用[39-41]。在水稻植株生长期间,根系会分泌大量混合有机酸,同时在其根系周围发现了大量的硅酸运输蛋白质,将溶液中的硅酸运输至叶片等部位的细胞中脱水以无定形的二氧化硅形式存储;这个运输过程极大的破坏了溶液中的矿物溶解平衡,促进了矿物的溶解[42-48]。而在矿物中硅的溶出过程中,低分子量有机酸起着至关重要的作用。
4 低分子量有机酸溶解硅酸盐矿物的研究现状
低分子量有机酸主要是指分子量小于500的含羧基的一类有机物(R-COOH),按羧基个数可分为单羧基、双羧基和多羧基。小麦、蚕豆、大豆、红树科秋茄等植物根系在生长期会大量分泌柠檬酸、乳酸、草酸、苹果酸、乙酸等多种低分子量有机酸[49-51],在土壤表生环境中,有机酸存量丰富,其与土壤中矿物的作用影响着地球表层元素的循环方向[52]。
低分子量有机酸的化学性质主要由其羧基所决定,羧基(-COOH)是由羰基(-CO-)和羟基(-OH)结合而成的基团。羧酸根离子中每个氧原子都含有孤对电子,因此两个氧原子均可进入金属离子的空轨道与金属离子进行配位生成配合物,理论上能够同硅酸盐矿物中阳离子(Si、Al、Mg等)形成络合物,从而促进矿物溶解[53-54]。
有关有机酸溶解硅酸盐矿物的研究主要集中在单一有机酸与石英、长石和高岭石的作用上,通常采用Si和Al的溶出浓度大小来衡量低分子量有机酸对矿物的溶解程度。Blake等在研究石英在70℃、pH=6条件下的溶出速率试验中,当柠檬酸根浓度分别为2和10 mM时,溶液中Si的溶出浓度分别为0.52和0.64 mM[23]。Si的溶出浓度随着有机酸根阴离子浓度增加而增大,然而即使在较高的反应温度下,Si的溶出浓度仍然小于1 mM。
Stillings等曾报道过,将中长石在pH=3、1 mM草酸作用下,其Si的溶出速率随着草酸的浓度(0、1、2、4、8 mM)增加而增加,分别为2.40 × 10-15、2.95 × 10-15、3.80 × 10-15、4.17 × 10-15、5.13 × 10-15 mol(cm-2·s-1);pH=3.12~3.32,1 mM草酸作用2739 h下,微斜长石和钠长石的溶出速率分别为8.28 × 10-16 mol(cm-2·s-1)和2.12 × 10-15 mol/(cm-2·s-1) [55]。White和Blum曾报道在5℃、20℃和35℃时,倍长石在1 mM的近中性(pH=6)草酸盐溶液中,溶解速率分别为2.77×10-16 mol(cm-2·s-1)、5.86×10-16 mol(cm-2·s-1)、8.84×10-16 mol(cm-2·s-1) [56],随着温度升高长石的溶出速率也增加。然而另有学者报道即使在80℃、1824 h作用下,固液比为60,柠檬酸根浓度分别为0、0.5、3、和10 mM时,钠长石中Si的溶出浓度分别为0.17、0.25、0.39和0.48 mM,Si的溶出浓度仍然小于1 mM,矿物溶解效率较小[23]。
Kong等研究了常温下不同浓度的草酸和柠檬酸对层状硅酸盐矿物高岭石的溶解作用,在浓度分别为0、0.025、0.05、0.10、0.25和0.50 M的草酸和柠檬酸作用下,高岭石中Si的溶出浓度随着有机酸浓度的增加而增大,溶出浓度最高可达1.79 mM[57]。Cama等在研究高岭石在草酸盐中溶解速率时,报道了在25℃、pH=2.82时Si、Al溶解速率为1.1×10-13 mol(cm-2·s-1)和1.3×10-13 mol(cm-2·s-1);当pH为3.36时Si、Al的溶出速率为6.5×10-13 mol(cm-2·s-1)和6.9×10-13 mol(cm-2·s-1)[24]。
结合Si和Al的溶出速率,Welch 和 Ullman给出了架状硅酸盐结构矿物(长石和石英)溶出速率同其Al/(Si+Al)经验方程:
nH和kH是同Al/(Si+Al)有关的量。作者认为有机酸通过质子作用,进攻铝硅酸盐矿物表面,促进矿物的溶解,其中Al为优先反应位点[58]。
有的学者认为Al占比较大的铝硅酸盐在低分子量有机酸作用下,溶解速率大大提高,可能同Al溶出机理有关[59]。在质子单独作用下,矿物溶出可以用以下公式来表示:
Al< 表示矿物表面的Al,P˙表示矿物表面附近富含Si的前驱物质。
根据实验中Al的溶出数据进行分析,发现Al溶出速率符合经验公式 :
式中 aH+和aAl3+分别表示溶液中氢离子和铝离子的活度,分别与溶液中H+和Al3+成正比[60]。这表明随着反应时间的增加,矿物中铝离子浓度增加,会导致矿物溶解速率降低,即矿物中Al溶出存在一个极限,这就是通常所说的Al抑制作用。在低分子量有机酸作用下,有机酸根阴离子能够络合矿物中的Al,Al抑制作用大大减弱甚至消失,从而矿物溶解速率增加。
有文章曾报道,根据溶出Si的数据进行推测,配合物Si/Al-有机配体促进矿物溶解的机制可能有:(1)降低破坏矿物表面Si/Al-O键需要的能量,降低了反应所需的活化能;(2)提高了过渡态配合物的分解速率;(3)形成的表面配合物改变了Si/Al-OH键的几何形状,更容易使得矿物溶解[61-63]。
根据文献调查可得出以下结论:(1)相同氢离子浓度下,相比于无机酸,有机酸作用下矿物骨架元素硅的溶出浓度高出很多;(2)不同硅酸鹽矿物在不同低分子量有机酸下硅的溶出速率不同;(3)硅酸盐矿物Si和Al的溶出速率与有机酸种类、浓度之间的关系、有机酸中羧基含量与矿物溶解速度的关联仍存在较大争议;(4)在实验室条件下,有机酸对硅酸盐矿物的溶解作用极其微弱,阳离子溶出量较少,只有在地质时间尺度下(>10万年)矿物的微观结构才会产生显著变化;(5)有机酸根阴离子能够促进矿物中Si和Al的溶出,但是无论是改变矿物组成、反应温度、有机酸浓度以及pH值,Si和Al的溶出浓度并未显著升高,尤其是Si[56-58, 64-67]。
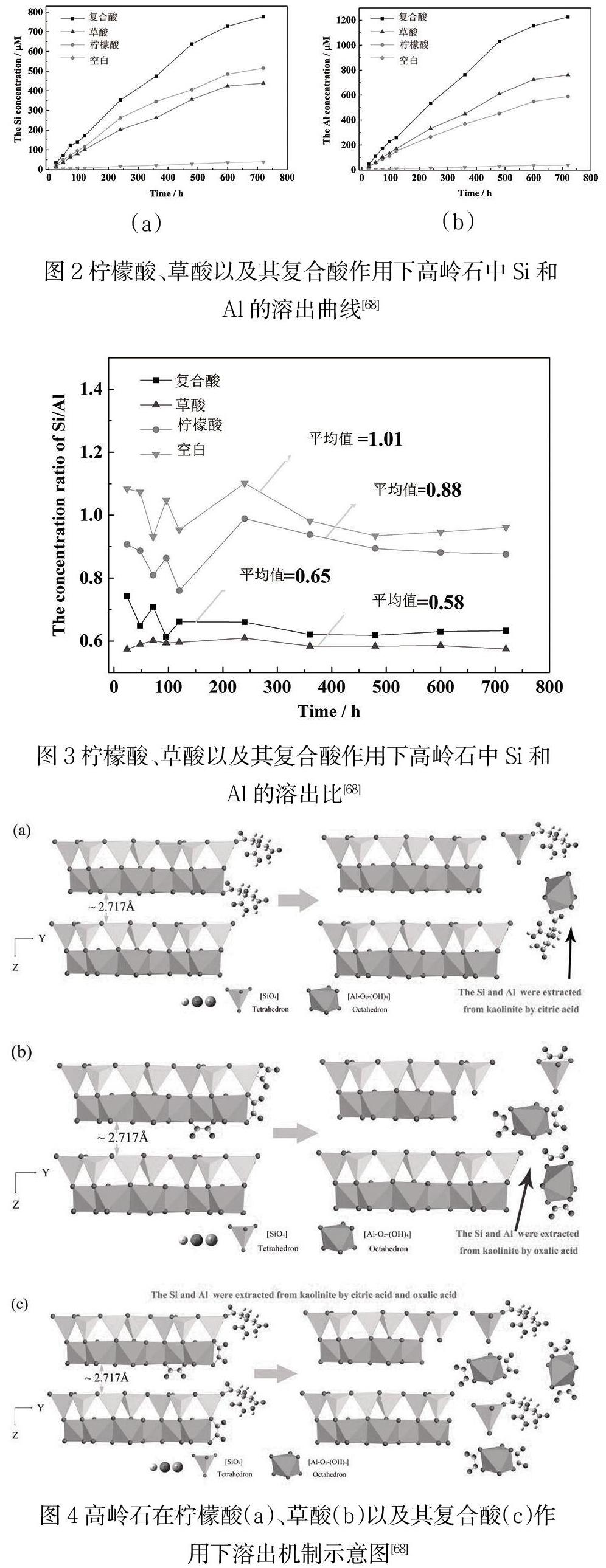
本課题曾研究柠檬酸和草酸及两者的复合酸活化高岭石的机制[68],得到了柠檬酸、草酸以及其复合酸作用下高岭石中Si和Al的溶出曲线,并分析了其机理。
对有机酸溶液中的Si和Al的溶出情况进行分析发现,在低分子量复合有机酸作用下,Si和Al的溶出浓度大于单一酸作用下的溶出浓度。单一酸作用时,草酸溶出Al的速率大于柠檬酸,而柠檬酸溶出Si的速率大于草酸(图2和图3)。有机酸作用下Si和Al的溶出数据同一级动力学方程(Ct=a(1-exp(-kt))拟合较好,高岭石中Si和Al的溶出机制为表面反应机制。
对活化前后的高岭石分析,发现有机酸处理后的高岭石结晶度下降,其大小顺序如下:混合酸<草酸<柠檬酸<空白样。可以发现草酸处理的高岭石I(020)/I(001)值最大,其次是混合酸,最小是柠檬酸。草酸比柠檬酸更容易沿着c轴进攻高岭石,而柠檬酸比草酸更容易沿着a、b轴进攻。复合有机酸作用下,草酸溶出Al的速率比柠檬酸快,而柠檬酸溶出Si的速率比草酸快,两者协同作用,高岭石晶体片层在c轴和a、b轴方向均遭到一定程度的破坏了(图4),使得高岭石中Si和Al的溶出速率最大,结晶度最小,比表面积最大。
根据以上研究可以发现,复合低分子量有机酸作用于高岭石,能够高效溶出矿物晶体结构的中的Si和Al,破坏高岭石晶体结构,提高其反应活性。
5 结语及展望
有机酸活化硅酸盐矿物存在氢离子和有机酸根阴离子的双重促进作用,因此相同浓度酸条件下,有机酸溶出的Si和Al多于无机酸。然而,单一有机酸溶解硅酸盐矿物的试验中,溶出硅最多的是采用20 mM的草酸溶液,在液固比为200时,浸泡高岭石1600 h,溶液中硅离子含量为3 mM[25],此溶出量远远小于水稻田中有机酸的溶出Si。因此,单一有机酸的作用难以解释水稻根系附近硅酸盐的快速溶解。水稻生长过程中,其根区分泌的有机酸包括:苹果酸8.04 mg,酒石酸6 mg,琥珀酸4.25 mg,柠檬酸4.54 mg,乳酸0.72 mg[69]。而且土壤微生物代谢产物主要包括柠檬酸、草酸、苹果酸、酒石酸等[70-71]。因此可以认为水稻根系附近存在较高浓度的混合有机酸,即混合有机酸的协同作用起到了1+1>2的效果,促进硅酸盐矿物中Si和Al的溶出,有利于破坏硅酸盐矿物结构,提高硅酸盐矿物的活性。相比于单一有机酸,复合有机酸高效活化硅酸盐矿物应是今后研究的一个重要方向,其活化产物在陶瓷产业中也会有广阔的应用前景。
参考文献
[1] Madlool N., Saidur R., Hossain M., et al. A critical review on energy use and savings in the cement industries[J]. Renewable and Sustainable Energy Reviews, 2011,15(4): 2042-2060.
[2] 董剑, 王迪, 陈施华,等. 我国水泥工业产能及能耗现状浅析[J]. 新世纪水泥导报, 2016, 22(2):1-6.
[3] 张志杰. 材料物理化学[M]. 第二版. 北京:化学工业出版社, 2019.
[4] 周露亮, 汪和平, 余琴仙. 日用陶瓷烧成能耗状况与节能分析[J]. 中国陶瓷, 2010(1):57-59.
[5] Belver, C., Ba?ares, M.A., Vicente M.A., et al. Chemical Activation of a Kaolinite under Acid and Alkaline Conditions. Chemistry of Materials, 2002, 14: 2033-2043.
[6] Goldberg M.A., Smirnov V.V., Titov D.D., et al. Effect of mechanical activation of powders on the sintering of calcium carbonate-based ceramic materials containing carbonated hydroxyapatite[J]. Doklady Chemistry, 2014, 456(1):79-82.
[7] Panda A.K., Mishra B.G., Mishra D.K., et al. Effect of sulphuric acid treatment on the physico-chemical characteristics of kaolin clay. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2010, 363:98-104.
[8] San A.G., Castelló R., Martín M.A., et al. Acid activation of mechanically and thermally modified kaolins. Materials Research Bulletin, 2009, 44:2103-2111.
[9] Prajitno M.Y. , Harbottle D. , Hondow N., et al.. The effect of pre-activation and milling on improving natural clinoptilolite for ion exchange of cesium and strontium. Journal of Environmental Chemical Engineering, 2020, 8(1):102991.
[10] Wang C, Hu H, Yan S, et al. Activating Bi2O3 by ball milling to induce efficiently oxygen vacancy for incorporating iodide anions to form BiOI. Chemical Physics, 2020, 533:110739.
[11] 朱明. 水泥基材料矿相粉磨机械力化学效应与分形理论研究[D]. 武汉: 武汉理工大学, 2005
[12] 孙德文, 李彦锋, 张博, 等. 苏州高岭土的热活化及其表征研究[J]. 功能材料, 2009, (40): 510-513
[13] 钟声亮, 张迈生, 苏锵. 微波热法煅烧高岭土的机理研究[J]. 中山大学学报, 2005, 44(3): 71-74
[14] 闫伟. 绢云母活化处理及对其结构和性能的影响研究[D]. 北京: 中国地质大学, 2008
[15] Castillo L.A., Barbosa S.E., Maiza P., et al. Surface modifications of talcs. Effects of inorganic and organic acid treatments[J]. Journal of Materials Science, 2011, 46(8):2578-2586.
[16] Steudel A., Batenburg L.F., Fischer H.R., et al. Alteration of swelling clay minerals by acid activation[J]. Applied Clay Science, 2009, (44): 95-104.
[17] Steudel A., Batenburg L.F., Fischer H.R., et al. Alteration of swelling clay minerals by acid activation[J]. Applied Clay Science, 2009, 44: 105-115
[18] 欧延, 林敬东, 陈文瑞, 等. 酸改性高岭土的结构与性能研究[J]. 厦门大学学报, 2004, 43(2): 272-274
[19] 喻新平. 盐酸浸取高岭土中氧化铝的研究[J]. 矿产综合利用, 2002, (2): 10-12
[20] Nguetnkam J.P., Kamga R., Villieras F., et al. Alteration of cameroonian clays under acid treatment. Comparison with industrial adsorbents[J]. Applied Clay Science, 2011, (52): 122-132
[21] Golubev S.V., Bauer A., Pokrovsky O.S.. Effect of pH and organic ligands on the kinetics of smectite dissolution at 25°C[J]. Geochimica Et Cosmochimica Acta, 2006, 70(17):4436-4451.
[22] Drever J.I. and Stillings L.L. The role of organic acids in mineral weathering[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 1997, 120(1-3):167-181.
[23] Blake R.E. and Walter L.M. Kinetics of feldspar and quartz dissolution at 70–80°C and near-neutral pH: effects of organic acids and NaCl[J]. Geochimica Et Cosmochimica Acta, 1999, 63(13–14):2043-2059.
[24] Cama J.and Ganor J.. The effects of organic acids on the dissolution of silicate minerals: A case study of oxalate catalysis of kaolinite dissolution[J]. Geochimica Et Cosmochimica Acta, 2006, 70(9):2191-2209.
[25] Wang X., Li Q., Hu H., et al. Dissolution of kaolinite induced by citric, oxalic, and malic acids.[J]. Journal of Colloid & Interface Science, 2005, 290(2):481-488.
[26] 張永旺, 曾溅辉, 郭建宇. 低温条件下长石溶解模拟实验研究[J]. 地质论评, 2009, 55(1):134-142.
[27] 介冬梅, 王升忠, 卜兆君. 东北地区芦苇植硅体对时空变化的响应机制[M]. 科学出版社, 2015.
[28] Ehrlich H., Demadis K.D., Pokrovsky O.S., et al. Modern Views on Desilicification: Biosilica and Abiotic Silica Dissolution in Natural and Artificial Environments[J]. Chemical Reviews, 2010, 110(8):4656-89.
[29] Stuve G.A., De silca in Plantis Nonnullis, Dissertation Berlin,1835.
[30] 派潘诺. 植硅石分析:在考古学和地质学中的应用[M]. 北京大学出版社, 1994.
[31] Garrison E. Techniques for Archaeo logical Sediments and Soils[M]. Techniques in Archaeological Geology. Springer International Publishing, 2016.
[32] Keutmann I C, Melzer B, Seidel R, et al. Review: The Functions of Phytoliths in Land Plants[M]. Evolution of Lightweight Structures. Springer Netherlands, 2015.
[33] 马同生. 我国水稻土硅素养分与硅肥施用研究现况[J]. 土壤学进展, 1990(4):1-5.
[34] 臧惠林, 张效朴, 何电源. 我国南方水稻土供硅能力的研究[J]. 土壤学报, 1982(2):131-140.
[35] 唐晓东, 侯捷, 屈明,等. 我国水稻土的硅素营养研究[J]. 中国土壤与肥料, 2008, 2008(1):1-5.
[36] Dürr H.H., Meybeck M., Hartmann J., et al. Global spatial distribution of natural riverine silica inputs to the coastal zone[J]. Biogeosciences, 2011, 8(3):597-620.
[37] Tamai, K. and Jian M.A., Characterization of silicon uptake by rice roots. Commentary[J]. New Phytologist, 2003, 158: 431-436.
[38] Cornelis J.T., Delvaux B., Georg R.B., et al. Tracing the origin of dissolved silicon transferred from various soil-plant systems towards rivers: a review[J]. Biogeosciences Discussions, 2010, 7(4):5873-5930.
[39] Ma J.F., Mitani N., Nagao S., et al. Characterization of the silicon uptake system and molecular mapping of the silicon transporter gene in rice[J]. Plant Physiology, 2004, 136(2):3284-3289.
[40]Ma J.F., Silicon Transporters in Higher Plants[M]. MIPs and Their Role in the Exchange of Metalloids. Springer New York, 2010:99-109.
[41] 初敬華. 植物体内的硅及硅酸体[J]. 生物学教学, 2003, 28(3):5-7.
[42] 高会, 李家兵, 何涛,等. 闽江河口典型植被群落带及交错带植物-土壤体系中硅素的分布特征[J]. 水土保持学报, 2017, 31(1):279-285.
[43] 华海霞, 梁永超, 娄运生,等. 水稻硅吸收动力学参数固定方法的研究[J]. 植物营养与肥料学报, 2006, 12(3):358-362.
[44] 华海霞. 4种植物对硅的吸收动力学[J]. 江苏农业科学, 2015, 43(11):440-442.
[45] 贺从武. 水稻(Oryza sativa)细胞壁上硅—半纤维素复合物存在的化学证据及功能研究[D]. 华中农业大学, 2015.
[46] 史新慧, 覃闯登, 宋建兰,等. 水稻及其他禾本科植物体内硅结合蛋白的免疫印迹检测[J]. 生物化学与生物物理进展, 2005, 32(4):371-376.
[47] 魏朝富, 谢德体, 郭碧花,等. 酸性水稻土上水稻对硅、钾、钙、镁的吸收及其动力学研究[J]. 植物营养与肥料学报, 2002, 8(4):452-457.
[48] 邢雪荣, 张蕾.植物的硅素营养研究综述[J]. 植物学报, 1998, 15(2):33-40.
[49] 卢豪良, 严重玲. 秋茄(Kandelia candel(L))根系分泌低分子量有机酸及其对重金属生物有效性的影响[J]. 生态学报, 2007, 27(10):4173-4181.
[50] 万敏, 周卫, 林葆. 不同镉积累类型小麦根际土壤低分子量有机酸与镉的生物积累[J]. 植物营养与肥料学报, 2003, 9(3):331-336.
[51] 肖靖秀, 郑毅, 汤利,等. 小麦-蚕豆间作对根系分泌低分子量有机酸的影响[J]. 应用生态学报, 2014, 25(6):1739-1744.
[52] 丁永祯, 李志安, 邹碧. 土壤低分子量有机酸及其生态功能[J]. 土壤, 2005, 37(3):243-250.
[53] 徐忠, 汪群慧, 江兆华. L-乳酸的制备及其应用的研究进展[J]. 化学与粘合, 2004, 25(4):000214-217.
[54] 伊玉娟. 甲酸配合物和螺噁嗪类化合物合成、结构及性质研究[D]. 天津大学, 2007.
[55] Stillings L.L., Drever J.I., Brantley S.L., et al. rates of feldspar dissolution at pH 3-7 with 0-8 m M, oxalic acid[J]. Chemical Geology, 1996, 132(1):79-89.
[56] White A.F., Blum A.E., Bullen T.D., et al. The effect of temperature on experimental and natural chemical weathering rates of granitoid rocks[J]. Geochimica Et Cosmochimica Acta, 1999, 63(19–20):3277-3291.
[57] Kong M., Huang L., Li L., et al. Effects of oxalic and citric acids on three clay minerals after incubation[J]. Applied Clay Science, 2014, 99(3):207-214.
[58] Welch S.A. and Ullman W.J. Feldspar dissolution in acidic and organic solutions: Compositional and pH dependence of dissolution rate[J]. Geochimica Et Cosmochimica Acta, 1996, 60(16):2939-2948.
[59] 易玲娜. 有機酸活化钾长石的机制及其应用研究[D]. 华南理工大学, 2015.
[60] Oelkers E.H. and Schott J. Does organic acid adsorption affect alkali-feldspar dissolution rates[J]. Chemical Geology, 1998, 151(1-4):235-245.
[61] Chen C.P. and Mei B.W. Water phase synthesis of SiO2/oxalate complex and its spectral evidences[J]. Journal of Jianghan Petroleum Institute, 2004, 26(2):6-8.
[62] Marley N.A., Bennett P., Janecky D.R., et al. Spectroscopic evidence for organic diacid complexation with dissolved silica in aqueous systems. I: Oxalic acid[J]. Organic Geochemistry, 2016, 14(5):525-528.
[63] hman L.O., Nordin A., Sj?berg S., et al. Equilibrium and Structural Studies of Silicon(IV) and Aluminium(III) in Aqueous Solution. 28. Formation of Soluble Silicic Acid--Ligand Complexes as Studied by Potentiometric and Solubility Measurements[J]. Acta Chemica Scandinavica, 1991, 45:335-341.
[64] Bennett P. and Siegel D.I. Increased solubility of quartz in water due to complexing by organic compounds[J]. Nature, 1987, 326(6114):684-686.
[65] Kong M., Huang L., Li L., et al. Effects of oxalic and citric acids on three clay minerals after incubation[J]. Applied Clay Science, 2014, 99(3):207-214.
[66] Cama J., Ganor J.. The effects of organic acids on the dissolution of silicate minerals: A case study of oxalate catalysis of kaolinite dissolution[J]. Geochimica Et Cosmochimica Acta, 2006, 70(9):2191-2209.
[67] Wang X., Li Q., Hu H., et al. Dissolution of kaolinite induced by citric, oxalic, and malic acids.[J]. Journal of Colloid & Interface Science, 2005, 290(2):481-488.
[68] Lin S.M., Yu Y.L., Zhang Z.J., et al. Chen-Yang ZhangThe synergistic mechanisms of citric acid and oxalic acid on the rapid dissolution of kaolinite[J]. Applied Clay Science, 196 (2020):105756.
[69] 杨建昌, 常二华, 张文杰,等. 根系化学讯号与稻米品质的关系[J]. 中国农业科学, 2006, 39(1):38-47.
[70] 沈仁芳. 铝在土壤-植物中的行为及植物的适应机制[M]. 北京:科学出版社, 2008.
[71] Eldhuset T.D., Low molecular weight organic acids in root exudates and soil solutions[J]. Microscopy & Microanalysis, 2006, 15(1):432.

