卵形鲳JunB基因克隆及其胚胎组织表达分析
潘传燕 余艳玲 罗洪林 冯鹏霏 宋漫玲 肖蕊 张永德

卵形鯧JunB基因克隆及其胚胎组织表达分析
潘传燕,余艳玲,罗洪林,冯鹏霏,宋漫玲,肖 蕊,张永德*
(广西水产科学研究院/广西水产遗传育种与健康养殖重点实验室,南宁 530021)
摘要:【目的】明确卵形鲳鲹(Trachinotus ovatus)JunB基因(ToJunB)在胚胎发育过程中的表达规律,为揭示JunB基因在鱼类胚胎发育过程中的作用机制打下基础。【方法】采用RT-PCR扩增ToJunB基因编码区(CDS)序列,通过ProtParam、NetSurfP 2.0、TMHMM、SignalP、PSORT及NetNGlyc 1.0等在线软件进行生物信息学分析,并采用荧光定量PCR检测ToJunB基因在卵形鲳鲹17个胚胎发育时期(受精卵、2-细胞期、8-细胞期、16-细胞期、32-细胞期、64-细胞期、多细胞期、高囊胚期、原肠早期、原肠中期、原肠末期、胚胎形成期、眼囊期、耳囊期、心脏跳动期、晶体出现期和初孵仔期)的表达情况。【结果】克隆获得的ToJunB基因(1777 bp)包含344 bp的5'端非编码区(5'-UTR)、954 bp的开放阅读框(ORF)及479 bp的3'端非编码区(3'-UTR),共编码318个氨基酸残基;其编码蛋白分子量为35.03 kD,理论等电点(pI)为8.26,呈碱性;总平均疏水指数(GRAVY)为-0.567,为亲水性蛋白。ToJunB蛋白无跨膜结构和信号肽,主要定位于细胞核,属于非分泌型蛋白,在第39、129和168位氨基酸处各存在1个潜在的糖基化位点;其二级结构中α-螺旋占35.67%、延伸链占14.33%、无规则卷曲占50.00%。基于JunB氨基酸序列相似性构建的系统发育进化树显示,卵形鲳鲹与黄尾鰤的遗传距离最近,均隶属于鲈形目鲹科。ToJunB基因在胚胎发育前期(受精卵至原肠早期)的相对表达量较高,至原肠中期达最高值,在胚胎发育后期(原肠末期至初孵仔期)的相对表达量均较低,且ToJunB基因在受精卵至原肠中期共10个发育时期的相对表达量极显著高于胚胎发育后期的7个时期(P<0.01)。【结论】ToJunB基因在卵形鲳鲹胚胎受精卵至原肠早期的相对表达量较高,于原肠中期达最高值后迅速降低,原肠末期至初孵仔期的相对表达量均较低,说明JunB基因在卵形鲳鲹胚胎发育的细胞分裂和增殖过程中发挥重要作用。
关键词: 卵形鲳鯵;JunB基因;胚胎发育;生物信息学分析;表达规律
中图分类号: S965.331 文献标志码: A 文章编号:2095-1191(2021)11-3102-09
Cloning of JunB gene in Trachinotus ovatus and its
expression in embryonic tissues
PAN Chuan-yan, YU Yan-ling, LUO Hong-lin, FENG Peng-fei,
SONG Man-ling, XIAO Rui, ZHANG Yong-de*
(Guangxi Academy of Fishery Sciences/Guangxi Key Laboratory of Aquatic Genetic Breeding and
Healthy Aquaculture, Nanning 530021, China)
Abstract:【Objective】To explore the expression pattern of Trachinotus ovatus JunB gene(ToJunB) in embryonic development, and lay a foundation for exploring the mechanism of JunB on embryonic development process. 【Method】RT-PCR was used to amplify the encoding region(CDS) sequence of the ToJunB gene, and the bioinformatics analysis was carried out with online softwares such as ProtParam, NetSurfP 2.0, TMHMM, SignalP, PSORT and NetNGlyc 1.0. Real-time fluorescence quantitative PCR was used to detect the expression of ToJunB mRNA in 17 bryonic development stages of T. ovatus(zygote, 2-cell embryo, 8-cell embryo, 16-cell embryo, 32-cell embryo, 64-cell embryo, multicellular stage, blastula stage, early gastrula stage,gastrula stage, late gastrula stage,embryo formed stage, optic vesicle stage, otocyst vesicle stage, heart pulsation stage, formation of eye lens and hatching stage). 【Result】The ToJunB gene cloned from embryonic tissues of T. ovatus was 1777 bp in length, consisted of 344 bp 5' end non-coding region(5'-UTR), 954 bp open reading frame(ORF) and 479 bp 3' end non-coding region(3'-UTR), encoding 318 amino acid residues, its protein molecular weight was 35.03 kD, theoretical isoelectric point(pI) was 8.26, it was alkaline. The total ave-rage hydrophobic index(GRAVY) was -0.567, indicating that it belonged to hydrophilic protein. ToJunB protein had no transmembrane structure, no signal peptide sequence, and a potential glycosylation site at amino acid 39, 129, 168. The ToJunB protein mainly existed in the nucleus, belonging to asecretory protein. In the secondary structure,α- helix and extended strand accounted for 35.67% and 14.33%,random coil accounted for 50.00%. The phylogenetic trees based on amino acid sequence similarity of JunB indicated that the closest genetic distance with T. ovatus and Serio lalalandi dorsalis. They both were Hericidae,Perciformes. The relative expression of ToJunB gene was higher in the early stage of embryonic development(from the zygote to the early gastrula stage), reached the highest value in the gastrula stage, and kept low value in the late stage of embryonic development(from the late gastrula stage to the hatching stage). The expression level of ToJunB gene in the 10 developmental stages from zygote to early gastrula was extremely significantly higher than that from the late gastrula to the early hatching stage(P<0.01). 【Conclusion】The relative expression of ToJunB gene is higher from the zygote to the early gastrula stage, reaches the highest value in the gastrula stage and then reduces rapidly, and keeps low value from the late gastrula stage to the hatching stage. The result show that JunB gene plays an important role in the cell division and proliferation in embryo development of T. ovatus.
Key words: Trachinotus ovatus; JunB gene; embryonic development; boinformatics analysis; expression pattern
Foundation item:Innovation Driven Development Project of Guangxi(Guike AA17204080-3,Guike AA18242031-2); Independent Project of Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture(19-A-01-05)
0 引言
【研究意义】激活蛋白-1(Activator protein 1,AP-1)家族成员包括两大类蛋白转录因子(Jun和Fos),其中Jun基因家族包含c-jun、JunB及JunD等多个成员。JunB基因位于19号染色体的p13.2,全长1820 bp,编码39 kD的DNA结合蛋白(由347个氨基酸残基构成),能与任意的AP-l家族转录因子结合形成同源或异源二聚体(杨霞,2009)。JunB基因与c-jun基因的结构相类似,二者具有相互拮抗的作用。JunB基因在含有多个AP-1位点的启动子中以一种不依赖c-jun基因的方式对其靶基因进行调控,通过与定位于目标基因顺式调控域的认知结合序列结合,进而调控细胞增殖、分化及凋亡等生物学过程(郭崟等,2018),在肿瘤形成或抑制肿瘤细胞增殖方面发挥重要作用。JunB基因可通过降低Cyclin A表达、抑制AP-1活性、延长G1期及下调周期蛋白D1等机制调控细胞周期(杨霞,2009)。因此,克隆JunB基因并研究其在胚胎发育时期的表达情况,对进一步揭示JunB基因的功能及作用机制具有重要意义。【前人研究进展】JunB基因过量表达可抑制恶性小鼠角化细胞增殖,也可促进头颈部鳞状细胞癌的细胞侵袭、迁移和远处转移(Gurzov et al.,2008)。也有报道指出,JunB基因在肝细胞癌变中呈上调表达,因此可作为肝细胞癌(Hepatocellular carcinoma,HCC)发生发展的潜在标志物(张彧等,2013)。JunB基因还可通过激活周期蛋白依赖性激酶(Cyclin-dependent kinases,CDK)抑制物p16,抑制细胞增殖,故被认为是肿瘤抑制基因,且已有研究证实JunB基因在肝细胞癌、乳腺癌及肾细胞癌中的表达呈下调趋势(Koo et al.,1992;Chang et al.,2005;Langer et al.,2006)。此外,Mao等(2003)推测JunB基因在皮肤T细胞淋巴瘤的发病过程中发挥重要作用;张彧(2014)研究表明,JunB基因可通过激活Cyclin A转录,促进成骨细胞和成软骨细胞的生长;徐畅等(2015)研究发现JunB基因通过抑制釉质蛋白的分泌而促进釉质发育成熟。JunB基因在不同微环境中具有不同的作用模式与功能,可抑制B细胞的增殖和分化(Szremska et al.,2003),或通过上调IL-4促进Th2细胞分化(孔蕴毅,2008),还可通过诱导p16高表达及下调Cyclin D等途径调控细胞生长周期(Mao et al.,2003)。当机体受到血清、生长因子及辐射等刺激时均可诱导JunB基因迅速表达,导致细胞过度增殖甚至癌变(de Groot et al.,1991;冉丕鑫和钟南山,1996;欧阳能太等,1997)。JunB基因在人类疾病主要是癌症中的作用功能研究较多,而在鱼类生长发育等方面的研究至今未见相关报道。【本研究切入点】卵形鲳鲹(Trachinotus ovatus)又称黄腊鲳、金鲳鱼,为广盐暖水性中上层鱼类,因其生长速度快、肉质细嫩、无刺、味道鲜美,且营养价值高,作为名贵食用鱼类在我国南部沿海地区的人工养殖得到迅速发展(张永德等,2020)。近年来,针对卵形鲳鲹的研究主要集中在生长发育(黄小林等,2018;Liu et al.,2019)、病害防控与免疫(熊向英等,2018;Sun et al.,2019)、饲料营养(胡海滨等,2019;You et al.,2019)及分子生物学(Wu et al.,2019;Sun et al.,2020)等方面,而有关卵形鲳鲹胚胎发育的研究较少,对卵形鲳鲹JunB基因(ToJunB)在胚胎发育过程中的表达模式及其作用机制尚未明确。【拟解决的关键问题】以卵形鲳鲹为研究对象,探究ToJunB基因在17个胚胎发育时期的表达情况,明确卵形鲳鲹胚胎发育中ToJunB基因的表达规律,为揭示JunB基因在鱼类胚胎发育过程中的作用机制打下基础。
1 材料与方法
1. 1 试验材料
从深圳市南澳镇大鹏湾海域人工养殖群体中选取性成熟的健康卵形鯧鲹,体重6.2~7.8 kg,经人工催产后自然交配繁殖。待其自然产卵受精后,置于1000 L孵化桶进行孵化。显微镜下观察确定胚胎发育阶段,并收集从受精卵至仔鱼孵化共17个时期(受精卵、2-细胞期、8-细胞期、16-细胞期、32-细胞期、64-细胞期、多细胞期、高囊胚期、原肠早期、原肠中期、原肠末期、胚胎形成期、眼囊期、耳囊期、心脏跳动期、晶体出现期和初孵仔期)的样品,液氮速冻保存备用。RNAsimple提取试剂盒购自天根生化科技(北京)有限公司,HiScript? III RT SuperMix反转录试剂盒、ChamQ Universal SYBR qPCR Mix荧光定量试剂盒及AceTaq? Master Mix购自南京诺唯赞生物科技股份有限公司。ABI 7500 Fast qPCR仪购自美国Thermo Fisher公司,PCR仪购自德国Biometra公司。
1. 2 总RNA提取及cDNA合成
从液氮盒取出适量冻存组织样品,经研磨棒充分磨碎后按RNAsimple提取试剂盒说明提取卵形鲳鲹不同发育阶段的胚胎组织总RNA。采用2.0%琼脂糖凝胶电泳检测RNA完整性,以NanoDrop One检测其浓度。对完整性较好的RNA,根据HiScript? III RT SuperMix反转录试剂盒说明进行反转录,合成cDNA第一链。
1. 3 ToJunB基因克隆
根据转录组测序获得的ToJunB基因序列,采用Primer 5.0设计特异性PCR扩增引物(表1),预计扩增片段长度为1777 bp。以合成的cDNA为模板对ToJunB基因进行PCR扩增,扩增程序:95 ℃预变性3 min;95 ℃ 30 s,59 ℃ 30 s,72 ℃ 90 s,进行30个循环;72 ℃延伸5 min。PCR扩增产物采用2.0%琼脂糖凝胶电泳进行检测,切胶回收目的条带并送至英潍捷基(上海)贸易有限公司测序。
1. 4 ToJunB基因生物信息学分析
经测序及序列核对后,利用NCBI ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder)进行开放阅读框(ORF)及推导氨基酸预测分析,采用ProtParam(https://web.expasy.org/protparam/)分析其编码蛋白基本理化性质,运用NetSurfP 2.0(https://services.healthtech.dtu.dk/service.php?NetSurfP-2.0)和Phyre2(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index)分别预测ToJunB蛋白二、三级结构,并以SAVES 6.0(https://saves.mbi.ucla.edu/)对预测的模型进行评估;ToJunB蛋白跨膜结构采用TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)进行预测,信号肽利用SignalP(https://services.healthtech.dtu.dk/service.php?SignalP-5.0/)进行预测,亚细胞定位运用PSORT(http://psort1.hgc.jp//form.html)进行预测,糖基化位点则以NetNGlyc 1.0(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)进行预测。
1. 5 ToJunB基因序列同源分析
采用MEGA X将ToJunB基因序列与31个已知物种的JunB基因序列进行比对分析,包含鱼类、两栖动物、爬行动物、哺乳动物及人类(表2),计算其遗传距离,构建系统发育进化树,并选用Jones-Taylor-Thornton(JTT)模型,对空位采用完全删除,设Bootstrap为1000次。
1. 6 卵形鲳鲹胚胎组织ToJunB基因表达定量分析
以卵形鲳鲹不同发育期的胚胎组织cDNA为模板、18S为内参基因,采用实时荧光定量PCR检测ToJunB基因在卵形鲳鲹17个胚胎发育时期的表达情况。实时荧光定量PCR反应体系16.0 μL:ChamQ Universal SYBR qPCR Master Mix 8.0 μL,上、下游引物(10 μmol/L)各0.32 μL,cDNA模板1.6 μL,DEPC水补足至16.0 μL。ToJunB基因相对表达量采用2-??Ct法进行换算,并以SPSS 21.0进行单因素方差分析(One-way ANOVA)。
2 結果与分析
2. 1 ToJunB基因克隆及序列测定结果
PCR扩增获得1条长度约1800 bp的目的基因片段,对测序结果进行比对分析,确定该片段即为ToJunB基因(1777 bp),包含344 bp的5'端非编码区(5'-UTR)、954 bp的ORF及479 bp的3'端非编码区(3'-UTR),共编码318个氨基酸残基(图1),其中强碱性氨基酸残基34个、强酸性氨基酸残基32个、疏水氨基酸残基91个、极性氨基酸残基101个。基因序列组成分析发现,碱基A、C、G、T含量分别为26.34%(468个)、26.34%(468个)、25.27%(449个)和22.06%(392个),且G+C含量(51.60%)高于A+T含量(48.40%),说明ToJunB基因序列DNA双链结构较稳定。
2. 2 ToJunB蛋白理化性质分析结果
采用ProtParam分析ToJunB蛋白理化性质,结果发现该蛋白编码氨基酸残基数为318个,分子量为35.03 kD,理论等电点(pI)为8.26;带负电氨基酸残基总数(Asp+Glu)32个,带正电氨基酸残基总数(Arg+Lys)34个;不稳定指数为49.66,表明该蛋白稳定性较差;脂溶指数为73.68,总平均疏水指数(GRAVY)为-0.567(图2),说明ToJunB蛋白为亲水性蛋白。
2. 3 ToJunB蛋白跨膜结构预测结果
通过TMHMM对ToJunB蛋白进行跨膜结构预测,结果(图3)显示,ToJunB蛋白不存在跨膜结构,318个氨基酸残基均处于细胞膜外,在胞外发挥作用,有效减少跨膜区疏水性氨基酸对蛋白折叠的影响,更有利于原核表达及纯化。
2. 4 ToJunB蛋白信号肽预测结果
信号肽在引导外源蛋白的跨膜转运过程中发挥重要作用,使用SignalP进行预测,结果(图4)表明在ToJunB蛋白氨基酸序列中未检测到信号肽,即该蛋白属于非分泌型蛋白。
2. 5 ToJunB蛋白亚细胞定位及糖基化位点预测结果
利用PSORT对ToJunB蛋白进行亚细胞定位分析,结果显示,细胞核为0.940,微体(过氧化物酶体)为0.300,线粒体基质空间为0.100,溶酶体(管腔)为0.100,表明ToJunB蛋白主要存在于细胞核,其次是微体(过氧化物酶体),少量分布在线粒体基质和溶酶体内。ToJunB蛋白糖基化位点预测结果(图5)显示,在第39、129和168位氨基酸处各存在1个潜在的糖基化位点。
2. 6 ToJunB蛋白二、三级结构预测结果
利用NetSurfP对ToJunB蛋白二级结构进行预测,发现ToJunB蛋白二级结构由α-螺旋、延伸链及无规则卷曲构成,其中α-螺旋占35.67%、延伸链占14.33%、无规则卷曲占50.00%(图6)。利用同源建模对ToJunB蛋白进行三级结构预测,同源建模的模板序列与ToJunB氨基酸序列的一致度为68%,模型可信度为98.5%,其主体结构为一段柱状的双螺旋结构(图7),其余为无规则结构。采用SAVES在线程序对构建的模型进行评估,结果显示,ERRAT质量评分为100,Procheck 8项评估中通过7项、警告1项,无错误项,说明构建的模型可靠性较高。
2. 7 ToJunB氨基酸序列同源比对分析结果
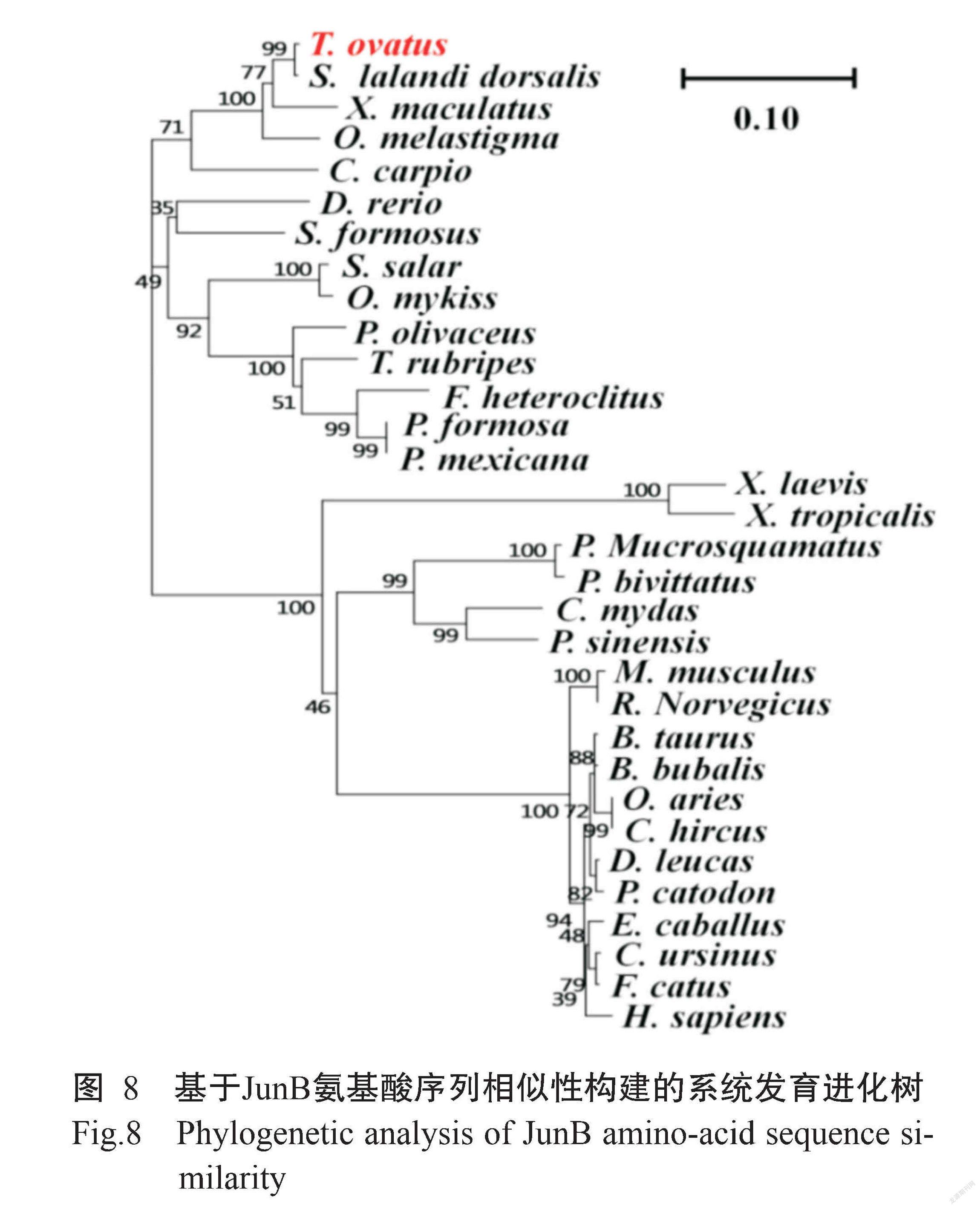
以ToJunB氨基酸序列与GenBank已公布其他物种的JunB氨基酸序列进行同源比对分析,并基于JunB氨基酸序列相似性构建系统发育进化树,结果(图8)显示,32个物种聚类成两大分支,鱼类为一支,另一支为爬行动物、两栖动物、哺乳动物及人类。在鱼类分支中,卵形鲳鲹和黄尾鰤(S. lalandi dorsalis)同属于鲈形目(Perciformes)鲹科(Carangidae),其遗传距离最近;其次与鳉形目(Cyprinodontiformes)和鲤形目(Cypriniformes)鱼类也具有较近的亲缘关系。
2. 8 ToJunB基因在卵形鲳鲹不同胚胎发育时期的表达情况
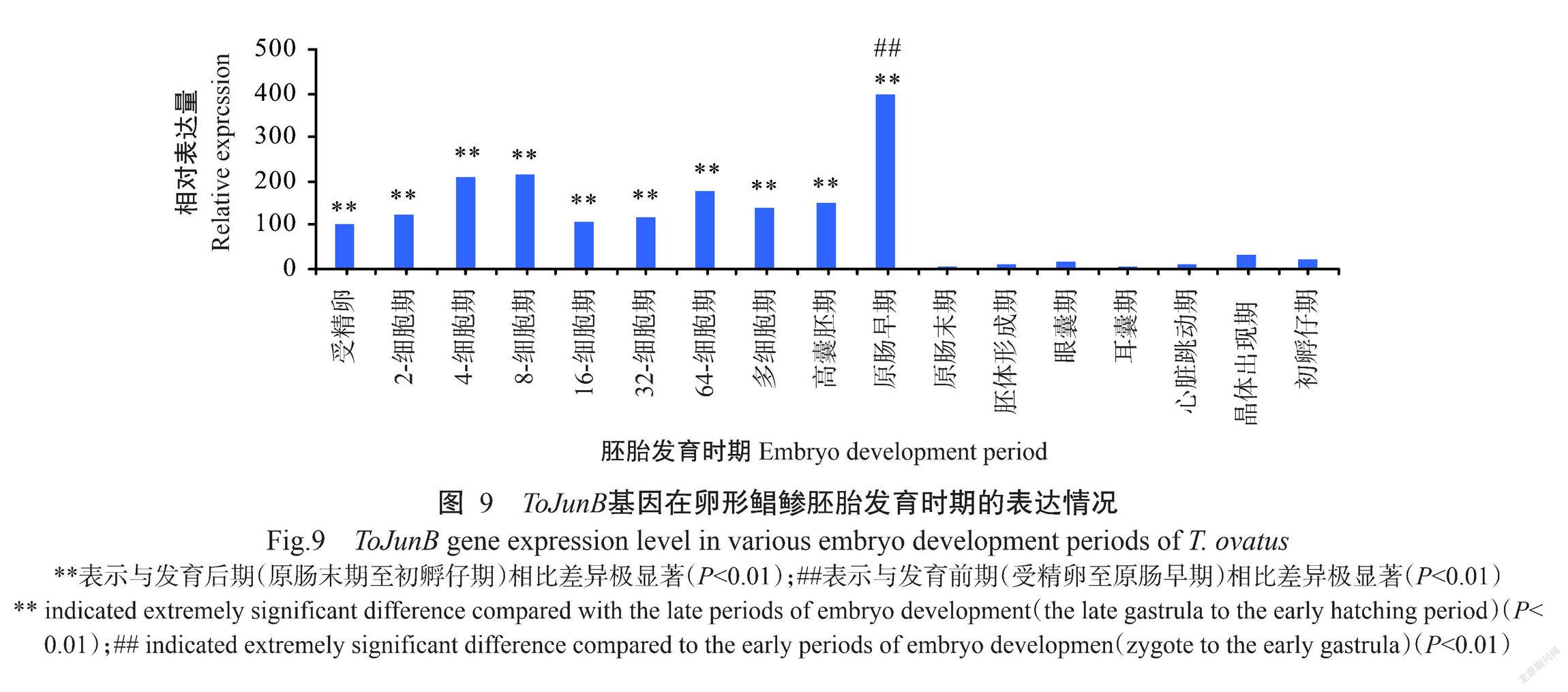
采用实时荧光定量PCR检测ToJunB基因在卵形鲳鲹17个胚胎发育时期的表达情况,结果如图9所示。ToJunB基因在卵形鲳鲹胚胎发育过程中的表达情况表现为:发育前期(受精卵至原肠早期)的相对表达量较高,于原肠中期达最高值后迅速降低,发育后期(原肠末期至初孵仔期)的相对表达量均较低。其中,ToJunB基因在受精卵至原肠中期共10个发育时期的相对表达量极显著高于胚胎发育后期的7个时期(原肠末期至初孵仔期)(P<0.01)。
3 讨论
JunB基因是Jun基因家族的成员之一,是構成AP-1的重要亚基,其主要功能作用是参与调控细胞进程及编码关键性调控蛋白等(王磊等,2010)。早在1998年,Kr?mer等就筛选出JunB基因,并指出JunB基因是低氧耐受候选基因。至今,关于JunB基因的研究主要集中在人类疾病(肿瘤)的发生发展过程方面。杨霞(2009)研究发现,JunB基因能抑制肿瘤细胞增殖,可抑制胃癌细胞的浸润及转移,在肾细胞癌(Koo et al.,1992)、肝细胞癌(Chang et al.,2005)及乳腺癌(Langer et al.,2006)的研究中也有类似结论。张彧(2014)研究表明,JunB基因在肝癌组外周血的相对表达量均高于其他组,可能与HCC的发生发展有关,提示其可作为肝细胞癌预警标志物。此外,JunB基因在牙釉质形成分泌期和釉质成熟期也发挥重要作用(Nishikawa,2000)。
胚胎发育是动物机体生长发育的基础,是一项庞大的系统工程,由多个基因共同发挥作用完成。哺乳动物只有1个JunB基因,在胚胎血管网络的形成过程中发挥重要作用,主要是作为新型的血管生成调节剂调节血管的形成及发育(Yoshitomi et al.,2017)。JunB被证明是血管发育和体内稳态的关键正调节剂,也是炎症反应和肿瘤生长的负调节剂,因此被称为具有正负调控功能的转录调控因子(Hess et al.,2004;Pflegerl et al.,2009)。在水产动物方面,JunB基因作为调节斑马鱼淋巴管生成的转录因子,是通过miR-182控制斑马鱼淋巴血管的发育(Kiesow et al.,2015);JunB基因在非洲爪蟾早期胚胎发生期间还参与尾巴的形成(Yoshida et al.,2016)。本研究结果表明,ToJunB基因ORF为954 bp,共编码318个氨基酸残基,其编码蛋白分子量为35.03 kD,pI为8.26,属于碱性蛋白,稳定性较差;ToJunB蛋白不存在跨膜结构,318个氨基酸残基均处于细胞膜外,也不存在信号肽;ToJunB蛋白主要存在于细胞核,其次是微体(过氧化物酶体);存在3个潜在的糖基化位点;其二级结构由α-螺旋(占35.67%)、延伸链(占14.33%)及无规则卷曲(占50.00%)构成。基于JunB氨基酸序列相似性构建的系统发育进化树显示,卵形鲳鲹与黄尾鰤的遗传距离最近,均隶属于鲈形目鲹科,与其传统分类结果一致。
为了解ToJunB基因在卵形鲳鲹胚胎发育过程中的表达规律,本研究收集受精卵至仔鱼孵化共17个时期的样品,并通过实时荧光定量PCR进行定量分析,结果显示:ToJunB基因在胚胎发育前期(受精卵至原肠早期)的相对表达量较高,至原肠中期达最高值,在胚胎发育后期(原肠末期至初孵仔期)的相对表达量均较低,且ToJunB基因在受精卵至原肠中期共10个发育时期的相对表达量极显著高于胚胎发育后期的7个时期(原肠末期至初孵仔期)。可见,ToJunB基因在卵形鲳鲹胚胎发育的细胞分裂和增殖过程中发挥重要作用,但其作用机制有待进一步探究。
4 结论
ToJunB基因在卵形鲳鲹胚胎受精卵至原肠早期的相对表达量较高,于原肠中期达最高值后迅速降低,原肠末期至初孵仔期的相对表达量均较低,说明JunB基因在卵形鲳鲹胚胎发育的细胞分裂和增殖过程中发挥重要作用。
參考文献:
郭崟,訾龙,谷泉,徐振明. 2018. JunB基因在先天性小耳畸形中的表达及临床意义[J]. 中国优生与遗传杂志,26(12):89-91. [Guo Y,Zi L,Gu Q,Xu Z M. 2018. Expression and clinical significance of JunB gene in congenital microtia[J]. Chinese Journal of Birth Health & Heredity,26(12):89-91.] doi:10.13404/j.cnki.cjbhh.2018.12.036.
胡海滨,解绶启,钱雪桥,贠彪,庄界成. 2019. 饲料中添加玉米蛋白粉或鸡肉粉替代部分鱼粉对卵形鲳鲹生长性能的影响[J]. 动物营养学报,31(6):2752-2764. [Hu H B,Xie S Q,Qian X Q,Yuan B,Zhuang J C. 2019. Effects of dietary corn gluten meal or poultry meal partially replacing fish meal on growth performance of golden pompano(Trachinotus ovatus)[J]. Chinese Journal of Animal Nutrition,31(6):2752-2764.] doi:10.3969/j.issn.1006-267x.2019.06.036.
黄小林,张殿昌,林黑着,黄忠,虞为,杨育凯,李涛. 2018. 池塘养殖卵形鲳鲹早期形态性状与体质量的灰色关联分析[J]. 南方农业学报,49(5):1016-1022. [Huang X L,Zhang D C,Lin H Z,Huang Z,Yu W,Yang Y K,Li T. 2018. Grey relational analysis between early morphological traits and body weight of Trachinotus ovatus bred in pond[J]. Journal of Southern Agriculture,49(5):1016-1022.] doi:10.3969/j.issn.2095-1191.2018.05.27.
孔蕴毅. 2008. 原发皮肤CD30+淋巴组织增生性疾病临床病理、TCR基因重排研究及JunB表达的探讨[D]. 上海:复旦大学. [Kong Y Y. 2008. A study of primary cutaneous CD30+ lymphoproliferative disease on clinicopathologic features,TCR gene rearrangements and JunB expression[D]. Shanghai:Fudan University.] doi:10.7666/d.y1965713.
欧阳能太,冉丕鑫,杜志强,朱彤,钟南山. 1997. 缺氧对大鼠肺组织成纤维细胞生长因子和C-myc癌基因表达的影响[J]. 中华结核和呼吸杂志,20(1):22-24. [Ouyang N T,Ran P X,Du Z Q,Zhu T,Zhong N S. 1997. Expression of FGF-b and C-myc in mouse lung tissue affected by hypoxia[J]. Chinese Journal of Tuberculosis and Respiratory Diseases,20(1):22-24.]
冉丕鑫,钟南山. 1996. 生长因子、原癌基因与低氧性肺动脉高压[J]. 基础医学与临床,16(1):1-5. [Ran P X,Zhong N S. 1996. Growth factor,proto oncogene and hypoxic pulmonary hypertension[J]. Basic and Clinical Medicine,16(1):1-5.] doi:10.16352/j.issn.1001-6325.1996.01.001.
王磊,张瑞,孟艳玲,余桂戎,王涛,赵晶,杨安钢. 2010. 转录因子JunB在肝癌细胞中的表达、定位及其转录作用研究[J]. 细胞与分子免疫学杂志,26(1):5-8. [Wang L,Zhang R,Meng Y L,Yu G R,Wang T,Zhao J,Yang A G. 2010. Expression and function alanalysis of transcriptional factor JunB in hepatic cancer cells[J]. Chinese Journal of Cellular and Molecular Immunology,26(1):5-8.] doi:10.13423/j.cnki.cjcmi.005354.
熊向英,黄国强,王志成,文雪. 2018. 广西卵形鲳鲹海豚链球菌基因分型、耐药谱型以及毒力基因检测[J]. 水产学报,42(4):586-595. [Xiong X Y,Huang G Q,Wang Z C,Wen X. 2018. Molecular typing,antibiogram type and detection of virulence genes of Stereptococcus iniae strains isolated from golden pompano(Tranchinotus ovatus) in Guangxi Province[J]. Journal of Fisheries of China,42(4):586-595.] doi:10.11964/jfc.20170410791.
徐暢,魏亚红,王玉敏,张莉,韩晓谦,韩婷婷,高玉光. 2015. Jun家族蛋白在釉质发育中的表达及对amelogenin的调控作用[J]. 牙体牙髓牙周病学杂志,25(9):515-518. [Xu C,Wei Y H,Wang Y M,Zhang L,Han X Q,Han T T,Gao Y G. 2015. The expression of Jun family proteins in enamel development and the effect on amelogenin[J]. Chinese Journal of Conservative Dentistry,25(9):515-518.] doi:10.15956/j.cnki.chin.j.conserv.dent.2015.09.001.
杨霞. 2009. HMGI/Y与JunB在胃癌中的表达及其意义[D]. 南昌:南昌大学. [Yang X. 2009. The expressions of HMGI/Y and JunB in gastric cancer and its significance[D]. Nanchang:Nanchang University.] doi:10.7666/d.y1544329.
张永德,冯鹏霏,余艳玲,潘传燕,宋漫玲,肖蕊,罗洪林. 2020. 卵形鲳鲹MyoG基因克隆及其胚胎组织表达分析[J]. 南方农业学报,51(12):3090-3098. [Zhang Y D,Feng P F,Yu Y L,Pan C Y,Song M L,Xiao R,Luo H L. 2020. Gene cloning of MyoG in Trachinotus ovatus and its embryonic tissues analysis[J]. Journal of Southern Agriculture,51(12):3090-3098.] doi:10.3969/j.issn.2095- 1191.2020.12.027.
张彧,陈铃,何国珍,邓伟,张春燕,黄天壬. 2013. JUNB基因和TOB1基因在肝细胞癌中的表达及意义[J]. 现代肿瘤医学,21(11):2504-2507. [Zhang Y,Chen L,He G Z,Deng W,Zhang C Y,Huang T R. 2013. JUNB and TOB1 gene expression and significance in hepatocellular carcinoma[J]. Journal of Modern Oncology,21(11):2504-2507.] doi:10.3969/j.issn.1672-4992.2013.11.35.
张彧. 2014. JUNB基因、TOB1基因和ASGR2基因在肝细胞癌中的表达及意义[D]. 南宁:广西医科大学. [Zhang Y. 2014. JunB gene,TOB1 gene and ASGR2 gene expression and significance in hepatocellular carcinoma[D]. Nanning:Guangxi Medical University.]
Chang Y S,Yeh K T,Yang M Y,Liu T C,Lin S F,Chan W L,Chang J G. 2005. Abnormal expression of JunB gene in hepatocellular carcinoma[J]. Oncology Reports,13(3):433-438.
de Groot R P,Auwerx J,Karperien M,Staels B,Kruijer W. 1991. Activation of JunB by PKC and PKA signal transduction through a novel cis-acting element[J]. Nuclc Aci-ds Research,19(4):775-781. doi:10.1093/nar/19.4.775.
Gurzov E N,Ortis F,Bakiri L,Wagner E F,Eizirik D L. 2008. JunB inhibits ER stress and apoptosis in pancreatic beta cells[J]. PLoS One,3(8):e3030. doi:10.1371/journal.pone.0003030.
Hess J,Angel P,Schorpp-Kistner M. 2004. AP-1 subunits:Quarrel and harmony among siblings[J]. Journal of Cell Science,117(25):5965-5973. doi:10.1242/jcs.01589.
Kiesow K,Bennewitz K,Miranda L G,Stoll S J,Hartenstein B,Angel P,Kroll J,Schorpp-Kistner M. 2015. JunB controls lymphatic vascular development in zebrafish via miR-182[J]. Scientific Reports,5:15007. doi:10.1038/srep15007.
Koo A S,Chiu R,Soong J,Dekernion J B,Belldegrun A. 1992. The expression of C-jun and JunB mRNA in renal cell cancer and in vitro regulation by transforming growth factor beta 1 and tumor necrosis factor alpha 1[J]. The Journal of Urology,148(4):1314-1318. doi:10.1016/s0022-5347(17)36899-4.
Kr?mer B K,Ritthaler T,Schweda F,Kees F,Schricker K,Holmer S R,Kurtz A. 1998. Effects of hypoxia on renin secretion and renal renin gene expression[J]. Kidney International,67:S155-S158. doi:10.1046/j.1523-1755.1998. 06732.x.
Langer S,Singer C F,Hudelist G,Dampier B,Kaserer K,Vinatzer U,Pehamberger H,Zielinski C,Kubista E,Schreibner M. 2006. Jun and Fos family protein expression in human breast cancer:Correlation of protein expression and clinicopathological parameters[J]. European Journal of Gynaecological Oncology,27(4):345-532.
Liu B,Guo H Y,Zhu K C,Guo L,Liu B S,Zhang N,Yang J W,Jiang S G,Zhang D C. 2019. Growth,physiological,and molecular responses of golden pompano Trachinotus ovatus (Linnaeus,1758) reared at different salinities[J]. Fish Physiology and Biochemistry,45(6):1879-1893. doi:10.1007/s10695-019-00684-9.
Mao X,Orchard G,Lillington D M,Russell-Jones R,Young B D,Whittaker S J. 2003. Amplification and overexpression of JunB is associated with primary cutaneous T-cell lymphomas[J]. Blood,101(4):1513-1519. doi:10.1182/blood-2002-08-2434.
Nishikawa S. 2000. Localization of transcription factor AP-1 family proteins in ameloblast nuclei of the rat incisor[J]. The Journal of Histochemistry and Cytochemistry,48(11):1511-1520. doi:10.1177/002215540004801108.
Pflegerl P,Vesely P,Hantusch B,Schlederer M,Zenz R,Janig E,Steiner G,Meixner A,Petzelbauer P,Wolf P,Soleiman A,Egger G,Moriggl R,Kishimoto T,Wagner E F,Kenner L. 2009. Epidermal loss of JunB leads to a SLE phenotype due to hyper IL-6 signaling[J]. Procee-dings of the National Academy of Sciences of the United States of America,106(48):20423-20428. doi:10.1073/pnas.0910371106.
Sun B M,Lei Y,Cao Z J,Zhou Y C,Sun Y,Wu Y,Wang S F,Guo W L,Liu C S. 2019. TroCCL4,a CC chemokine of Trachinotus ovatus,is involved in the antimicrobial immune response[J]. Fish & Shellfish Immunology,86:525-535. doi:10.1016/j.fsi.2018.11.080.
Sun J H,Zhu K C,Guo H Y,Zhang N,Jiang S G,Zhang D C. 2020. Genome-wide comparative analysis ofbone morphogenetic proteins: Genomic structure,phylogeny,and expression patterns in the golden pompano,Trachinotus ovatus(Linnaeus,1758)[J]. Fish Physiology and Bioche-mistry,46(1):345-358. doi:10.1007/s10695-019-00721-7.
Szremska A P,Kenner L,Weisz E,Ott R G,Passegué E,Artwohl M,Freissmuth M,Stoxreiter R,Theussl H C,Par-zer S B,Moriggl R,Wagner E F,Sexl V. 2003. JunB inhibits proliferation and transformation in B-lymphoid cells[J]. Blood,102(12):4159-4165. doi:10.1182/blood-2003-03-0915.
Wu M,Guo L,Zhu K C,Guo H Y,Liu B S,Zhang N,Jiang S G,Zhang D C. 2019. Molecular characterization of toll-like receptor 14 from golden pompano Trachinotus ovatus(Linnaeus,1758) and its expression response to three types of pathogen-associated molecular patterns[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry & Molecular Biology,232:1-10. doi:10.1016/j.cbpb. 2019.02.010.
Yoshida H,Okada M,Takebayashi-Suzuki K,Ueno N,Suzuki A. 2016. Involvement of JunB proto-oncogene in tail formation during early xenopus embryogenesis[J]. Zoological Science,33(3):282-289. doi:10.2108/zs150136.
Yoshitomi Y,Ikeda T,Saito H,Yoshitake Y,Ishigaki Y,Hatta T,Kato N,Yonekura H. 2017. JunB regulates angiogenesis and neurovascular parallel alignment in mouse embryonic skin[J]. Journal of Cell Science,130(5):916-926. doi:10.1242/jcs.196303.
You C H,Chen B J,Wang M,Wang S Q,Zhang M,Sun Z J,Juventus A J,Ma H Y,Li Y Y. 2019. Effects of dietary lipid sources on the intestinal microbiome and health of golden pompano(Trachinotus ovatus)[J]. Fish & Shellfish Immunology,89:187-197. doi:10.1016/j.fsi.2019.03. 060.
收稿日期:2020-10-26
基金項目:广西创新驱动发展专项(桂科AA17204080-3,桂科AA18242031-2);广西水产遗传育种与健康水产养殖重点实验室自主研发项目(19-A-01-05)
通迅作者:张永德(1977-),https://orcid.org/0000-0001-9186-9294,博士,正高级农艺师,主要从事水产动物遗传育种研究工作,E-mail:yondar@126.com
第一作者:潘传燕(1988-),https://orcid.org/0000-0001-8749-2404,主要从事水产动物遗传育种研究工作,E-mail:723870955@qq.com

