慢加急肝衰竭的诊断标准及管理
李 海
(上海交通大学医学院附属仁济医院消化科 上海市消化疾病研究所,上海 200127)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)最早于1995 年由日本学者[2]提出,是指在各种急性损伤因素的作用下,肝功能相对稳定的慢性肝病患者病情迅速恶化的肝衰竭综合征。ACLF 患者具有极高的短期死亡率,其发病3 个月内的死亡率达50%左右。全球对ACLF 的诊断标准尚未统一,存在不同的定义和诊断标准,主要有亚太、欧洲、美国及中国的定义和诊断标准。ACLF 的治疗手段相当有限,其诊疗面临着巨大挑战。探讨、比较全球的ACLF 诊断标准,乃至统一全球标准,对指导治疗至关重要。笔者比较各诊断标准,并对2021 年由美国及印度学者牵头进行的全球统一ACLF 诊断标准进行介绍,同时根据ACLF 的自然病程转归,结合我国的诊治特点,提出适合中国人群的ACLF 管理策略。
ACLF 的定义和诊断标准
当前,ACLF 的定义和诊断标准各有侧重,具体如下。
一、亚太肝脏研究学会(Asian-Pacific Association for the study of the liver,APASL) 定义和诊断标准
ACLF的概念被提出后,2008年APASL对ACLF 的概念进行了初步定义[1],即在慢性肝病(先前诊断或未诊出)基础上,在急性肝损伤诱因作用下,患者临床表现为黄疸、凝血障碍,以及4 周内出现腹水或肝性脑病,同时提出相应的诊断标准,具体如下。①有慢性肝病病史;②可有肝损伤诱因;③总胆红素≥5 倍正常值上限以及国际凝血酶原比值≥1.5;④发病4 周内出现腹水和肝性脑病。
APASL 定义认为,ACLF 仅发生于既往无失代偿的肝硬化患者(即肝硬化代偿期)和非肝硬化慢性肝病患者,肝硬化失代偿期患者和首次发生急性失代偿性肝硬化患者均不包括在定义中。此外,肝外损伤(如脓毒症或胃肠道出血)也不被视为导致ACLF 的诱因,而被认为是其并发症。后续APASL定义有多版修订,提出了预后模型等外延内容,但诊断标准仍以上述4 点为核心内容。APASL 是全球最早提出ACLF 诊断标准的组织,但其将正进入代偿期(急性失代偿)或已进入失代偿期的肝硬化患者排除在ACLF 以外,目前被业内人士认为存在重大遗漏。
二、欧洲肝脏研究学会(European Association for the Study of the Liver,EASL)定义和诊断标准
2010 年美国肝病研究学会及EASL 共同提出了以多脏器功能衰竭和发病3 个月内高死亡率为核心的ACLF 定义,该定义的侧重点明显不同于APASL[2]。基于上述定义为框架,2011年欧洲开展了覆盖29个医院关于ACLF的前瞻性研究[3],于2013 年6 月制定出了相应的EASL-慢性肝衰竭诊断标准[4]。由于欧洲国家的慢性乙型肝炎病毒(hepatitis B virus,HBV)感染者较少,因此该研究对象为酒精性及慢性丙型肝炎病毒感染为病因的肝硬化急性失代偿患者。该诊断标准以欧洲肝病学者的共识为基础,并对原有的通用多脏器衰竭指数进行修正,制定了适合于肝衰竭患者的肝、肾、神经、凝血、心、肺六大脏器(或系统)功能衰竭诊断标准,进而提出了慢性肝衰竭-序贯器官衰竭评分标准,即存在急性失代偿性肝硬化患者出现肝、神经、肾、凝血、心血管及呼吸6 个主要脏器(或系统)中2 个或以上的器官衰竭、单器官肾脏衰竭或其他单脏器衰竭合并肾脏/神经损害的患者即可诊断为ACLF[3-4]。同时,该评分标准将ACLF 患者根据脏器衰竭的个数分为Ⅰ级[肾脏衰竭或其他单脏器衰竭合并肾脏(或神经损害)],Ⅱ级(2 个脏器衰竭)和Ⅲ级(3 个脏器衰竭)(见表1)。Ⅰ~Ⅲ级ACLF 患者的90 d 死亡率分别为41%、52%和79%[4]。上述EASL-慢性肝衰竭定义包括了肝外器官衰竭。欧洲标准认为,ACLF 只在肝硬化患者中存在。肝硬化中的急性失代偿患者是发生ACLF 的高危人群。欧洲的研究中,判断是否为ACLF 患者的主要临床判断终点是入院后28 d 内发生LT-free 的死亡率≥15%。

表1 EASL-ACLF 分级[1]
三、美国终末期肝病研究联盟的ACLF 诊断标准
美国终末期肝病研究联盟将ACLF 定义为急性失代偿性肝硬化患者存在2 个或2 个以上的肝外器官衰竭(包括脓毒血症休克在内)。符合其ACLF诊断标准的患者基本属于严重的终末期ACLF 患者,4 周内死亡率高达63%。该诊断标准对患者28 d死亡预测的阳性预测值高达97%[3],可以据此作为放弃积极治疗、姑息治疗的依据。
四、中国的ACLF 诊断标准
在2002 年前,我国以慢性重症肝炎作为上述疾病的统一名称,急性肝损伤(如HBV 活化或急性酒精性肝炎)是其起因,黄疸和凝血功能障碍为其临床特征。中国ACLF 诊断标准为,总胆红素≥10 倍正常值上限及国际凝血酶原比值≥1.5(或凝血酶原活动度≤40%)。2002 年,我国为与国际接轨,以ACLF 代替慢性重症肝炎命名,而其诊断标准不变。在疾病严重度分级方面,我国的ACLF 分级标准按凝血酶原活动度将患者分为轻、中、重3 级。
近年来,浙大一院团队根据我国多中心研究数据提出了覆盖肝硬化及非肝硬化慢性肝病人群的中国乙型重型肝炎研究组诊断标准[5],即①非肝硬化且符合以上中国重症肝炎标准的人群或肝硬化急性失代偿人群,符合总胆红素≥10 倍正常值上限以及国际凝血酶原比值≥1.5,②符合EASL 标准的患者,符合其中任意一项均可诊断为ACLF。该标准来源于我国人群,较适合在我国HBV 高流行区的慢性肝病人群中诊断ACLF。但肝硬化与非肝硬化患者是否均可适用这同一诊断标准还有待进一步研究。可见,ACLF 的诊断标准仍有进一步优化。
自2015 年,我国15 家三甲医院肝病中心组成了中国慢(加急)肝衰竭联盟,目前该联盟已完成了中国慢加急性肝衰竭患者自然病程(CATCH-LIFE)多中心、前瞻性队列的建设,包括2 600 例建模队列[8]以及1 370 例[9]验证队列,致力于通过HBV 高流行区患者大队列的证据,探讨肝硬化基础以及慢性肝炎纤维化基础的ACLF 患者是否需要使用不同的诊断标准。
五、全球统一标准
鉴于上述ACLF 诊断标准均是基于各自地区、不同病因的患者,为了促进建立全球统一的ACLF诊断标准,2021 年由美国和印度学者牵头的CLEARED,基于全球50 个肝病中心,自2021 年其开展了包含各种病因、肝硬化/肝纤维化基础的慢性肝病急性加重住院患者的短期自然病程研究。每家中心入组50 例患者,总体目标为建立全球统一的ALCF 诊断标准,并明确以下3 点为目标。①肝硬化是否对肝衰竭短期预后存在独立影响;②较代偿期肝硬化,肝硬化急性失代偿病史的存在是否对短期预后产生独立的影响;③肝内外诱因对急性失代偿患者向ACLF 演变的独立风险度影响如何。
慢性肝病重症化人群及ACLF 患者的分层管理
一、识别ACLF 高危人群
目前,来源于欧洲及亚洲的多项大队列证据表明,肝硬化基础上的ACLF 高危群体为肝硬化急性失代偿患者。经典的肝硬化急性失代偿患者[4]应包括以下5 项中至少1 项。①1 个月内发生过上消化道出血;②存在肝性脑病;③存在显性腹水(B 超显示5 cm 以上腹水厚度);④有明确部位的细菌感染。在HBV 高流行区的肝硬化患者,诊断急性失代偿时,还需增加患者存在黄疸(总胆红素≥5 mg/dL,1 L=10 dL)的条件,以符合东方型ACLF 高危人群的特点。文献报道显示,肝硬化急性失代偿患者3个月内的死亡率为8%~20%。
二、按短期死亡风险高低对ACLF 高危人群及ACLF 患者进行分层管理
根据上海交通大学医学院附属仁济医院牵头的全国15 家三甲医院多中心完成的CATCH-LIFE研究结果,依据慢性肝病急性加重、急性失代偿、ACLF 患者间存在显著的90 d 死亡率差异,中国慢(加急)肝衰竭联盟提出了以下的分层管理思路。
1.按肝硬化急性失代偿定义标准分层:按该定义标准,可以将死亡率混杂的慢性肝病急性事件需住院患者分为短期(90 d)高死亡风险(90 d 死亡率>15%)和极低死亡风险(90 d 死亡率<3%)患者。建议高死亡风险患者在三级医院专科病房住院治疗,而极低死亡率的慢性肝病急性事件患者则可在基础医院接受治疗。
2.按ACLF 标准分层:按ACLF 标准(EASL 或中国乙型重型肝炎研究组标准和分级),将90 d 死亡率超过25%的ACLF 患者与低于10%的非ACLF患者进行区分。对ACLF 患者应强化监护治疗,如转入重症监护病房、予人工肝治疗以及进行肝移植评估。非ACLF 患者针对急性失代偿并发症进行治疗,一旦急性失代偿消失,即可出院进行门诊治疗随访。
3.按衰竭器官个数分层:对于90 d 死亡率接近25%或达25%以上的ACLF 患者,根据其衰竭器官个数进行ACLF 分级,可以将其进一步分为死亡率差异明显的Ⅰ级(单个器官衰竭)、Ⅱ级(2 个器官衰竭)、Ⅲ级(3 个或以上器官衰竭)。Ⅲ级ACLF患者在没有循环和呼吸衰竭,可以承受手术情况下,宜进行紧急肝移植。Ⅱ级患者则需进入肝移植等候名单,在有肝源情况下限期进行肝脏移植。对Ⅰ级ACLF 患者则以综合强化治疗和监测为主,当疾病进展至Ⅱ级,则按Ⅱ级方案治疗。
二、依据早筛系统及精准诊断标志物分层管理
目对于前ACLF 患者尚无有效的治疗药物,3 个月死亡率高达50%左右,早诊、早治是目前提高ACLF 患者存活率的主要策略(见图2)。
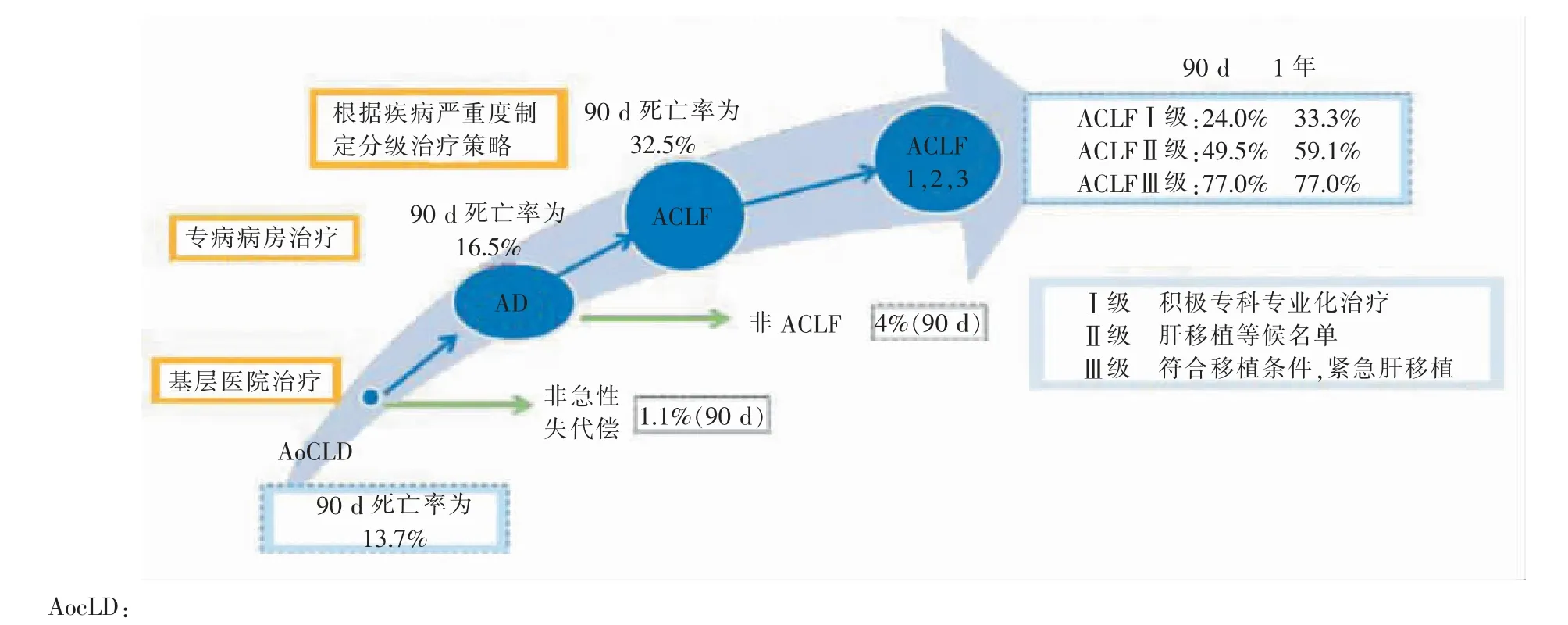
图1 按短期死亡风险对ACLF 高危人群、ACLF 患者进行医疗场所和医疗资源分配
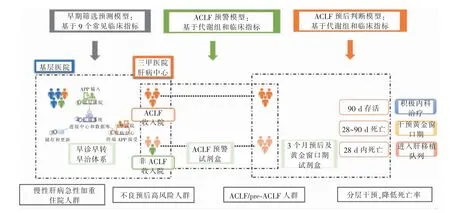
图2 中国慢(加急)性肝衰竭联盟中预测、预警和预后模型
1.ACLF 早筛系统的研究:由于ACLF 患者早期主要表现为乏力、纳差和黄疸等非特异性症状,故大多患者至基层医院或内科急诊就诊。由于第一线接诊的非专科医师缺乏快速判断疾病预后的经验及能力,导致大量患者在基层医院病房或急诊采用常规治疗数天至1 周后,疾病快速进展、恶化后才开始联系上级医院进行转诊,从而使ACLF患者转入三级医院专病病房后已进入器官衰竭的进展期或晚期。因此,如何提供快速、有效的辅助诊断方式,以帮助非肝病专科的基层医师快速识别预后不良的早期ACLF 患者,实现早期识别、早转诊至三级医院专科病房进行治疗,是目前需要关注、也是可能突破的关键环节。
以中华医学会肝病青年委员为基本成员,于2015 年组建的中国慢加急肝衰竭研究小组,在2017 年上海亚太肝病年会期间,正式成立了中国慢(加急)性肝衰竭联盟(目前正式成员包括15 家三甲医院),成立起即发起CATCH-LIFE 的前瞻性研究,目的是探索中国证据支持的东方型ACLF 诊断标准、影响不良结局的独立危险因素以及早期识别该疾病的精准标志物。CATCH-LIFE 研究分为2015 年至2016 年入组的2 600 例慢性肝病急性加重住院患者的建模队列,以及2018 年至2019 年完成的1 370 例相同入组标准的验证队列。该研究对2 600 例建模队列入组患者入院首日的40 多项体征或生化指标以及与入院后3 个月内不良结局可能有关的体征或生化指标进行观察,采用Logistic回归方法获得9 项基层医院易获得的常用指标组合模型。在验证队列中对该模型进行验证,发现其对高度异质性的慢性肝病急性加重住院患者90 d预后判断具有良好的准确率和特异度,曲线下面积为84%。经该模型预测为死亡高风险的患者,其在真实世界中的死亡率为43.48%,即每2.3 人中发生1 例死亡;而该模型预测为死亡低风险的患者,每16 例患者才会出现1 例死亡。该模型为基于我国真实世界的早筛模型,十分适合协助基层医院医生对高风险ACLF 患者及时作出决策判断并向三级医院专科病房转诊,帮助具有短期不良预后的极早期高风险ACLF 患者获得早诊、早治的时机。
2.对ACLF“黄金窗口干预期”患者的精准判断:对于ACLF“黄金窗口干预期”的判断,业内有各种假说。中国慢(加急)性肝衰竭联盟团队基于实际可操作的路径提出了ACLF“黄金窗口干预期”的2 个标准,①pre-ACLF 患者(上述患者入院后28 d 内进展至ACLF),在发展至ACLF 前的阶段是其黄金窗口干预期;②入院后29~90 d 死亡的ACLF 患者,入院后的4 周是上述患者的可干预期。基于上述目的,CATCH-LIFE 研究采用高通量测序分别筛选2 000 例患者血浆中的非靶向代谢组学以及蛋白组学(芯片)特征,每例患者血浆中可获得900 余个代谢物以及1 000 个经单克隆抗体检测的蛋白。在ACLF 与非ACLF 患者间有200 多种代谢物以及160 多种蛋白水平存在显著差异,最终筛选出3~5 个可以精准判断上述2 个黄金窗口干预阶段患者的标志物。目前,该研究正处于验证和试剂盒研发的早期转化阶段。
ACLF 的治疗
目前,ACLF 尚无有效的治疗药物,主要为对症支持、器官支持及营养支持治疗,保护残存的肝脏实质、保护肝外重要器官功能以及去除肝内、外损伤诱发因素是临床上常用的策略,而肝移植是使患者长期存活的唯一治疗手段。早诊、早治是目前提高ACLF 患者存活率的主要策略,实现在基层医院筛查极早期ACLF 患者,并将其转诊至三级医院专科病房进行治疗,以及有效识别处于“黄金干预窗口期”的ACLF 患者,是精准识别、诊断以降低患者高死亡率的关键环节。
一、器官支持
根据欧洲2018 年治疗失代偿性肝硬化的治疗指南[7],器官支持在ACLF 患者的管理中非常重要。如果患者有明显的低血压,应监测血流动力学并进行升压治疗。对于出现肝性脑病的患者,应尽早采用标准疗法。同时还应注意保持患者的气道通畅,从而预防吸入性肺炎。对于出现凝血功能衰竭的患者,只有当临床上出现明显出血时,才需给予替代治疗。如患者出现呼吸衰竭,应给予氧疗和通气支持。最后,如果患者有肾衰竭,应确定其病因并给予对应处理。对于体液丢失或发生自发性腹膜炎的患者,需予扩容治疗,但应避免过度。对符合急性肾损伤-肝肾综合征标准的患者应予特利加压素治疗,当没有特利加压素时,可以使用白蛋白或去甲肾上腺素治疗。对疑似急性肾功能衰竭的患者,在符合肾脏替代治疗标准的情况下,应予肾脏替代治疗。
二、肝脏支持体系
体外肝支持体系[6],特别是白蛋白透析(MARS体系)和分级的血浆分离和吸附(普罗米修斯系统),已被评估为ACLF 的治疗方法之一。这些方法能去除与白蛋白结合的物质以及在ACLF 病程中积累的其他物质。这2 种方法已在ACLF 患者的大型随机对照试验中进行了评估,但未证明其能提高患者的生存率。然而,需要强调的是,这2 项试验中ACLF 的定义与目前基于规范研究的ACLF 的定义不同。此外,一项关于普罗米修斯研究的亚分析显示,其能提高终末期肝病模型评分高于30 分患者的生存率。尽管如此,基于现有随机对照试验的结果,体外肝支持系统并不能改善ACLF 患者的生存率,故不在此适应证中被推荐[6]。
三、其他治疗方法
大量的治疗方法已经在ACLF 患者身上进行过评估,包括地塞米松、中草药、caspase 抑制剂、粒细胞集落刺激因子治疗和间充质干细胞移植、血浆交换。在大多数案例中,这些治疗方法疗效的信息仍然非常有限,目前尚无法就它们在临床实践中的潜在应用提出任何推荐。
小 结
ACLF 具有极高的短期死亡率 (发病3 个月内死亡率达50%左右),全球的ACLF 诊断标准尚未统一,且治疗手段相当有限,给疾病的诊疗带来了相当巨大的挑战。近十多年来,全球各区域都在开展高质量的多中心、前瞻性研究,通过真实世界的循证依据对疾病的预警、诊断以及预后判断等关键环节进行攻关,尝试建立全球统一的ACLF 诊断标准、疾病分层管理路径和帮助基层临床医师诊断的有效、易行、准确的AI 早筛、早转诊系统,以及开发精准早期诊断ACLF 患者以获得“黄金窗口干预期”的诊断试剂盒,是今后ACLF 研究的主要方向。

