光照处理对花生萌发过程中营养成分和活性成分的影响
李先翠,李保国*,姜元荣,史海明,王红玲
1(上海理工大学 医疗器械与食品学院,上海, 200093)2(丰益(上海)生物技术研发中心有限公司, 上海, 200137)
花生又称“长生果”,豆科落花生属植物,是我国产量丰富、食用广泛的一种油料作物。花生营养丰富,脂肪含量为44.27%~58%,蛋白含量在25%~36%[1],糖类占6%~19%[2]。此外,花生中还含有多酚、γ-氨基丁酸等功能活性物质。多酚是一类广泛存在于植物体内的次生代谢产物,具有较强的抗氧化活性[3]。白藜芦醇是一种非黄酮类多酚化合物,白藜芦醇及其衍生物具有抗氧化、抗肿瘤、防止动脉粥样硬化等多种功效[4]。γ-氨基丁酸是一种四碳非蛋白质氨基酸,具有抗炎、促进睡眠、预防糖尿病、抗癌等生理功能[5]。
种子萌发是指种子在生长过程中,从吸收水分开始,到胚根出现在周围结构中的过程[6]。萌发可以提高种子营养成分的生物利用率,改善蛋白质的质量,降低抗营养因子[7]。花生萌发过程中功能活性成分和营养物质会发生变化,如白藜芦醇及γ-氨基丁酸含量增加,营养成分更易被人体吸收利用[8]。糖类为花生萌发提供能量,花生萌发过程中,糖类含量变化因花生品种而异。花生萌发期间,贮能物质脂肪在相关酶的作用下代谢降解,含量降低。杨天等[9]研究不同品种花生萌发过程中发现,随萌发天数增加,脂肪含量先略微增加后显著降低。花生萌发过程中蛋白含量的变化相对复杂,于淼等[10]研究发现花生在萌发过程中蛋白含量显著增加,增加量因品种而异。花生萌发有利于提高多酚含量,LIMMONGKON等[11]检测了5种花生芽苗菜中总酚含量,结果表明Kalasin1花生中总酚含量在萌发1 ~3 d显著上升,第3天总酚含量达到40.67 μg/g,第4天开始下降。茹万飞[12]研究结果表明花生萌发过程中白藜芦醇含量显著增加,其中阜花17号花生萌发5 d,白藜芦醇含量达到29.81 μg/g。
种子萌发是植物生长周期中的关键阶段,光照条件可影响种子萌发、植物生长过程及果实品质,农业生产中通过覆盖不同颜色薄膜改变光谱组成,从而调控植物生长发育[13-14]。冯娜娜[15]研究了不同光质对紫花苜蓿芽苗菜品质的影响,结果发现红光可显著提高可溶性糖含量,蓝光能够增加蛋白含量,日光可增加其总酚和类黄酮含量。SIMLAT等[16]研究光照质量对甜叶菊种子萌发及生化特性的影响时发现,蓝光照射可提高种子发芽率,避光萌发可提高酚类和可溶性糖的含量。TAUSIF等[17]研究了不同光照条件下,油菜种子萌发过程中其所含酚类的变化,其结果表明:采用日光照射萌发总酚含量为0.29 mg/g,蓝、黄、绿、红和避光萌发总酚含量在0.96~9.49 mg/g。光是影响种子萌发的重要因素,关于花生萌发的研究报道主要集中在考察温度、湿度条件对萌发过程中营养物质的影响,光照条件对花生萌发的影响还未见报道。
因此,本文主要研究不同光照条件对花生萌发过程中营养成分及活性成分的影响,为评价萌发花生的营养价值及萌发花生功能性食品的开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
山东青花7号花生,有色透明聚脂薄膜,颜色分为紫、蓝、绿、黄、红和无色(透明)6种,经日立U-4100型光谱仪测定,不同颜色薄膜透过光波长:紫膜(380~450 nm);蓝膜(450~475 nm);绿膜(495~570 nm);黄膜(570~590 nm);红膜(620~750 nm);无色膜(380~760 nm)。
1.1.2 试剂
正己烷、无水乙醇、NaOH、次氯酸钠、冰醋酸、没食子酸标准品(纯度≥90%,分析纯),上海国药集团;白藜芦醇标准品,上海阿拉丁生化科技股份有限公司;甲醇、乙腈,上海安谱实验科技有限公司。
1.2 仪器与设备
KBF240 恒温恒湿箱,上海捷沪仪器仪表有限公司;Labconco-6L真空冷冻干燥机,妙生科技有限公司;UV-1800 紫外-可见分光光度计,日本岛津公司;日立LA8080氨基酸分析仪,日立高新技术公司;FOSS Kjeltec 8400 型自动凯氏定氮仪,上海展仪仪器设备有限公司;Agilent 1200型液相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 花生萌发处理
挑选外观饱满、大小一致、无霉变的新鲜花生种子,于5 g/L的次氯酸钠溶液中浸泡20 min,用去离子水冲洗3次,于25 ℃避光浸泡6 h,用去离子水润洗后在30 ℃、80%相对湿度条件下分别采用紫膜、蓝膜、绿膜、黄膜、红膜、白膜6种膜,覆盖发芽盘上,置于LED光源下萌发,取避光(dark)为对照组,每隔24 h用去离子水清洗种子,共萌发48 h,间隔12 h取样,经真空冷冻干燥,高速粉碎后过 40 目筛,真空包装,置于-25 ℃干燥箱保存用于后续检测。
1.3.2 营养成分测定方法
脂肪测定:采用索氏抽提法GB 5009.6—2016[18];蛋白测定:采用凯氏定氮法GB 5009.5—2016[19];还原糖测定:采用3,5-二硝基水杨酸比色法[20];生育酚测定:采用KAN等[21]报道的方法。
1.3.3 多酚含量测定
参照LIU等[22]的方法稍作修改:称取0.5 g冻干花生粉加入25 mL 80%乙醇超声提取30 min,离心(5 000 r/min,20 min,4 ℃),收集上清液,采用上述操作再次提取,合并2次提取的上清液于试管中。取0.5 mL提取液于试管中,加入3.75 mL福林酚试剂反应5 min,加入3.75 mL 7.5%碳酸钠,混合均匀,避光90 min漩涡振荡,在765 nm下测定吸光度。没食子酸标准曲线:y=0.008 3x+0.072,r2=0.999 5,线性范围为8~96 μg/mL。
1.3.4 白藜芦醇含量测定
参照GB/T 24903—2010[23],液相提取条件:色谱柱:ZORBAX Eclipse XDB-C185 μm(4.6 mm×150 mm),柱温:30 ℃;流动相:乙腈25%,水75%,冰醋酸0.09%;检测波长306 nm,进样量10 μL。白藜芦醇苷标准曲线:y=37.85x-0.48,r2=0.999 9,线性范围为1~10 mg/L;反式白藜芦醇标准曲线:y=88.14x+0.67,r2=0.999 8;线性范围为1~10 mg/L。
1.3.5 γ-氨基丁酸含量测定
参照NY/T 2890—2016[24],准确称取1 g样品(精确至 0.1 mg),加入10 mL 60%乙醇提取溶剂,超声提取20 min,离心,取上清液;沉淀重复提取1次,合并上清液,并定容至25 mL,0.22 μm微孔滤膜过滤,注入氨基酸自动分析仪测定γ-氨基丁酸含量。γ-氨基丁酸标准曲线:y=116.7x+177.12,r2=0.999 3。线性范围为2~50 μg/mL。
1.3.6 数据统计分析
本实验所有指标均设3组重复,采用SPSS 19.0软件进行统计学分析,用 Duncan法对结果进行显著性分析,P<0.05 时表示存在显著性差异,运用Origin 8.5软件作图,数据结果均以平均值±标准偏差表示。
2 结果与分析
2.1 花生萌发过程中营养成分含量变化
2.1.1 花生萌发过程中脂肪含量变化
图1为花生萌发过程中脂肪含量的变化。由图1可知,该品种花生原料脂肪含量约为53%,萌发12 h,脂肪含量略微升高,可能是萌发初期花生中脂肪、蛋白质等物质之间的转化不稳定所致[25],萌发48 h脂肪含量降低,波长为570~590 nm的黄光照射萌发48 h,脂肪含量降低了3.56%(P<0.05)。花生萌发过程中,脂肪酶被激活,花生中贮藏的脂肪开始降解为脂肪酸为萌芽提供能量,脂肪含量降低。本研究与于淼[10]研究结果一致。一般禾谷类种子萌发时碳水化合物提供能量,而大部分油料作物萌发时,脂肪首先分解为其萌发提供能量。
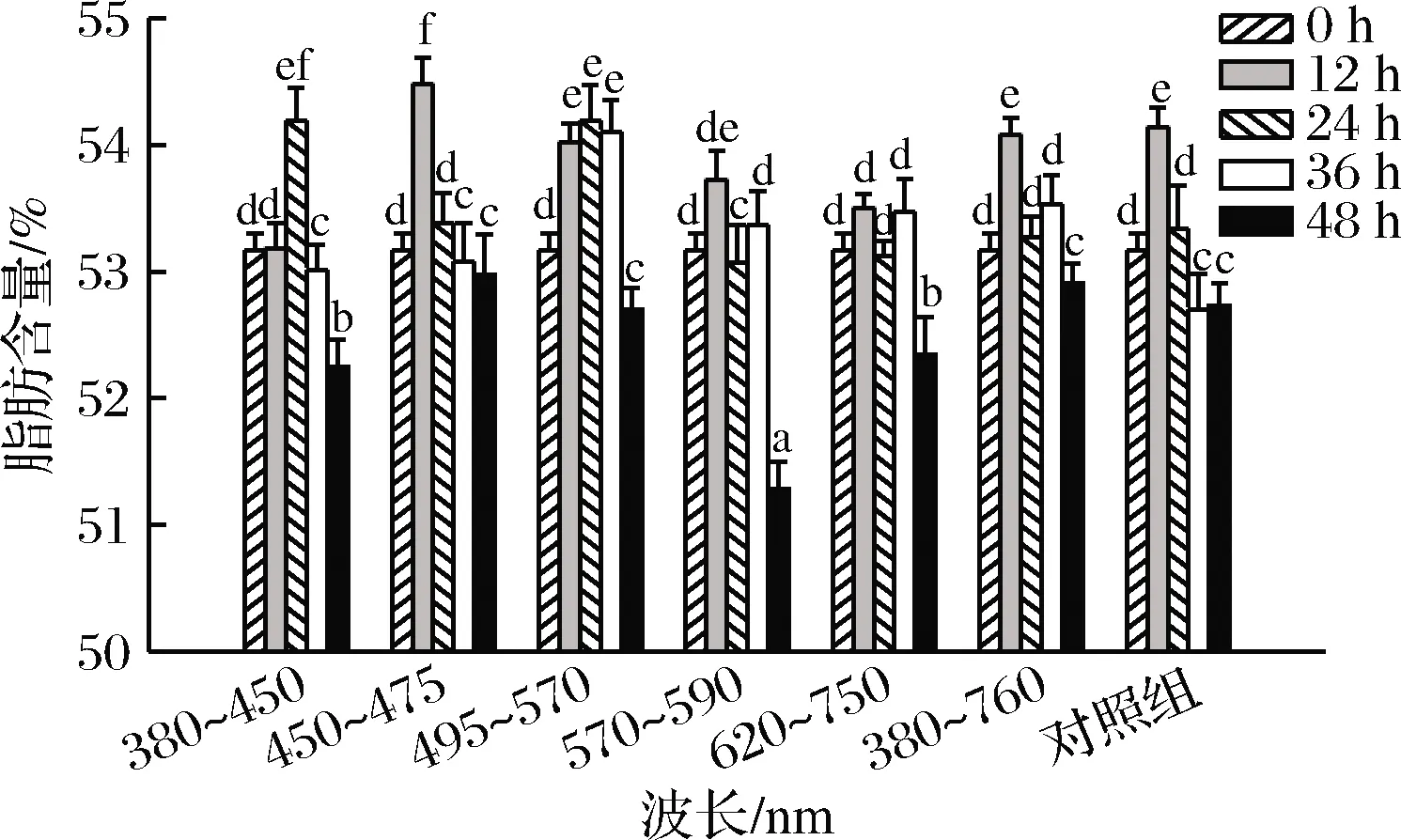
图1 花生萌发过程中脂肪含量变化Fig.1 Changes in fat content of peanut during germination under different wavelengths illumination注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.1.2 花生萌发过程中蛋白含量变化
如表1所示,花生原料蛋白含量为22.36%,萌发0~36 h蛋白含量有所波动,不同波长光照萌发48 h后花生中蛋白含量有显著性差异(P<0.05)。与未萌发相比,波长为380~450 nm、495~570 nm、570~590 nm、620~750 nm的紫光、绿光、黄光、红光及避光萌发48 h后蛋白含量无显著性变化,波长为450~475 nm的蓝光和380~760 nm日光光照萌发48 h蛋白含量显著增加(P<0.05)。萌发过程中蛋白含量变化主要是因为萌发前种子浸泡吸水膨胀,一部分可溶性氮溶于水中以及萌发过程中部分蛋白分解为小分子肽和氨基酸为种子萌发提供能量,消耗了蛋白。萌发36~48 h后花生中部分蛋白降解增加了可溶性蛋白含量,同时为合成新蛋白提供原料,花生中蛋白含量增加[26]。
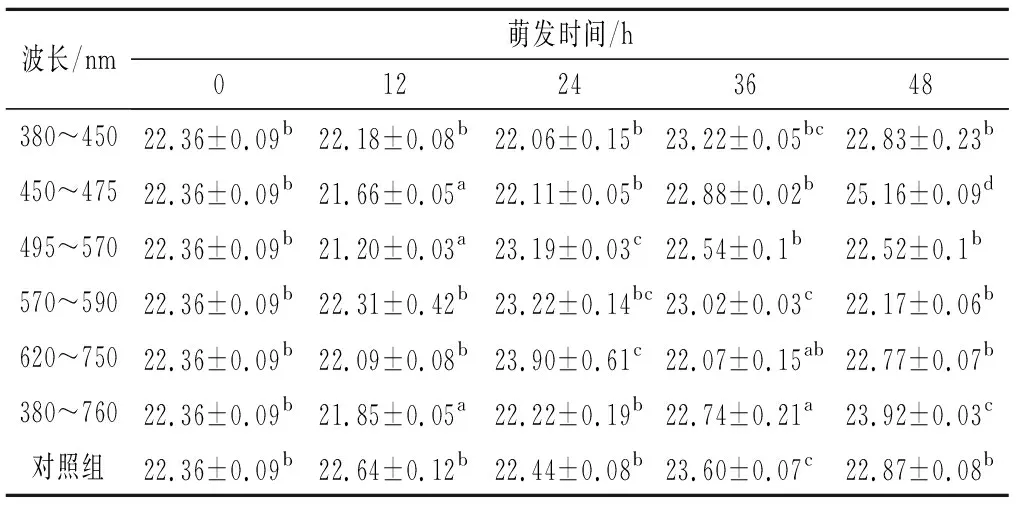
表1 花生萌发过程中蛋白含量的变化 单位:%Table 1 Changes in protein content of peanut during germination under different wavelengths illumination
2.1.3 花生萌发过程中还原糖含量变化
图2所示为花生萌发条件对还原糖含量的影响,花生原料还原糖含量为0.9%,波长为450~475 nm、495~570 nm、570~590 nm、620~750 nm、380~760 nm的蓝光、绿光、黄光、红光、日光及避光萌发48 h还原糖含量显著增加(P<0.05),萌发初期,大分子碳水化合物代谢分解为小分子糖类为花生萌发提供能量,还原糖含量增加。波长为380~450 nm的紫光光照萌发48 h,花生中还原糖含量显著降低35.56%,糖在许多代谢功能的调节中起重要作用,并且在萌发过程中会干扰发育调控的基因表达[27],不同波长光照改变了植物生长环境进而影响其品质,紫光光照可能抑制了花生的生长代谢,降低了大分子碳水化合物降解为小分子糖类的速率。黄、蓝光促进了碳水化合物的积累,提高了还原糖的含量[28]。梁森苗等[29]研究不同颜色薄膜对杨梅中可溶性糖含量影响时发现黄光处理,其可溶性糖含量显著提高。FAN等[30]研究表明蓝光促进小白菜可溶性糖的积累。
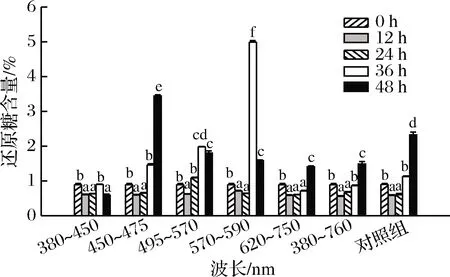
图2 花生发芽过程中还原糖含量变化Fig.2 Changes in reducing sugar content of peanut during germination under different wavelengths illumination
2.1.4 花生萌发过程中生育酚含量的变化
图3所示该花生品种的生育酚含量为488 mg/kg,不同波长光照萌发48 h生育酚含量变化显著(P<0.05),波长为380~450 nm、620~750 nm、380~760 nm的紫光、红光、日光光照萌发48 h过程中生育酚含量呈现先下降后上升再下降趋势,萌发36 h生育酚含量最高,分别为503.9 mg/kg、500.1 mg/kg、503.5 mg/kg。蓝光、黄光、红光、日光及避光萌发48 h生育酚含量略微降低。杨天等[9]研究结果发现随萌发时间的延长,生育酚含量先增加后减少,变化幅度因品种而异。生育酚是脂溶性抗氧化维生素,具有4种异构体,包括 α-生育酚,β-生育酚,γ-生育酚和δ-生育酚。发芽大豆中的生育酚含量显著增加,而发芽羽扇豆和绿豆中生育酚含量降低。生育酚含量变化与种子类型和品种密切相关。
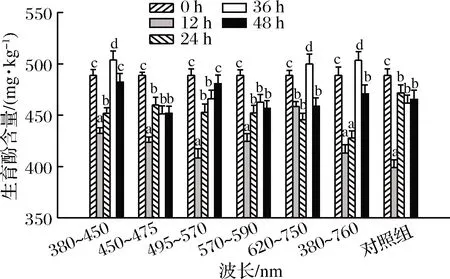
图3 花生萌发过程中生育酚含量变化Fig.3 Changes in tocopherol content of peanut during germination under different wavelengths illumination注:图中不同小写字母表示差异显著(P<0.05)
2.2 花生萌发过程中活性物质含量变化
2.2.1 花生萌发过程中多酚含量变化
表2为花生萌发过程中多酚含量的变化,花生原料中多酚含量为1.8 mg/g,不同波长光照萌发48 h后多酚含量发生显著性变化(P<0.05),波长为620~750 nm的红光光照萌发过程中多酚含量先下降后上升,萌发48 h多酚含量达2.11 mg/g,为原料的1.17倍。波长为380~450 nm、450~475 nm、495~570 nm、570~590 nm、380~760 nm的紫光、蓝光、绿光、黄光、日光及避光萌发48 h多酚含量下降。赵珮等[31]研究大麦发芽过程中酚类物质变化,发现随萌发过程进行,相关酶被激活,释放酚酸,从而使酚类化合物含量增加,这与本研究中红光照射花生萌发结果一致。也有报道认为酚酸与木质素交联形成细胞壁,酚酸含量增加有利于种子萌发过程中形成细胞壁[32]。黄光、绿光、蓝光、紫光、日光、避光萌发对植物的影响各不相同,可能降低了酚类相关酶的合成进而抑制多酚的积累。

表2 花生萌发过程中多酚含量的变化 单位:mg/gTable 2 Changes in phenolics content of peanut during germination under different wavelengths illumination
2.2.2 花生萌发过程中白藜芦醇含量变化
图4为未萌发及紫光萌发48 h花生中白藜芦醇液相色谱图,由图4可看出萌发后花生中白藜芦醇苷及反式白藜芦醇含量显著增加,图5所示为花生萌发过程中白藜芦醇总量的变化,花生原料中白藜芦醇总量为4.33 mg/kg,不同波长光照萌发48 h后白藜芦醇总量总体呈现显著增加趋势(P<0.05)。不同波长范围的紫光、蓝光、绿光、黄光、红光、日光及避光处理花生种子,萌发过程中,白藜芦醇总量呈现先减少后增加趋势,萌发48 h白藜芦醇总量为5.3~14 mg/kg,均比未发芽的白藜芦醇含量高。其中,波长范围为380~450 nm及620~750 nm的紫光、红光光照萌发48 h白藜芦醇总量分别为13.38 mg/kg、12.01 mg/kg,约为花生原料的3倍。由此可见,不同波长光照萌发有利于花生中白藜芦醇含量的提升。有研究表明,花生中白藜芦醇以苯丙氨酸为底物,在酶的作用下,通过苯丙烷代谢途径合成。芪合酶和白藜芦醇合成酶在白藜芦醇的生物合成过程中发挥重要作用。花生种子的萌发会激活大量的酶原,萌发过程中芪合酶和白藜芦醇合成酶被激活而进行白藜芦醇的生物合成。詹玉婷等[33]研究不同品种花生避光萌发时发现随萌发时间延长,花生中白藜芦醇增加量因品种而异,HY33花生萌发第4天,花生中白藜芦醇含量是未萌发的2.7倍,与本研究中红光和紫光光照萌发花生结果相似,表明红光与紫光光照萌发有利于花生中白藜芦醇含量的提升。

A-未萌发;B-紫光萌发48 h图4 未萌发及紫光萌发48 h花生中白藜芦醇液相色谱对比图Fig.4 HPLC chromatogram of resveratrol in original peanut and 48-hour peanut sprout under violet light

图5 花生萌发过程中白藜芦醇总量变化Fig.5 Changes in total resveratrol content of peanut during germination under different wavelengths illumination
2.2.3 花生萌发过程中γ-氨基丁酸含量变化
图6为不同波长光照萌发花生过程中γ-氨基丁酸含量的变化。花生在紫光、绿光、红光、日光及避光萌发48 h后,γ-氨基丁酸含量均增加4倍以上。波长为450~475 nm、570~590 nm的蓝光、黄光光照萌发24 h后,γ-氨基丁酸含量迅速增加,萌发48 h,γ-氨基丁酸含量均超过200 mg/kg,约为未萌发的7倍,萌发显著提高γ-氨基丁酸含量。γ-氨基丁酸广泛存在于动植物体内,是一种非蛋白质氨基酸,具有降血压、调节内分泌、改善记忆力、预防老年痴呆等作用。有研究表明发芽可富集大豆及糙米中γ-氨基丁酸,杨天等[9]研究不同品种花生萌发过程中γ-氨基丁酸含量变化,发现随萌发时间延长,γ-氨基丁酸含量均显著增加,萌发5 d时,5种花生中γ-氨基丁酸含量均提高7倍以上。萌发激活谷氨酸脱羧酶活性,促进谷氨酸转化成γ-氨基丁酸,因此,花生萌发有利于富集γ-氨基丁酸。
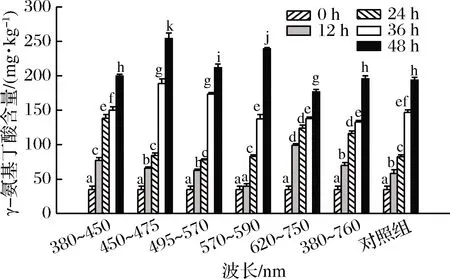
图6 花生萌发过程中γ-氨基丁酸含量变化Fig.6 Changes in γ-aminobutyric acid content of peanut during germination under different wavelengths illumination
3 结论
花生是一种营养丰富的健康食品,不同波长的光照萌发过程中花生中营养成分和活性成分发生变化。在萌发过程中,随萌发时间延长,脂肪含量减少,蛋白含量波动,紫光、绿光、黄光、红光及避光萌发48 h蛋白含量无显著性差异,蓝光、日光光照萌发48 h显著增加。蓝光、绿光、黄光、红光、日光及避光萌发48 h还原糖含量显著增加,萌发48 h生育酚含量降低。功能活性物质多酚含量发生变化,红光光照萌发后多酚含量增加,其他波长光照萌发多酚含量减少。萌发48 h白藜芦醇含量显著增加,红光、紫光萌发白藜芦醇含量增加为原料的3倍,不同波长光照萌发γ-氨基丁酸含量提高4倍以上。综上,不同波长光照对花生中营养物质及活性物质均具有重要影响,萌发能显著增加花生中白藜芦醇及γ-氨基丁酸含量,提高花生的营养价值。

