‘修水化红’甜橙成熟过程中黄酮含量与相关酶活性及抗氧化能力的关系
周明,朱晓娟,尧梅香,卢剑青,陈卡卡,朱凤妮,陈金印,沈勇根*
1(江西共青江中食疗科技有限公司,江西 九江,332020)2(江西农业大学 食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西 南昌,330045)3(江中药业股份有限公司,江西 南昌,330000)4(江西农业大学 农学院,江西省果蔬保鲜与无损检测重点实验室,江西 南昌,330045)
‘修水化红’是赣西北九江市修水县种植的一种特色甜橙,目前已有400多年的栽培历史,其甜中带酸、味道鲜美、香气浓郁,且具有止咳、化痰、消炎、健胃等多种功效,皮可入药,是修水县乃至江南地区难得的特色保健水果[1]。通常‘修水化红’果实在8月初左右进入快速增长期,此时便陆续开始采摘‘修水化红’果实并干制作为药材,在10月底或11月初‘修水化红’果实完全成熟,此时大量采摘果实鲜销和干制。研究表明黄酮类物质是柑橘果实中最重要的生物活性成分,从柑橘果实检测出新橙皮苷、柚皮素、橙皮苷、柚皮素、橙黄酮、香蜂草苷、橘皮素等多种黄酮类物质[2],具有抗氧化、抗炎、调节脂质代谢、抗癌等多种生物活性[3],且经常作为评定柑橘果实食用及药用品质的主要指标。
黄酮类物质先后通过磷酸戊糖途径、苯丙烷代谢途径及黄酮合成代谢途径在果实中进行积累。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH)、苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)、肉桂酸-4-羟基化酶(cinnamic acid 4-hydroxylase,C4H)、4-香豆酸-CoA-连接酶(4-coumarate coenzyme A ligase,4CL)、查尔酮异构酶(chalcone isomerase,CHI)等是黄酮类物质合成积累途径中的相关合成酶。其中G6PDH催化6-磷酸葡萄糖反应转化为6-磷酸葡萄糖酸内酯,同时伴随着还原型烟酰胺腺嘌呤二核苷酸磷酸的生成,是磷酸戊糖途径的关键酶[4]。PAL是苯丙烷代谢的初始酶,催化L-苯丙氨酸反应脱氨生成反式肉桂酸,其活性决定了L-苯丙氨酸的反应速度及整个黄酮代谢通路的速率[5]。C4H催化植物苯丙烷代谢途径中的第二步反应,作用于肉桂酸对位羟基化反应生成对香豆酸[6]。4CL作用于对香豆酸、咖啡酸、阿魏酸等酚酸类物质反应生成相应的CoA硫酯,为一系列次生代谢产物提供前体物质,其中对香豆酰-CoA直接进入黄酮类物质的生物合成途径中[7]。CHI是黄酮代谢途径的关键酶,催化查尔酮异构化反应生成柚皮素、圣草素等二氢黄酮[8]。研究表明,G6PDH、PAL、C4H、4CL、CHI等是影响植物黄酮类化合物合成积累相关性比较高的酶,在桃[9]、银杏[10]、葡萄柚[11]、马铃薯[12]等植物中得到了验证。目前关于黄酮类物质在‘修水化红’果实成熟过程中动态变化规律及其合成相关酶缺乏相关探索,同时果实成熟过程中的抗氧化能力变化规律鲜有报道。
基于上述研究背景,本试验对2016年8月~10月不同成熟度的‘修水化红’果实黄酮类物质含量及合成相关酶活性与抗氧化能力的动态变化规律进行分析,并进行相关性分析,明确果实成熟过程中的黄酮积累特性及黄酮含量与相关酶活性、抗氧化能力之间的联系与调控关系,为‘修水化红’果实的黄酮质量控制及资源开发利用提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
‘修水化红’:采自江西省修水县西港镇‘修水化红’基地,选择树势和结果基本一致的果树,于2016年8月10日~10月26日,每隔10 d,从树冠中部外围随机采果,并当天运回实验室进行处理,挑选大小均一的果实并分离果皮、果肉(去果籽),混合均匀,一部分进行液氮速冻置于-80 ℃超低温冰箱保存,一部分置于55 ℃热风下干燥磨粉并过60目筛;芦丁(纯度≧98%)、柚皮苷(纯度≧98%)、橙皮苷(纯度≧98%)、新橙皮苷(纯度≧98%)、L-苯丙氨酸、反式肉桂酸、P-香豆酸、查尔酮,北京索莱宝科技有限公司;乙腈(色谱纯),美国天地有限公司;DPPH、ABTS+,上海阿拉丁试剂有限公司;水杨酸、三氯化铁,国药集团化学试剂有限公司。
1.2 仪器与设备
Sp-754PC紫外可见分光光度计,上海光谱仪器有限公司;1260高效液相色谱仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 黄酮类物质含量测定
‘修水化红’总黄酮、橙皮苷的测定参照周明等[13]的方法进行。
1.3.2 黄酮相关酶活性的测定
G6PDH提取及活性测定参照AOKI等[14]的方法并修改。称取适量‘修水化红’样品(果皮1 g,果肉2 g),加入预冷的pH 8.5,0.05 mol/L Tris-HCl缓冲液10 mL(内含1 mmol/L乙二胺四乙酸二钠与0.5 mmol/L二硫苏糖醇),后冰浴研磨成匀浆,4 ℃下12 000 r/min离心15 min,收集上清液测定G6PDH活性。100 μL上清液与3 mL pH 8.5,0.05 mol/L Tris-HCl缓冲液(内含3 mmol/LD-葡萄糖-6磷酸二钠,0.15 mmol/L氧化性辅酶Ⅱ钠盐与2 mmol/L MgCl2)混合,25 ℃水浴下培育3 min以蒸馏水为空白对照,于340 nm下测定吸光值。以单位时间吸光度变化值代表G6PDH活性,用U/(min·g FW)表示。
PAL提取及活性测定参照LI等[15]的方法并修改。称取适量‘修水化红’样品(果皮1 g,果肉2 g),加入预冷的pH 8.8,0.05 mol/L硼酸缓冲液10 mL(内含0.05 mol/L β-巯基乙醇、1 mmol/L乙二胺四乙酸二钠与2%聚乙烯吡咯烷酮),冰浴研磨成匀浆,4 ℃下12 000 r/min离心15 min,收集上清液测定PAL活性。取100 μL上清液与2 mL pH 8.8,0.05 mol/L 硼酸缓冲液、100 μL 0.02 mol/L苯丙氨酸溶液混合,置于37 ℃水浴下反应30 min,后立即加入100 μL 6 mol/L HCl结束反应,以蒸馏水为空白对照,于290 nm下测定吸光度。PAL活性以每小时变化0.01为1个酶活性单位U,表示为U/(h·g FW)。
C4H提取及活性测定参照LAMB等[16]的方法并修改。称取适量‘修水化红’样品(果皮1 g,果肉2 g),加入预冷的pH 8.9,0.05 mol/L Tris-HCl缓冲液10 mL(内含15 μmol/L β-巯基乙醇,10 μmol/L亮抑肽酶,1 mmol/L苯甲基磺酰氟,2.5 mmol/L VC,4 mmol/L MgCl2,0.15%聚乙烯吡咯烷酮与10%甘油),冰浴研磨成匀浆,4 ℃下12 000 r/min离心15 min,收集上清液测定C4H活性。取50 μL上清液与2.95 mL pH 8.9,0.05 mol/L Tris-HCl缓冲液(内含2 μmol/L反式肉桂酸,2 μmol/L氧化性辅酶Ⅱ钠盐及5 μmol/LD-葡萄糖-6磷酸二钠)混合,置于25 ℃水浴下振荡反应30 min,后立即加入100 μL 6 mol/L HCl结束反应,再4 ℃下12 000 r/min离心15 min,取上清液并用2 mol/L NaOH溶液调节pH值至11,以蒸馏水为空白对照,于340 nm下测定吸光度。C4H活性以每分钟变化0.01为1个酶活性单位U,表示为U/(min·g FW)。
4CL提取及活性测定参照KNOBLOCH等[17]的方法并修改。称取适量‘修水化红’样品(果皮1 g,果肉2 g),加入预冷的pH 8.9,0.05 mol/L Tris-HCl缓冲液10 mL(内含1%聚乙烯吡咯烷酮),后冰浴研磨成匀浆,4 ℃下12 000 r/min离心15 min,收集上清液测定4CL活性。取100 μL上清液与3 mL pH 8.9,0.05 mol/L Tris-HCl缓冲液(内含5 mmol/L P-香豆酸,1 μmol/L辅酶A、50 μmol/L 5-三磷酸腺苷二钠及15 μmol/L MgSO4)混合,置于40 ℃水浴下反应10 min,立即加入100 μL 6 mol/L HCl结束反应,以蒸馏水为空白对照,于333 nm下测定吸光度。4CL活性以每分钟变化0.1为1个酶活性单位U,表示为U /(min·gFW)。
CHI提取及活性测定参照LISTER等[18]的方法并修改。称取适量‘修水化红’样品(果皮1 g,果肉2 g),加入预冷的pH 7.0,0.05 mol/L 磷酸钾缓冲液10 mL(内含0.018 mol/L β-巯基乙醇和0.05 mol/L VC),冰浴研磨成匀浆,4 ℃下12 000 r/min离心15 min,收集上清液测定CHI活性。取100 μL上清液与2 mL pH 7.4,0.05 mol/L Tris-HCl缓冲液(内含7.5 mg/L牛血清蛋白和1%乙醇)、50 μL 1 mg/mL查尔酮乙醇溶液混合,置于34 ℃水浴下反应30 min,后立即加入100 μL 6 mol/L HCl结束反应,以蒸馏水为空白对照,于390 nm下测定吸光度。CHI活性以每分钟变化0.001为1个酶活性单位U,表示为U/(min·g FW)。
1.3.3 抗氧化能力的测定
‘修水化红’清除DPPH自由基、·OH、ABTS+·等能力及还原力的测定参照周明等[13]的方法进行。
1.3.4 数据处理
利用Excel 2013和Origin 8.5进行数据处理和作图,SPSS 20.0进行ANOVA分析,采用Duncan′s新复极差法进行差异显著性检验,各项结果均以平均值±标准差表示。
2 结果与分析
2.1 ‘修水化红’成熟过程中总黄酮、橙皮苷含量的变化
由图1-A可知,随着‘修水化红’果实的成熟,果皮总黄酮含量一直在降低,8月10日果皮总黄酮含量最高,达15.01 mg/g DW,10月26日果皮总黄酮含量最低。‘修水化红’果肉总黄酮变化规律与果皮相类似,在10月26日总黄酮含量最低,仅为2.25 mg/g DW。在果实成熟期间,果肉总黄酮含量均显著低于果皮(P<0.05)。如图1-B所示,‘修水化红’果皮与果肉在成熟过程中,橙皮苷含量均不断降低,且果肉橙皮苷含量均显著低于果皮(P<0.05),10月26日时,果皮橙皮苷含量是果肉的2.4倍左右。
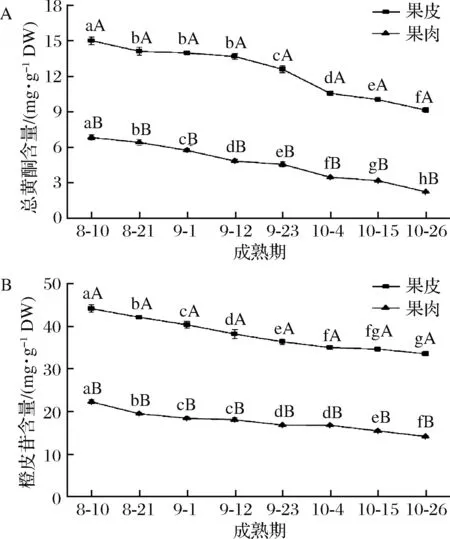
A-总黄酮含量;B-橙皮苷含量图1 ‘修水化红’成熟过程中果实总黄酮与橙皮苷含量变化Fig.1 The change of the total flavonoids and hesperidin content in ‘Xiushui Huahong’ during maturity of fruit注:不同小写字母表示不同成熟期‘修水化红’果皮、果肉组内差异显著(P<0.05),不同大写字母表示同一个成熟期下‘修水化红’果皮与果肉组间差异显著(P<0.05)(下同)
2.2 ‘修水化红’成熟过程中G6PDH活性的变化
由图2可知,‘修水化红’果皮与果肉G6PDH活性在果实的成熟过程中总体呈现降低的趋势,且果皮G6PDH活性均显著高于果肉(P<0.05)。随着果实的成熟,果皮G6PDH活性先下降,在9月12日和10月15日有略微的升高, 10月26日降到最低,仅为0.77 U/(min·g FW)。果肉G6PDH活性在8月21日有略微的升高,与8月10日差异显著(P<0.05),随后降低至0.62 U/(min·g FW),9月12日又增加至0.73 U/(min·g FW)。

图2 ‘修水化红’果实成熟过程中G6PDH酶活性变化Fig.2 The change of the G6PDH activity in ‘Xiushui Huahong’during maturity of fruit
2.3 ‘修水化红’成熟过程中PAL活性的变化
从图3中可以看出,随着果实的成熟,果皮PAL活性一直在降低,8月21日~9月1日,果皮PAL活性下降速度最快,由375.87 U/(h·g FW)快速降低至270.97 U/(h·g FW)。果肉PAL活性在果实的成熟期间先降低,在9月12日有略微的升高,后又继续下降至42.40 U/(h·g FW),仅为8月10日的1/3左右。成熟过程中,果皮PAL酶活性均显著高于果肉(P<0.05),是果肉酶活性的3倍左右。

图3 ‘修水化红’果实成熟过程中PAL活性变化Fig.3 The change of the PAL activity in ‘Xiushui Huahong’during maturity of fruit
2.4 ‘修水化红’成熟过程中C4H活性的变化
从图4可以看出,‘修水化红’果皮C4H活性在成熟过程中先由8月10日的38.97 U/(min·g FW)降低至25.87 U/(min·g FW),后在9月12日有略微的升高,继而继续降低,在10月26日又有略微的升高,但与前一时期差异不显著(P>0.05)。果肉C4H活性在果实成熟过程中呈降低的趋势。成熟过程中‘修水化红’果皮C4H活性均显著高于果肉(P<0.05),8月10日果皮C4H活性是果肉的3倍左右,到10月26日,果皮C4H活性是果肉的5倍左右。
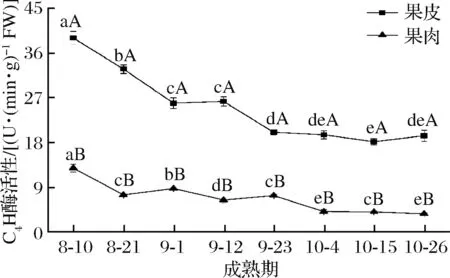
图4 ‘修水化红’果实成熟过程中C4H活性变化Fig.4 The change of the C4H activity in ‘Xiushui Huahong’ during maturity of fruit
2.5 ‘修水化红’成熟过程中4CL酶活性的变化
由图5可知,随着‘修水化红’果实的成熟,果皮与果肉4CL酶活性均呈降低的趋势。不同成熟期果皮4CL活性均显著高于同时期的果肉酶活性(P<0.05),是果肉的1.5倍左右。果皮与果肉4CL活性均在10月15日最低,分别是10.93 U/(min·g FW)、5.16 U/(min·g FW),比8月10日的果皮、果肉分别低35.66%、54.70%。

图5 ‘修水化红’果实成熟过程中4CL酶活性变化Fig.5 The change of the 4CL activity in ‘Xiushui Huahong’ during maturity of fruit
2.6 ‘修水化红’成熟过程中CHI活性的变化
由图6可知,随着果实的成熟,‘修水化红’果皮和果肉CHI活性均一直在降低,果皮酶活性由8月10日的171.01 U/(min·g FW)降低至10月26日的104.10 U/(min·g FW),果肉则由83.28 U/(min·g FW)降低至38.10 U/(min·g FW),同时果皮酶活性均显著高于同时期的果肉(P<0.05)。
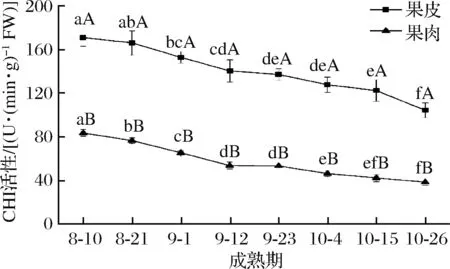
图6 ‘修水化红’果实成熟过程中CHI活性变化Fig.6 The change of the CHI activity in ‘Xiushui Huahong’during maturity of fruit
2.7 ‘修水化红’成熟过程中抗氧化能力的变化
随着果实的成熟,‘修水化红’果皮与果肉的DPPH自由基、·OH、ABTS+·清除率及还原力均表现出的降低趋势,且果皮各指标均显著高于果肉(P<0.05)。
如图7-A所示,‘修水化红’果皮DPPH自由基清除率在9月23日与10月4日有较大的降幅,在10月26日有略微的升高,但与前一时期差异不显著(P>0.05);除9月1日与12日之间的果肉DPPH自由基清除率差异不显著外(P>0.05),其余时期之间都表现出显著的差异(P<0.05),并在10月26日降低速度最大,达13.73%。如图7-B所示,‘修水化红’果皮·OH清除率先降低至73.26%而后升高,再降低至69.65%,比8月10日低9.80%;果肉·OH清除率由8月10日的63.78%降低至10月26日的49.27%,降低幅度比果皮高。
由图7-C可知,果皮ABTS+·清除率在8月21日、9月23日与10月15日均有略微的升高,但都与前一时期的清除率差异不显著(P>0.05),10月15日~10月26日ABTS+·清除率降低速度最大;果肉ABTS+·清除率在9月1日~9月23日期间降低速度较快,进入10月份后,果肉ABTS+·清除率差异不显著(P>0.05)。如图7-D所示,果皮还原力在9月12日和10月15日有略微的升高,10月15日后便大幅度降低至0.406;果肉还原力在成熟过程中先快速地降低至0.388,继而升高,再快速降低,后在10月26日有略微升高。
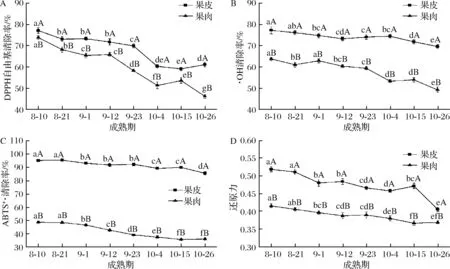
A-DPPH自由基清除率;B-·OH清除率;C-ABST+·清除率;D-还原力图7 ‘修水化红’果实成熟过程中抗氧化能力变化Fig.7 The change of the antioxidant capacity in‘Xiushui Huahong’ during maturity of fruit
2.8 ‘修水化红’果实黄酮含量与相关酶活性的相关性分析
如表1和表2所示,果皮和果肉中的总黄酮含量、橙皮苷含量与G6PDH、PAL、C4H、4CL、CHI等合酶活性均呈极显著正相关(P<0.01)。果皮总黄酮含量与CHI活性相关系数最高,达0.947,其次是PAL,达0.910;果皮橙皮苷含量与PAL活性相关系数最高,达0.988,其次是CHI,达0.972。果皮中的黄酮相关酶活性之间都表现出显著正相关(P<0.05)关系。果肉总黄酮含量、橙皮苷含量都与CHI活性相关系数最高,分别是0.973、0.956,其次是PAL,分别是0.938、0.941。果肉中的5个黄酮相关酶活性之间除了G6PDH与C4H,其他均呈极显著正相关(P<0.01)。

表1 ‘修水化红’成熟过程中果皮总黄酮、橙皮苷含量与相关酶活性相关性分析Table 1 The correlation analysis between the total flavonoids,hesperidin content and related enzyme activity in‘Xiushui Huahong’ peel during maturity of fruit

表2 ‘修水化红’成熟过程中果肉总黄酮、橙皮苷含量与相关酶活性相关性分析Table 2 The correlation analysis between the total flavonoids,hesperidin content and related enzyme activity in ‘Xiushui Huahong’ pulp during maturity of fruit
2.9 ‘修水化红’成熟过程中黄酮含量与抗氧化能力的相关性分析
由表3与表4可知,果皮与果肉的总黄酮、橙皮苷含量与DPPH自由基、·OH、ABTS+·清除率及还原力均呈极显著正相关(P<0.01)。在果皮中,总黄酮、橙皮苷含量都与DPPH自由基清除率相关系数最大,分别为0.971、0.910。在果肉中,总黄酮含量与DPPH自由基清除率相关系数最大,达0.970,而橙皮苷含量与还原力相关系数最大,达0.956。

表3 ‘修水化红’成熟过程中果皮总黄酮、橙皮苷含量与抗氧化能力相关性分析Table 3 The correlation analysis between the total flavonoids,hesperidin content and antioxidant capacity in ‘Xiushui Huahong’ peel during maturity of fruit
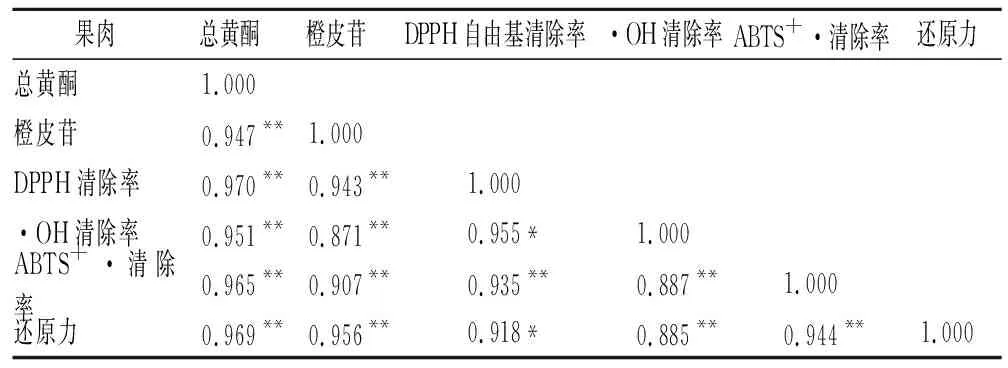
表4 ‘修水化红’成熟过程中果肉总黄酮、橙皮苷含量与抗氧化能力相关性分析Table 4 The correlation analysis between the total flavonoids,hesperidin content and antioxidant capacity in‘Xiushui Huahong’ pulp during maturity of fruit
3 讨论
3.1 ‘修水化红’成熟过程中黄酮含量变化分析及其开发利用
黄酮类化合物是柑橘果实含量最丰富的次生代谢产物。研究表明,黄酮物质广泛存在于柑橘类水果的皮、肉、汁及种子中,其中甜橙皮约占全果重的30%,但黄酮含量是最高的[19]。本试验中,‘修水化红’皮总黄酮和橙皮苷含量均高于同时期的果肉。ZHAO等[20]在研究纽荷尔脐橙橙皮苷分布时也发现橙皮苷主要积累在果皮中且果皮橙皮苷含量是果肉的7~8倍。柑橘果实成熟度不同,其黄酮含量也不同,柑橘幼果黄酮类物质含量最高,随着成熟度的增加,果实橙皮苷、柚皮苷等黄酮含量降低[21]。本研究中,‘修水化红’在成熟过程中,其果皮和果肉总黄酮与橙皮苷含量一直在降低,与前人的研究相吻合。对比研究发现10月26日修水化红橙皮苷含量均高于同时期左右采收的南丰蜜桔早熟系品种、新余蜜橘、台湾椪柑、安岳尤力克柠檬[22-24],因此在这些柑橘类水果中,‘修水化红’皮是橙皮苷较好来源之一,我们可充分利用这一优势来开发富含黄酮类物质的功能性食品。从总黄酮与橙皮苷含量的角度上,我们可以在8月初,果实开始进入膨大期进行采收。
3.2 ‘修水化红’成熟过程中黄酮含量与相关酶活性的关系探讨
G6PDH活性增强导致代谢产物苯丙氨酸含量增加和PAL活性增强[9]。PAL是苯丙烷途径的关键酶,其与总酚、木质素、生物碱与类黄酮等次生代谢产物合成密切相关[25]。C4H控制黄酮类化合物前体物质简单酚的合成,4CL是苯丙烷代谢从主途径进入分支途径的关键酶,CHI控制苯丙烷代谢向黄酮类物质合成的转化,活性高伴随着代谢产物类黄酮的大量积累。本研究结果显示,‘修水化红’果皮和果肉在成熟期间总黄酮、橙皮苷含量与G6PDH、PAL、C4H、4CL、CHI的活性变化趋势一致,并呈极显著正相关,表明这5种合成酶均是影响‘修水化红’果皮与果肉黄酮物质含量的重要酶,通过提高这些酶的活性可能促进‘修水化红’黄酮的积累。果皮总黄酮含量与CHI活性相关系数最高,橙皮苷含量与PAL活性相关系数最高,果肉总黄酮与橙皮苷含量都与CHI活性相关系数最高,因此推测CHI与PAL是在‘修水化红’果实黄酮合成中起着最主要作用的关键酶,但有待采用分子生物学方法进一步确认。KONG等[26]在研究金银花绿原酸积累与相关合成酶关系中发现在金银花生长发育前期PAL、C4H、4CL与CHI活性变化趋势一致,我们在‘修水化红’中也发现了类似的规律,且‘修水化红’果皮和果肉5种黄酮合成酶之间均呈正相关,相关系数大于0.7,有的存在显著或极显著正相关关系,表明G6PDH、PAL、C4H、4CL、CHI之间可能存在相互协同和双向调控的关系,最终促进‘修水化红’果实黄酮积累。此外,‘修水化红’果皮与果肉合成酶活性变化规律并不完全一致,且果皮5种合成酶活性均显著高于果肉,这可能是‘修水化红’果皮直接与外界环境相接触,成熟过程中长期遭受非生物或生物胁迫促使合成酶活性增强、生成较多的黄酮物质适应环境压力[27]。值得关注的是,‘修水化红’5种黄酮合成酶活性在成熟过程中均呈降低的趋势。前人结果显示黄酮相关合成酶活性易受一些环境因子影响,强光、水分胁迫等在一定程度上会促进酶活性增强,‘修水化红’果实成熟前期黄酮合成酶活性较高可能是受到季节性的强光辐射和土壤水分低的影响,成为维持果皮、果肉黄酮含量较高的一个原因[28]。综上所述, G6PDH、PAL、C4H、4CL、CHI等合成酶活性减弱可能是果皮和果肉总黄酮、橙皮苷含量降低的主要原因。
3.3 ‘修水化红’成熟过程中黄酮含量与抗氧化能力的关系
柑橘类果实是重要的天然抗氧化剂,所含的总酚、黄酮等植物化学物是其抗氧化能力的物质基础[29]。BARROS等[30]在研究巴西佩拉与利马甜橙抗氧化能力中发现,两个品种的甜橙果皮DPPH自由基清除率及FRAP铁离子还原力均显著高于果肉,果皮是甜橙果实起抗氧化能力的主要组织,在‘修水化红’中也得到了验证。‘修水化红’果皮和果肉中的黄酮含量与抗氧化能力相关性分析显示不论是果皮还是果肉,总黄酮、橙皮苷含量均与DPPH自由基、·OH、ABTS+·清除能力及还原力呈极显著正相关,这表明黄酮物质是‘修水化红’果实发挥抗氧化能力的主要物质,同时也印证了黄酮类化合物是‘修水化红’果实主要的抗氧化成分。
4 结论
‘修水化红’的果皮与果肉总黄酮及橙皮苷含量在果实成熟过程中均呈逐渐降低的趋势,且果皮均显著高于果肉。G6PDH、PAL、C4H、4CL、CHI在‘修水化红’果实成熟过程中活性逐渐减弱,相关性分析表明,5种合成酶在果实总黄酮、橙皮苷的积累均发挥着重要的作用,且CHI与PAL起着最主要的作用,成熟过程中果实黄酮含量降低可能是由于相关合成酶活性减弱。‘修水化红’果皮及果肉清除DPPH自由基、·OH、ABTS+·能力与还原能力也随着成熟度的增大而表现出逐渐下降的规律。相关性分析证明总黄酮、橙皮苷是‘修水化红’果实主要的抗氧化成分。

