HMBR内微生物群落结构分析及功能菌脱氮机理
李 莹,史浩辰,刘 强,郑晓英,郑嘉雄,项 玮,曲吉祥
(1.徐州工程学院环境工程学院,江苏 徐州 221018;2.浅水湖泊综合治理与资源开发教育部重点实验室,河海大学,江苏 南京 210098; 3.河海大学环境学院,江苏 南京 210098;4.陆军工程大学,江苏 徐州 221000)
膜生物反应器(membrane bio-reactor,MBR)因具有低成本、处理效果显著等特点,被广泛应用于污水处理中[1]。很多学者对MBR的运行效果、反应器内部的微生物群落结构及功能菌开展了研究[2-3],发现整个系统中存在着丰富的亚硝化菌、硝化菌和反硝化菌,微生物类群在好氧段中与硝化过程中非常丰富,而在缺氧段与反硝化相关的微生物较多。
将悬浮填料与MBR有机结合的复合式膜生物反应器(hybrid membrane bioreactors,HMBR)工艺,除了具有活性污泥和MBR的优点外,还能提高各种污染物的去除效果[4]。关于HMBR的研究大多着眼于其污水处理效果[5-6],而对于HMBR工艺反应器内不同作用单元(微滤膜、悬浮填料、活性污泥混合液)中微生物的多样性和群落结构差异,以及从微生物功能角度解析污染物脱氮机理的研究较少[7]。因此本文以脱氮菌为分析对象,通过分析比较HMBR装置内不同位置所含活性污泥内微生物群落结构,以期为脱氮机理的研究提供一定参考。
1 材料与方法
1.1 试验装置
HMBR系统见图1,该反应器为有机玻璃材质,有效容积为1.0 m3。反应器中填料投加百分比为50%,反应器中污泥取自某污水厂二沉池的回流污泥。该系统膜组件由PVDF材料制成,膜孔径为0.2 μm,膜面积为1.0m2,膜通量为10.0 L/(m2·h-1),采取间歇交替运行的方式,每运行4 min暂停2 min。试验过程中控制该反应装置内部环境的pH值为7.5左右,DO控制在4.0 mg/L,温度为20℃。根据之前的研究结论[8],反应器的最佳运行工况水力停留时间(HRT)为10 h,污泥停留时间(SRT)为30 d。
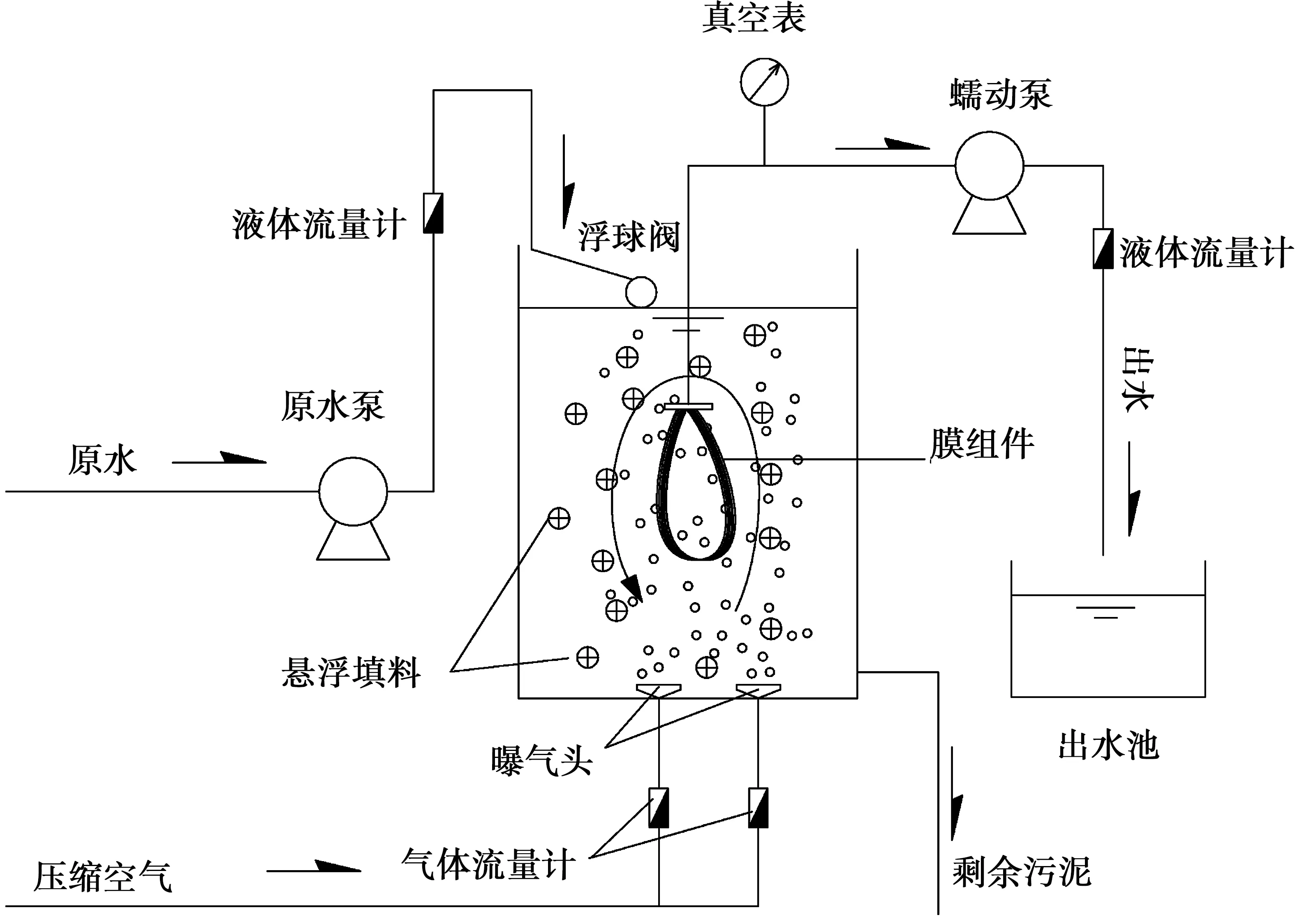
图1 复合式膜生物反应器装置构造示意
1.2 试验用水
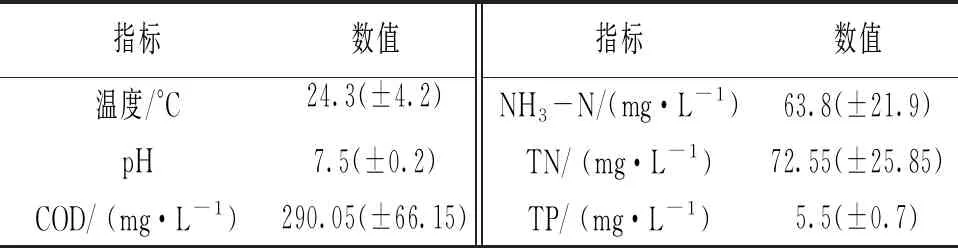
表1 原水水质指标
1.3 检测项目及方法
1.3.1常规水质指标测定方法
常规水质指标测定方法见表2。

表2 常规检测项目及其检测方法
1.3.2高通量测序
将黏附在膜丝(C1)和悬浮填料(C2)表面的生物质用塑料刀片小心地刮下,从反应器底部剩余污泥排放口收集活性污泥样本(C3),稳定运行2个周期,运行结束时共收集到6个样本,即C1-1、C1-2、C2-1、C2-2、C3-1和C3-2。送检前将所有样本保存在-20℃冰箱的无菌离心管中,送检时将所有样本置于含有足够干冰的保温箱中运送到微基生物科技(上海)有限公司(中国上海),进行DNA提取和高通量测序。
采用二次扩增的方法提高目标DNA的纯度,PCR扩增体系的参数见表3。第一次PCR扩增条件为94°C下预变性2 min;94°C下变性30 s,56°C下退火30 s,72°C下延伸30 s,总共23个扩增循环;最后72°C下延伸5 min,10°C保存。第二次PCR扩增条件为94°C下预变性2 min;94°C下变性30 s,56°C下退火30 s,72°C下延伸30 s,总共8个扩增循环;最后72°C下延伸5 min,10°C保存。根据试验需求,设计引物如下。
F内侧引物:5′-TTCCCTACACGACGCTCTTCCGATCT-barcodeF1特异引物-3′;
F外侧引物:5′-AATGATACGGCGACCACCGAGATCTACAC-TCTTTCCCTACACGACGCTC-3′;
R内侧引物:5′-GAGTTCCTTGGCACCCGAGAATTCCA- barcodeR1特异引物-3′;
在小组合作过程中,为了更大地发挥同学之间的合作效能,可采用下列竞争方法,如:表扬激励法、小组得分制、评选最佳组员等,可采用激励性语言,并把小组合作成果具体量化,进行评比、给予公布。
R外侧引物:5′-CAAGCAGAAGACGGCATACGAGAT- barcodeR2 -GTGACTGGAGTTCCTTGGCACCCGAGA-3′。
2 结果与分析
2.1 系统处理效果分析
试验中HMBR系统处理后出水的理化指标见表4。按照GB 8978—1996《污水综合排放标准》、GB 18918—2002《城镇污水处理厂污染物排放标准》,出水满足污水综合排放的二级标准。该工况下HMBR对于COD和NH3-N的平均去除率分别高达94.2%、98.0%,对于TP和TN平均去除率分别达到了76.3%、40.6%左右。而传统MBR系统处理COD、NH3-N、TN和TP的最高去除率分别是90%、98%、50%、63%[9],与传统MBR系统相比,HMBR系统在较难处理的TN和TP上平均去除率分别提高了52.60%、55.17%。这可能归因于本系统中生物膜内层形成的厌氧微环境使得反应器内部具有更多元化的环境,有利于各种类型微生物的代谢,特别是具有脱碳脱氮除磷功能的微生物,因此生物膜内层可以进行反硝化反应,故而脱氮效果较传统活性污泥工艺有明显提高。为了从生物学角度揭示HMBR去除污染机理,下面将从群落结构和功能菌的角度进行探讨。
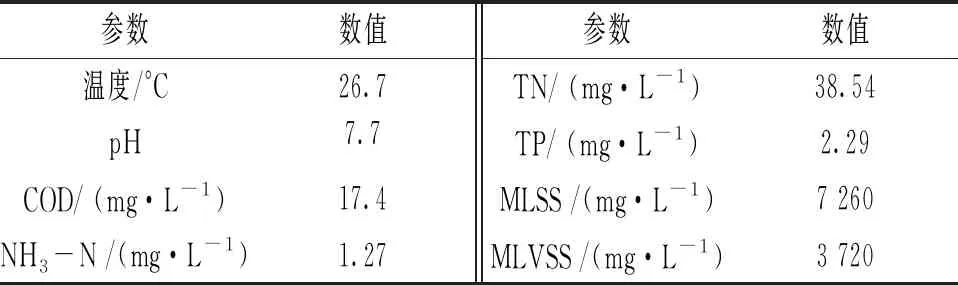
表4 HMBR工艺运行效果
2.2 微生物群落多样性分析
2.2.1各样本 Alpha 多样性分析
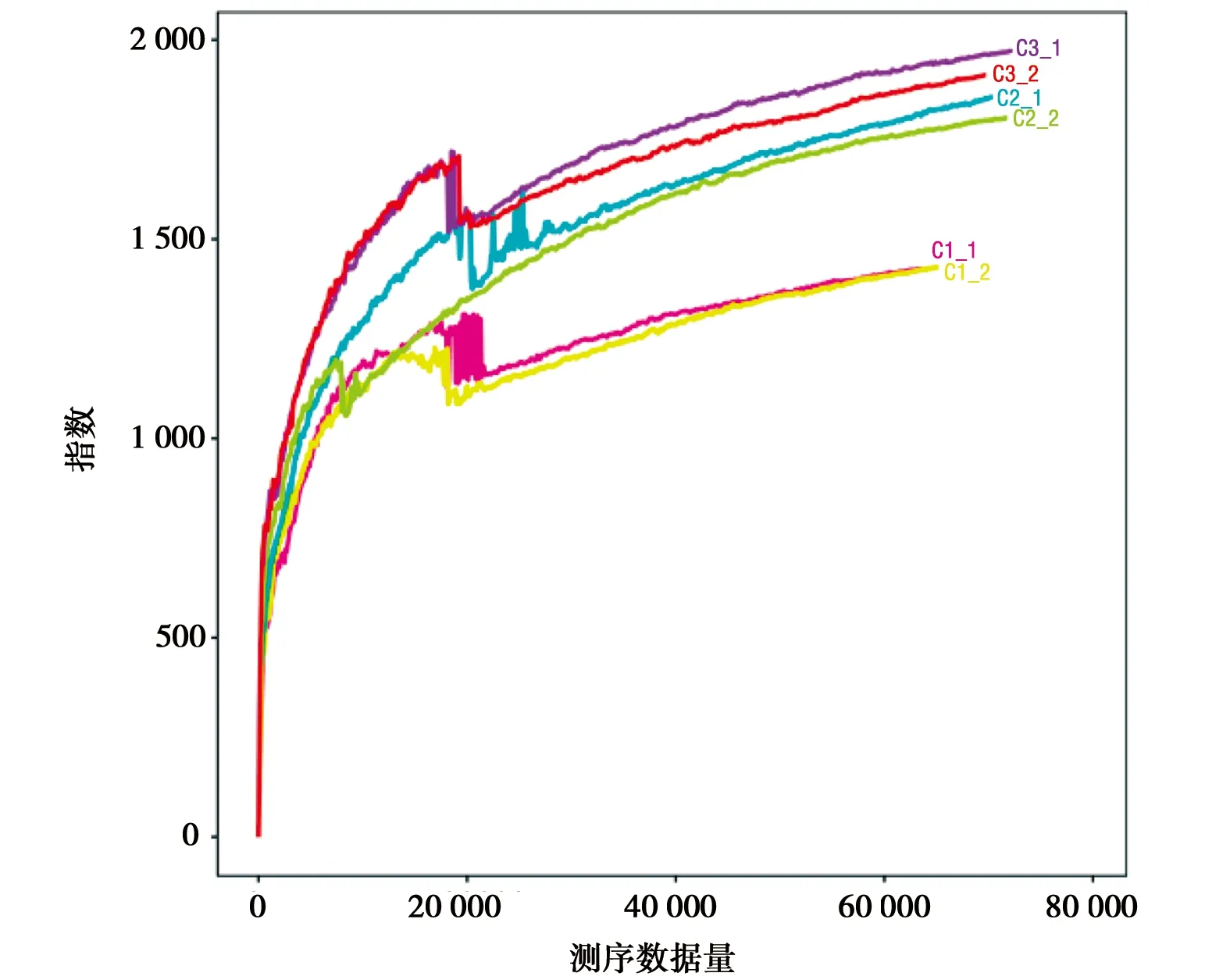
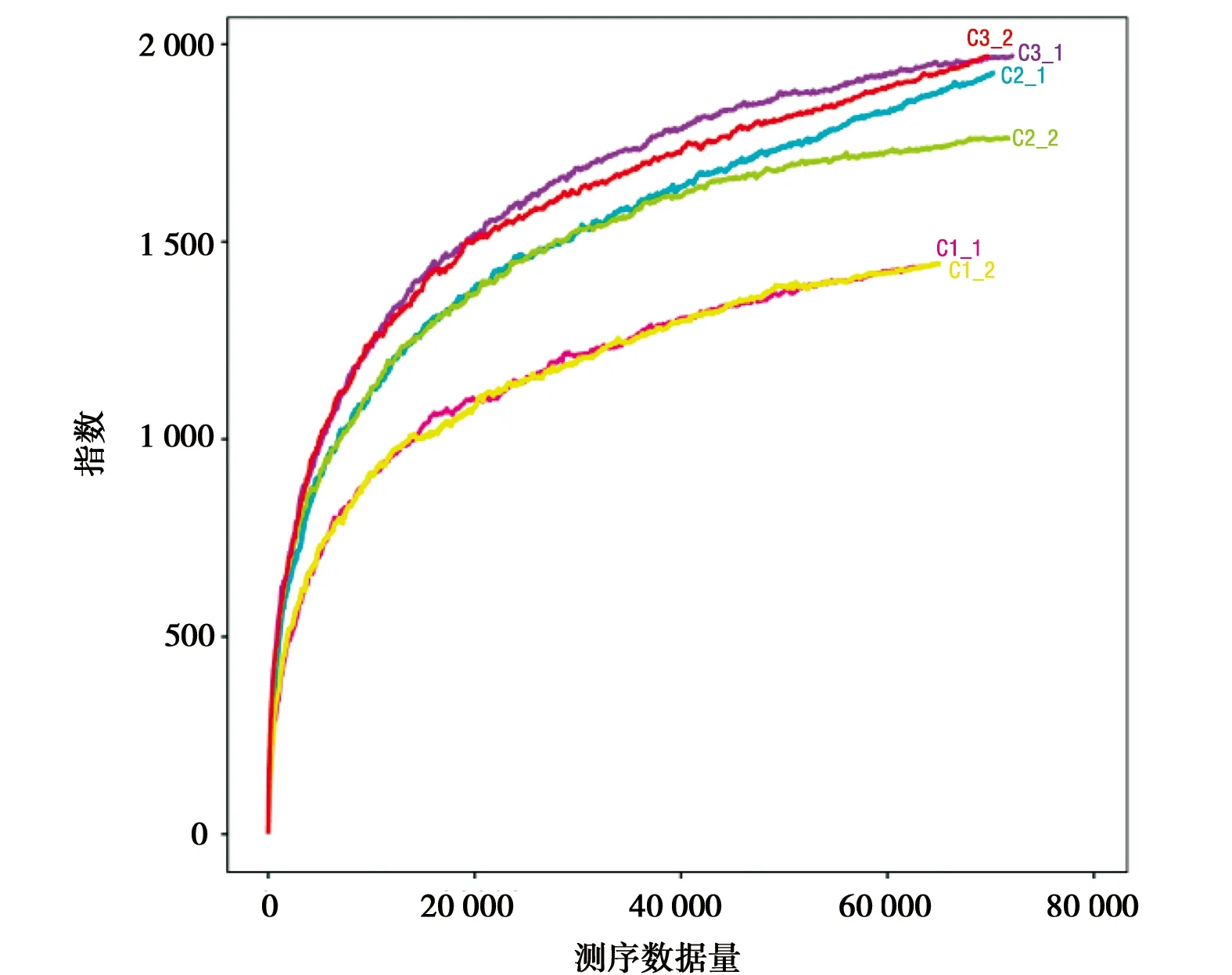
图2所示,6个样本的稀释性曲线皆趋于平缓,可见样品的测序数据量趋于饱和,即样本的测序深度已经能够较为精准地反映出样品中OTU的丰富程度。根据图3中的Chao指数曲线和Ace指数曲线可见C3组的OTU总数最大,C2组次之,C3最小,而根据Shannon指数和Simpson指数可知三组的物种丰富度呈现出C2组>C3组>C1组。
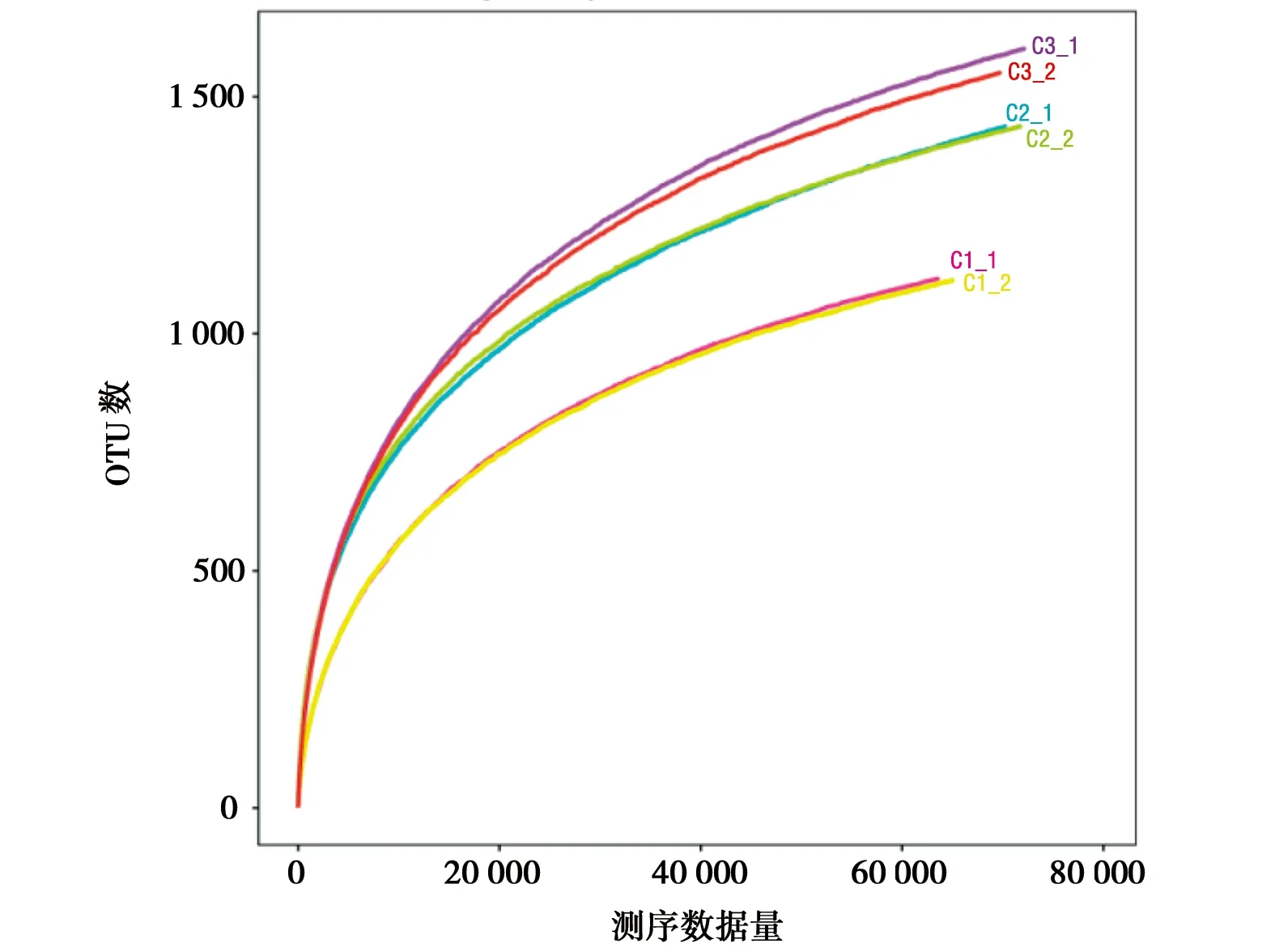
图2 稀释性曲线
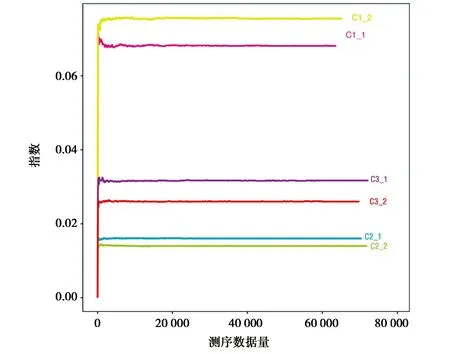
a) Simpson图3 Alpha多样性指数
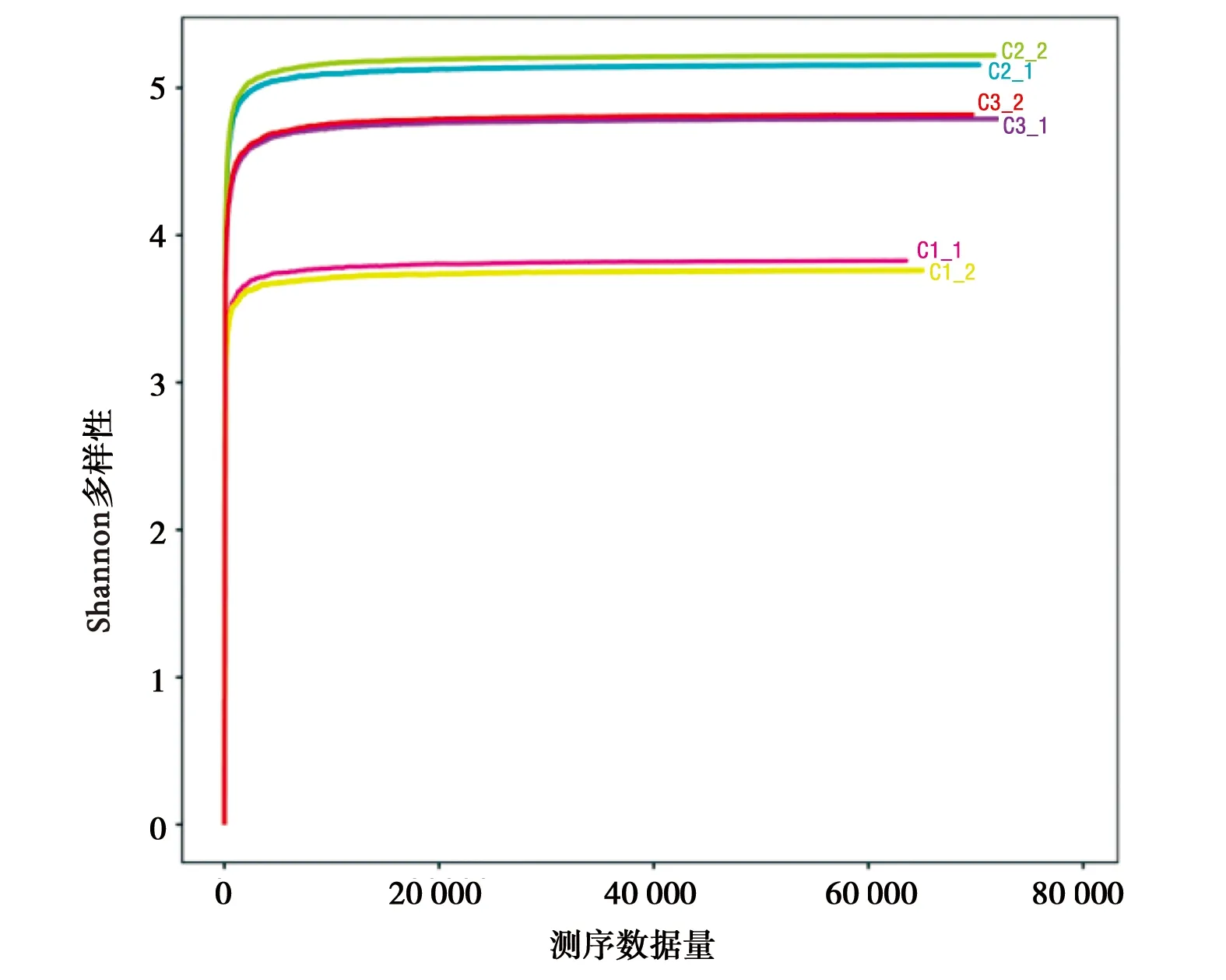
b) Shannon指数曲线
c) Ace
d) Chao续图3 Alpha多样性指数
2.2.2样本间Venn分析
Venn(花瓣)图可用于统计多个样品中所共有和独有的OTU数目,可以比较直观地表现环境样品的OTU数目组成相似性及重叠情况。将C1、C2、C3 3个组别中的平行样取平均值统计后得图4、表5。3个组别中共有的OTU数目为1 034个,其中3个组别独有的OTU数目分别为122个(C1),235个(C2)以及252个(C3),两两样本之间分别有44个(C1∩C2)、439个(C2∩C3)和173个OTU(C1∩C3)。由此可见,C2、C3组的样品微生物组成结构上更为接近。
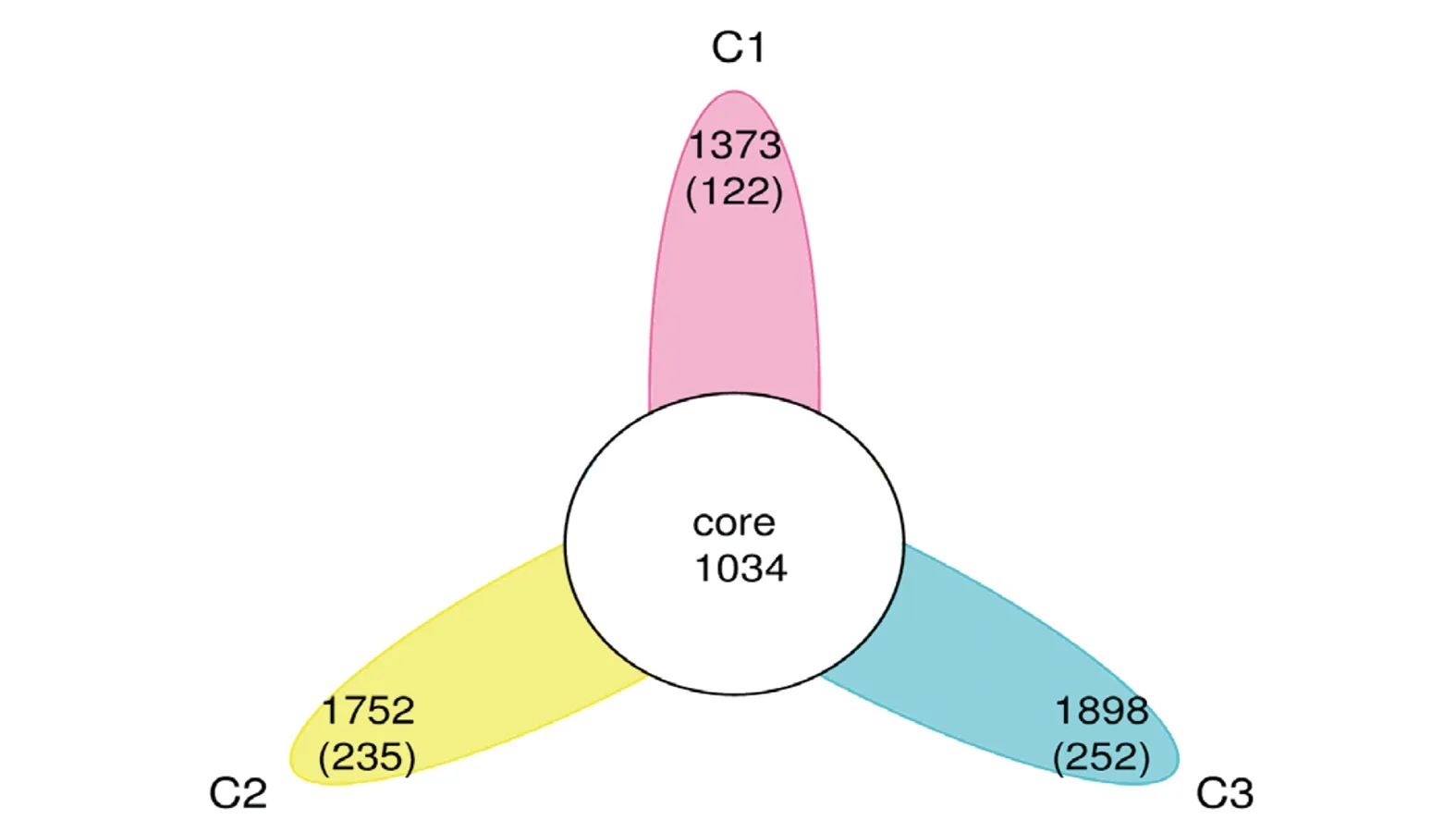
图4 C组Venn花瓣

表5 各组别OTU共有数目交集
2.2.3基于OTU的Beta 多样性分析
通过对3组样品的聚类分析以及差异性分析,图5所示,3个组别因位置的区别在微生物进化方面存在明显差异,而C1与C3在门水平下进化相似度较高。通过分析统计出相对丰度大于1%的菌属,作为3组样品中的优势菌属。其中,C1组别样品中的优势菌属依次为:变形菌门(Proteobacteria,68.7%)、拟杆菌门(Bacteroidetes,16.6%)、厚壁菌门(Firmicute,6.7%)和酸杆菌门(Actinobacteria,4.2%);C2组别样品中的优势菌属依次为:变形菌门(Proteobacteria,54.4%)、拟杆菌门(Bacteroidetes,18.0%)、浮霉菌门(Planctomycetes,8.4%)和厚壁菌门(Firmicute,7.6%),绿弯菌门(Chloroflexi,3.2%)和蓝藻细菌门(Cyanobacteria,2.0%), 酸杆菌门(Actinobacteria,1.9%);C3组别样品中的优势菌属依次为:变形菌门(Proteobacteria,63.4%)、厚壁菌门(Firmicute,12.1%)、拟杆菌门(Bacteroidetes,7.7%)、酸杆菌门(Actinobacteria,5.6%)、浮霉菌门(Planctomycetes,3.7%)、绿弯菌门(Chloroflexi,2.9%)、蓝藻细菌门(Cyanobacteria,1.1%)。
由图5可知,Proteobacteria(变形菌门)是膜丝污泥、活性污泥和和悬浮填料中的绝对优势菌群[10-11]。Proteobacteria为革兰氏阴性菌,大部分Proteobacteria能够以有机物作为碳源,代谢类型多种多样,是典型的兼性异养菌,污水中的COD大部分由此类微生物降解[12]。由分析结果还可以得知在此HMBR工艺中,脱碳菌主要存在于膜丝表面和悬浮填料表面。相较于Proteobacteria(变形菌门)而言,Bacteroidetes(拟杆菌门)在系统中相对丰度较小,但仍然是优势菌种,特别是在C1、C2中(相对丰度分别为16.6%、18.2%)。Bacteroidetes(拟杆菌门)是化能异养菌,能够降解纤维素、淀粉、蛋白质、脂类等大分子有机物[13]。
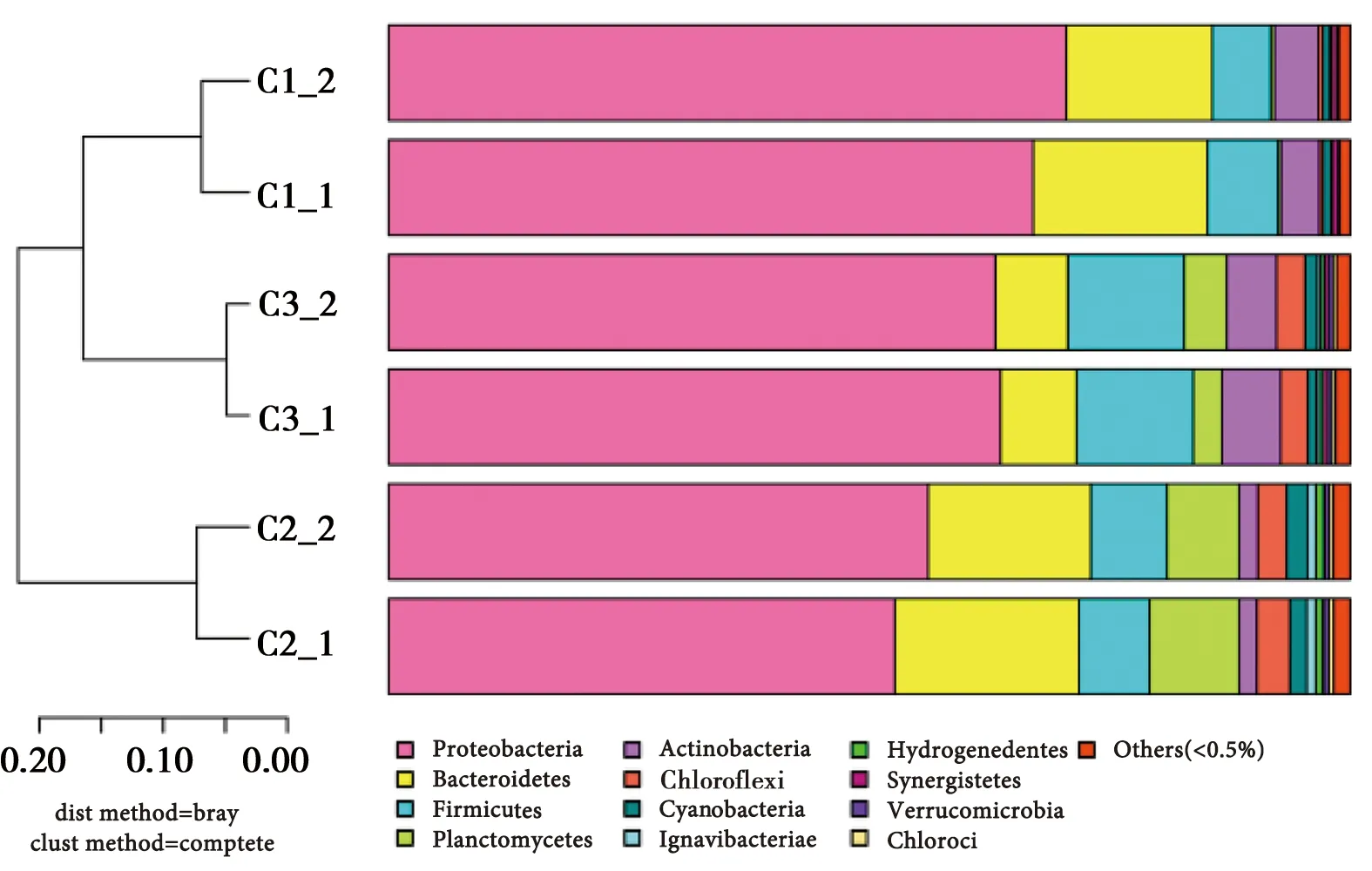
图5 门水平样品聚类树与柱状图组合分析
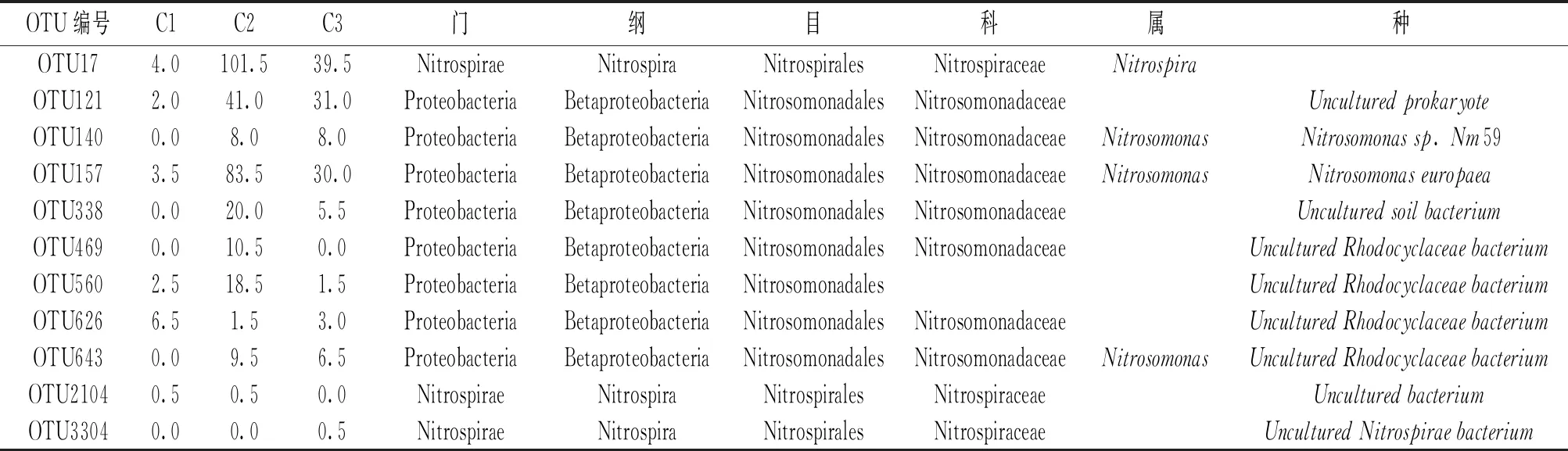
表6 HMBR(膜生物反应器)系统中硝化作用微生物分类统计
悬浮填料的投加增加了Proteobacteria(变形菌门)和Bacteroidetes(拟杆菌门)的数量,与传统的MBR相比能够提高污染物的去除率。
2.3 脱氮菌分析
此HMBR系统检测到的两大AOB优势菌群,分别是Nitrosomonas(亚硝化单胞菌,50.9%)和未培养菌(49.1%);在NOB克隆文库中检测到传统的硝化菌属——Nitrospira(硝化螺菌属),而没有检测到另一个传统的硝化菌属——Nitrosococcus(硝化杆菌属)。进一步分析AOB和NOB在本反应器内分布的位置可知,AOB和NOB主要存在于悬浮填料表面,这是因为这两类微生物的世代时间较长,而膜生物反应器中悬浮填料上的微生物生长在固定的载体上,其SRT和HRT可分别控制,因此有利于亚硝酸菌和硝酸菌的生长。通过分析Nitrosomonas和Nitrospira在不同污泥样品中的相对丰度可知,硝化作用主要在活性污泥混合液和悬浮填料上进行,因此可以推断HMBR中悬浮填料的投加能够促进硝化作用。
生物脱氮的最后一个环节是反硝化,传统的反硝化过程是由反硝化菌在缺氧或厌氧环境下将硝酸氮和亚硝酸氮还原成N2,能够进行这类反应的细菌主要有Proteus(变形杆菌属)、Micrococcus(微球菌属)、Bacillus(芽胞杆菌属)、Alcaligenes(产碱杆菌属)、Flavobacterium(黄杆菌属)等兼性细菌,在本HMBR系统中检测到的有Micrococcus、Pseudomonas、Bacillus、Alcaligenes和Flavobacterium,其中Flavobacterium的相对丰度较高。除了厌氧反硝化菌外,在本系统的混合液和膜丝表面还检测到好氧反硝化菌属,比如从属于β-Proteobacteria的Comamonas(丛毛单胞菌属)和Pseudomonas(假单胞菌属),说明此反应器内存在同步硝化反硝化过程。
3 结论
本文研究了HMBR的污染物去除效果,从微生物学角度比较分析了HMBR内部各单元的群落结构差异,并探讨了功能微生物脱氮菌在HMBR内的分布特点及原因,得到以下结论。
a) 本试验测序数据量合理,可以反映样品中的真实情况;各样本差异明显,膜丝和混合液中的微生物在门水平下发育关系更为接近;HMBR系统中的绝对优势种群为变形菌门(Proteobacteria),占克隆子总数的62.18%,其次是拟杆菌门(Bacteroidetes),优势菌群与常规活性污泥系统、脱氮系统、除磷系统的优势菌群类似。
b) HMBR中含有丰富的脱氮菌,亚硝化和硝化过程主要由悬浮填料表面的AOB和NOB完成,反硝化反应主要发生在混合液和膜丝表面,这些微生物相互协作,共同完成整个系统的脱氮过程。
c) 悬浮填料的投加促进了厌氧环境的形成,多种代谢类型的微生物的大量存在表明系统内同时存在好氧反硝化、异养硝化和同步硝化反硝化等多种脱氮途径,从而提高了脱氮效率。

