活络通脑片对大鼠脑缺血再灌注损伤的治疗作用
林艳霞,张胜杰,耿海局,王权,马仁强,陈健文*(.深圳市健元医药科技有限公司,广东 深圳5888;.中山大学药学院,广州 50006)
脑卒中俗称中风,是一种严重威胁人类生命健康的神经系统疾病,具有高发病率、高致死率和高致残率的特点。脑卒中死亡率已超过缺血性心脏病、肺癌、慢性阻塞性肺疾病和肝癌,仅次于恶性肿瘤,每年大约有2200 万人发病[1]。脑卒中主要包括缺血性脑卒中、出血性脑卒中和蛛网膜下腔出血,以缺血性脑卒中最为常见(占87%[2]),其中患者病后残疾率高达25%[3]。目前,关于缺血性脑卒中的治疗指南推荐的方法包括溶栓、脑神经元保护、降低颅内压、抗凝、抗血小板聚集、降纤、脑血管支架植入、康复及心理治疗、改善脑循环等,后续治疗药物却相对有限。因此,研发疗效确切的新药十分必要。
我国传统中医药源远流长,具有本身独特的理论体系和疗效优势。活络通脑片是一种依据传统中医药理论组方,利用现代化技术手段制成的中成药片剂。本研究拟利用大鼠脑缺血再灌注模型来考察活络通脑片的药理作用,探究其对大鼠脑缺血的治疗作用,为后期开发应用提供药理学依据。
1 材料
1.1 实验动物
SPF 级雄性Wistar 大鼠[南方医科大学实验动物中心,许可证号:SCXK(粤)2016-0041,200 ~240 g],饲养于中山大学实验动物中心屏障系统,实验动物使用许可证号:SYXK(粤)2016-0112。
1.2 仪器
电热恒温干燥箱(长沙医疗器械厂,101-4A);AB104S 电子天平、SB32000电子天平(METTLER TOLEDO);脱水机(TP1020)、石蜡包埋机(EG1160)、切片机(RM2155)、生物荧光显微镜(DM5000B)(Leica);血小板聚集仪(上海医大仪器厂,QX-200);大鼠MCAO 专用栓线(北京沙东生物技术公司,2432-AAA)等。
1.3 试药
活络通脑片提取物干粉(未醇沉工艺样品,HRT,批号:16070601,中山大学药学院);银杏叶片(深圳海王药业,批号:20160102)。BSA(Sigma公 司),羊 抗 兔-IgG(Abcam,ab97049),SABC(博士德公司),DAB 显色试剂盒(Roche),血小板活化因子(PAF,SIGMA),bFGF 抗体(Abcam,ab108319),BDNF 抗体(Abcam,ab106245)等。
2 方法
2.1 造模及神经学评分标准
参考文献[4]制备大鼠缺血再灌注模型,同法制备假手术组。完成后,按照Zea Longa 的5 分制评分标准进行神经病学评分,0 分:无明显神经缺损症状;1 分:不能完全伸展对侧前爪;2 分:向外侧转圈;3 分:向对侧倾倒;4 分:不能自行行走。
2.2 分组及给药
将神经评分1 ~3 分的大鼠随机分为5 组,分别为模型对照组,HRT 低、中、高剂量组(85、170、340 mg·kg-1)和阳性对照组(银杏叶片26 mg·kg-1),每组15 只。另设假手术组大鼠10 只。造模24 h 后开始灌胃给药;每日给药1 次,连续给药14 d。药物用蒸馏水配制成相应的浓度,使给药体积均为10 mL·kg-1。模型对照组和假手术组大鼠同法给予药物溶剂蒸馏水。
2.3 神经学评分
观察大鼠行为学变化,参考Zea Longa 的5分制评分标准进行神经病学评分。于给药前(造模24 h)及给药后3、7、10、14 d 为观察时间点进行检测。
2.4 行为学观察
2.4.1 横木行走实验 横木行走实验用于评价脑缺血再灌注损伤后动物运动协调能力和整合缺损。根据文献[5]报道方法于给药前(造模24 h 后)以及给药后3、7、10、14 d 对大鼠进行运动功能评价。
2.4.2 前肢抓握力量测试 前肢抓握力量测试评价动物脑缺血再灌注损伤后前肢抓握力量的大小。参考文献[6]方法分别于给药前(造模24 h 后)及给药后3、7、10、14 d 测试大鼠的前肢抓握力量。
2.5 血小板聚集实验
末次给药后120 min 从腹腔静脉抽血,以柠檬酸钠抗凝,每管0.5 mL,用PAF(终浓度为1 nmol·L-1)诱导全血血小板聚集,以QX-200 全血血小板聚集仪测定聚集度(Ω),并计算血小板聚集抑制率。
2.6 免疫组化实验
于给药14 d 后,麻醉大鼠,4%的多聚甲醛液灌注固定后断头取脑,除去小脑和脑干后分成三等份,取中间部分固定2 d,常规脱水、石蜡包埋,切片,厚5 μm。分别进行BDNF 和bFGF 免疫组化实验。具体方法如下:常规脱水、抗原修复后,PBS 洗涤3 次,室温封闭30 min 后分别滴加适量的含抗体BDNF(1∶100)和bFGF(1∶100)的一抗稀释液,4℃过夜,PBS 洗涤3 次,同法滴加适量含二抗(羊抗兔1∶2000)的二抗稀释液,37℃孵育30 min,PBS 洗涤3 次×5 min 后,常规DAB 显色后用中性树胶封片。根据大鼠脑缺血半暗带的定位方法,取半暗带和海马相近部位同倍(400×)的6 个不同视野,用图像分析系统对BDNF 和bFGF 免疫组织化学染色阳性细胞平均吸收光密度(OD值)进行统计分析,取平均值。
2.7 脑部病理检查
常规HE 染色,光镜下观察大鼠大脑皮质区和海马区病理学变化,并参考文献[7]方法进行评分:未观察到组织学改变,0 分;组织学改变比例10%~20%,1 分;组织学改变比例21%~40%,2 分;组织学改变比例41%~100%,3 分。
2.8 数据统计
采用SPSS 23.0 软件进行数据统计分析,实验结果以均数±标准差(±s)表示,多组样本采用One-Way ANOVA 分析,两组样本采用t检验,P<0.05 为差异有统计学意义。
3 结果
3.1 HRT 对模型大鼠神经学评分的影响
与假手术组比较,模型对照组大鼠给药前及给药3、7、10 和14 d 神经功能缺损评分均有所升高(P<0.05)。与模型对照组相比,给药10 d和14 d,HRT 中、高剂量组以及阳性对照组均可改善神经功能缺损评分(P<0.05),见表1。
表1 HRT 对模型大鼠神经学评分的影响(分,± s)Tab 1 Effect of HRT on the neurological score in rats (score,± s)

表1 HRT 对模型大鼠神经学评分的影响(分,± s)Tab 1 Effect of HRT on the neurological score in rats (score,± s)
注:与假手术组比较,aP <0.05;与模型对照组比较,bP <0.05。Note:Compared with the sham group,aP <0.05;compared with the model group,bP <0.05.
组别 给药前 给药3 d 给药7 d 给药10 d 给药14 d 存活率/n(%)假手术组 0.05±0.11 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 10(100)模型对照组 1.62±0.48a 1.58±0.70a 1.38±0.62a 1.23±0.52a 1.18±0.46a 11(73)HRT 低剂量组 1.64±0.53 1.33±0.49 0.14±0.50 1.05±0.50 1.02±0.50 11(73)HRT 中剂量组 1.62±0.52 1.35±0.47 1.17±0.33 0.83±0.25b 0.79±0.26b 11(73)HRT 高剂量组 1.59±0.51 1.27±0.47 0.98±0.39 0.81±0.25b 0.77±0.26b 13(87)阳性对照组 1.62±0.47 1.35±0.43 1.24±0.40 0.83±0.33b 0.79±0.33b 12(80)
3.2 HRT 对模型大鼠横木行走能力的影响
与假手术组比较,模型对照组大鼠给药前以及给药3、7、10 和14 d 平衡木行走评分均有下降(P<0.05)。与模型对照组比较,HRT 中、高剂量组和阳性对照组大鼠给药后7、10 和14 d 横木行走能力均有所改善(P<0.05),见表2。
3.3 HRT 对模型大鼠前肢抓握力的影响
与假手术组比较,模型对照组大鼠给药前以及给药3、7、10 和14 d 前肢抓握力均明显降低(P<0.05)。与模型对照组比较,HRT 高剂量组大鼠给药后7 ~14 d 前肢抓握力有显著改善(P<0.05),见表3。
3.4 HRT 对模型大鼠血小板聚集的影响
与模型对照组比较,HRT 各剂量组及阳性对照组均能明显抑制PAF 诱导的体外血小板聚集(P<0.05),见表4。
3.5 HRT 对模型大鼠海马及半暗带BDNF 和bFGF 表达的影响
与假手术组比较,模型对照组海马及半暗带中bFGF 和BDNF 的表达改变不明显,差异无统计学意义(P>0.05);与模型对照组相比,HRT高剂量组海马bFGF 表达量增加(P<0.05),HRT中、高剂量组和阳性对照组海马BDNF 表达量增加(P<0.05);HRT 中、高剂量组和阳性对照组半暗带bFGF 表达量增加(P<0.05),HRT 中、高剂量组半暗带BDNF 表达增加(P<0.05),见表5。
表2 HRT 对模型大鼠横木行走能力的影响(分,± s)Tab 2 Effect of HRT on the beam-walking performance in rats (score,± s)
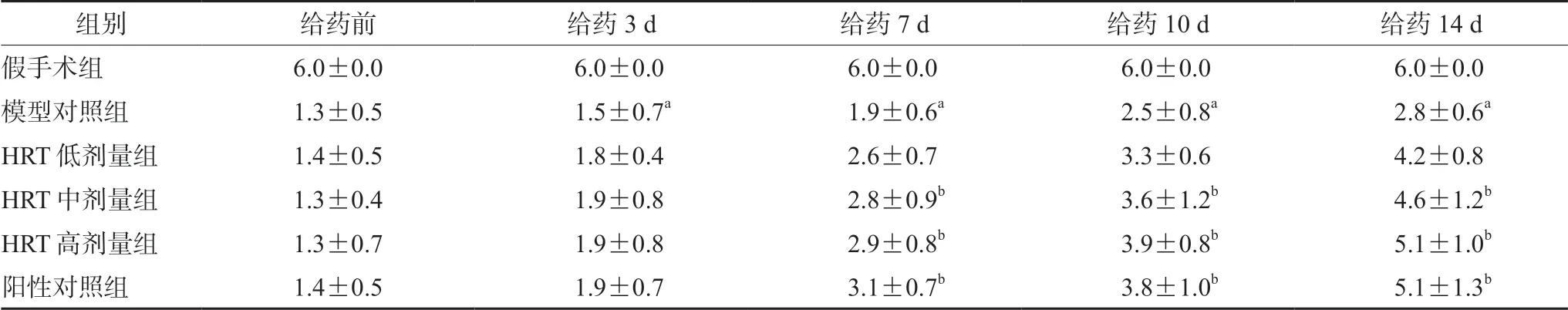
表2 HRT 对模型大鼠横木行走能力的影响(分,± s)Tab 2 Effect of HRT on the beam-walking performance in rats (score,± s)
注:与假手术组比较,aP <0.05;与模型对照组比较,bP <0.05。Note:Compared with the sham group,aP <0.05;compared with the model group,bP <0.05.
组别 给药前 给药3 d 给药7 d 给药10 d 给药14 d假手术组 6.0±0.0 6.0±0.0 6.0±0.0 6.0±0.0 6.0±0.0模型对照组 1.3±0.5 1.5±0.7a 1.9±0.6a 2.5±0.8a 2.8±0.6a HRT 低剂量组 1.4±0.5 1.8±0.4 2.6±0.7 3.3±0.6 4.2±0.8 HRT 中剂量组 1.3±0.4 1.9±0.8 2.8±0.9b 3.6±1.2b 4.6±1.2b HRT 高剂量组 1.3±0.7 1.9±0.8 2.9±0.8b 3.9±0.8b 5.1±1.0b阳性对照组 1.4±0.5 1.9±0.7 3.1±0.7b 3.8±1.0b 5.1±1.3b
表3 HRT 对模型大鼠前肢抓握力的影响(g,± s)Tab 3 Effect of HRT on the bar-grasping performance in rats (± s)

表3 HRT 对模型大鼠前肢抓握力的影响(g,± s)Tab 3 Effect of HRT on the bar-grasping performance in rats (± s)
注:与假手术组比较,aP <0.05;与模型对照组比较,bP <0.05。Note:Compared with the sham group,aP <0.05;compared with the model group,bP <0.05.
组别 给药1 d 给药3 d 给药7 d 给药10 d 给药14 d假手术组 764±100 873±98 969±94 1049±100 1086±97模型对照组 592±79a 634±99a 672±101a 679±125a 695±118a HRT 低剂量组 592±95 606±95 656±95 707±110 726±108 HRT 中剂量组 592±97 606±101 737±108 758±102 778±111 HRT 高剂量组 597±101 623±114 765±124b 790±114b 861±143b阳性对照组 595±87 610±101 722±107 785±118 850±145b
表4 HRT 对模型大鼠血小板聚集的影响(± s)Tab 4 Effect of HRT on the platelet aggregation in rats (± s)

表4 HRT 对模型大鼠血小板聚集的影响(± s)Tab 4 Effect of HRT on the platelet aggregation in rats (± s)
注:与模型对照组比较,bP <0.05。Note:Compared with the model group,bP <0.05.
组别 血小板聚集率/Ω 聚集抑制率/%假手术组 10.33±1.42 11.55模型对照组 11.68±1.42 0.00 HRT 低剂量组 9.23±1.79b 20.99 HRT 中剂量组 9.08±0.93b 22.19 HRT 高剂量组 9.36±1.26b 19.87阳性对照组 9.29±1.61b 20.47
3.6 HRT 对模型大鼠脑组织病理学改变的影响
与假手术组比较,模型对照组大鼠脑皮质和海马均明显损伤,表现为脑皮质体细胞大面积变性坏死,出现明显梗死灶,炎性细胞浸润明显等现象。与模型对照组比较,各给药组均有一定的改善作用,表现为脑皮质神经细胞变性坏死减轻,梗死灶相对较小,炎性细胞浸润减轻,其中HRT 中、高剂量组和阳性对照组大脑皮质损伤评分差异有统计学意义(P<0.05),HRT 高剂量组海马损伤评分差异有统计学意义(P<0.05),见表6及图1。
表5 HRT 对模型大鼠海马及半暗带BDNF 和bFGF 表达的影响(± s)Tab 5 Effect of HRT on the BDNF and the bFGF expression at hippocampus and penumbra areas in rats (± s)
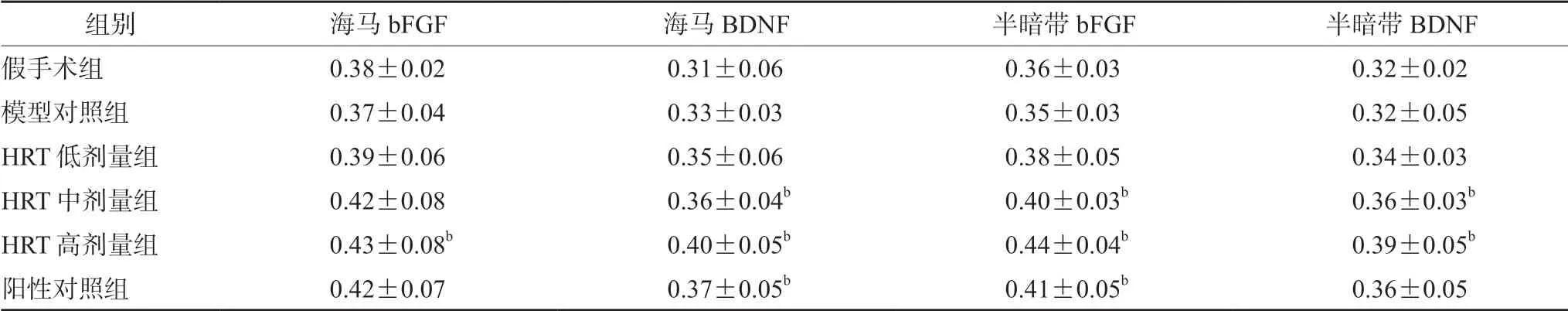
表5 HRT 对模型大鼠海马及半暗带BDNF 和bFGF 表达的影响(± s)Tab 5 Effect of HRT on the BDNF and the bFGF expression at hippocampus and penumbra areas in rats (± s)
注:与模型对照组比较,bP <0.05。Note:Compared with the model group,bP <0.05.
组别 海马bFGF 海马BDNF 半暗带bFGF 半暗带BDNF假手术组 0.38±0.02 0.31±0.06 0.36±0.03 0.32±0.02模型对照组 0.37±0.04 0.33±0.03 0.35±0.03 0.32±0.05 HRT 低剂量组 0.39±0.06 0.35±0.06 0.38±0.05 0.34±0.03 HRT 中剂量组 0.42±0.08 0.36±0.04b 0.40±0.03b 0.36±0.03b HRT 高剂量组 0.43±0.08b 0.40±0.05b 0.44±0.04b 0.39±0.05b阳性对照组 0.42±0.07 0.37±0.05b 0.41±0.05b 0.36±0.05
4 讨论
近年来,脑血管病逐年上升,已经给人类的健康带来严重的威胁,成为仅次于心肌梗死的第二大致死性疾病[8]。脑卒中是一种发病率很高的脑血管疾病,已经成为影响伤残调整寿命年第三大因素[9]。在国内,脑卒中每年新增病例超过200 万[10-11]。研究显示,缺血性脑卒中整个发病过程中,除了缺血对脑组织造成损伤外,缺血区组织恢复血流灌注后会加重损伤,出现“二次”损伤,即脑缺血再灌注损伤[12]。脑缺血再灌注损伤的病理机制较为复杂,影响因素也比较多,不同疾病阶段的因素也有所不同。因此,研发治疗缺血性脑卒中的药物也需考虑到多方面的因素,寻找相应的策略和作用靶点。
表6 HRT 对模型大鼠脑组织病理改变的影响(分,± s)Tab 6 Effect of HRT on the cerebral pathological changes in rats(score,± s)
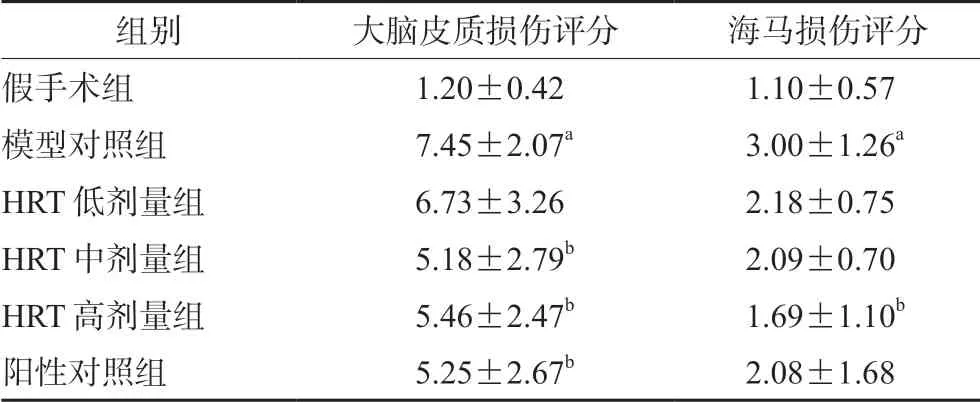
表6 HRT 对模型大鼠脑组织病理改变的影响(分,± s)Tab 6 Effect of HRT on the cerebral pathological changes in rats(score,± s)
注:与假手术组比较,aP <0.05;与模型对照组比较,bP <0.05。Note:Compared with the sham group,aP <0.05;compared with the model group,bP <0.05.
组别 大脑皮质损伤评分 海马损伤评分假手术组 1.20±0.42 1.10±0.57模型对照组 7.45±2.07a 3.00±1.26a HRT 低剂量组 6.73±3.26 2.18±0.75 HRT 中剂量组 5.18±2.79b 2.09±0.70 HRT 高剂量组 5.46±2.47b 1.69±1.10b阳性对照组 5.25±2.67b 2.08±1.68
脑缺血最主要的后遗症就是神经功能障碍和运动功能障碍[13],本研究重点评价了模型动物的神经功能和运动功能,结果显示,HRT 能够显著改善动物的神经学评分和运动功能评分,提高模型动物的横木行走能力及前肢抓握力,表明HRT可以改善脑缺血动物的神经功能和运动功能。
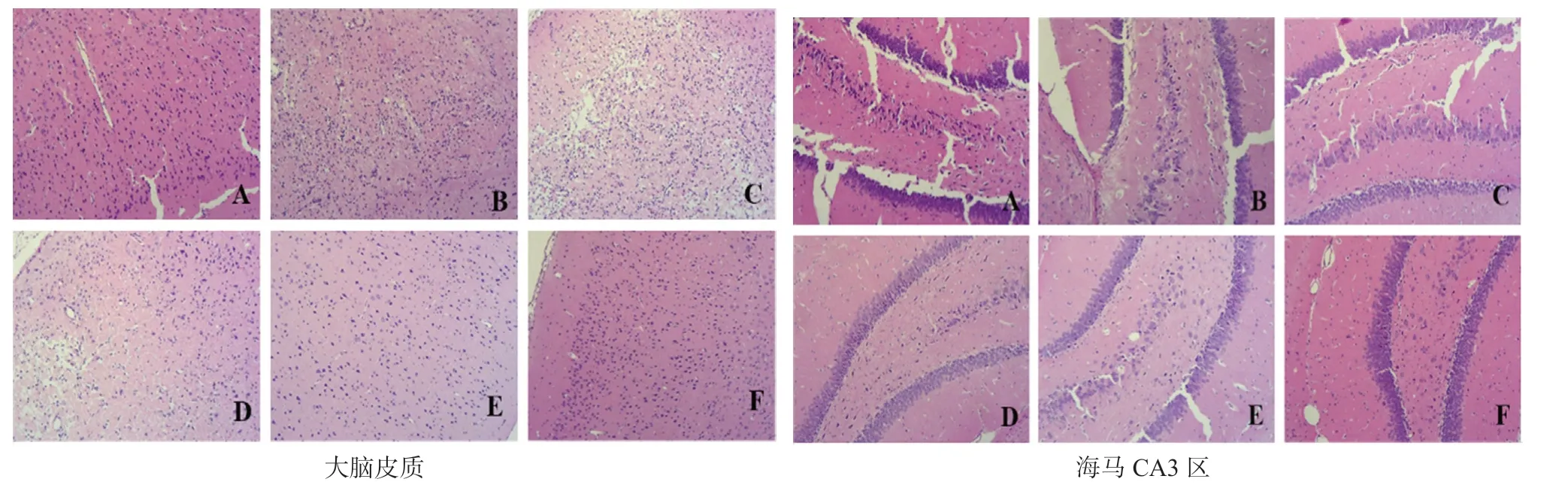
图1 大鼠大脑皮质(上)及海马CA3 区(下)HE 染色(100×)Fig 1 Hematoxylin eosin staining of the cerebral cortex area(up)and the hippocampal CA3 area(down)in rats(100×)
脑血管血液循环正常离不开血液因素和血管因素,当血液循环发生障碍时,脑组织供氧供血量不足,继而发生缺血性脑卒中[14],改善血管血液功能、恢复大脑血液供应是治疗缺血性脑卒中的重要手段[15],治疗药物包括静脉溶栓药、抑制血小板药物和中药复方等[16]。本研究中,HRT能够明显抑制PAF 诱导的体外血小板聚集,提示HRT 具有抑制血小板聚集,减少血栓形成,进而改善血液循环的作用。
BDNF 在中枢神经系统中分布广泛,在神经元的生长分化过程中作用至关重要,是维持神经元正常生理功能必不可少的内源性物质之一[17]。bFGF 具有多种生物学活性,含有154 个氨基酸。正常生理状态下,脑内bFGF 表达量较少;在缺血性脑卒中发生后,bFGF 表达量增加,其受体表达随之上调,bFGF 能减少缺血脑组织神经细胞的凋亡,促进神经细胞修复,对受损神经细胞有重要的保护作用[18]。本研究中,HRT 能够显著提高模型大鼠脑组织bFGF 和BDNF 的含量,提示HRT 具有提高bFGF 和BDNF 表达的作用,这一作用可能与其改善大鼠脑缺血再灌注有关。
脑组织结构的完整性是正常生理功能的前提条件,海马和皮质结构在脑组织的作用至关重要,一旦脑缺血发生,就会直接导致大脑结构的损伤。本研究中,HE 染色的结果也证明了这一点,还显示HRT 能够显著改善模型大鼠缺血再灌注造成的脑组织损伤。
综上,HRT 具有较好地治疗大鼠脑缺血再灌注损伤的作用,本研究可为HRT 后期开发应用提供药理学依据。

