水貂阿留申病毒诱导猫肾细胞(CrFK)凋亡
栾美慧,葛桂阳,宫庆龙,徐 宁,郜艳雪,时 坤,李健明,刘 艺,李东丽,孙志博,冷 雪*,杜 锐
(1.吉林农业大学 中药材学院,吉林 长春 130118;2.吉林农业大学 动物科学技术学院,吉林 长春 130118;3.吉林农业大学 教育部动物生产及产品质量安全重点实验室/吉林省梅花鹿生产与产品应用研究室,吉林 长春 130118)
水貂阿留申病(Aleutian mink disease,AMD)是由水貂阿留申病毒(Aleutian mink disease virus,AMDV)引起的一种慢性、进行性、病毒性传染病。AMD最初被认为是一种遗传病,后来证明是由病毒引起的[1]。AMDV分布在世界各地的水貂养殖国家,包括瑞典、丹麦、西班牙、爱尔兰、荷兰、俄罗斯、冰岛、英国、日本、芬兰及中国等均有该病流行的报道[2-9]。该病的流行给水貂养殖业带来巨大的经济损失,严重影响了水貂养殖业的发展[10]。据不完全统计,在中国主要的水貂繁殖地区,AMDV感染率为40%~70%,甚至高达80%[11]。GONG等[12]抽取1981-2017年AMD相关的研究,进行了系统的回顾和分析,结果显示,在此期间中国的AMD总体阳性率为55.3%。目前,已知的AMDV易感动物种类已从水貂扩展为灰狐、臭鼬和貉等[13-17]。新发现的貉蓝狐阿留申病毒(RFAV)、火狐阿留申病毒(RFFAV)和灰狐阿留申病毒(GFAMDV)在2014年被国际病毒分类委员会纳入阿留申病毒属[18]。AMDV可通过血液、唾液、粪便和尿液的直接或间接接触感染[19-20]。相关研究人员在貂场养殖工人体内检测到病毒[21]。AMDV对水貂的感染以不同的方式表现,取决于感染宿主基因型、年龄及病毒株的不同,其所表现的临床症状也不同[22]。在成年貂中,AMDV引起浆细胞增多症[23-24]。幼貂感染AMDV后,病情表现为急速发展,出现呼吸困难、发热、咳嗽等上呼吸道感染症状,死亡率较高[25]。
AMDV与其他自主复制型细小病毒相比有其特殊的致病机制。免疫过的成年貂虽然已产生保护性抗体,但并不能使其免于AMDV的感染,反而会加快疾病进程,即抗体依赖增强作用(antibody-dependent enhancement,ADE)。目前研究AMDV疫苗的瓶颈除了复杂的ADE作用还有尚不清楚的AMDV复制机理,有相关研究表明病毒感染细胞后,想要在细胞中完成增殖就必须要参与细胞本身的调节活动,病毒会凭自身的某一些基因阻止细胞凋亡过程从而使病毒大量复制或者帮助病毒的持续感染[26]。因此细胞凋亡是否在AMDV复制和持续性感染中发挥重要调节作用十分值得探索。相关研究显示AMDV在体外培养时仅可在水貂睾丸细胞、水貂肾细胞和猫肾细胞(CrFK)等中有限地增殖,且不同毒力毒株对细胞培养条件要求也不同[27-29]。本研究首先通过SYBR Green Ⅱ荧光定量PCR确定AMDV-G在CrFK细胞中的有效增殖,然后验证细胞凋亡相关指标来确定AMDV感染CrFK细胞后诱导了细胞凋亡现象,然而细胞凋亡在AMDV致病过程中是否在发挥重要作用仍有待于进一步研究。
1 材料与方法
1.1 材料AMDV-G株和CrFK细胞[29]由吉林农业大学经济动物疫病实验室保存;MEM美国Hyclone公司;胰蛋白酶消化液、不含EDTA胰蛋白酶消化液北京索莱宝生物技术有限公司;病毒基因组提取试剂盒Omega Bio-Tek公司;CCK-8细胞增殖及毒性检测试剂盒、Rabbit Anti-Mink IgG/FITC北京博奥森生物技术有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒B&D有限公司;Caspase-3活性检测试剂盒江苏凯基生物技术股份有限公司。
1.2 细胞培养CrFK细胞用含6%胎牛血清的MEM培养基培养,置于37℃、5% CO2的恒温培养箱中,培养过程中用0.25%的胰蛋白酶消化传代。
1.3 病毒培养及毒价测定待CrFK细胞汇合度达60%~80%时,接种AMDV,于37℃、5% CO2培养箱中孵育1 h,期间每隔15 min晃动1次,然后加入含有2%胎牛血清的MEM细胞维持液,继续培养。培养至3~5 d,在-80℃冰箱反复冻融2~3次,离心取上清,将上清液置于-80℃中保存备用。应用间接免疫荧光法测定已收集的AMDV-G株病毒滴度(TCID50),用Karber法计算病毒株TCID50。
1.4 AMDV增殖曲线汇合度达到70%的6孔板CrFK细胞,接种AMDV-G株(MOI 为1.0)。感染后2,12,24,36,48,72,96,120 h收集病毒液,每个时间点设3个重复,反复冻融3次,离心取上清液,提取其基因组,应用实验室建立的AMDV SYBR Green Ⅱ荧光定量PCR来测定不同时间段AMDV-G株的基因组拷贝数。
1.5 用CCK-8法检测细胞活性收集处于对数生长期的CrFK细胞用含有6%胎牛血清的MEM培养液配成细胞悬液,调整细胞浓度以每孔5104/100 μL置于96孔细胞培养板,在37℃、5% CO2温箱中培养。待细胞长满70%单层时,每孔分别加入0.5,1.0,1.5,2.0,2.5,3.0 MOI的AMDV-G株病毒液,设置空白孔调零,试验重复3次。感染组及对照组均分别培养2,12,24,36,48,60 h,对应时间段的试验孔加入10 μL的CCK-8溶液,然后将培养板在培养箱里孵育2 h,使用酶标仪测定D450 nm值。
1.6 AO/EB荧光染色以1.0 MOI的AMDV-G感染汇合度达到70%的CrFK细胞为试验组,同时设置阴性细胞对照组。分别在感染后2,12,24,36,48,60 h收集细胞样本,用PBS洗涤2次,用500 μL染色缓冲液重悬细胞,加入5 μL AO染色液和5 μL EB染色,轻轻混匀并于4℃避光孵育15 min,用PBS洗涤细胞1次,利用荧光倒置显微镜观察细胞形态变化。
1.7 流式细胞术检测细胞凋亡率取处于对数生长期的CrFK细胞用含有6%胎牛血清的MEM培养液配成细胞悬液,接种于6孔细胞培养板中,待汇合度达70%后,按MOI=1.0接种AMDV,于37℃温箱孵育。用不含EDTA的胰蛋白酶消化感染AMDV后2,12,24,36,48,60 h的细胞和空白对照组细胞,4℃、1 000 r/min离心5 min,用冷的PBS洗涤细胞2次,用缓冲液重悬1×106个细胞,取100 μL缓冲液,加入5 μL Annexin V-FITC和5 μL PI室温避光孵育15 min,加入400 μL结合缓冲液,立即进行流式细胞仪检测。
1.8 分光光度计法检测Caspase-3活性收集对数生长期CrFK细胞,接种到6孔板,待细胞长至70%,用AMDV-G株(MOI=1.0)感染CrFK细胞为试验组,同时设立阴性对照组,分别于接毒后的2,12,24,36,48,60 h收集细胞(3~5)×106个,使用4℃预冷的PBS洗涤细胞2次;在收集的沉淀细胞中加入200 μL 4℃预冷的Lysis Buffer并且缓慢吹打均匀,放置于冰上裂解30 min,其间涡旋振荡3~4次;4℃、10 000 r/min离心1 min,吸取上清蛋白转移到新的EP管中,使用Bradford法测定蛋白的浓度;吸取50 μL(100 μg)蛋白的细胞裂解上清(各组均采用同样的蛋白量进行测定和比较),加入50 μL 的2×Reaction Buffer,5 μL Caspase-3 Substrate在37℃避光条件下孵育4 h;通过测定D405 nm值,根据诱导剂组D405 nm/阴性对照D405 nm的倍数来确定凋亡诱导剂组Caspase-3活化程度。
1.9 统计学分析用统计学软件SPSS 20.0对试验所得到的数据进行单因素方差分析,运用Dunnett-t检验进行显著性检验,其中*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果
2.1 AMDV-G株培养及毒价测定AMDV-G株接种CrFK细胞后,应用间接免疫荧光试验对接种病毒的细胞进行检测,可见亮绿色荧光(图1),测定收获病毒液的病毒含量,结果为106.25TCID50/mL。

A.AMDV-G株感染细胞;B.阴性对照细胞
2.2 AMDV-G株增殖曲线使用基于SYBR Green Ⅱ的实时荧光定量PCR方法获得病毒生长曲线。感染后48 h,AMDV-G株在CrFK细胞中大量增殖;感染后120 h,病毒基因组拷贝数达最大值为4.41×104拷贝/μL(图2)。结果表明,AMDV-G株能够在CrFK细胞中稳定增殖。
2.3 AMDV-G株感染对CrFK细胞活性的影响CCK-8法检测发现,1.0 MOI 及以上病毒滴度的AMDV-G株感染CrFK细胞24 h,能显著抑制CrFK细胞的生长(P<0.05),而0.5 MOI的AMDV-G株感染CrFK细胞36 h后,才能显著抑制CrFK细胞的生长(P<0.05)。结果表明,AMDV-G株感染CrFK细胞具有生长抑制作用,并且感染时间和病毒滴度呈正相关(图3)。
2.4 AMDV-G株诱导CrFK细胞凋亡的形态学变化AO/EB染色后,利用倒置荧光显微镜观察AMDV-G株感染CrFK细胞后2,12,24,36,48,60 h 的感染组和对照组细胞形态学变化。结果显示,正常对照组细胞只能被AO染色,2 h感染组和对照组形态结构均正常,核染色质呈绿色;病毒感染CrFK细胞12 h后开始出现染色质浓缩的早期凋亡状态,而感染24 h不仅出现早期凋亡形态并且伴随核固缩和核碎裂的橙红色荧光晚期凋亡形态,且随着时间延长出现更多的晚期凋亡细胞(图4)。

图2 AMDV毒株在CrFK细胞中的增殖曲线
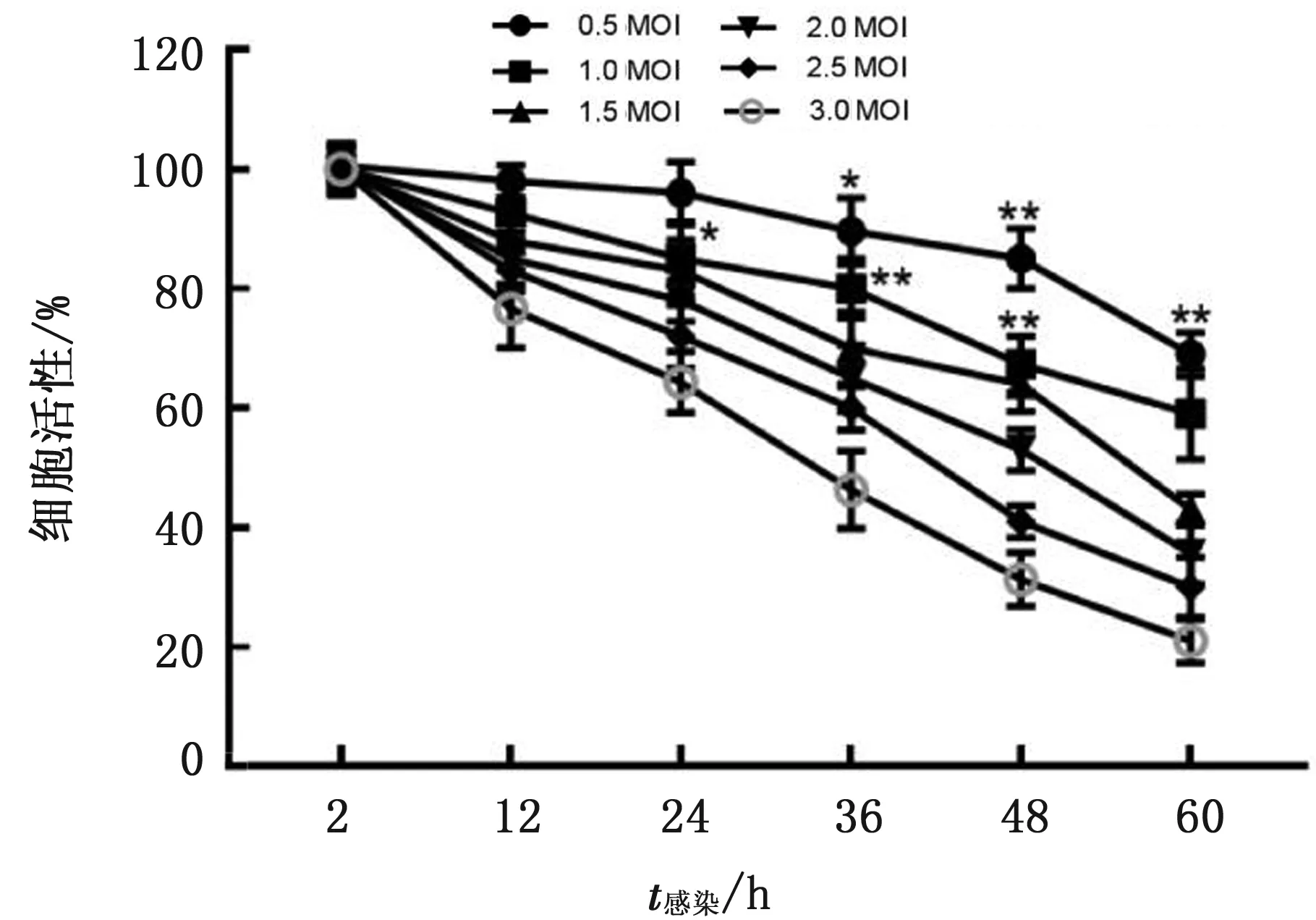
图3 AMDV-G株感染对CrFK细胞活性的影响

图4 AMDV-G株感染对CrFK细胞形态学变化的影响
2.5 流式细胞术检测AMDV-G株感染对CrFK细胞凋亡率的影响流式细胞术显示,AMDV-G株感染CrFK后细胞凋亡率随着病毒感染时间的延长而呈现升高趋势,AMDV-G株(MOI为1.0)感染CrFK细胞12 h时,与对照组差异显著(P<0.05),其细胞凋亡率为9.13%;在60 h时与对照组差异极显著(P< 0.01),其细胞凋亡率均值可达57.55%(图5)。
2.6 AMDV-G株感染对CrFK细胞内Caspase-3活性的影响分别在AMDV-G株感染CrFK细胞后2,12,24,36,48,60 h收集细胞,通过Caspase-3活性检测试盒检测其活性变化。数据表明,AMDV-G株感染(MOI 为1.0)CrFK细胞后,Capase-3活性在12 h后发生了显著变化(P<0.05);在感染后60 h时,Caspase-3的活性变化差异极显著(P<0.01),与2 h对照组细胞相比活性增加了3.08倍(图6)。
3 讨论
AMDV强毒株,例如AMDV-Utah、AMDV-K和AMDV-TR株,可以在体内传播,但难以在体外培养和适应[30]。AMDV-G是唯一通过AMDV-Utah强毒株的体外细胞培养获得的减毒株。据报道,AMDV-SL3和AMDV-DL125株对水貂有毒力并且可以在体外培养[31-33]。本研究通过先前建立的基于SYBR Green Ⅱ的实时荧光定量PCR技术检测了CrFK细胞中AMDV-G株基因组的拷贝数,结果显示感染后120 h,AMDV-G株基因组DNA的最大拷贝数为4.41×104拷贝/μL,说明AMDV-G株可在CrFK细胞中有效增殖。相关研究表明,病毒感染细胞,想要完成复制就要参与宿主细胞的相关调节。AMDV-G株增殖的验证为进一步研究AMDV-G株感染CrFK细胞后,引起了哪些调节打下了基础。
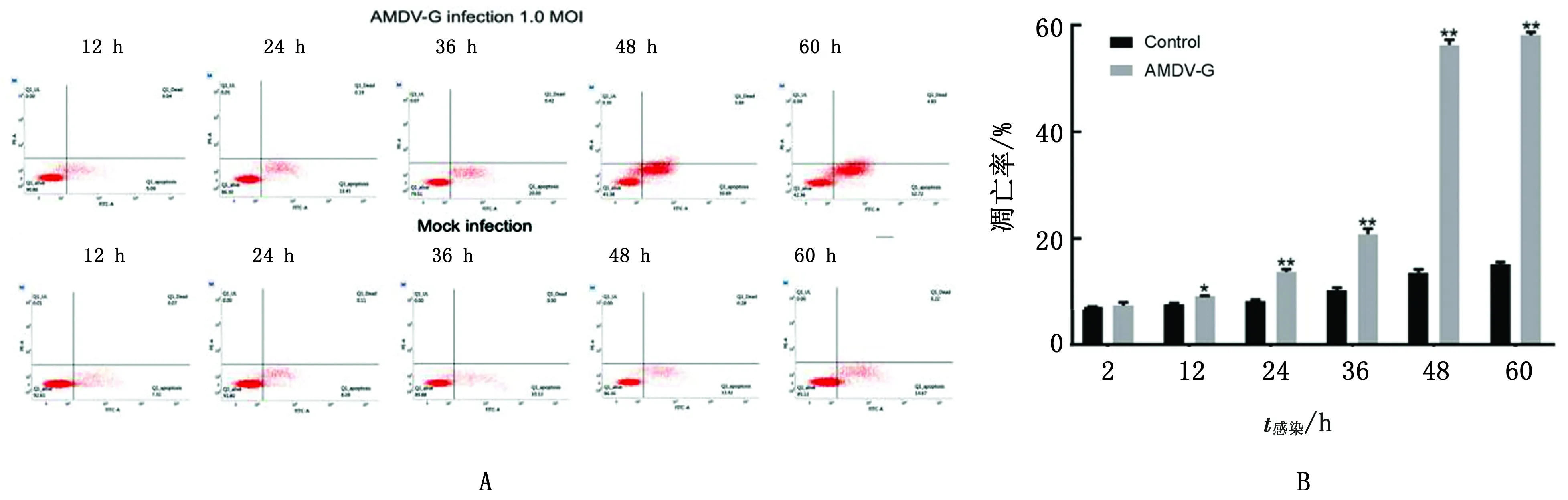
A.流式检测AMDV-G感染对CrFK细胞凋亡率的影响;B.流式数据的统计分析结果

图6 AMDV-G株感染对Caspase-3活性的影响
本研究利用CCK-8法检测AMDV-G株感染对CrFK细胞活性的影响,试验结果表明,CrFK细胞的活性在AMDV-G株感染后可被显著抑制,且随着病毒滴度的增大或感染时间的延长,CrFK细胞存活率降低越显著。AO/EB染色验证了AMDV感染后CrFK细胞在形态学方面的典型凋亡特征,凋亡早期时,细胞皱缩,细胞核内染色质凝聚和固缩,凋亡中晚期时,细胞核发生碎裂,出现凋亡小体具有明显的凋亡特征。当细胞凋亡发生的时候,细胞膜内的磷脂酰丝氨(phosphatidylserine,PS)就会外翻到细胞膜表面,流式细胞术可通过荧光探针的Annexin V与外翻的PS结合来检测凋亡的细胞。本研究表明,AMDV-G株感染导致了CrFK细胞凋亡现象,并且具有感染时间的依赖性。Caspase-3作为细胞凋亡过程中的重要执行分子,它的活化通常被认为是凋亡发生的重要依据,AMDV-G株感染细胞后Caspase-3分子活性随着时间的延长具有显著性差异。因此,利用多种检测方法综合起来分析,AMDV-G株感染CrFK细胞的凋亡率升高和形态学变化可进一步证明AMDV-G株能够诱导CrFK细胞发生凋亡。
目前,由于AMDV的复杂致病机理和ADE作用,并没有有效的疫苗预防该病。本研究证明AMDV-G株感染CrFK细胞后诱导了凋亡的发生,为进一步研究AMDV的致病机理及疫苗的研制奠定理论基础。

