笼养蛋鸡关节炎病的诊断
汪 敏 , 徐子恒 , 王 粲 , 梁竞臻 , 周辰瑜 , 张远琴 , 杨耀炎 , 韦 平
(广西大学养禽与禽病研究所 , 广西 南宁 530000)
近年来,规模化养鸡场发展迅速,但在养殖过程中,鸡关节炎病凸显,尽管该病的死亡率不高,但能导致病鸡生长迟缓、生产性能下降、淘汰率增高[1],对养殖场造成巨大的经济损失。鸡关节炎病是一类由病毒、细菌或支原体引起的以关节发炎、肿胀、站立困难、行走障碍等为特征的局部性疾病,主要病原有禽呼肠孤病毒(Avian reovirus,ARV)、金黄色葡萄球菌(Staphylococcusaurous,S.aurous)、沙门菌(Salmonellaspp.)、滑液囊支原体(Mycoplasmasynoviae,MS)等[2-4]。研究显示[5-6],MS主要以水平传播的方式导致鸡群间感染,病原携带鸡为主要的传染源,此外还可经垂直传播感染下一代,产生病原携带者,成为全球家禽养殖业的一种重要的致病性病原体。目前报道的金黄色葡萄球菌和滑液囊支原体混合感染引起的鸡关节炎病较为少见,本试验通过对广西某蛋鸡场关节炎发病鸡群进行病原鉴定及对滑液囊支原体阳性样品进行vlhA基因序列分析和系统进化树分析,旨在为由葡萄球菌和滑液囊支原体混合感染引起鸡关节炎病的诊断和研究提供参考依据。
1 材料与方法
1.1 病料来源 广西某养鸡场有96日龄的海兰灰蛋鸡共50 000只,转群后不少鸡只于90日龄时开始出现关节肿胀、跗关节着地、卧地不起、行动不便等症状,且肿胀部位手触发热有波动感。每天以0.2%的增长率发病、死亡,淘汰率达0.3%。鸡场曾针对鸡群发病症状投以盐酸头孢噻呋和大观林可霉素,但治疗效果不佳。
1.2 主要试剂 革兰染色液及常规生化试剂盒,均购自广东环凯微生物科技有限公司;17种常规药敏纸片,购自杭州微生物试剂有限公司;DNA抽提试剂盒、胶回收试剂盒,均购自北京天根生化科技有限公司;pMD-18T载体,购自TaKaRa;DL-2 000 DNA Marker,购自南京诺维赞生物科技有限公司;DMEM培养基,购自BIOLOGICAL INDUSTRIES;血平板和ddH2O,均由本实验室制备。
1.3 检测方法
1.3.1 细菌的分离培养 用无菌接种环分别采集病鸡的病变部位、骨髓及关节液,并划线于血平板上,37 ℃培养24 h,观察菌落形态。挑取单个可疑菌落进行革兰染色观察,并将其划线于普通营养琼脂培养基上。
1.3.2 生化鉴定 将上述1.3.1中的分离株接种于生化常规微量鉴定管中,并置于37 ℃培养24~72 h;同时进行血浆凝固酶试验试管法,置于37 ℃培养24 h后观察结果。
1.3.3 菌株16S rRNA 序列鉴定 用加热煮沸法提取上述1.3.1中的菌株DNA并对其进行16S rRNA序列鉴定。引物为16S rRNA基因通用引物,序列为F:5′-AGAGTTTGATCCTGGCTCAG-3′,R:5′-GGTCAGGTTGTTACGACTT-3′。PCR扩增体系:GreenTaqMix 12.5 μL,ddH2O 9.5 μL,上、下游引物各0.5 μL,DNA 2 μL。PCR扩增程序:95 ℃ 预变性5 min;95 ℃ 变性1 min,56 ℃ 退火1 min,72 ℃ 延伸1 min,共35个循环;72 ℃ 延伸10 min。取PCR扩增产物经1.2%琼脂糖凝胶电泳检测,再用DNA回收试剂盒进行胶回收。将胶回收产物送至华大基因公司测序。将测序结果上传至GenBank中进行比对。
1.3.4 细菌的药敏试验 从血平板上挑取单个菌落接种于普通营养琼脂板上37 ℃纯化培养24 h,采取K-B纸片扩散法[7]对纯化后的分离株进行17种常见抗菌药的敏感性试验,并参考美国临床实验室标准委员会(CLSI)的标准[8]进行判定。
1.3.5 MS的鉴定及vlhA基因测序 无菌取病鸡关节渗出物置于DMEM培养基中,于37 ℃摇床培养24 h,按照DNA提取试剂盒操作步骤提取DNA,并参照Ghaniei[9]建立的MS检测方法对vlhA基因进行扩增,上游引物序列为F:5′-TACTATTAGCAGCTAGTGC-3′,下游引物序列为R:5′-AGTAACCGATCCGCTTAAT-3′,扩增目的条带长度约为399 bp。PCR扩增体系为25 μL:上、下游引物各0.5 μL,GreenTaqMix 12.5 μL,DNA 2 μL,ddH2O 9.5 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸10 min。反应产物经1.5%琼脂糖凝胶电泳检测并观察结果。将阳性PCR产物经电泳鉴定后按胶回收试剂盒说明书步骤进行胶回收,将其连接至pMD-18T载体并转入大肠杆菌DH5α感受态细胞中。最后将筛选出的阳性菌液送至北京华大基因有限公司进行测序。
1.3.6 序列进化树的构建分析 使用 DNASTAR对测序序列进行编辑以及同源性分析,并将其与 GenBank中参考序列进行比对,进化树由MAGE 6软件制作完成。
2 结果
2.1 临床症状 病鸡精神沉郁、羽毛蓬乱、消瘦、鸡冠苍白、关节肿大、单侧或双侧跛行、无法站立、不愿走动。
2.2 病理变化 剖检发现病鸡跗关节肿胀,大部分病变关节腔内有干酪样渗出物,少部分病变处有脓液,其他内脏器官无明显病变。
2.3 血平板分离培养及镜检 本试验的分离株在血平板上生长为湿润、光滑、圆形、凸起的菌落,菌落较大,且在菌落周围有β溶血环。革兰染色后经显微镜观察,只存在蓝紫色的球菌,初步确定其为葡萄球菌。5只病鸡中有3只分离到葡萄球菌,分离率为60%(3/5)。
2.4 生化试验 由表1可知,本试验中分离到的葡萄球菌可发酵葡萄糖、乳糖、甘露醇、山梨醇、蔗糖,对凝固酶、鸟氨酸脱羧酶、赖氨酸脱羧酶呈阳性,不可发酵尿素、木糖醇、卫矛醇、西蒙氏橼酸盐、硫化氢。

表1 分离株的生化试验结果Table 1 Biochemical test results
2.5 16S rRNA鉴定 由图1可知,分离菌株经16S rRNA 通用引物PCR扩增后,得到1 500 bp左右的条带。将测序结果与GenBank中已有的金黄色葡萄球菌16S rRNA基因序列进行同源性比对,结果表明,分离到的菌株与参考株金黄色葡萄球菌MK780062.1的同源性相近,为99%,说明本试验分离得到的葡萄球菌为金黄色葡萄球菌。
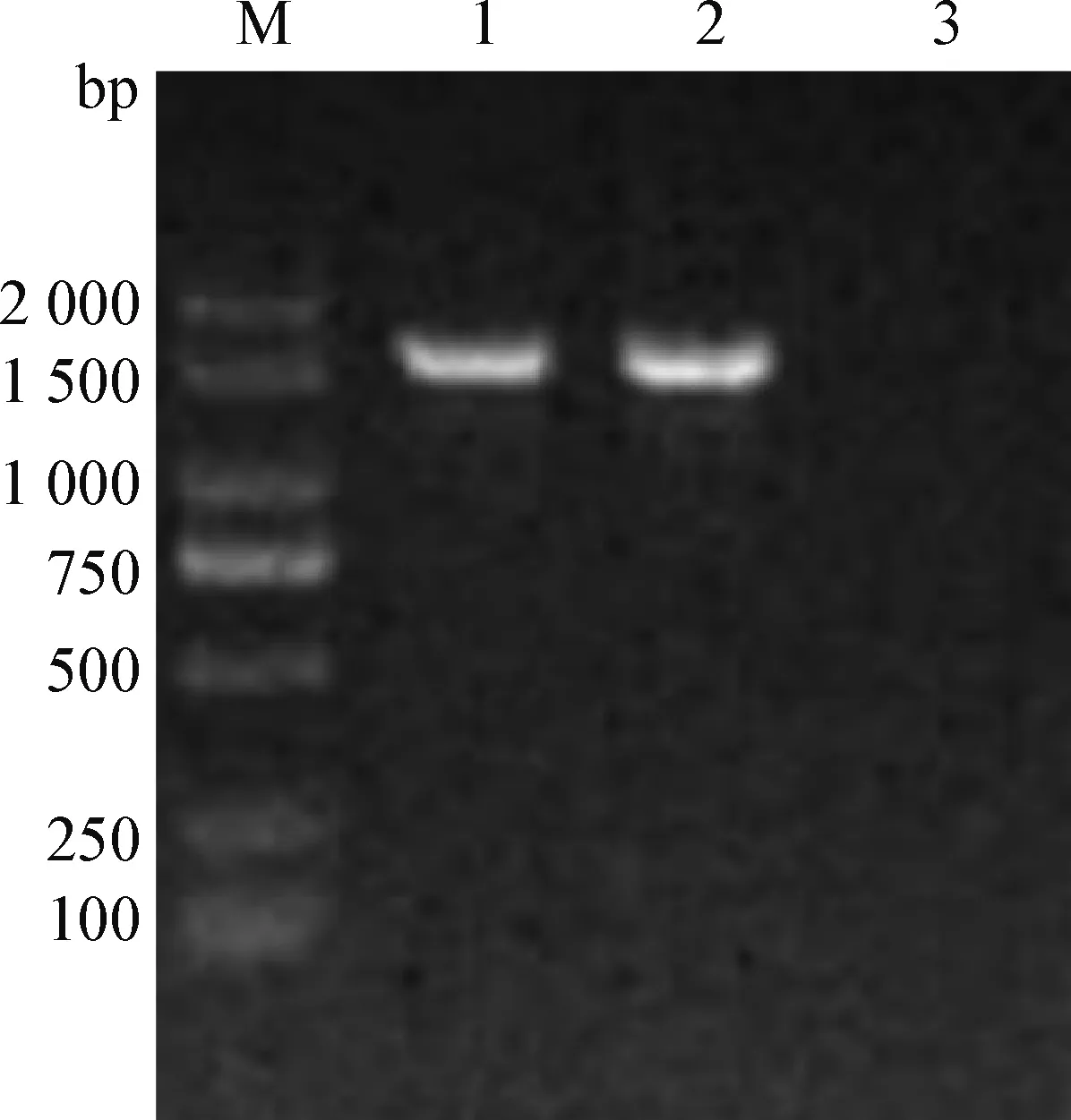
图1 分离株的16S rRNA PCR扩增结果Fig.1 Results of the 16S rRNA PCR amplification of the isolationM.DL-2 000 DNA 相对分子质量标准; 1:金黄色葡萄球菌; 2:阳性对照; 3:阴性对照M.DL-2 000 DNA marker; 1:S. aurous; 2:Positive control; 3:Negative control
2.6 药敏试验 分离株对磺胺异噁唑、复方新诺明、萘啶酸、链霉素、四环素均不敏感;对环丙沙星敏感;对阿莫西林、氨苄西林、头孢曲松、头孢噻肟、头孢他啶、甲氧苄胺嘧啶、庆大霉素、卡那霉素、呋喃妥因、氟苯尼考和丁胺卡那等不同类别抗菌药均表现不同程度的敏感性。
2.7 MS检测 由表2可知,5份样品中有4份经vlhA基因PCR扩增出条带,大小约为399 bp,与预期目的片段大小相符,表明扩增样品为MS阳性。目的片段测序结果经 MegAlign 分析,显示其与GenBank中已上传的 MS 序列的同源性在94%左右,表明该阳性样品确实为滑液囊支原体。

表2 金黄色葡萄球菌药敏试验结果Table 2 Results of Staphylococcus aureus to 17 kinds of antibiotics

图2 MS vlhA基因的PCR检测结果Fig.2 PCR amplification of MS vlhA geneM:DL-2 000 DNA 相对分子质量标准; 1:MS阴性对照; 2:MS阳性对照; 3~4,6~7:阳性样品MS引物基因的扩增; 5:阴性样品MS引物基因的扩增M:DL-2 000 DNA marker; 1:MS negative control; 2:MS positive control; 3-4,6-7:MS gene fragment of positive samples; 5:MS gene fragment of negative samples
2.8 序列分析 由图3可知,阳性样品MS-1基于vlhA基因的保守区域的氨基酸残基与国外参考株存在明显的遗传进化差异,与国内的参考株几乎都处于同一分支上,未呈现出明显的地域性,除与KU572366株遗传关系较远,据悉KU572366株属于E基因群,而其余国内参考株属于K基因群。MS-1的序列与MS-H疫苗株序列(CP021129)的遗传距离远,处在不同的进化分支上,且CP021129与KU72366株的遗传关系近。所以可判定本试验检测到的MS阳性样品不是由疫苗株感染所致,且不属于E基因群。

图3 基于vlhA基因序列的系统进化发育树Fig.3 Phylogenetic tree based on vlhA gene sequence▲:本次试验的测序样品▲:Sequenced sample in this experiment
3 讨论
鸡关节炎病是家禽养殖过程中较为常见的疾病之一,威胁着养殖业的健康发展。随着我国养殖业的发展、养殖水平的提高,由营养因素引起的鸡关节炎病较为少见,但由禽呼肠孤病毒、滑液囊支原体、金黄色葡萄球菌、大肠埃希菌、沙门菌等病原单一或混合感染引起的鸡关节炎病时有发生[10]。不同病原引起的临床症状也较为相似,但仅凭肉眼无法确定发病病原,因此需依靠实验室技术进行鉴定。无菌采集病鸡的病变部位并进行病原菌的分离鉴定、16S rRNA 基因序列测定和vlhA基因检测,结果表明该鸡场暴发鸡关节炎病的原因是由金黄色葡萄球菌和滑液囊支原体混合感染。
金黄色葡萄球菌是一种条件性致病菌,广泛存在于鸡舍地面、空气等环境中[1,11];同时也是一种人兽共患病原菌,可引起人和多种动物的败血症。此外被感染的家禽还可表现关节炎等症状,本试验从病鸡的坏死股骨头部位分离出金黄色葡萄球菌,这与姬忠华等[12]的研究结果相符。此外,创伤感染是金黄色葡萄球菌引起鸡关节炎的主要原因[4],同时立体笼养的养殖方式在一定程度上促进细菌在鸡体内增殖,造成细菌性股骨头坏死的发生[13]。结合鸡场养殖情况及鸡群发病情况可初步判定该鸡群感染金黄色葡萄球菌的病程较长。凝固酶是金黄色葡萄球菌的主要致病因子,凝固酶试验是判定葡萄球是否具有致病性的重要试验。吴胜等[14]、张晓梅等[15]的研究发现,小鼠腹腔接种金黄色葡萄球菌数小时后逐渐表现出精神不济、败血症等症状,随着病程的发展而死亡,结合本试验分离获得的葡萄球菌的凝固酶试验为阳性,说明该分离菌株具有一定的致病能力。针对金黄色葡萄球菌的治疗,目前最好的方法就是使用抗菌药,但是抗菌药的过度使用会导致细菌的耐药性增加,而该发病鸡群的葡萄球菌分离菌株对盐酸头孢噻呋和大观林可霉素不敏感,再结合本试验药敏结果可知,该分离菌株已产生多重耐药情况。建议鸡场在投喂药物前,根据药敏试验结果合理选择用药。本试验药敏结果显示,分离菌株对环丙沙星、氨苄西林等药物较为敏感,可考虑作为治疗该病的首选药物。
MS主要引起鸡和火鸡的渗出性滑膜炎、腱鞘炎等。鸡群一旦感染MS,便会终生带菌,可通过蛋源垂直传播或者接触污染源水平传播,且该病发展缓慢,病程较长。结合鸡场实际情况,即发病蛋鸡是从其他鸡场引种过来的、鸡场未免疫过疫苗以预防滑液囊支原体病,且vlhA基因序列分析表明该MS阳性样品与疫苗株亲缘关系远,推断该鸡群在引种前已有部分鸡只感染MS,成为病原携带鸡,再通过污染饲料、饮水等方式传播该病,造成同群健康鸡只感染。目前,我国MS的防治尚未大规模的使用MS疫苗,也尚无有效的特异性治疗方式,多以药物治疗和及时淘汰发病鸡群为主要手段。通过vlhA基因序列构建进化树分析可知,我国MS流行株的基因型与其他国家的差异较大,而本试验中检测到的阳性样品MS-1属于K基因群,属于国内的流行毒株,可考虑用国内流行血清型毒株制备针对性疫苗进行MS的防治[16]。
综上可知,该鸡群暴发关节炎病的主要原因是在引种前已有部分蛋鸡感染MS,再加上转群过后,鸡舍温度、环境的变化或是工作人员暴力抓鸡等因素引起鸡群强烈的应激反应,致使机体抗体能力下降,并通过创伤继发感染金黄色葡萄球菌导致发病。结合鸡场的实际情况,建议采取以下几种方式进行后续防治工作:(1)及时淘汰发病鸡群,并进行无害化处理,对暂未发病鸡群考虑用血清学检测的方法淘汰阳性鸡,有效控制MS污染;(2)加强饲养管理、提供良好的饲养环境,严格执行生物安全管理措施;(3)慎重引种,应从未发生过该病的正规鸡场引种(引种前进行血清学检测);(4)定期对环境进行消毒;(5)针对发病鸡群用药时,应结合药敏试验的结果合理用药,并注意药物轮换使用,避免产生耐药菌株;(6)考虑长期投喂具有预防作用的抗菌药的替代物——益生菌;(7)今后对鸡只进行转群时应做好转群前的准备,如消毒拟转入鸡舍、准备抗应激药物等,注意减少抓鸡过程的应激,做好转群后的饲养管理等。

