细菌类多糖疫苗冻干工艺优化研究
赵阳,周园,卓晓琴,杨淼,王弢


摘 要:目的 研究细菌类多糖疫苗冻干工艺优化方法。方法 首先根据A群C群脑膜炎球菌多糖疫苗共晶点温度确定预冻温度;然后统计分析一次干燥阶段和解析干燥阶段制品温度线与设定温度线的重合时间,以确定一次干燥时间和解析干燥时间是否有缩短空间;最终确定优化冻干工艺曲线后,进行冻干试验,对优化前后冻干产品进行质量对比分析。结果 将A群C群脑膜炎球菌多糖疫苗冻干工艺优化为:预冻-40℃,3h;一次干燥-45℃→-10℃→10℃→25℃→40℃→31℃,总时间为12h,真空控制为0.10~0.16mbar;解析干燥31℃、6h,真空控制为0.005mbar。优化后A群C群脑膜炎球菌多糖疫苗的关键质量属性(外观、复溶性、水分、分子大小和多糖含量)均符合质量标准,检定结果无差异;优化后冻干周期缩短310min。結论 优化后A群C群脑膜炎球菌多糖疫苗冻干工艺周期明显缩短,设备负荷和生产能源成本降低。
关键词: 细菌类多糖疫苗,冻干工艺,优化方法,冻干周期
中图分类号:R392
细菌类多糖疫苗是预防病原菌感染的有效方法,其中A群C群脑膜炎球菌多糖疫苗是典型的、使用量较大的细菌类多糖疫苗,它是通过分别提取和纯化A群和C群脑膜炎奈瑟球菌培养液的荚膜多糖抗原,混合后加入冻干保护剂,再通过冻干工艺而制成,用于预防A群和C群脑膜炎奈瑟球菌引起的流行性脑脊髓膜炎[1-2]。其中冻干工艺对制品延长保存期有良好的效果,目前冻干工艺优化方法研究比较复杂,本文将以A群C群脑膜炎球菌多糖疫苗为例,通过测定共晶点,分析一次干燥和解析干燥制品温度线与设定温度线的重合时间,确定现有冻干工艺是否有优化空间,以此确定细菌类多糖疫苗初步优化冻干工艺。
1 材料与方法
1.1 材料和设备 A群C群脑膜炎球菌多糖疫苗半成品由兰州生物制品研究所有限责任公司菌苗一室提供,共计6批,用于优化前后冻干工艺质量比对分析,使用设备为东富龙Lyo-15冷冻干燥机。
1.2 方法 首先根据A群C群脑膜炎球菌多糖疫苗共晶点温度确定预冻温度;然后统计分析一次干燥阶段和解析干燥阶段制品温度线与设定温度线的重合时间,以确定一次干燥时间和解析干燥时间是否有优化空间;最终确定优化冻干工艺曲线后,在A群C群脑膜炎球菌多糖疫苗分装生产过程中,每批取600瓶,使用优化后的冻干工艺进行冻干,共6批次;冻干结束后,分别对使用现有冻干工艺和优化后冻干工艺的制品取样,送公司质量检定室,检测外观、复溶性、水分、分子大小和多糖含量。对优化前后冻干产品进行质量对比分析,确认优化后冻干工艺是否能够满足产品质量要求。
2 结果
2.1 根据A群C群脑膜炎球菌多糖疫苗共晶点温度为-26℃,为保证全部冻结,预冻温度的设定要求比共晶点温度低10~15℃[3],确定将现有冻干工艺预冻温度从-45℃提升至-40℃;
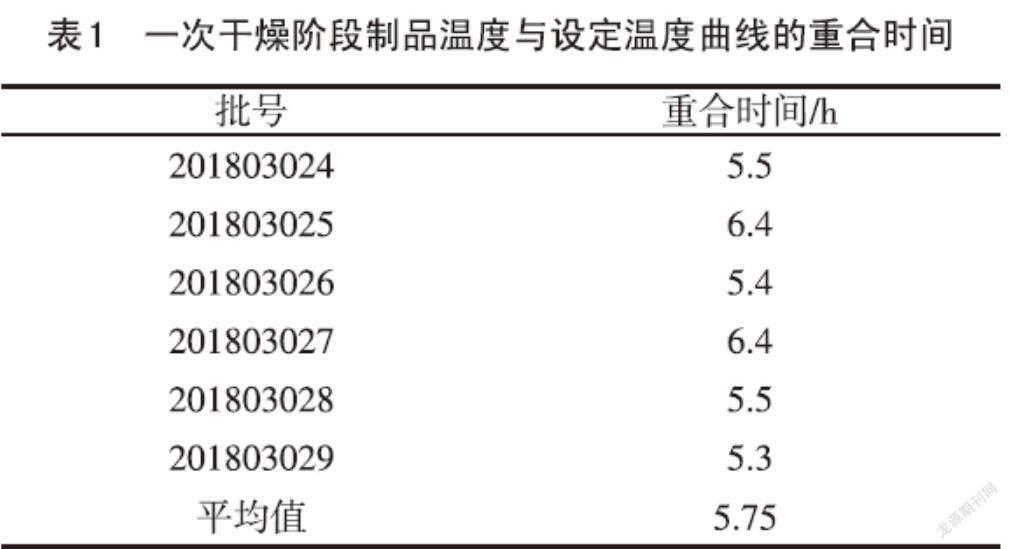
2.2 一次干燥阶段制品温度线与设定温度线的重合时间 A群C群脑膜炎球菌多糖疫苗现有冻干工艺中一次干燥阶段为-45℃→-10℃→10℃→25℃→40℃→31℃,总时间为15.17h,真空控制为0.13~0.19mbar。根据表1中6批一次干燥阶段制品温度线与设定温度线重合平均时间为5.75h,认为一次干燥时间有缩短的空间,同时考虑到制品温度探头位置、冻干机板层大小以及中心位置制品完全干燥等因素的影响,将A群C群脑膜炎球菌多糖疫苗冻干工艺一次干燥阶段改为-45℃→-10℃→10℃→25℃→40℃→31℃,总时间为12h,真空控制为0.10~0.16mbar,一次干燥时间比原先缩短3.17h。
2.3 解析干燥阶段制品温度线与设定温度线的重合时间 A群C群脑膜炎球菌多糖疫苗现有冻干工艺中解析干燥阶段为31℃、8h,真空控制为0.005mbar。根据表2中6批解析干燥阶段制品温度线与设定温度线的重合平均时间为3.52h,认为解析干燥时间有缩短的空间,同时考虑到制品温度探头位置、冻干机板层大小以及中心位置制品完全干燥等因素的影响,将A群C群脑膜炎球菌多糖疫苗冻干工艺解析干燥阶段改为31℃、6h,真空控制为0.005mbar,解析干燥时间比原先缩短2h。
2.4 最终将A群C群脑膜炎球菌多糖疫苗冻干工艺优化为:预冻-40℃,3h;一次干燥温度设定为-45℃→-10℃→10℃→25℃→40℃→31℃,总时间为12h,真空控制为0.10~0.16mbar;解析干燥温度设定为31℃、6h,真空控制为0.005mbar。优化后冻干工艺预冻温度从-45℃提升至-40℃,冻干周期缩短了310min。
2.5 冻干工艺优化前后质量检定结果如下:
2.6 将表3检定结果与质量标准分析比对后,可以看出使用现有冻干工艺和优化后冻干工艺冻干A群C群脑膜炎球菌多糖疫苗,制品外观、复溶性、水分、分子大小和多糖含量均符合质量标准要求,并且使用两种冻干工艺,制品检定结果无差异,优化后冻干工艺能够满足产品质量要求,同时具有生产适用性。
2.7 通过本研究初步确定了一种较为简便的细菌类多糖疫苗冻干工艺优化方法,即可以首先测定细菌类多糖疫苗共晶点温度,以共晶点温度为依据确定制品预冻温度,一般预冻温度比共晶点温度低10~15℃;然后与现有冻干工艺预冻温度做对比,确定是否需要改变现有冻干工艺预冻温度;同时统计分析一次干燥阶段和解析干燥阶段制品温度线与设定温度线的重合时间,以确定一次干燥时间和解析干燥时间是否有缩短空间;最终确定冻干工艺优化曲线后,进行冻干试验,比对优化前后冻干产品质量检定结果,确认优化后冻干工艺是否能够满足产品质量要求。
3 讨论
冷冻干燥是一个复杂的传热传质过程。在生物制品冻干过程中,除了考虑冻干后制品的外观成型要好、干损率少、残余水分含量小于 3%外,还应重点考虑冻干过程对生物活性物质的冻结过程损伤和干燥过程损伤[4-5]。
在确定预定温度时,除了以共晶点温度为依据外,还应考虑冻干机型号以及板层面积等因素,以保证制品能够全部冻结。在确定一次干燥阶段和解析干燥阶段时间时,本文采用的原理为产品升华带走大量的热,从而导致制品温度一直低于设定温度,干燥结束后,升华带走热量的现象停止,产品温度与设定温度达到一致,同时考虑到制品温度探头位置、冻干机板层大小以及中心位置制品完全干燥等因素的影响,一般将一次干燥和解析干燥设定时间略长于制品温度线与设定温度线的重合时间。
本研究中可以看出,使用优化后的冻干工艺冻干A群C群脑膜炎球菌多糖疫苗时,其关键质量结果无差异,同时优化后的冻干工艺提升了预冻温度和缩短冻干周期,设备负荷和生产能源成本降低。这将对后期冻干工艺变更提供有利支撑。另外,本试验初步确定了冻干工艺的优化方法,可以通过初步确定的冻干工艺做进一步的优化研究。
致谢:感谢兰州生物制品研究所有限责任公司质量检定室对试验的帮助。
参考文献
[1] Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Repubic of China(Vol Ⅲ)[S]. Beijing:China Med Sci Press,
2010:41-43.(in Chinese)国家药典委员会. 中华人民共和国药典(三部)[S]. 北京:中国医药科技出版社,2010:41-43.
[2] Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Repubic of China(Vol Ⅲ)[S]. Beijing:China Med Sci Press,2015:71-73.(in Chinese)国家药典委员会. 中华人民共和國药典(三部)[S]. 北京:中国医药科技出版社,2015:71-73.
[3]马兆堂,丁敏.浅谈药物冻干曲线的制定及常见问题分析[J].当代化工研究,2017,04:146-147.
[4]徐斌,王弢,周园,李睿,刘毅.麻疹减毒活疫苗冻干工艺的优化[J].中国生物制品学杂志,2010 ,23(12):1343-1346.
[5] 华泽钊,任禾盛.低温生物医学技术[M].北京:科学出版社,1994.

