显色平板与Baird-Parker平板在金黄色葡萄球菌能力验证中的比较分析
范鹏飞,顾春华,杨陶丽薇,郭娇娇,杨雅珺
摘 要:目的 通过参加中日联合微生物检测技能考核(2021年第1回合)项目金黄色葡萄球菌(定量)检验,提高实验室竞争力,比较分析显色平板与Baird-Parker平板菌落计数结果的差异性。方法 采用GB4789.10-2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》,同时采用显色平板进行计数,对可疑菌落采用全自动微生物菌种鉴定系统进行结果验证。结果 样品21-Q669用Baird-Parker平板计数结果为20000 CFU/mL,显色平板计数结果为19000 CFU/ mL,经Duncan法单因素方差分析,差异不显著(P>0.05),反馈结果为满意。结论 显色平板在能力验证中可以进行平板计数,通过参加技能考核,提升了实验室竞争力,可以为能力验证活动及食品中金黄色葡萄球菌检测提供指导。
关键词:金黄色葡萄球菌; 能力验证; 平板计数; 比较分析
中图分类号:O651
金黄色葡萄球菌(Staphylococcus aureus)属于葡萄球菌属(Staphylococcus),革兰氏染色为阳性菌,在显微镜下呈葡萄串状,是一种常见的食源性致病微生物。金黄色葡萄球菌无鞭毛、芽胞,少部分有荚膜,不能运动,为需氧或兼性厌氧菌,最适宜的生长温度为 37 ℃,pH 值为 7.4[1]。在葡萄球菌属的 20 多个种中,金黄色葡萄球菌是最严重的致病菌[2]。致病原因为分泌的毒素和侵袭性酶而引起食物中毒,如杀白细胞素、肠毒素、溶血毒素、血浆凝固酶和脱氧核糖核酸酶[3-4]。可导致人皮肤感染、败血病、中毒性休克、心内膜炎等[5] 。统计分析发现,在世界范围内,与金黄色葡萄球菌相关的感染特别是那些表达多药耐药性的感染在逐年增加[6]。
金黄色葡萄球菌鉴定主要有免疫学方法,包括免疫凝聚和沉淀法、放射免疫法、酶联免疫法[7]等;分子生物学方法包括实时荧光定量PCR技术[8]、多重PCR技术[9]、环介导等温扩增技术[10]、数字PCR系统等[11]。这些方法由于其设备昂贵,操作人员水平要求高,对于普通实验室难以达到。所以常规平板培养法是食品检验中主要的检测方法,但比较耗时,一般要经过培养增菌、划线纯化、形态观察、生化鉴定、血清分型等,鉴定结果至少2~7天。金黄色葡萄球菌定量检测国标(GB4789.10-2016)方法中采用Baird-Parker平板进行计数,该平板是一种选择性培养基,在含有氮源的基础上,加入了促生长的丙酮酸钠和抑制剂亚碲酸钾,故有较好的选择性,但对于金黄色葡萄球菌没有抑制,能将亚碲酸钾还原为碲在菌落中心呈黑色,易于观察。加入卵黄,由于卵磷酯酶阳性特征,其菌落周围可出现明显的沉淀环,可与其它菌进行区别。显色培养基目前发展的较为成熟,该原理是利用目的菌的特征代谢物与培养基中的物质发生反应,从而使菌落显现特有颜色,达到与杂菌分离的方法,目前显色培养基在食品检验中已广泛应用。本试验采用了Baird-Parker琼脂平板与金黄色葡萄球菌显色平板分别进行计数,采用统计学方法进行分析,比较显色平板与Baird-Parker平板菌落计数结果的差异性,可以为食品中金黄色葡萄球菌定量检测能力验证和日常检验提供参考。
1 材料及方法
1.1 材料与试剂
样品21-Q669(中国检验检疫科学研究院测试评价中心发放);金黄色葡萄球菌显色培养基(法国科马嘉公司); Baird-Parker琼脂、营养琼脂、革兰氏染液、血平板、冻干兔血浆、L型涂布棒(北京陆桥技术股份有限公司);NID鉴定板(美国BD公司);金黄色葡萄球菌标准菌株ATCC6538(广东微生物研究所);表皮葡萄球菌标准菌株CMCC(B)26069(广东环凯微生物科技有限公司)。
1.2 仪器与设备
IPP260plus生化培养箱(美国墨尔特公司);CL-32L高压灭菌器(日本ALP公司);AC2-5S1生物安全柜(新加坡艺思高科技有限公司); Phoenix M50全自动菌种鉴定仪(美国BD公司); BX53显微镜(日本奥林巴斯株式会社公司);sensor turn培养皿自动转盘(德国wld-tec公司);levo plus电动移液器(北京大龙兴创公司);Votex 2涡旋振荡器(德国IKA公司)。
1.3 方法
1.3.1 样品的复原
用酒精棉球消毒西林瓶外部,小心打开瓶盖,立即加入20 mL生理盐水进行水化,充分溶解后吸出放入无菌瓶中,用剩余的生理盐水清洗西林瓶内部,回收清洗液放入上述无菌瓶中,总共60 mL,此溶液即为复原后60 mL的食品样品。
1.3.2 平板计数
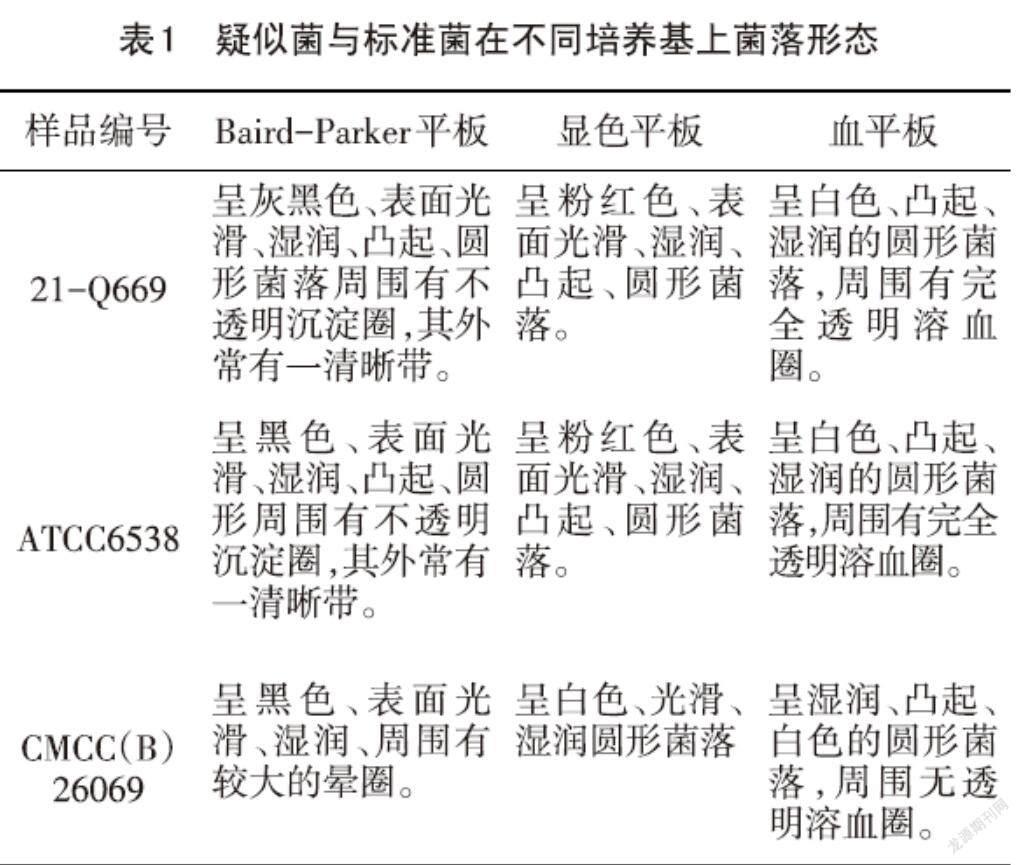
用1 mL无菌移液管吸取样品原液,加入9 mL生理盐水管中,制成1∶10(浓度)的样品匀液,吸取1∶10的样品匀液1 mL,加入加入9 mL生理盐水管中,制成1∶100的样品匀液,以此类推,制成10倍系列的稀释液。每个稀释度的稀释液以0.3 mL、0.3 mL、0.4 mL接种量分别加入三个Baird-Parker平板和三个显色平板,用L型涂布棒涂抹均匀,直至平板表面样液完全吸收,每个稀释度两个平行。倒置后于36 ℃培养24 h。金黄色葡萄球菌在BP平板上为灰黑色或黑色、表面光滑、湿润、凸起的圆形菌落,周围有不透明沉淀圈,其外常有一清晰带,在显色平板上呈紫红色、红色、粉红色,其它菌呈蓝色、无色或抑制生长。
1.3.3 确证鉴定
(1)血平板
挑取BP平板和显色平板上各10個典型的菌落,划线接种于血平板,倒置后于36 ℃培养24 h。在血平板上金黄色葡萄球菌菌落较大,呈黄色或白色、凸起、湿润的圆形菌落,周围有完全透明溶血圈。同时血平板上划线接种金黄色葡萄球菌标准菌株和表皮葡萄球菌标准菌株,表皮葡萄球菌在血平板上呈湿润、凸起、白色的圆形菌落,周围无透明溶血圈。
(2)染色镜检
对血平板上典型的菌落进行革兰氏染色,在100倍油镜下观察,金黄色葡萄球菌为革兰氏阳性球菌,无芽胞,呈葡萄球状排列,直径约为0.5~1.0 μm。表皮葡萄球菌为革兰氏阳性球菌,直径1.0μm左右,成葡萄状排列。
(3)血浆凝固酶实验
将血平板上典型的菌落接种到5 mL 脑心浸出液肉汤管中,36 ℃培养24 h。取0.3 mL BHI培养物加入兔血浆中,,置36 ℃培养箱中,每半小时观察一次,观察6 h。同时以金黄色葡萄球菌标准菌株作阳性对照,以表皮葡萄球菌标准菌株作阴性对照。
1.3.4 生理生化鉴定
经确证后的菌落,划线于营养琼脂平板,36 ℃培养24 h后采用全自动微生物菌种鉴定系统进行鉴定,用接种环挑取营养琼脂平板上的菌落到4.5 mL的Phoenix ID肉汤管中,制成0.5 McFarland的菌悬液,倒入NID卡后封盖,放入BD机箱中进行鉴定。
1.3.5 结果计算
按照GB4789.10-2016 《食品安全国家标准 食品微生物检验 金黄色葡萄球菌检验》中的计算公式和规则进行计算。
1.3.6 统计分析
数据分析采用SPSS 19.0软件,对不同平板计数所得的数据进行Duncan法单因素方差分析(P<0.05)。
2 结果与分析
2.1 菌落形态及菌体形态
经Baird-Parker平板与显色平板分离,样品中的菌落与金黄色葡萄球菌标准菌菌落形态基本一致(见表1),但样品中的疑似金黄色葡萄球菌菌落颜色在Baird-Parker平板上呈灰黑色,而金黄色葡萄球菌标准菌在Baird-Parker平板呈黑色。长期贮存的脱水或冷冻食品中的金黄色葡萄球菌,其菌落颜色较典型菌落浅些,有时可见到没有不透明圈和清晰带的金黄色葡萄球菌,这种菌的其他外观与典型的金黄色葡萄球菌基本相同,在选取疑似菌时,除典型菌落之外,还应对其它有差异的菌落进行确证实验,避免漏掉一些特殊的菌落。
2.2 确证实验
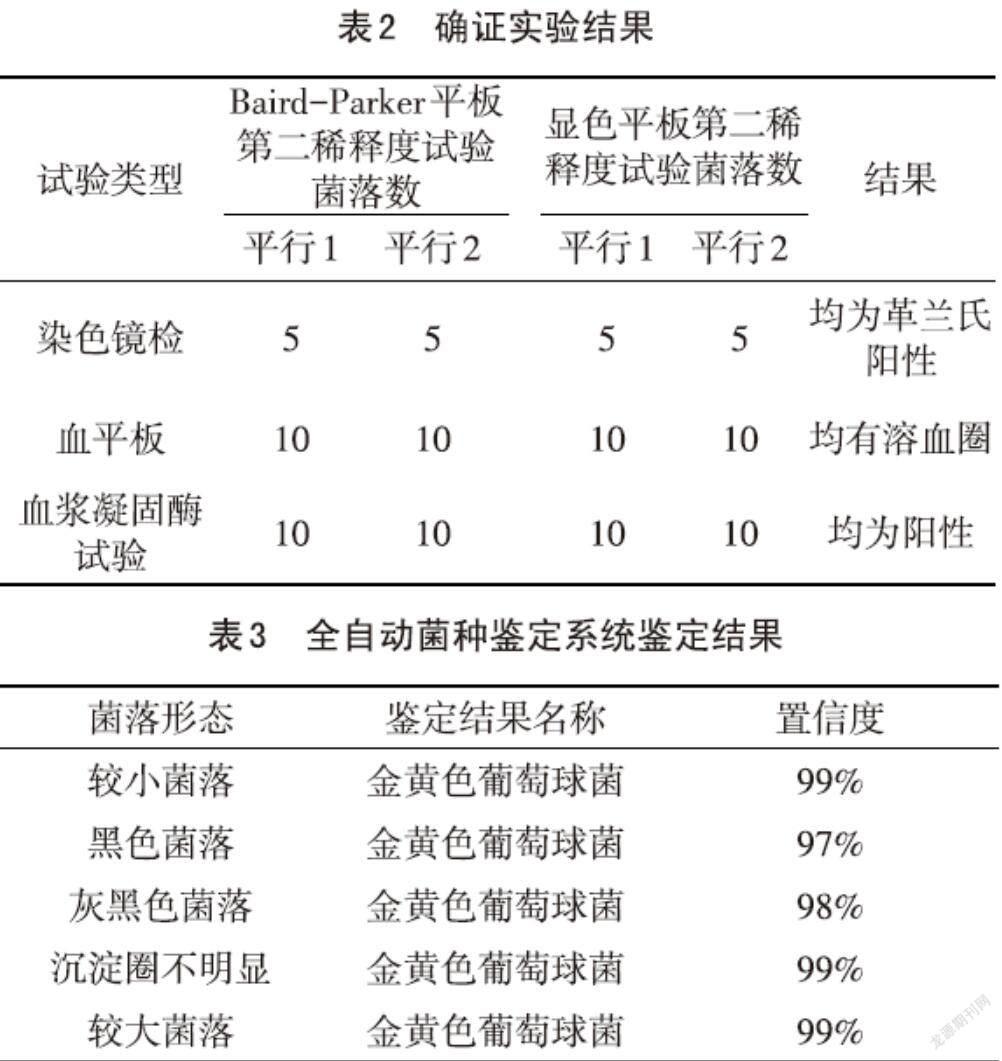
对Baird-Parker平板和显色平板中的疑似菌落进行确证实验(见表2),对第二稀释度平板上的疑似菌落进行革兰氏染色镜检、血平板划线和血浆凝固酶试验,挑取的20个菌落革兰氏染色镜检均为阳性球菌,40个疑似菌落划线血平板后均有溶血圈,40个菌落进行血浆凝固酶试验均为阳性。利用微生物全自动菌种鉴定系统对较小菌落、较大菌落、黑色菌落、灰黑色菌落和沉淀圈不明显的菌落进行鉴定,其鉴定结果均为金黄色葡萄球菌(见表3),置信度均在97 %以上,为极好的鉴定。
2.3 平板计数
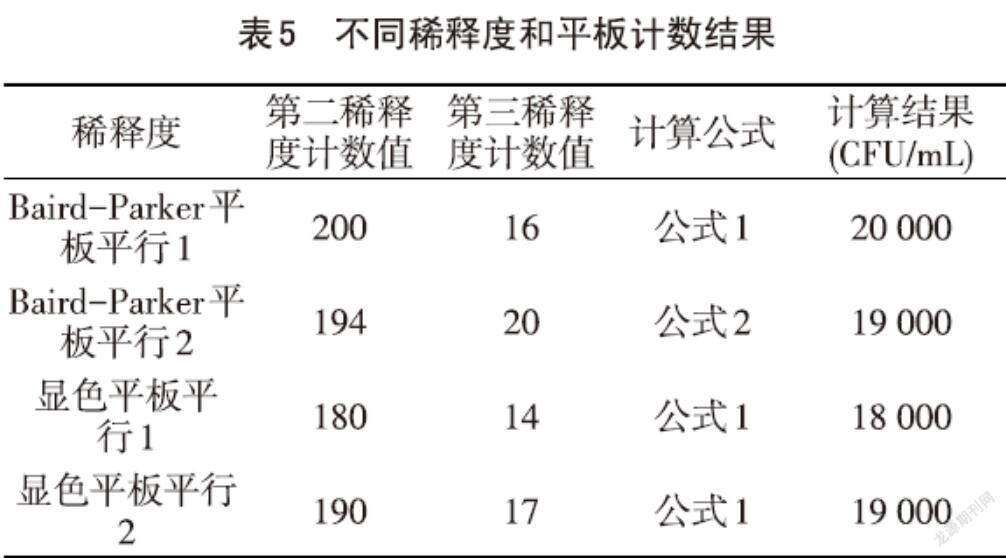
样品平板涂布后计数的原始数据见表4,样品原液和第一稀释度菌落多不可计,第二稀释度和第三稀释度平板上涂布均匀,根据标准GB4789.10-2016中的计算公式,Baird-Parker平板中平行1和显色平板中平行1和平行2的数值用公式1计算,Baird-Parker平板中平行2的值用公式2计算,其结果见表5。
2.4 统计分析
根据国标GB4789.10-2016 《食品安全国家标准 食品微生物检验 金黄色葡萄球菌检验》,选取菌落数在20~200之间的平板计算菌落数,即第二稀释度和第三稀释度的值符合要求。对两种培养基第二稀释度的菌落数进行Duncan法单因素方差分析,F = 4.235,P = 0.176,差异不显著(P > 0.05),结果见表6。对两种培养基第三稀释度的菌落数进行Duncan法单因素方差分析,F = 1.000,P = 0.423,差异不显著(P > 0.05),结果见表 7。用两种培养基最终计算结果进行Duncan法单因素方差分析,F = 2.000,P = 0.293,差异不显著(P > 0.05),结果见表 8。由此可见,金黄色葡萄球菌定量检测中,使用显色培养基和Baird-Parker培养基分别计数,其结果差异不显著,显色培养基可以在金黄色葡萄球菌定量能力验证中计数。
3 结论与讨论
样品21-Q669用Baird-Parker平板计数结果为20000 CFU/mL显色平板计数结果为19000 CFU/mL,最终所报的值采用了Baird-Parker平板计数结果,反馈值为Z = 0.00(|Z| ≤ 2为满意结果,2.0<|Z |<3.0为可疑结果,|Z| ≥ 3.0为不满意结果。),评价结果为满意。若采用显色平板计数结果,其值也在通报数值范围内(13000~32000 CFU/mL)。在检验过程中需要注意的是,使用鉴定合格的移液枪,培养基均应验收合格,涂布同一稀释度平板应使用同一涂布棒,以减少误差,使結果更准确。对两种培养基的计数结果,分别选取了第二稀释度和第三稀释度平板上计数的值,以及两种培养基计数后最终计算结果进行了Duncan法单因素方差分析,分析表明,显色培养基和Baird-Parker琼脂计数结果差异不显著(P > 0.05),显色培养基在能力验证中可以用作金黄色葡萄球菌计数。由于显色培养基可以区分出杂菌,排除干扰菌,在计数时更直观明了,节省检验时间,尤其在能力验证中,采用不同的方法进行检验,可以相互验证和比较,使结果更加准确。
金黄色葡萄球菌遍布于自然界,很多食品容易被污染,在食品致病菌检验中为重要的检测项目,其中乳制品、水果干制品、肉类、糕点等较容易检出[12]。引起污染的原因主要为原料带菌、生产过程灭菌不彻底、生产人员污染等。目前金黄色葡萄球菌检验主要采用传统的平板培养法[13-14],食品中以GB4789.10-2016 《食品安全国家标准 食品微生物检验 金黄色葡萄球菌检验》为依据。目前,显色培养基在多个国家标准中被应用,比如GB4789.4-2016、GB4789.5-2012、GB4789.7-2013等方法中均采用了显色培养基,但食品中金黄色葡萄球菌检测的国家标准中只采用了Baird-Parker琼脂。显色培养基发展已经较为成熟,比如法国科玛嘉公司和北京陆桥公司等生产的显色培养基灵敏度高、质量稳定、易观察,帮助检验人员节约了大量的检验时间,提高了检出率。在日常检验以及能力验证中,显色培养基可以作为不同的方法进行检测,利用显色培养基检测金黄色葡萄球菌,较传统的 Baird - Parker 更易于区分杂菌,具有较好的检测效果,有良好的应用前景[15]。
参考文献
[1] 张超楠. 食品中金黄色葡萄球菌的快速检测方法研究[D].吉林大学,2012.
[2] 张涛涛,王兰,龚频,等.环介导等温扩增技术快速检测金黄色葡萄球菌[J].江苏农业科学,2014,42(2):238-241.
[3] 高 路,何聪芬,李 萌,张昕悦等. 金黄色葡萄球菌快速检测技术的研究进展[J]. 食品科学技术学报,2014,32(02):51-55+71.
[4] 陈瑶,刘张玲,汤荣睿. 金黄色葡萄球菌生物膜预防和治疗的研究进展[J]. 中国抗生素杂志, 2021,46(01):20-26.
[5] Zhou QianJin, Lu JianFei, Su XiuRong, et al. Simultaneous detection of multiple bacterial and viral aquatic pathogens using a fluorogenic loop-mediated isothermal amplification-based dual-sample microfluidic chip [J]. Journal of Fish Diseases, 2020,
[6] Soltani Malihe, Hajikhani Bahareh, Zamani Samira, et al. Molecular characterization of Staphylococcus aureus strains isolated from hospitalized patients based on coagulase gene polymorphism analysis: High frequency of vancomycin-intermediate S. aureus and the emergence of coagulase type II in Iran[J]. Gene Reports, 2021, 23
[7] Hu Yaozhong, Sun Ying, Gu Jiaxin, et al. Selection of specific nanobodies to develop an immuno-assay detecting Staphylococcus aureus in milk[J]. Food Chemistry, 2021, 353
[8] 苏明权,杨柳,马越云,等. 实时荧光定量 PCR 检测金黄色葡萄球菌方法的试验研究[J].国际检验医学杂志,2010( 8) : 794-796.
[9] Li Peng, Zhang Dingxiu, Li Hongmei, et al. Establishment and Application of Multiplex PCR for Simultaneously Detecting Escherichia coli, Salmonella, Klebsiella pneumoniae, and Staphylococcus aureus in Minks [J]. Frontiers in Veterinary Science, 2020,
[10] HongYang,XiaoyanMa,XianzhouZhang,WeiZhang. Development and Evaluation of a Loop-mediated Isothermal Amplification Assay for the Rapid Detection of Staphylococcus aureus in Food [J]. European Food Research and Technology. 2001,232(5):769-776.
[11] [Zhang Tiantian, Niu Zhiqiang, Wu Feng, et al. Qualitative and quantitative detection of surgical pathogenic microorganisms Escherichia coli and Staphylococcus aureus based on ddPCR system [J]. Scientific Reports, 2021, 11(1)
[12] 徐文文,梁玉林,王云霞,劉秀,尹建军,周广军,宋全厚,丁梦璇,周鹏飞. 二重环介导等温扩增法快速检测乳粉中沙门氏菌和金黄色葡萄球菌[J]. 食品与发酵工业,2021,47(02):241-246.
[13] 中华人民共和国卫生部.化妆品卫生规范[S].北京:中国标准出版社,2007: 271-273.
[14] 陈丙卿,王茂起.现代食品卫生学[M].北京:人民卫生出版社,2001: 757-758.
[15] 蔡芷荷,卢勉飞,滕昆仑,时威,吴清平,梁家豪.金黄色葡萄球菌显色培养基检测效果评价[J].中国卫生检验杂志,2015,0(6)

