食管鳞癌组织中PD-1和PD-L1的表达及与患者预后的相关性研究
张群 蔡彭 杨妍 朱超莽 周士祥 张蕾 殷红梅 李红伟 李多杰
【摘要】 目的:探討PD-1和PD-L1在食管鳞癌(esophageal squamous cell carcinoma,ESCC)肿瘤组织中的表达情况及与患者临床病理特征和预后的相关性。方法:回顾性分析2012年1月-2016年12月于本院行食管癌根治性R0切除的139例Ⅲ期ESCC患者的病历资料。通过免疫组织化学(IHC)法分析139例的ESCC肿瘤组织与其中50例的癌旁组织(距肿瘤切缘>5 cm)中的PD-1、PD-L1蛋白表达,研究其表达情况与患者临床特征和预后的相关性。结果:ESCC肿瘤组织内PD-1、PD-L1蛋白阳性表达率均较癌旁组织高(18.7% vs 0,40.3% vs 22.0%,P<0.05)。不同PD-1、PD-L1表达情况患者年龄、性别、肿瘤部位、分化程度、淋巴结(N)分期比较,差异均无统计学意义(P>0.05)。Kaplan-Meier生存分析结果显示,PD-1阳性表达患者与PD-1阴性表达患者总生存率(overall survival rate,OS)及无病生存率(disease-free survival rate,DFS)比较,差异均无统计学意义(P>0.05);PD-L1阳性表达患者OS、DFS较PD-L1阴性表达患者均显著降低,差异均有统计学意义(P<0.05)。Cox回归分析结果显示,PD-L1蛋白表达是ESCC患者的独立预后因子。结论:PD-1的表达与食管鳞癌患者的预后无明显相关性,而PD-L1在食管鳞癌中的高表达与患者更差的预后相关。
【关键词】 食管鳞癌 PD-1 PD-L1 预后
Study on Expression of PD-1 and PD-L1 in Esophageal Squamous Cell Carcinoma and Its Correlation with Prognosis of Patients/ZHANG Qun, CAI Peng, YANG Yan, ZHU Chaomang, ZHOU Shixiang, ZHANG Lei, YIN Hongmei, LI Hongwei, LI Duojie. //Medical Innovation of China, 2021, 18(29): 0-032
[Abstract] Objective: To analyze the expression of PD-1 and PD-L1 in esophageal squamous cell carcinoma (ESCC) and the relationship between the expressions of PD-1, PD-L1 and the clinicopathological characteristics and prognosis of the patients. Method: The data of 139 patients with ESCC in stage Ⅲ who underwent radical R0 resection of esophageal carcinoma in our hospital from January 2012 to December 2016 were retrospectively analyzed. Immunohistochemistry (IHC) was used to analyze 139 cases of ESCC and 50 cases of paracancerous tissues (>5 cm from the margin of tumor), and the relationships between the expression of PD-1, PD-L1 and clinicopathological characteristics and prognosis of patients were analyzed. Result: The positive expression rates of PD-1 and PD-L1 proteins in ESCC tumor tissues were higher than those in para-cancer tissues (18.7% vs 0, 40.3% vs 22.0%, P<0.05). There were no significant differences in age, gender, tumor site, degree of differentiation and lymph node (N) stage among patients with different PD-1 and PD-L1 expressions (P>0.05). Kaplan-Meier survival analysis showed that there were no significant differences in overall survival rate (OS) and disease-free survival rate (DFS) between PD-1 positive patients and PD-1 negative patients (P>0.05). OS and DFS in PD-L1 positive expression patients were significantly lower than those in PD-L1 negative expression patients, and the difference were statistically significant (P<0.05). Cox regression analysis showed that PD-L1 protein expression was an independent prognostic factor in ESCC patients. Conclusion: The expression of PD-1 is not significantly correlated with the prognosis of patients with ESCC, while the high expression of PD-L1 in ESCC is correlated with the worse prognosis of patients.
[Key words] Esophageal squamous cell carcinoma PD-1 PD-L1 Prognosis
First-author’s address: The First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
doi:10.3969/j.issn.1674-4985.2021.29.007
近年来,在全球范围内食管癌的发病率逐年升高,其发病率、病死率分别居第4、6位[1-2]。在我国所有食管癌中,食管鳞癌(esophageal squamous cell carcinoma,ESCC)占其中的90%左右[3]。虽然同步放化疗、免疫及靶向治疗在食管癌的治疗方面已取得了突破性进展,但其局部复发率和远处转移率仍然较高,文献[4-5]报道患者5年生存率仅为30%左右。PD-1属于免疫球蛋白超家族CD28成员,表达部位主要位于T细胞、DC细胞与B细胞的细胞膜。PD-L1的表达部位以激活态T细胞、成纤维细胞、B细胞、DC细胞、巨噬细胞与其他部分肿瘤细胞的细胞膜为主[6]。信号通路PD-1/PD-L1的激活会导致活化的T细胞衰竭,促进肿瘤细胞的免疫逃逸[7-9]。目前,已有多项研究表明相比于正常食管组织,ESCC患者中PD-1和PD-L1表达量增高,但这些差异表达和患者生存预后的相关性仍存在较大争议。因此,本文旨在研究ESCC患者病理组织中PD-1/PD-L1蛋白的表达水平,研究其表达情况和患者临床病理特征及预后的关联性,以期为食管癌的治疗提供新线索。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月-2016年12月于本院行食管癌根治性R0切除的139例Ⅲ期ESCC患者的病历资料。(1)纳入标准:①治疗前行内镜下组织活检,经病理确诊为ESCC;②经影像学、消化道钡餐造影、超声内镜等检查证实为Ⅲ期ESCC;③均为初次治疗;④无其他系统(如心、肺、肾、脑等)严重合并症,无手术禁忌证;⑤临床病理和随访资料完备。(2)排除标准:①术前行新辅助放化疗;②术前卡氏评分(KPS评分)<70分。同时选取其中50例的癌旁组织进行对照研究。收集患者年龄、性别、肿瘤分化级别、淋巴结转移情况及肿瘤部位等数据。本研究涉及的所有组织标本均来自本院病理组织库。
1.2 实验试剂 兔抗PD-1/PD-L1单抗(剑桥Abcam公司,英国),多克隆过氧化物酶偶联的抗兔IgG(中国福州麦心生物技术开发有限公司)。
1.3 PD-1/PD-L1表达的检测
1.3.1 组织芯片 对肿瘤组织与其癌旁组织先进行苏木精-伊红(H&E)独立染色,再通过福尔马林固定,接着采取石蜡包埋(FFPE)处理,并由两名病理学专家进行双重检查。用石蜡组织块构建了139例病例和50个对照标本的组织微阵列。从每个标本的FFPE组织块中取出直径2 mm的区域。切下一系列4 µm厚的切片,并根据制造商的说明转移到载玻片上进行免疫组化染色。
1.3.2 免疫组化 通过兔抗PD-1/PD-L1单抗开展IHC染色,用来对PD-1/PD-L1组织表达进行评估。将组织微阵列去石蜡并再水化,再对切片实施中和内源性过氧化物酶(PO)处理,最后通过山羊封闭血清完成封闭处理。随后将样品与PD-1/PD-L1抗体结合,和多克隆PO偶联的抗兔IgG同时接受20 min孵育。最后,通过苏木精对玻片实施复染处理。
1.3.3 免疫染色评估 在低倍镜(×100)下检查免疫组织化学结果,对于阳性染色的切片,以高放大倍数确定在每个选定视野中显示高和低染色的肿瘤细胞的染色强度和比例。研究中使用的免疫反应评分模式(ISP)是强度类别和比例类别的组合[10],强度类别等级为0分(蓝紫色)、1分(淡黄色)、2分(棕黄色)和3分(棕褐色),比例类别等级为0分(小于1%),1分(1%~30%),2分(31%~60%)和3分(61%~100%)。通过将强度类别等级与比例类别等级相乘得出最终得分,分值0~9分,ISP<3分为阴性,ISP≥3分为阳性。两名病理学专家对肿瘤样本进行独立双盲审查并进行了评分,对于有争议的标本进行讨论直到达成共识。
1.4 随访 术后2年内,每3~6个月进行1次复查,2年后随访1次/年,直至死亡,将全因死亡(或疾病进展)作为随访终点事件,在随访时间上,中位值是29.5个月,结束随访的时间是2019年12月31日。
1.5 统计学处理 采用SPSS 26.0软件对所得数据进行统计分析,通过字2检验或Fisher确切概率法分析PD-1、PD-L1蛋白的表达情况和患者临床病理特征间的关联性。通过Kaplan-Meier方法比较PD-1、PD-L1阴性表达与阳性表达两组患者的OS和DFS差异。通过Cox比例风险模型筛选影响ESCC患者预后的相关因子。以P<0.05为差异有统计学意义。
2 结果
2.1 ESCC肿瘤组织中PD-1/PD-L1的表达情况 139例ESCC组织中,PD-1阳性26例(18.7%),阴性113例(81.3%);PD-L1阳性56例(40.3%),阴性83例(59.7%)。50例癌旁組织,无PD-1阳性,阴性50例(100%);PD-L1阳性11例(22.0%),阴性39例(78.0%)。相比于癌旁组织,PD-1、PD-L1在ESCC的细胞膜或细胞质(或两者)中均过表达(P<0.05)。
2.2 PD-1、PD-L1与ESCC临床病理特征的关系 不同PD-1、PD-L1表达情况患者年龄、性别、肿瘤部位、分化程度、淋巴结(N)分期比较,差异均无统计学意义(P>0.05),见表1、2。
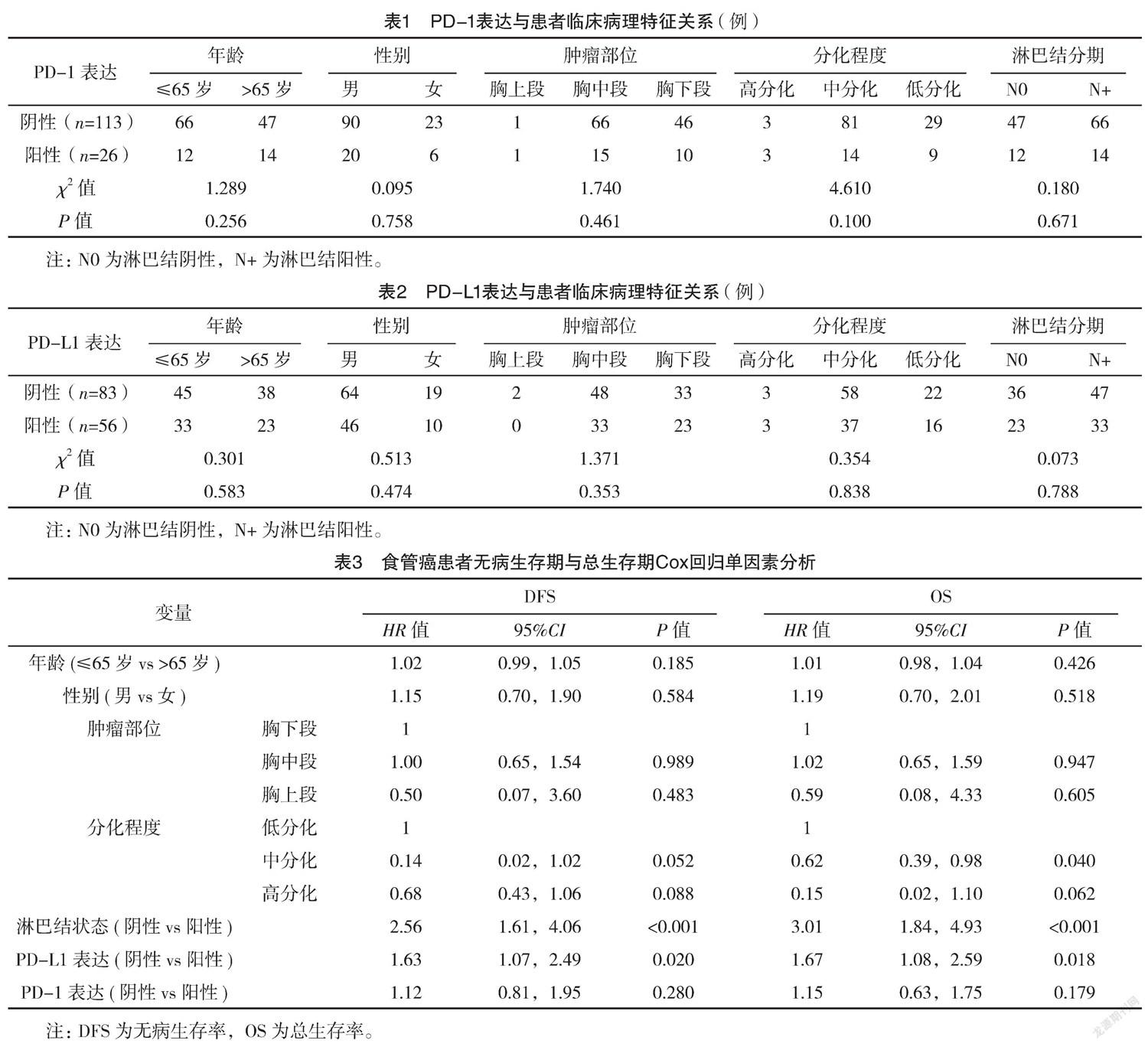
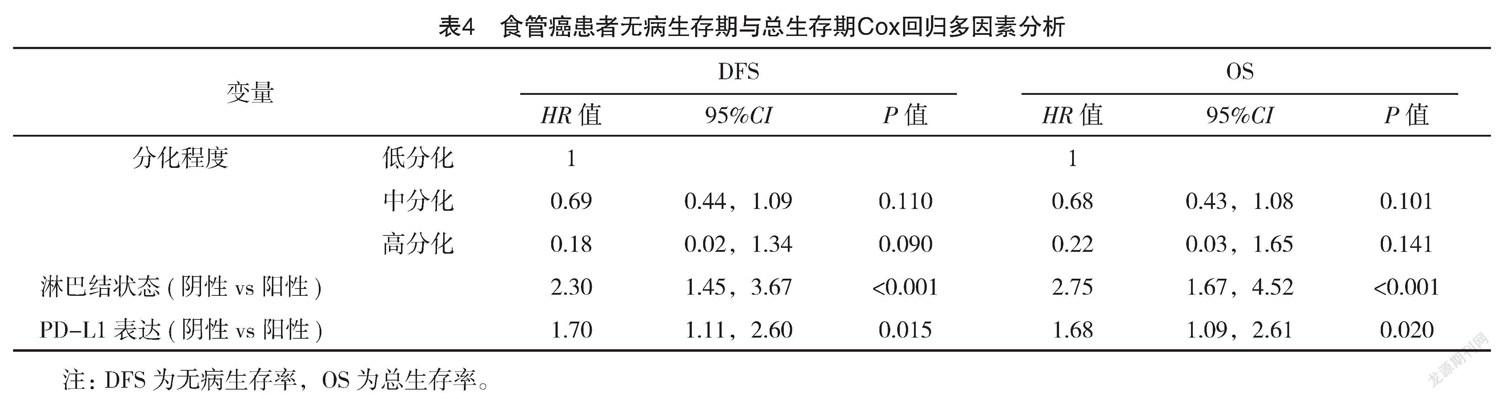
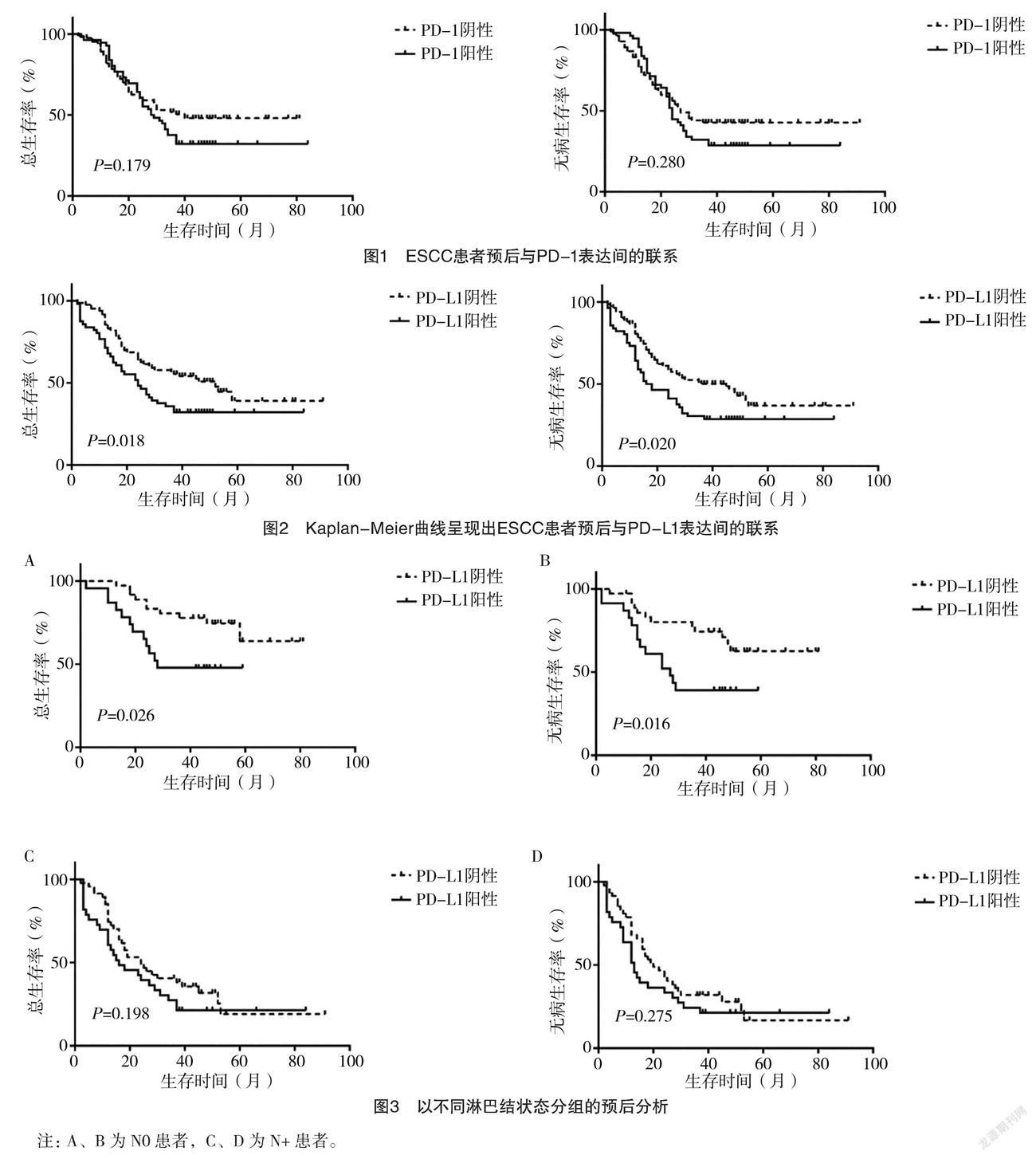
2.3 ESCC患者的预后多因素分析及PD-1、PD-L1蛋白表达的预后价值 通过Cox多因素模型分析影响患者OS、DFS的因素,结果显示:淋巴结转移状态、PD-L1表达均是OS、DFS的独立预后因子(P<0.05),见表3、4。PD-1的表达不是OS、DFS的独立预后因子(P=0.518、0.602),见图1。PD-L1阳性表达患者OS(中位OS为22.4个月)和DFS(中位DFS为18.7个月)较PD-L1阴性表达患者(中位OS为43.2个月,中位DFS为41.4个月)均显著降低(P<0.05),见图2。N0患者,PD-L1阳性表达患者OS(中位OS为28.7个月)与DFS(中位DFS为24.5个月)较PD-L1阴性表达患者均低(P<0.05);N+患者,PD-L1阳性表达患者OS(中位OS为17.2个月)与DFS(中位DFS为16.6个月)与PD-L1阴性表达患者(中位OS为22.1个月,中位DFS为19.4个月)比较,差异均无统计学意义(P>0.05)。见图3。
3 讨论
PD-1和PD-L1的结合会传递机体免疫抑制相关信号,属于抑制性的协同刺激分子,并抑制T淋巴细胞的活化,抑制T淋巴细胞杀伤靶细胞的功能,促进肿瘤增殖转移[11-15]。但在ESCC中,患者肿瘤组织中的PD-1、PD-L1的表达与患者的临床病理特征、预后的相关性仍然未知,虽然既往大量研究进行了探索,但各个研究之间报道的结果仍存在较大争议。因此,本项研究通过回顾性分析139例ESCC术后标本,探讨PD-1、PD-L1表达在局部可切除的Ⅲ期ESCC患者中的临床意义及预后价值,以期为食管鳞状细胞癌患者的预后提供预测指标。
本研究通过ISP法进行肿瘤组织中PD-1、PD-L1表达的评估,总体PD-1、PD-L1阳性表达率分别为18.7%、40.3%。统计分析结果显示,不同PD-1、PD-L1表达情况患者年龄、性别、肿瘤部位、分化程度、淋巴结(N)分期比较,差异均无统计学意义(P>0.05)。但PD-L1高表达是影响ESCC患者OS、DFS的独立预后因子(P<0.05)。相比于PD-L1阴性表达患者,PD-L1阳性患者OS与DFS均明显降低(P<0.05)。提示PD-L1的表达与患者较差的预后有关。目前PD-L1过表达导致ESCC患者预后不良的机制仍不清楚,有研究表明PD-L1表达会加深肿瘤浸润深度,从而促进局部进展[16-18]。李琦等[19]通过回顾性分析87例食管鳞癌患者PD-1/PD-L1表达与临床特征的相关性,结果表明,PD-L1的表达与患者性别、年龄、吸烟、肿瘤位置、肿瘤形态、TNM分期均无明显相关性,且其研究结果发现PD-L1高表达组1、2、3年生存率分别为32%、12%、12%,显著低于PD-L1低表达组的59.8%、35.0%、28.7%,PD-L1高表达的患者死亡风险为PD-L1低表达的患者的1.587倍,是影响食患者生存预后的独立影响因子。隋启海等[20]收集325例行手术切除的食管癌患者的临床资料并通过免疫组化的方法分析了肿瘤组织和部分癌旁组织中PD-1、PD-L的表达,结果表明,PD-1、PD-L1阳性表达率分別为12.0%、52.6%,PD-1、PD-L1的表达与患者性别、年龄、吸烟、肿瘤位置、肿瘤最大径、淋巴结转移均无明显相关性,生存分析方面显示,PD-1阴性表达患者与PD-1阳性表达患者总生存率比较,差异无统计学意义(P=0.500),但是在随访期内存活组的PD-L1阳性表达率明显低于死亡组。以上结果与本研究是一致的,均提示肿瘤组织中PD-L1的过表达是ESCC切除术后患者生存的独立预后因子。
此外,在本项研究中按淋巴结转移状态分类,N+患者,PD-L1阳性表达患者OS(中位OS为17.2个月)与DFS(中位DFS为16.6个月)与PD-L1阴性表达患者(中位OS为22.1个月,中位DFS为19.4个月)比较,差异均无统计学意义(P>0.05)。分析原因可能是在癌症的晚期阶段,淋巴结转移对患者预后的影响远大于PD-L1的表达,提示针对不同淋巴结分期的ESCC患者,PD-L1表达对患者预后的预测价值存在局限性,显示出对早期ESCC预后价值更高。
综上,ESCC肿瘤组织中PD-1、PD-L1蛋白阳性表达率显著增加,其表达和患者临床病理特征之间无显著关联。但是PD-L1可作为ESCC患者OS、DFS的独立预后因素,尤其对于N0的患者,PD-L1的高表达与患者更差的预后相关,但这一结论仍需要进一步的大规模,多中心的临床试验来验证。
参考文献
[1] Rustgi A K,El-Serag H B.Esophageal carcinoma[J].N Engl J Med,2014,371:2499-2509.
[2] Siegel R L,Miller K D,Jemal A.Cancer statistics,2020[J].CA Cancer J Clin,2020,70(1):7-30.
[3] Chen W,Zheng R,Baade P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66:115-132.
[4] CHEN W,ZHENG R,ZENG H,et al.Annual report on status of cancer in China,2011[J].Chin J Cancer Res,2015,27:2-12.
[5] Short M W,Burgers K G,Fry V T.Esophageal Cancer[J].Am Fam Physician,2017,95(1):22-28.
[6] Hansen J D,Du Pasquier L,Lefranc M P,et al.The B7 family of immunoregulatory receptors:a comparative and evolutionary perspective[J].Mol Immunol,2009,46:457-472.
[7] Francisco L M,Salinas V H,Brown K E,et al.PD-L1 regulates the development, maintenance, and function of induced regulatory T cells[J].J Exp Med,2009,206:3015-3029.
[8] Sanmamed M F,Chen L.Inducible expression of B7-H1(PD-L1) and its selective role in tumor site immune modulation[J].Cancer J,2014,20:256-261.
[9] Pardoll D M.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12:252-264.
[10] QIAO W,FAN F,FEI W,et al.PD-L1 Expression On tumor Cells Was Associated With Unfavorable Prognosis In Esophageal Squamous Cell Carcinoma[J].J Cancer,2018,9:2224-2231.
[11] Seliger B.Basis of PD1/PD-L1 Therapies[J].J Clin Med,2019,8(12):2168.
[12] REN D,HUA Y,YU B,et al.Predictive biomarkers and mechanisms underlying resistance to PD1/PD-L1 blockade cancer immunotherapy[J].Mol Cancer,2020,19(1):19.
[13] WANG Z,WU X.Study and analysis of antitumor resistance mechanism of PD1/PD-L1 immune checkpoint blocker[J].Cancer Med,2020,9(21):8086-8121.
[14] Mazieres J,Drilon A,Lusque A,et al.Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations:results from the IMMUNOTARGET registry[J].Ann Oncol,2019,30(8):1321-1328.
[15] WANG L,MA Q,YAO R,et al.Current status and development of anti-PD-1/PD-L1 immunotherapy for lung cancer[J].Int Immunopharmacol,2020,79:106088.
[16] Poggio M,Hu T,Pai C C,et al.Suppression of Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory[J].Cell,2019,177(2):414-427.
[17] YU H,Boyle T A,ZHOU C,et al.PD-L1 Expression in Lung Cancer[J]. J Thorac Oncol,2016,11(7):964-975.
[18] WANG X,TENG F,KONG L,et al.PD-L1 expression in human cancers and its association with clinical outcomes[J].Onco Targets Ther,2016,9:5023-5039.
[19]李琦,李濤,范羽,等.PD-1/PD-L1在食管鳞状细胞癌中的表达及临床意义[J].肿瘤预防与治疗,2018,31(4):248-257.
[20]隋启海,詹成,马可,等.食管鳞状细胞癌(ESCC)中PD-1/PD-L1/PD-L2的表达与临床因素及预后的相关性[J].复旦学报(医学版),2020,47(1):76-82,100.
(收稿日期:2021-08-23) (本文编辑:程旭然)

