一种基于CCD的全自动循环肿瘤细胞检测系统
张俊哲 贾强 陈柯宇 王骏哲

摘要:文章旨在介绍一种基于CCD的全自动循环肿瘤细胞检测系统。该系统主要采用多路阀控制实验进程,通过对血液中过量表达EpCAM的细胞进行分离富集,然后经过免疫化学染色,通过CCD摄像头来将采集到的多重荧光成像的图像传递给LabView进行处理,根据图像表征的不同来确定是否为循环肿瘤细胞以及检测个数并对其进行相关图像特性的分析。
关键词:CCD;循环肿瘤细胞;免疫荧光染色;LabView平台;图像处理
中图分类号:TP311 文献标识码:A
文章编号:1009-3044(2021)06-0186-03
Abstract: This paper is aimed to introduce an automatic detecting system for circulating tumor cells(CTCs) based on CCD. This system mainly employs multi-way valve to control the whole experimental process, with separating and enriching the overexpressed EpCAM cells in blood, then using immunohistochemical stain for cells. CCD Cameras are used to collect multiple fluorescence images of staining cells and LabView analyzes those cell image. The characterizations of images are used to determine whether the cells are CTCs and the number of CTCs, following the analysis of associated biochemical characteristics.
Key words: CCD; Circulating tumor cells; immunohistochemical staining; LabView; image process
1 背景
利用多重免疫熒光染色原理进行循环肿瘤细胞的鉴别,在目前针对循环肿瘤细胞检测的研究中得到广泛的应用[1]。在循环肿瘤细胞检测研究中,利用标记了荧光素的抗体与细胞表面的抗原特异结合,使细胞在荧光显微镜下呈现不同的荧光,进而鉴别和检测循环肿瘤细胞并进行细胞相关的生化分析[2]。因此细胞染色成像结果的不同对于鉴别和检测循环肿瘤细胞具有重要的作用。传统的免疫荧光染色方式是人为通过细胞样品准备、固定、封闭、一抗孵育、二抗孵育等一系列实验过程进行操作,不但复杂烦琐,而且耗时耗力,不能保证染色效果[3]。本系统利用多路阀控制样品和试剂的注入和抽出,保证染色过程的反应时间和效果,并用摄像头采集染色得到的多重荧光成像图传递给LabView进行分析,从而达到自动鉴别循环肿瘤细胞并计数的目的。
2 三重免疫荧光染色原理
三重免疫荧光染色是建立在免疫学、生物化学和显微镜技术基础上,结合抗原抗体反应的特异性与荧光物质检测的敏感性和直观性形成的一种染色技术[4]。其主要原理是通过抗原抗体之间的特异性识别作用与荧光物质检测的敏感性来显示目的细胞。通过免疫或者生物化学的方法将不同荧光素标记在特异性抗体上,使之成为荧光抗体[5]。在一定条件下荧光抗体与细胞表面的抗原特异结合,在一定波长的光照下,结合在细胞表面的不同荧光素发出不同波长的荧光[6],通过荧光显微镜即可观察到细胞多重荧光成像图,进而鉴别循环肿瘤细胞。
三重荧光染色的步骤通常分为细胞样品准备、固定细胞、封闭、一抗孵育、二抗孵育、三重染色[7]。人工染色不仅容易污染实验,导致实验成像误差较大,难以鉴别循环肿瘤细胞,而且耗时耗力。因此,我们设计出一种基于CCD摄像头的全自动循环肿瘤细胞检测系统代替传统人工操作模式,通过多路阀来控制不同荧光染色试剂的自动注入与抽出,保证细胞染色过程的反应时间和效果,并将CCD摄像头采集到的细胞多重荧光成像图用LabView软件进行分析,进而达到识别、定位和计数循环肿瘤细胞的目的。
3 系统设计
3.1 硬件设计
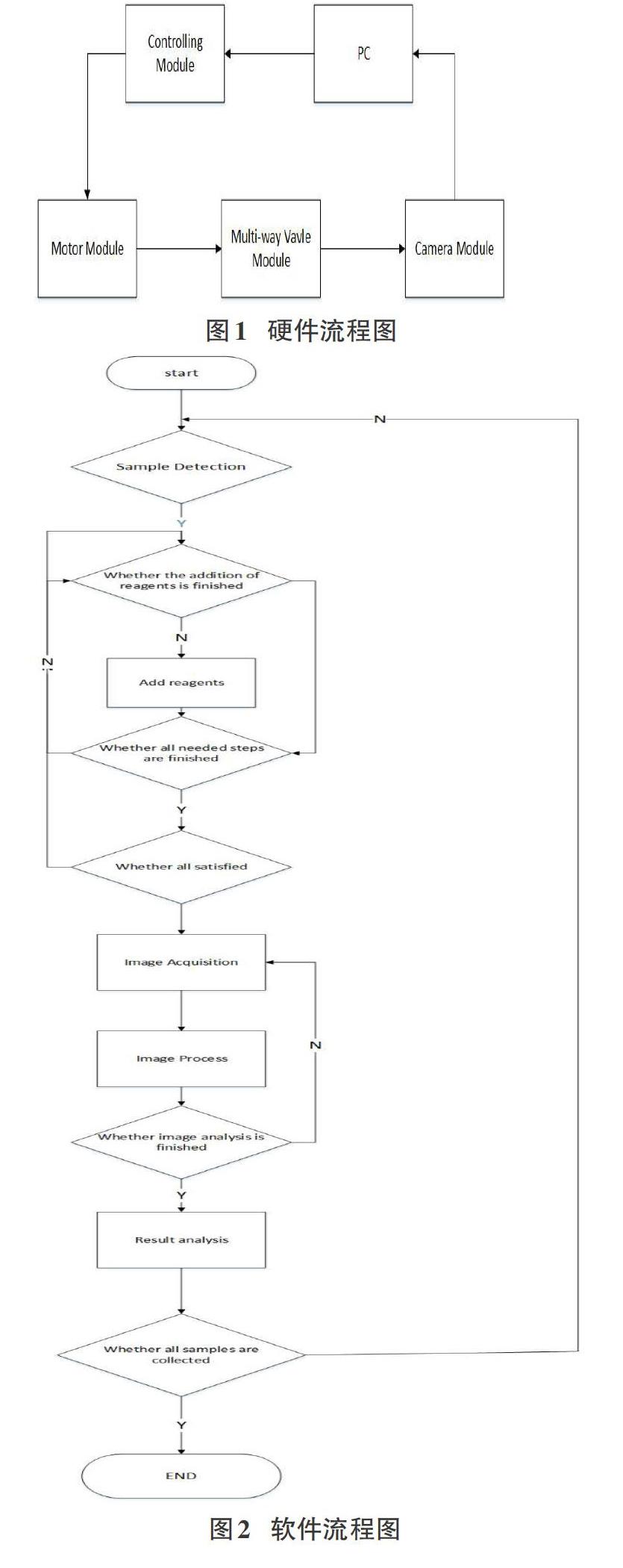
本系统硬件设计主要包括PC、主控模块、电机模块、多路阀模块、CCD摄像头模块五部分。如图1所示。
PC发出指令,主控模块得到命令驱动电机工作,进而操纵多路阀控制不同荧光染色试剂和待染色样本的注入及抽取,并通过软件实时控制不同试剂的反应时间,以确保三重荧光染色步骤每一步的准确性和无污染性。待染色结束后,CCD摄像头自动采集多重荧光染色成像并传递给PC端的LabView进行图像处理分析,最终鉴别是否为循环肿瘤细胞并计数,达到自动检测循环肿瘤细胞的目的。
3.2 软件设计
本系统软件设计是利用人机交互界面的LabView程序结合STM32系列微控制器的程序来设计,软件设计流程图如图2所示:
3.2.1 样本三重荧光染色编程模块
样本三重荧光染色的程序主要实现不同试剂的注入与抽出及相应反应时间的控制,其主要程序中的部分代码如图3所示:
3.2.2 图像采集编程
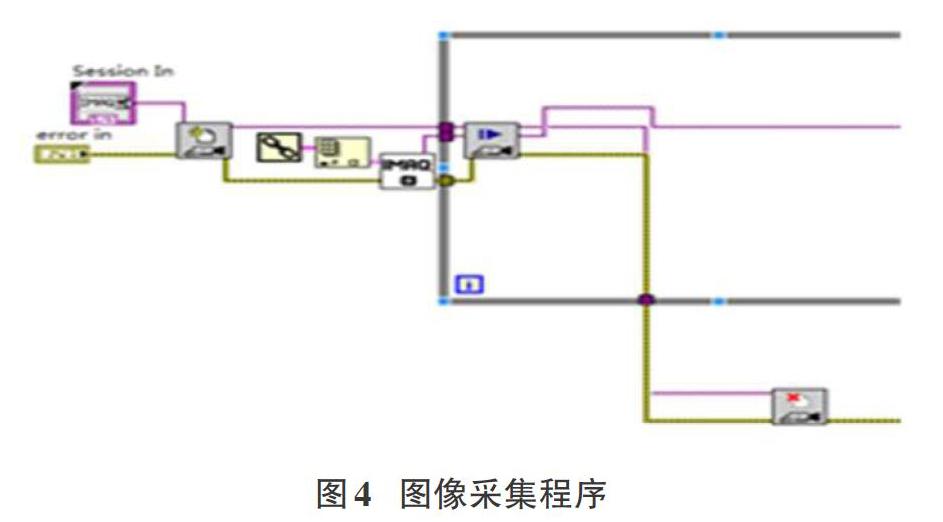
PC端控制CCD摄像头采集三重荧光染色图像的程序模块如图4所示,主要有以下几个步骤:
1)使用IMAQ Create.vi来创建采集的图形存储空间;
2)使用IMAQdx Open Camera.vi来打开CCD摄像头;
3)使用IMAQdx Snap.vi来获取CCD摄像头采集的图像;
4)使用IMAQdx Close Camera.vi来关闭CCD摄像头。
3.2.3 图像处理编程
LabView对循环肿瘤细胞三重荧光染色成像进行图像处理的模块如图5所示,对采集到的荧光图像进行的处理主要包括以下几个步骤:
1)图像滤波处理, 图像滤波主要是针对采集到的图像亮暗对比度不够明显的情况,主要使用IMAQ Convolute.VI来实现;
2)图像区域阈值处理,图像区域阈值处理主要是对区域中的阈值进行计算。主要使用IMAQ AutoBThreshold 2. VI来实现;
3)图像形态转换处理,图像形态转换处理主要借由改变图素价值在图像中修正特征的形状。主要使用IMAQ Morphology.VI 来实现;
4)图像填充处理,图像填充主要是针对粒子中不规则的部分进行填充处理,主要使用IMAQ FillHole.VI来实现;
5)图像边缘去除处理,图像边缘去除处理主要是针对图像边缘粒子的清理。主要使用IMAQ RejectBorder.VI来实现;
6)图像粒子过滤处理,图像粒子过滤主要是针对根据过滤器标准除去图像中的粒子,主要利用IMAQ Particle Filter3.VI来实现;
7)图像计数功能处理。图像计数功能主要是对二进位图像中检测到的粒子进行计数和分析,主要利用IMAQ Particle Analysis.VI来实现。
3.2.4 图像结果检测
关联对比选定区域中经过LabView图像处理之后的三个阶段的细胞荧光图像后,得出结论并显示相应的结果[8]。其模块如图6所示。主要有以下三个步骤:
1)区域坐标定位,区域坐标定位主要是针对图像中特定区域内的细胞进行定位,主要采用自定义模块IMAQ RegionCoordinatePosition.vi来实现;
2)颜色匹配,颜色匹配主要是针对图像中特定区域内的粒子颜色进行匹配,主要采用IMAQ MatchColorPattern.vi来实现;
3)区域对比判定,区域对比并判定主要是针对图像中特定区域进行对比并判定结果,主要采用自定义模块IMAQ RegionComparisonDetermination.vi来实现。
3.2.5 串口通信编程
串口通信的程序模块如图7所示,对于三重荧光染色操作、染色图像采集操作,所需的相关数据传输至下位机中,而下位机相关反馈数据则会被传输到上位机PC端[9],主要有以下三个步骤:
1)使用VISA Configuration Serial Port.vi来对串口进行初始化操作;
2)使用VISA Read.vi和VISA Write.vi来对串口数据的读取和写入;
3)使用VISA Close.vi关闭串口。
4 实验结果
系统完成后,将需要进行鉴别和计数的肿瘤细胞样本放入系统平台上进行三重免疫荧光染色处理。系统运行结果如下图8、图9所示,其中图8第一行为循环肿瘤细胞三重免疫荧光成像图,第二行是LabView进行图像处理过程后的图,第三行是经过LabView处理完成之后的计数及定位图,图9是CTCs全自动检测平台界面图。
5 结束语
本文利用循环肿瘤细胞三重免疫荧光染色原理,采用CCD摄像头结合LabView平台设计出循环肿瘤细胞染色及图像检测处理自动化系统,实验结果表明系统可以实现方便快捷以及准确无污染的染色检测分析平台。整个系统操作便捷,工作稳定,精确无污染,可节省大量人力成本以及人工操作导致的误差,具有极大的实用价值。
参考文献:
[1] Stott S L,Hsu C H,Tsukrov D I,et al.Isolation of circulating tumor cells using a microvortex-generating herringbone-chip[J].Proc Natl Acad Sci,2010,107(43):18392-18397.
[2] Cristofanilli M,Mendelsohn J.Circulating tumor cells in breast cancer:Advanced tools for “tailored” therapy?[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(46):17073-17074.
[3] Paterlini-Brechot P,Benali N L.Circulating tumor cells (CTC) detection:Clinical impact and future directions[J].Cancer Letters,2007,253(2):180-204.
[4] Dong X,Alpaugh K R,Cristofanilli M.Circulating tumor cells (CTCs) in breast cancer:a diagnostic tool for prognosis and molecular analysis[J].Chinese Journal of Cancer Research,2012,24(4):388-398.
[5] Mostert B,Sleijfer S,Foekens J A,et al.Circulating tumor cells (CTCs):Detection methods and their clinical relevance in breast cancer[J].Cancer Treatment Reviews,2009,35(5):463-474.
[6] De Giorgi V,Pinzani P,Salvianti F,et al.Application of a filtration- and isolation-by-size technique for the detection of circulating tumor cells in cutaneous melanoma[J].Journal of Investigative Dermatology,2010,130(10):2440-2447.
[7] Adams A A,Okagbare P I,Feng J,et al.Highly efficient circulating tumor cell isolation from whole blood and label-free enumeration using polymer-based microfluidics with an integrated conductivity sensor[J].Journal of the American Chemical Society,2008,130(27):8633-8641.
[8] Warkiani M E,Khoo B L,Wu L,et al.Ultra-fast,label-free isolation of circulating tumor cells from blood using spiral microfluidics[J].Nature Protocols,2016,11(1):134-148.
[9] 呂向锋,高洪林,马亮,等.基于LabVIEW串口通信的研究[J].国外电子测量技术,2009,28(12):27-30,42.
[10] 刘佳,刘震.单细胞分析技术研究进展[J].色谱,2016,34(12):1154-1160.
【通联编辑:谢媛媛】

