大豆根瘤菌HH103 rhcN突变对结瘤能力的影响
刘函西,吕浩,郭广雨,刘冬旭,石岩,孙志君,张泽鑫,张艳娇,文莹楠,王洁琦,刘春燕,陈庆山,辛大伟,王锦辉
大豆根瘤菌HH103突变对结瘤能力的影响
刘函西1,吕浩1,郭广雨2,刘冬旭1,石岩1,孙志君1,张泽鑫1,张艳娇1,文莹楠1,王洁琦1,刘春燕1,陈庆山1,辛大伟1,王锦辉1
1东北农业大学农学院,哈尔滨 150030;2哈尔滨农业科学院,哈尔滨 150028
大豆是重要的经济作物,能够为人类提供大量的植物蛋白和油脂。大豆在生长过程中,能够与根瘤菌形成共生体系进行共生固氮,该形式的共生固氮能够将空气中的氮气还原成氨,为大豆生长发育提供丰富氮源。根瘤菌Ⅲ型分泌系统是根瘤菌中重要的蛋白分泌结构,能够通过分泌Ⅲ型效应因子在共生体系建立过程中发挥重要调控作用。根瘤菌编码一种ATP转移酶,是根瘤菌Ⅲ型分泌系统的重要组成部分,能够保障根瘤菌Ⅲ型效应因子向宿主细胞的正常分泌。【】探索突变情况下对根瘤菌结瘤能力的影响,提高大豆-根瘤菌共生体系的固氮效率,为大豆农业生产提供必要的参考和支持。通过三亲杂交和同源重组,在起始密码子ATG下游插入了一个抗性基因,利用PCR扩增和Southern blot对插入情况进行验证,从而构建插入突变体HH103ΩrhcN。利用大豆染料木苷(Genistin)对野生型根瘤菌HH103及HH103ΩrhcN突变体进行诱导,并对处理组合对照组进行胞外蛋白纯化,通过Western blot检测突变对根瘤菌III型效应因子NopC及NopT分泌的影响。利用双层钵植物培养系统对大豆Williams82进行野生型根瘤菌HH103和HH103ΩrhcN突变体接种,分析突变对根瘤表型的影响。利用前期收集的100份基因型差异的大豆品种进行结瘤能力鉴定,分析根瘤菌Ⅲ型效应因子分泌异常情况下在不同基因型大豆品种中的结瘤表现。通过PCR扩增和Southern blot验证了成功构建的HH103ΩrhcN突变体,胞外蛋白鉴定表明突变能够抑制根瘤菌Ⅲ型效应因子NopC和NopT分泌。利用HH103ΩrhcN突变体和野生型HH103在Williams82进行结瘤鉴定,结果表明,突变能够显著抑制根瘤数和根瘤干重。对100份基因型差异的大豆品种进行结瘤鉴定,结果表明,突变能够引起其中80份大豆资源根瘤数目降低,13份根瘤数目显著升高,7份不发生显著性变化。突变能够引起根瘤菌Ⅲ型效应因子的异常分泌,进而能够影响共生体系的建立。根瘤菌III型效应因子在大豆-根瘤菌共生体系形成过程中发挥着重要作用,并且不同基因型大豆遗传背景对根瘤菌Ⅲ型效应因子具有不同应对反应。
大豆;根瘤菌;III型效应因子;;共生
0 引言
【研究意义】大豆是世界范围种植广泛的重要经济作物,能够为人类提供丰富的油脂和植物蛋白[1]。随着中国人民生活质量的提高,中国对大豆的需求逐年上升,已成为世界最大的大豆进口国。随着化肥施用量的增加,大豆生产对化肥的依赖越来越大[2-3],导致土壤板结加剧、水体富营养化和重金属富集等环境问题[4-5]。作为高需氮作物,大豆在长期的进化过程中通过与根瘤菌相互作用,在根部发育并形成根瘤。根瘤能够将空气中的氮气高效转化成化合态氮,使大豆适应低氮环境,维持大豆正常的生长发育[6-7]。所以充分发挥大豆根瘤菌共生固氮作用,是减少化肥施用、保障粮食安全、减轻能源压力、减少环境污染和提高土壤肥力、保障农业、环境可持续发展的有效措施[8-9],因此,对大豆-根瘤菌共生体系建立机制及固氮机制的研究具有十分重要的现实意义。【前人研究进展】前人研究发现,大豆-根瘤菌共生体系形成过程中涉及复杂的信号转导和物质交换,根瘤菌Ⅲ型效应因子是由Ⅲ型分泌系统向宿主细胞中分泌的一系列蛋白质,在根瘤菌侵染和根瘤形成过程中能够发挥重要调控作用[10]。根瘤菌Ⅲ型分泌系统(type Ⅲsecretion system,T3SS)是一种类注射器的复杂结构,是由多种蛋白组成[11],其中NopA和NopB是Ⅲ型效应分泌系统中针头的组成部分,NopX是分泌系统的基本构成[12-15],RhcN和RhcJ也是Ⅲ型分泌系统结构的组成部分之一,是最基本的结构蛋白,它们的缺失会直接造成整个Ⅲ型分泌系统结构的破坏,影响Ⅲ型效应因子的正常分泌[16-18]。近年来,对Ⅲ型效应因子研究进展表明,NopC是根瘤菌特异的效应蛋白,NopC位于NopA的上游,由于NopA是T3SS菌毛的结构组成成分,所以NopC也应该是T3SS的组成成分[19]。NopC突变后并不影响其他效应因子的分泌,腺苷酸环化酶测定显示NopC能促进宿主植物结瘤[19]。对于NopP的研究,在根瘤菌HH103中,的表达依赖于黄酮类化合物和转录调节因子TtsI,并影响大豆根和芽中致病相关基因的表达[20]。在根瘤菌NGR234中,Ⅲ型效应因子突变后能改变其在非洲山毛豆和扁豆上的结瘤数量[21]。所以根瘤菌Ⅲ型效应因子作用机制及大豆响应Ⅲ型效应因子机理的研究对阐明大豆-根瘤菌共生体系形成机制具有重要作用。【本研究切入点】RhcN是Ⅲ型分泌系统结构的组成部分,能够为根瘤菌Ⅲ型效应因子的分泌提供能量,保证Ⅲ型效应因子的正常分泌[16-18]。不同大豆品种具有不同的遗传背景,造成其与根瘤菌的共生固氮具有一定的差异,但根瘤菌Ⅲ型效应因子在该种差异中能发挥的作用并未得到深入研究。【拟解决的关键问题】本研究通过对中华根瘤菌HH103的T3SS结构基因进行基因突变,得到突变体HH103ΩrhcN,并用PCR和Southern blot鉴定。通过表达分析,确定能够影响Ⅲ型效应因子的分泌。对HH103ΩrhcN突变体以及野生型菌株HH103进行100份核心种质结瘤试验,通过对两者结瘤结果的比对,进一步明确Ⅲ型效应因子结构基因突变后对共生结瘤的影响。
1 材料与方法
1.1 材料
费氏中华根瘤菌HH103(源于西班牙塞维利亚大学Francisco Javier López-Baena实验室),利福平(Rif)抗性;大肠杆菌DH5α。
Williams82和大豆核心种质100份(源于东北农业大学陈庆山实验室保存)。
质粒提取试剂盒(TaKaRa公司,DC201-01),缺氮植物营养液(1 L包含MgSO40.5 mol·L-1、Na2MoO40.2 mmol·L-1、MnSO42 mmol·L-1、H3BO34 mmol·L-1、CaCl22 mol·L-1、CoSO40.2 mmol·L-1、K2SO40.5 mol·L-1、CuSO44 mmol·L-1、KH2PO41 mol·L-1、ZnSO41 mmol·L-1和C6H5FeO720 mmol·L-1)。
1.2 突变体的构建
1.2.1 重组自杀载体pJQ200SK-rhcN-Km的构建 从NCBI生物信息数据库中,获取HH103基因组中的序列,提取全基因组序列,进行PCR扩增,片段的引物命名为rhcN-F和rhcN-R。将扩增片段连接pGWC载体,连接体系转化大肠杆菌DH5α。测序获得pGWC-rhcN。选取的酶切位点Ⅰ(5'-ACTAGT-3'),突变位置的上下游各15 bp碱基序列作为上游引物,该引物反向互补序列作为对应的下游引物,以pGWC-rhcN为模板进行PCR扩增,用Ⅰ消化后转化大肠杆菌DH5α,测序获得突变结果pGWC-rhcN-DpnⅠ。抗性片段PCR扩增以pEASY-Blunt为模板,在扩增引物两端加上Ⅰ酶切位点序列,引物命名为Km-KpnⅠ-F、Km-KpnⅠ-R。将抗性片段插入,连接体系转化大肠杆菌DH5α,测序后得到pGWC-rhcN-Km。选取酶切位点Ⅰ和Ⅰ,用引物SacI-rhcN-XbaⅠ-F(R)扩增pGWC-rhcN-Km,将扩增片段和重组自杀载体分别进行双酶切,将酶切后的片段和重组自杀载体进行连接,经转化DH5α后测序,命名为pJQ200SK-rhcN-Km。
1.2.2 三亲杂交 将根瘤菌HH103划线于含Rif的TY固体培养基。将带有Helper质粒的大肠杆菌划线于含Km的LB固体培养基,将带有pJQ200SK-rhcN- Km的大肠杆菌划线于含有Km、Gent的LB固体培养基。过夜培养直至长出单克隆;将3种菌挑单克隆分别于5 mL相应培养基中培养至OD600值为0.6;取3种菌,每个各取1 mL,分别放于1.5 mL离心管中,离心12 000 r/min离心30 s,弃上清,用1 mL无抗TY重悬;取重悬后的HH103菌液200 μL,其余2种菌各100 μL加入到1.5 mL离心管中,离心12 000 r/min离心30 s,弃上清,用20 μL无抗TY重悬;将20 μL的混合菌液滴到无抗TY固体培养基平板上过夜培养;过夜培养后,刮取大斑划线到含Rif/Km的TY固体培养基培养,直至长出单克隆;将单克隆继续划线到含Rif/Km的TY固体培养基进行筛选,重复3次;将经过3次筛选的单克隆划线于含有5%蔗糖的Rif/Km的TY固体培养基进行筛选,重复3次;筛选到的突变体命名为HH103ΩrhcN。
1.3 突变体的验证
1.3.1 突变体的PCR鉴定 利用引物rhcN-F(R)以及rhcN-F和-R 2对引物分别扩增野生型根瘤菌HH103及突变菌株HH103ΩrhcN,通过电泳的方法,观察到目的条带,测序验证突变体HH103ΩrhcN。
1.3.2 突变体的Southern blot鉴定 提取野生型HH103和突变体HH103ΩrhcN的基因组;标记探针,设计探针引物,扩增突变体基因组,胶回收片段,沸水浴10 min,迅速插入冰中。DIG-High Prime(vial1)与变性的DNA混匀,37℃过夜,65℃水浴终止反应,-20℃保存;消化好的样品琼脂糖凝胶进行电泳;碱变性处理、转膜、预杂交、杂交、洗膜、显影[22],将杂交膜DNA面朝上放在显影夹上,加1 mL CSPD,室温静止避光温浴5 min。37℃避光10 min,获取Southern blot结果验证照片。
1.4 Western blot验证Ⅲ效应因子NopC及NopT的分泌
对野生型根瘤菌HH103和突变体HH103ΩrhcN在含有相应抗生素培养基中进行培养,每种菌培养2组,待OD600=0.8时,一组加入染料木苷,而另一组作为空白对照,28℃,200 r/min培养40 h;4℃,菌液8 000 r/min离心20 min,收集上清液。在上清液中,加入3倍体积的10%三氯乙酸,-20℃静置20 h;将溶液10 000 r/min离心30 min,用事先预冷的80%丙酮对沉淀进行清洗,重复2次,最后将沉淀用适量8 mol·L-1尿素进行稀释;最后利用NopC和NopT的兔源抗体进行Western blot检测[23]。
1.5 突变体结瘤能力鉴定及大豆核心种质根瘤表型分析
取Williams82的种子30粒,用氯气灭菌法对大豆种子表面进行灭菌,灭菌时长为12 h。在无菌操作台内吹去种子表面氯气,将种子种入高温灭菌的双层钵中,并在温室中进行培养,培养条件为光16 h/暗/8 h,温度为25℃[24]。待大豆生长到Vc[25]期时,用注射器在大豆根部土层下直接接种2 mL OD600值为0.2的费氏中华根瘤菌HH103菌液和突变体HH103ΩrhcN菌液,保证每个植株接种细菌的个数在109左右,接种30 d后对结瘤数目及根瘤干重等性状进行调查,并利用SPSS软件对不同处理数据进行-test检验,进行显著性分析。
取试验所需100份种质资源的种子各10粒,接种30 d后对结瘤数目及根瘤干重等性状进行调查,并利用SPSS软件对不同处理数据进行-test检验,进行显著性分析。
2 结果
2.1 突变体HH103ΩrhcN的PCR鉴定
三亲杂交得到的突变体HH103ΩrhcN及野生型菌株HH103,利用引物rhcN-F(R)以及rhcN-F和Km-R扩增HH103ΩrhcN,进行PCR鉴定(图1)。野生型HH103利用引物rhcN-F和rhcN-R扩增的条带大小应为长度,为1 300 bp,突变型菌株HH103ΩrhcN扩增的条带大小应为和长度,为2 300 bp。野生型HH103利用引物rhcN-F和Km-SpeI-R扩增,由于其不含插入的片段结果应无条带,突变型菌株HH103ΩrhcN扩增的条带大小应为上臂和的长度,为1 500 bp(图1)。由结果筛选出正确突变体HH103ΩrhcN,扩增结果与理论相符。
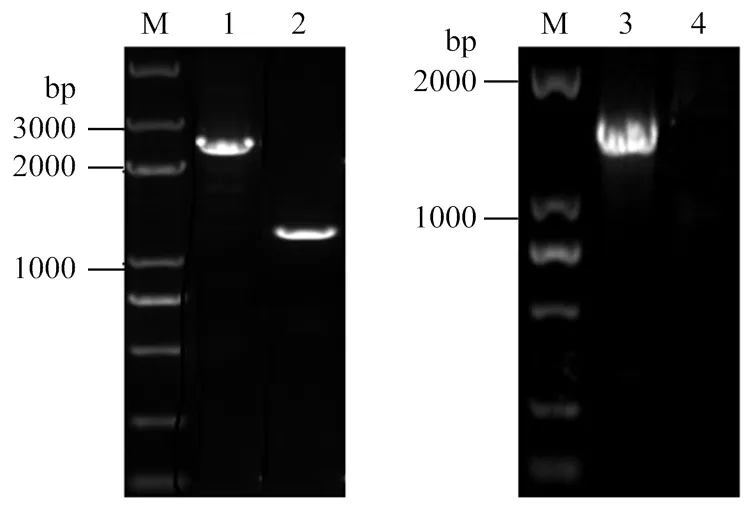
M: Trans 2K Plus DNA marker; 1: HH103ΩrhcN(rhcN-F,rhcN-R); 2: HH103(rhcN-F,rhcN-R); 3: HH103ΩrhcN(rhcN-F,Km-SpeⅠ-R); 4: HH103(rhcN-F,Km-SpeⅠ-R)
2.2 突变体HH103ΩrhcN的Southern blot鉴定
进一步验证突变体HH103ΩrhcN的真实性,采用地高辛标记和检测试剂盒进行突变体Southern blot鉴定。对野生型根瘤菌HH103和HH103ΩrhcN的基因组用2种内切酶酶切。选用内切酶时避免选用目的基因和内部的内切酶,以免将突变片段切碎影响验证结果。从杂交结果可以看出每种酶切后突变体的杂交片段比野生型的杂交片段约长1 000 bp(图2),即插入卡那霉素片段的大小,进一步证明突变体HH103ΩrhcN筛选成功。
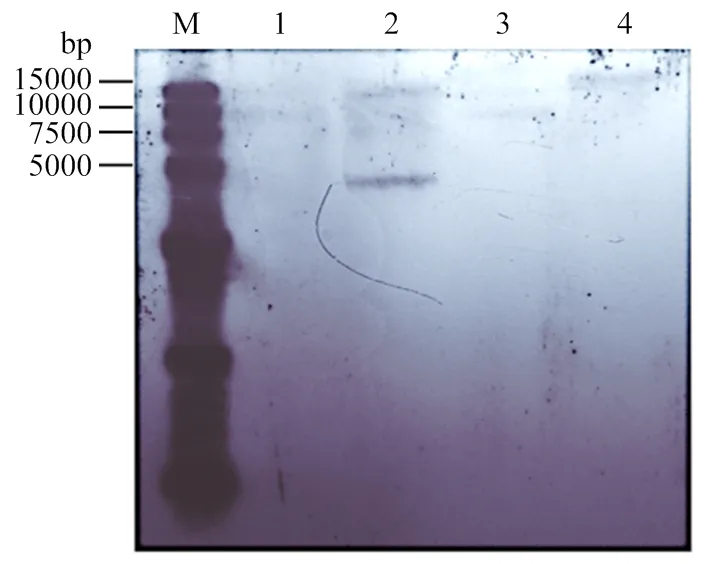
1:HH103ΩrhcN突变体基因组HindⅢ酶切结果;2:HH103基因HindⅢ酶切结果;3:HH103ΩrhcN突变体基因组SacⅠ酶切结果;4:HH103基因组SacⅠ酶切结果
2.3 rhcN突变抑制Ⅲ型效应因子的分泌
通过对野生型根瘤菌HH103和突变体中Ⅲ型效应因子NopC和NopT的分泌进行Western blot验证。结果表明,突变后能够抑制Ⅲ型效应因子NopC和NopT的分泌(图3)。
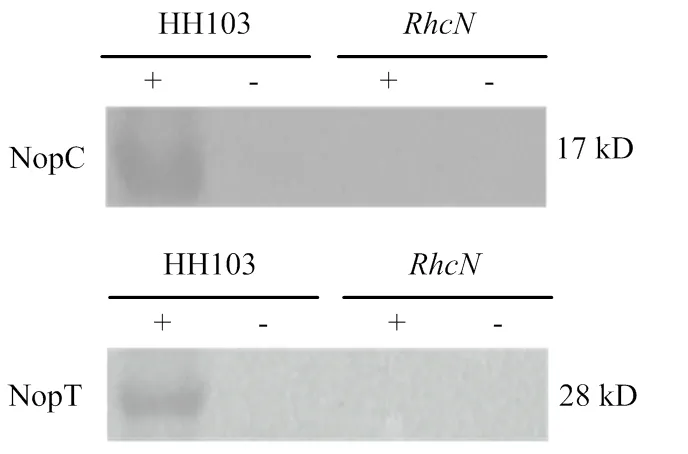
+:存在Genistein的诱导;-:不存在Genistein的诱导
2.4 rhcN突变能够抑制根瘤的形成
利用Williams82对野生型根瘤菌HH103和根瘤菌HH103ΩrhcN突变体进行结瘤鉴定,大豆植株Vc期时进行根瘤菌接种,接种30 d后对根瘤表型进行统计和分析(图4和图5)。与接种野生型HH103相比,突变能够引起根瘤数目的显著较少,也能够引起根瘤干重的显著降低。大豆根系中一定数目的根瘤对于大豆的氮源供给是非常必要的,突变能够引起根瘤菌Ⅲ型效应因子的分泌受到抑制,造成根瘤菌侵染和根瘤发育受到影响,说明根瘤菌Ⅲ型效应因子对于大豆-根瘤菌共生体系的正常建立是必要的。
2.5 HH103ΩrhcN突变体结瘤表型鉴定
利用来自不同积温带的全国大豆种质核心资源的100份品种对野生型根瘤菌HH103、突变型根瘤菌HH103ΩrhcN进行结瘤鉴定,重复10次,对接种后30 d的植株对结瘤数目及根瘤干重等性状进行调查,对表型数据的最大值、最小值、标准差及变异系数结瘤情况进行分析(表1和电子附表1),结果表明,突变能够引起80份大豆资源根瘤数目减少,13份根瘤数目显著升高,7份不发生显著性变化。说明在大豆-根瘤菌共生体系形成过程中发挥着重要作用,并且不同的大豆遗传背景具有不同应对反应。
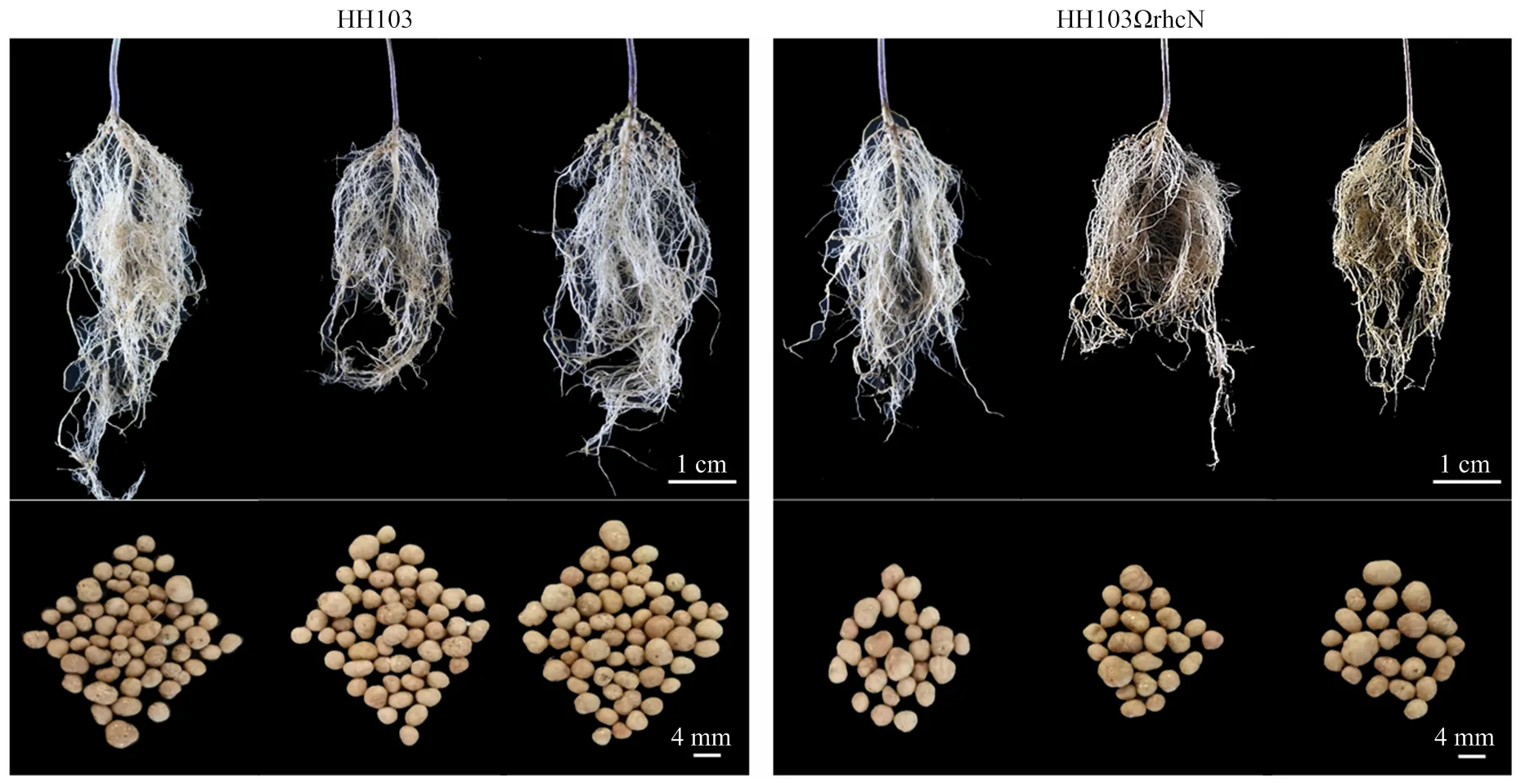
左图为接种HH103时大豆根系和根瘤形态,右图为接种HH103ΩrhcN时大豆根系和根瘤形态
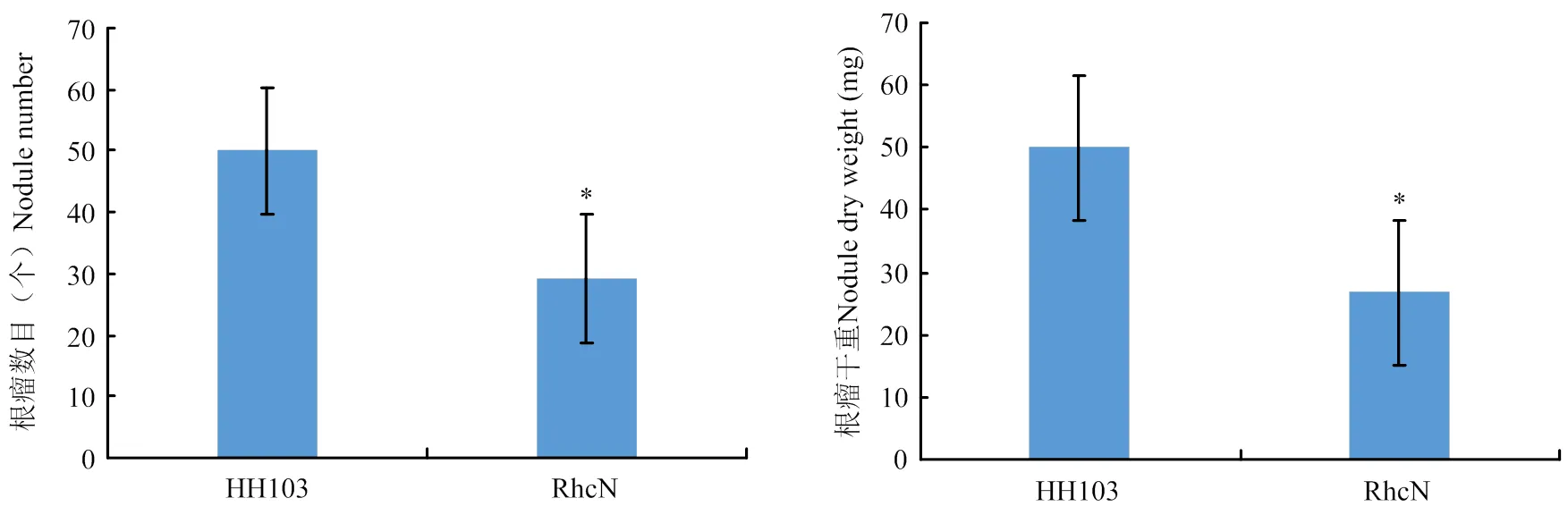
*表示在p<0.05水平差异显著 *for the difference was significant at P<0.05 level
*表示在<0.05水平差异显著;**表示在<0.01水平差异极显著
*: The difference was significant at the<0.05 level; **: the difference was extremely significant at the<0.01 level
3 讨论
根瘤菌能够编码RhcN蛋白,是一种ATP转移酶,是根瘤菌Ⅲ型分泌系统重要的结构蛋白,在效应因子的分泌过程中,能够为效应因子提供必不可少的能量,保障效应因子由根瘤菌分泌到宿主细胞中[18]。在其他根瘤菌菌种中,关于RhcN突变的研究较多,根瘤菌NGR234 RhcN突变能够显著抑制豇豆根瘤的产生[21],根瘤菌DOA9 RhcN突变能够引起美洲合萌根瘤的显著减少[26],与本研究根瘤菌HH103 RhcN突变之后对大豆根瘤表型产生影响相似,表明根瘤菌Ⅲ型效应因子在大豆-根瘤菌共生体系建立过程中发挥重要作用。在根瘤菌HH103中,现已报道的Ⅲ型效应因子有10种,分别为NopA、NopB、NopAA(GunA)、NopC、NopD、NopL、NopM、NopP、NopT和NopZ[27],但是HH103不同的效应因子发挥着不同的调控作用。NopAA(GunA)属于一种糖基水解酶,已被证实能够分解细胞壁调控根瘤菌的侵染,其突变情况下抑制根瘤的产生[28]。NopC被证实能够分泌到大豆宿主细胞中,并且在根瘤发育阶段也能发挥调控作用,在根瘤菌侵染过程中,NopC能够诱导大豆病程相关基因的表达,并且NopC突变情况下同样抑制根瘤的形成[19]。根瘤菌HH103Ⅲ型效应因子的作用机制并未得到解析,对根瘤菌Ⅲ型效应因子在共生结瘤中的研究,特别是大豆响应根瘤菌Ⅲ型效应因子基因的功能解析能够为研究共生结瘤机制提供重要的理论支持。利用根瘤菌Ⅲ型效应因子及大豆响应Ⅲ型效应因子信号网络对根瘤菌和大豆的相关改造,能够为大豆-根瘤菌共生体系高效结瘤和固氮的研究提供一种新的思路和可能。
本研究收集了来自不同地区的100份大豆种质资源,其分别来自东北、黄淮海和华南三大大豆种植区,品种之间具有明显的基因型和生态型差异。利用野生型根瘤菌HH103和根瘤菌HH103ΩrhcN突变体对该100份大豆种质资源进行根瘤表型鉴定,结果表明,突变能够引起其中80份大豆资源根瘤数目降低,13份根瘤数目显著升高,7份不发生显著性变化,此表型鉴定结果说明RhcN突变情况下能够引起大部分的大豆种质根瘤表型显著降低。而100份种质材料中,13份根瘤数目显著升高,7份不发生显著性变化,表明20份大豆品种的基因型造成了该表型的差异。根瘤菌Ⅲ型效应因子已经被证实能够影响根瘤菌与大豆宿主之间的亲和性,并且利用大豆与根瘤菌相互作用的基因型特异性及共生亲和性能够进行根瘤菌Ⅲ型效应因子相关信号通路研究及实际生产应用[29]。自1966年开始,利用不同大豆材料的基因型差异,越来越多与共生结瘤相关的大豆基因被定位和应用。例如()、()、()、()、()、()、()和()[30]。其中,()和()是被研究较多的建立共生密切相关的基因[31-32]。与根瘤菌Ⅲ型效应因子NopP具有互作关系,并且能够调控宿主大豆对根瘤菌的特异性识别[33]。能够调控大豆对根瘤菌的亲和敏感性,可响应根瘤菌Ⅲ型效应因子影响大豆-根瘤菌共生体系的建立[34]。作者所在实验室在前期的研究中发现,HH103和NopL突变体能够在栽培品种东农594和Charleston引起明显的根瘤表型差异,通过构建以东农594和Charleston为父母本的RIL群体,对大豆响应进行QTL定位和挖掘,鉴定出了大豆能够响应的基因和[35],说明利用大豆基因型差异对Ⅲ型效应因子的研究是可行的。利用本研究筛选的大豆种质材料进行大豆遗传群体的构建可以对大豆共生相关基因,尤其是响应Ⅲ型效应因子的大豆基因进行挖掘,通过进一步的功能解析为探究Ⅲ型效应因子作用机制提供重要支撑,同时利用基因型差异的大豆种质材料可以进行遗传改良,进一步培育高结瘤和高固氮大豆新品种。
4 结论
在共生结瘤过程中,不同基因型大豆在响应根瘤菌Ⅲ型效应因子过程中具有不同的表现。根瘤菌Ⅲ型效应因子在根瘤菌侵染、根瘤发育、固氮过程及根瘤衰老等过程中发挥重要调控作用。
[1] 沈琼, 刘小和. 我国油料、植物油的进口特征及品种间的替代性分析. 中国农村经济, 2006(5): 25-31.
SHEN Q, LIU X H. Analysis on the import characteristics of my country's oilseeds and vegetable oils and the substitution among varieties. China's Rural Economy, 2006(5): 25-31. (in Chinese)
[2] 魏培梅. 国际大豆供求背景下中国大豆出口贸易现状及对策. 对外经贸实务, 2019(9): 45-49.
WEI P M. China's soybean export trade status and countermeasures under the background of international soybean supply and demand. Foreign Economic and Trade Practices, 2019(9): 45-49. (in Chinese)
[3] 马利平. 生物有机肥替代化肥减施对大豆土壤微生物多样性的影响[D]. 哈尔滨: 黑龙江大学, 2019.
MA L P. Effects of reduced application of bio-organic fertilizer instead of chemical fertilizer on soybean soil microbial diversity[D]. Harbin: Heilongjiang University, 2019. (in Chinese)
[4] Foley J A, Ramankutty N, Brauman K A, Cassidy E S, Gerber J S, Johnston M, MUELLER N D, CONNELL C O, RAY D K, WEST P C, BALZER C, BENNETT E M, CARPENTER S R, HILL J, MONFREDA C, POLASKY S, Rockström J, SHEEHAN J, SIEBERT S, TILMAN D, ZAKS D P. Solutions for a cultivated planet. Nature, 2011, 478(7369): 337-342.
[5] Rockstrom J, Steffen W, Noone K, PERSSON A, CHAPIN F S, LAMBIN E F, LENTON T M, SCHEFFER M, FOLKE C, SCHELLNHUBER H J, NYKVIST B, DE WIT C A, HUGHES T, DER LEEUW S V, RODHE H, SORLIN S, SNYDER P K, COSTANZA R, SVEDIN U, FALKENMARK M, KARLBERG L, CORELL R W, FABRY V J, HANSEN J, WALKER B, LIVERMAN D, RICHARDSON K, CRUTZEN P, FOLEY J A. A safe operating space for humanity. Nature, 2009, 461(7263): 472-475.
[6] Contador Carolina A, Lo Siu-Kit, Chan Siu H J, Lam H M. Metabolic analyses of nitrogen fixation in the soybean microsymbiontusing constraint-based modeling. Msystems, 2020, 5(1): e00516-e00519.
[7] Willems A, Collins M D. Phylogenetic analysis ofandbased ongene sequences. International Journal of Systematic Bacteriology, 1993, 43(2): 305-313.
[8] Peoples M B, Herridge D F, Ladha J K. Biological nitrogen fixation: An efficient source of nitrogen for sustainable agricultural production. Plant and Soil, 1995, 174(1/2): 3-28.
[9] Kiers E T, Hutton M G, Denison R F. Human selection and the relaxation of legume defenses against ineffective rhizobia. Proceedings of the Royal Society B, 2007, 274(1629): 3119-3126.
[10] Hu Y, Huang H, Cheng X, SHU X, WHITE A P, STAVRINIDES J, KOSTER W, ZHU G, ZHAO Z, WANG Y. A global survey of bacterial type III secretion systems and their effectors. Environmental Microbiology, 2017, 19(10): 3879-3895.
[11] Habenstein B, EI MAMMERI N, TOLCHARD J, LAMON G, TAWANI A, BERBON M, LOQUET A. Structures of type III secretion system needle filaments. Current topics in microbiology and immunology, 2020(427): 109-131.
[12] Martin K, Allan D J. Identification of protein secretion systems and novel secreted proteins in.. Bmc Genomics, 2008, 9(1): 55.
[13] Kim W S, Krishnan H B. A nopA deletion mutant ofUSDA257, a soybean symbiont, is impaired in nodulation. Current microbiology, 2014, 68(2): 239-246.
[14] Lorio J C, Kim W S, Krishnan H B. NopB, a soybean cultivar-specificity protein fromUSDA257, is a type III secreted protein. Molecular plant-microbe interactions, 2004, 17(11): 1259-1268.
[15] Marie C, Deakin W J, Viprey V, KOPCINSKA J, GOLINOWSKI W, KRISHNAN H B, PERRET X, BROUGHTON W J. Characterization of Nops, nodulation outer proteins, secreted via the type III secretion system of NGR234. Molecular Plant-Microbe Interactions, 2003, 16(9): 743-751.
[16] Tampakaki A P. Commonalities and differences of T3SSs in rhizobia and plant pathogenic bacteria. Frontier in Plant Science, 2014, 5: 114.
[17] Krishnan H B, Lorio J, Kim W S, JIANG G, KIM K Y, DEBOER M, PUEPPKE S G. Extracellular proteins involved in soybean cultivar-specific nodulation are associated with pilus-like surface appendages and exported by a type III protein secretion system inUSDA257. Molecular plant-microbe interactions, 2003, 16(7): 617-625.
[18] Viprey V, Del Greco A, Golinowski W, BROUGHTON W J, PERRET X. Symbiotic implications of type III protein secretion machinery in Rhizobium. Molecular microbiology, 1998, 28(6): 1381-1389.
[19] Jiménez-Guerrero I, Pérez-Montao F, Carlos M, Javier O F, López-Baena F J, Peter M. NopC is a rhizobium- specific type 3 secretion system effector secreted by()HH103. PLoS ONE, 2015, 10(11): e0142866.
[20] Lopezbaena F J, Monreal J A, Perezmontano F, GUASCHVIDAL B, BELLOGIN R A, VINARDELL J M, OLLERO F J. The absence of Nops secretion inHH103 increasesexpression in williams soybean. Molecular Plant-microbe Interactions, 2009, 22(11): 1445-1454.
[21] Skorpil P, Saad M M, Boukli N M, KOBAYASHI H, ARES ORPEL F, BROUGHTON W J, DEAKIN W J. NopP, a phosphory-lated effector of. strain NGR234, is a major determinant of nodulation of the tropical legumesand. Molecular Microbiology, 2005; 57: 1304-1317.
[22] 朱华晨, 许新萍, 李宝健. 一种简捷的Southern印迹杂交方法. 中山大学学报(自然科学版), 2004(4): 128-130.
ZHU H C, XU X P, LI B J. A simple southern blot hybridization method. Journal of Sun Yat-sen University (Natural Science Edition), 2004(4): 128-130. (in Chinese)
[23] 龙火生, 杨公社, 庞卫军. 一种改进的Western杂交方法. 畜牧兽医杂志, 2003(3): 11-13.
LONG H S, YANG G S, PANG W J. An improved western hybridization method. Journal of Animal Husbandry and Veterinary Medicine, 2003(3): 11-13. (in Chinese)
[24] 李志辉, 傅豪, 靳巧玲, 段红光, 戴晋, 吴鹤敏. 大豆日光温室加代应用研究初报. 河北农业科学, 2017, 21(2): 88-91.
LI Z H, FU H, JIN Q L, DUAN H G, DAI J, WU H M. Preliminary report on the application of soybean solar greenhouse. Hebei Agricultural Sciences, 2017, 21(2): 88-91. (in Chinese)
[25] 于妍, 刘芳, 唐敬仙. 大豆生育期类型划分研究进展. 北京农业, 2015(8): 27.
YU Y, LIU F, TANG J X. Research progress on classification of soybean growth period. Beijing Agriculture, 2015(8): 27. (in Chinese)
[26] Kimbrel J A, Thomas W J, Jiang Y, CREASON A L, THIREAULT C A, SACHS J L, CHANG J H. Mutualistic co-evolution of type iii effector genes inand. PLoS Pathogens, 2013, 9(2): e1003204.
[27] López-Baena F, Ruiz-Sainz J, Rodríguez-Carvajal M, Vinardell J. Bacterial molecular signals in the-soybean symbiosis. International Journal of Molecular Sciences, 2016, 17(5): 755.
[28] JIMÉNEZ-GUERRERO i, perez-montano, zdyb a, beutler m, werner g, gottfert m, javier ollero f, maria yinardell j, lopez-baena f j. GunA of()HH103 is a T3SS-secreted cellulase that differentially affects symbiosis with cowpea and soybean. Plant and Soil, 2019, 435(1/2): 15-26.
[29] Triplett E W, Sadowsky M J. Genetics of competition for nodulation of legumes. Annual Review of Microbiology, 1992, 46: 399-428.
[30] Hwang S, Ray J D, Cregan P B, ANDY KING C, DAVIES M K, PURCELL L C. Genetics and mapping of quantitative traits for nodule number, weight, and size in soybean (L. [Merr.]). Euphytica, 2014, 195(3): 419-434.
[31] YANG S, TANG F, GAO M, KRISHNAN H B, ZHU H.gene-controlled host specificity in the legume–rhizobia symbiosis. Proceedings of the National Academy of Sciences of the USA, 2010, 107(43): 18735-18740.
[32] Tang F, Yang S, Liu J, Zhu H., a gene controlling nodulation specificity in soybeans, encodes a thaumatin-like protein but not the one previously reported. Plant physiology, 2016, 170(1): 26-32.
[33] Sugawara M, Takahashi S, Umehara Y, LWANO H, TSURUMARU H, ODAKE H, SUZUKI Y, KONDO H, KONNO Y, YAMAKAWA T, SATO S, MITSUI H, MINAMISAWA K. Variation in bradyrhizobial NopP effector determines symbiotic incompatibility with-soybeans via effector-triggered immunity. Nature communications, 2018, 9(1): 3139.
[34] Faruque O M, Miwa H, Yasuda M, FUJII Y, KANEKO T, SATO S, OKAZAKI S. Identification ofgenes involved in incompatibility with soybean plants carrying theallele. Applied and environmental microbiology, 2015, 81(19): 6710-6717.
[35] Zhang Y, Liu X, Chen L, FU Y, LI C, QI Z, ZOU J, ZHU R, LI S, WEI W, WANG J, CHANG H, SHI Y, WANG J, LI Q, ZHU J, LI J, JIANG H, WU X, JIA C, YIN Z, HU Z, LIU C, CHEN Q, XIN D. Mining for genes encoding proteins associated with NopL ofHH103 using quantitative trait loci in soybean (Merr.) recombinant inbred lines. Plant and Soil, 2018, 431(1/2): 245-255.
Effect ofgene mutation on nodulation ability of soybean rhizobium HH103
LIU HanXi1, Lü Hao1, GUO GuangYu2, LIU DongXu1, SHI Yan1, SUN ZhiJun1, ZHANG ZeXin1, ZHANG YanJiao1, WEN YingNan1, WANG JieQi1, LIU ChunYan1, CHEN QingShan1, XIN DaWei1, WANG JinHui1
1College of Agriculture, Northeast Agricultural University, Harbin 150030;2Harbinacademy of agricultural science, Harbin 150028
【】Soybean is an important economic crop, which is the main source of food and feed. Symbiosis is a special character of soybean to fix nitrogen in air and transferred into ammonia via rhizobia. Via symbiosis soybean can acquire enough nitrogen source for development. Rhizobial type Ⅲ effectors play pivotal roles in regulating the establishment of symbiosis. Thegene codes an ATP transferase, which can regulate the secretion of type Ⅲ effector of rhizobium into host cells.【】To elucidate the symbiotic mechanism will help to improve the nitrogen fixation efficiency of soybean-rhizobium symbiosis system and is useful for friendly agricultural development. 【】In this study,mutant was constructed by tri-parental mating method and inserted a kanamycin gene in the downstream ofstart codon. The mutant was confirmed by PCR and Southern blot. To detect whether the expression of other type Ⅲ effectors was affected bymutant. The expression of NopC and NopT were identified by induced by genistein via Western blot method. Nodulation experiment were performed in Leonard jars, to detect the nodule phenotype of Williams82 after inoculation with the wild strain HH103 and derived HH103ΩrhcN mutant. Finally, one-hundred soybean germplasms with different genotypes were used for nodulation experiment. 【】The results of PCR and Southern blot confirmed that HH103ΩrhcN mutant was successful, and the extracellular protein identification supported thatmutant can inhibit the secretion of type Ⅲ effectors NopC and NopT. The nodulation test of Williams82 showed thatmutation can significantly inhibit the nodule number and dry weight.Using HH103ΩrhcN mutant and wild type HH103, 100 core germplasm accessions were identified,these results showed thatmutation could reduce the root nodule phenotype of 80 soybean accessions, significantly increase the root nodule phenotype of 13 soybean accessions, and 7 soybean resources did not change significantly. 【】The results showed that the abnormal secretion of type Ⅲ effector factors of rhizobium could affect the establishment of symbiotic system.played an important role in the formation of soybean rhizobium symbiosis system, and different soybean genetic background had different responses.
soybean; rhizobium; type Ⅲ effector;; symbiosis

10.3864/j.issn.0578-1752.2021.06.003
2020-09-03;
2020-10-26
黑龙江省自然科学基金杰出青年项目(JC2017006)
刘函西,E-mail:396525797@qq.com。通信作者陈庆山,E-mail:qshchen@126.com。通信作者辛大伟,E-mail:dwxin@neau.edu.com。通信作者王锦辉,E-mail:jinhuiwang113@126.com
(责任编辑 李莉)

