高效靶向降解烟草花叶病毒核酸的dsRNA筛选与大量制备
徐翔,解屹,宋丽云,申莉莉,李莹,王勇,刘明宏,刘东阳,王小彦,赵存孝,王凤龙,杨金广
高效靶向降解烟草花叶病毒核酸的dsRNA筛选与大量制备
徐翔1,解屹1,宋丽云1,申莉莉1,李莹1,王勇2,刘明宏3,刘东阳2,王小彦3,赵存孝4,王凤龙1,杨金广1
1中国农业科学院烟草研究所,山东青岛 266101;2四川省烟草公司凉山州公司,四川西昌 615000;3贵州省烟草公司遵义市公司,贵州遵义 563000;4甘肃省烟草公司庆阳市公司,甘肃庆阳 745099
【】筛选高效靶向降解烟草花叶病毒(tobacco mosaic virus,TMV)的dsRNA,实现其大量制备,并探究其作用机制。以TMV编码的CP、MP、RdRP功能基因为靶序列,体外转录合成相应的dsRNA,浸润本氏烟(),24 h后接种TMV,于接毒后2、3 d取样提取总RNA和蛋白质,以CP基因mRNA水平和蛋白水平为指标,结合TMV病毒生物学症状,综合评价各dsRNA对TMV的抑制效果。同时结合侵染性克隆TMV-30B在本氏烟烟株上的荧光表达现象和TMV在三生烟(var. Samsun NN)上的过敏性坏死反应(hypersensitive necrosis reaction),通过比较TMV基因组上6个靶序列相对应的dsRNA,筛选出高效抑制TMV的dsRNA片段。为了获取大量的dsRNA,将dsRNA对应的基因片段插入到原核表达载体L4440的双T7启动子之间,转化至RNase III缺陷型大肠杆菌()HT115(DE3)中,并对原核表达制备的dsRNA喷施烟草后生成的siRNA进行深度测序,比较外源施用dsRNA后,对TMV侵染的small RNA表达特征和富集带的影响。筛选出高效影响TMV CP基因表达的dsRNA RdRP1461-1774,并构建了可诱导形成目的dsRNA的原核表达载体L4440-dsRdRP1461-1774,可在DE3中大量制备RdRP1461-1774的dsRNA,菌液中提取的dsRNA喷施于烟草上对TMV的防治效果显著。TMV-30B侵染本氏烟时荧光数量减少,并能够延长叶片萎蔫时间,在三生烟上施用时叶片枯斑数量明显减少。小RNA测序结果显示TMV侵染引起的RNAi过程中正义链和反义链以大致相等的频率产生siRNA,而外源性dsRNA的浸润会引起靶向区域siRNA的富集,siRNA反义链累积量骤增,对应的正义链累积量骤减,外源dsRNA的施用能够引起siRNA表达丰度的变化。通过比较dsRNA介导植物靶向抗TMV侵染的效果来筛选抗烟草花叶病毒的dsRNA序列,最终选定TMV RdRP基因上一段长313 bp的高效作用片段,该片段dsRNA能够高效与靶基因结合,降低染病植株烟草花叶病毒的表达量。同时构建了RdRP1461-1774基因的dsRNA原核表达系统,实现其低成本的高效量产,为后续dsRNA在植物病毒方面的防治应用打下了基础。
烟草花叶病毒;RNA干扰;dsRNA;small RNA测序;原核表达
0 引言
【研究意义】烟草花叶病毒(tobacco mosaic virus,TMV)属正单链RNA病毒,具有广泛的寄主范围,可侵染茄科、十字花科、葫芦科和菊科等多种主要的经济作物,给农业生产造成巨大损失[1]。在烟草上,由TMV侵染引起的烟草病毒病可造成烟叶产量损失达30%—50%,个别地块甚至绝产,危害十分严重。除种植抗病品种外,生产上尚无有效的防治措施进行控制。通过筛选靶向抗TMV的双链RNA (double- stranded RNA,dsRNA)并实现其大量制备,可为后续研究dsRNA诱导RNA干扰(RNA interference,RNAi)防治植物病毒病提供物质基础,同时应用小RNA测序比较短链siRNA(small interference RNA,siRNA)富集区的变化特征,可为利用该策略筛选特异性片段防治植物病毒病的研究提供理论依据。【前人研究进展】RNAi属于转录后基因沉默(post- transcriptional gene silencing,PTGS),是由dsRNA诱导产生的基因沉默现象,dsRNA被RNase Ⅲ家族的Dicer蛋白切割成siRNA,不同来源的dsRNA被Dicer酶切割后,通过与不同的AGO蛋白结合而行使功能[2]。siRNA解链后与AGO蛋白结合形成RISC复合体(RNA-induced silencing complex,RISC),降解序列互补的目标mRNA,在RNA水平上调控基因的表达[3]。siRNA是sRNA(small RNA,sRNA)的主要组成部分,sRNA广泛存在于植物中,并且种类多样,多是利用不同的RNA双链为前体切割而成的一类siRNA[4]。RNA沉默过程中还存在级联放大效应,即以siRNA中的一条链为引物,以mRNA为模板,在RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)的作用下合成新的次级siRNA,进而引发后续的循环扩大反应[5]。自然界中植物本身能够表达病毒的部分基因组来免疫病毒或类病毒,鉴于此,用转基因的方式实现了内源基因的沉默。Hameed等将3种马铃薯病毒——马铃薯X病毒(potato virus X,PVX)、马铃薯Y病毒(potato virus Y,PVY)、马铃薯S病毒(potato virus S,PVS)基因序列设计成600 bp反向重复序列载体,将其转入到马铃薯细胞中,该载体可以表达出具有发夹结构的双链RNA,获得对这3种病毒均有抗性的马铃薯转基因株系[6]。但是转基因体系可能存在严重的脱靶效应[7],因此难以获得具有强抗性的转基因品系。与转基因的方法相比,利用原核系统表达dsRNA来干扰病毒的侵染,减轻病毒病的危害,这一方法避开了转基因工作量大、周期长、费时费力的弊端,并且可以针对多种病毒,同时混合多种病原的dsRNA,与转基因植物相比优势明显,更加利于推广。常见的植物病毒病多是由RNA病毒引起的,因此植物体内的RNAi机制本身就是一道天然抗病屏障,如何将该原理用于生产从而实现对病毒病的防治是近些年的研究热点[8]。2003年,Tenllado等[9]利用体外喷施dsRNA的方法防治植物病毒病,开启了RNAi农药的研究热潮。该研究采用大肠杆菌()特异性菌株初步建立了dsRNA的细菌大量生产体系和粗提方法,针对辣椒轻斑驳病毒(pepper mild mottle virus,PMMoV)的PMMoV IR 54基因,在烟草叶面上直接施用菌液粗提液,发现可诱导烟草对PMMoV的抗性;Aalto等[10]利用噬菌体ϕ6、T7 RNA聚合酶和RNA依赖性RNA聚合酶来大规模生产用于RNAi的dsRNA;解昆仑等[11]利用超声波振碎的方法提取dsRNA,发现HC-Pro基因片段dsRNA对小西葫芦黄花叶病毒病的防治效果可达95%,显著降低植株的发病率、延迟植株发病时间。【本研究切入点】在烟田生产中利用dsRNA溶液预防TMV的侵染已有研究,将菌液超声波破碎后作为药液施用,具有良好的防治效果[12]。对于利用小RNA测序技术探究dsRNA抑制TMV致病机理的研究鲜见报道。【拟解决的关键问题】筛选高效抑制TMV侵染的dsRNA片段,构建原核表达载体实现该dsRNA的量化生产,同时利用小RNA深度测序技术探索small RNA表达特点。
1 材料与方法
试验于2019—2020年在中国农业科学院烟草研究所完成。
1.1 样品准备
供试植物、菌株及质粒:烟草花叶病毒普通株系(TMV-C)、TMV-30B侵染性克隆、本氏烟()、三生烟(var. Samsun NN)由中国农业科学院烟草研究所植物保护研究中心保存。烟株均在人工气候室中培养,条件为光周期L﹕D=16 h﹕8 h,25℃,光合有效辐射100 μmol·m-2·s-1,相对湿度约80%。供试大肠杆菌DH5购自北京全式金生物技术有限公司。大肠杆菌HT115、L4440质粒由福建农林大学植物病毒研究所馈赠。
试剂:PCR产物胶回收试剂盒、质粒小提试剂盒、RNA提取试剂盒购自北京全式金生物技术有限公司;pCE2 TA/Blunt-Zero vector购自诺唯赞公司;Transcription T7 Kit、S1 Nuclease、RNA反转录试剂盒和一步法荧光定量PCR试剂盒购自TaKaRa公司;蛋白提取试剂盒、SuperSignal West Pico Trial Kit购自Solarbio公司;异丙基--D-硫代半乳糖苷(isopropyl--D-thio-galactopyranoside,IPTG)、LB培养基、氨苄青霉素、四环素、Tris、NaCl、EDTA、苯酚、氯仿、异戊醇、SDS、-巯基乙醇购自北京国药集团化学试剂有限公司;试验引物于派森诺生物科技有限公司合成。
1.2 dsRNA的体外转录制备
根据TMV各基因功能选定CP、MP、P126、RdRP851-1238、RdRP1461-1774、RdRP1573-2330 6段序列(图1)并设计引物(表1),通过在线BLSAT程序(http://www.ncbi.nlm.nih.gov/blast/)进行验证,以避免引物序列与烟草基因组其他序列同源,利用表1所示引物对TMV基因组进行PCR扩增,得到含有T7启动子的TMV CP、MP、P126、RdRP851-1238、RdRP1461-1774、RdRP1573-2330基因片段扩增产物;扩增产物参照TaKaRa的Transcription T7 Kit试剂盒说明书进行体外转录制备dsRNA。

表1 本研究所用引物
带下划线的碱基字母表示相应的酶切位点The underlined base letters indicate the corresponding restriction sites
1.3 不同dsRNA对TMV的抑制检测
TMV抑制试验:以PBS处理为阴性对照,待烟株长至适当大小,选取大小一致的同位叶,分别浸润体外转录合成的dsRNA,每株300 µg,浸润24 h后,通过摩擦接种TMV。每个处理进行3次生物学重复,25℃、16 h·d-1光照培养。接种后2、3 d取样,于液氮中迅速冷冻,提取病毒接种叶片总RNA和总蛋白,于-80℃条件下保存备用。
qRT-PCR检测:Trizol法提取叶片总RNA后,检测RNA浓度和纯度达到预定标准,合成cDNA。以为内参,以浸润PBS样品的CT值为标准1,用相对CT法公式2-∆∆CT,ABI 7500上进行qRT-PCR反应,计算不同处理叶片的相对RNA积累量。
Western blot检测:提取处理叶总蛋白,保持上样蛋白浓度一致,进行SDS-聚丙烯酰胺凝胶电泳和转膜。取出PVDF膜封闭1 h,按1﹕2 000稀释TMV-CP一抗,4℃孵育过夜,按1﹕5 000稀释HRP标记的二抗,摇床上孵育2 h。TBST洗膜后涂抹发光液ECL(SuperSignal West Pico Trial Kit),于化学发光成像分析仪中成像拍照。
TMV-30B抑制试验:为进一步筛选TMV病毒防治中的高效dsRNA,待烟株长至适当大小,先浸润不同dsRNA及PBS,24 h后接种TMV-30B。25℃、16 h·d-1光照培养。TMV-30B接种3、5 d后,于紫外灯下观察荧光并拍照。
三生烟枯斑试验:为进一步验证TMV病毒防治中的高效dsRNA,待三生烟株长至适当大小,先浸润dsRNA及PBS,12 h后接种TMV病毒。TMV接毒后3 d观察枯斑数量并拍照。
small RNA深度测序分析:本氏烟叶片分别浸润RdRP1461-1774 dsRNA或PBS,24 h后接种TMV,接毒后72 h取浸润叶于液氮中速冻,送美吉生物公司进行small RNA测序,质控合格后获得的small RNA序列与TMV RdRP全长核酸序列进行bowtie比对。利用比对结果,统计在TMV RdRP全长核酸序列上每单位长度的small RNA表达丰度count计数值并绘图。
1.4 dsRNA的原核表达及大量制备
表达载体构建:根据RdRP1461-1774基因片段cDNA序列及L4440载体的酶切位点,Premier 5.0设计扩增引物L4440-dsRdRP1461-1774F和L4440- dsRdRP1461-1774R及测序引物(表1),利用高保真酶扩增 RdRP1461-1774基因片段,凝胶电泳鉴定片段长度,产物胶回收;回收产物与pCE2 TA/Blunt-Zero vector连接并转化DH5感受态,阳性克隆送至派森诺生物科技有限公司测序;测序正确的克隆,抽提质粒与L4440质粒分别用II、Ⅰ内切酶进行双酶切,产物经凝胶电泳回收大小约为381和2 624 bp目的条带。回收的DNA片段用T4酶连接,连接产物转化至DH5感受态,阳性克隆做菌液PCR,并抽提质粒做双酶切鉴定,鉴定正确的菌液送派森诺生物科技有限公司测序。测序正确的重组质粒转化至HT115感受态细胞中,阳性克隆做菌液PCR,并抽提质粒做双酶切鉴定,鉴定正确的菌液制成甘油菌保存于-80℃备用。
重组载体诱导表达及提取纯化:取保存的菌液接入10 mL LB培养基(Amp+Tet)中培养至OD600=0.4,加入20 μL的IPTG(终浓度为0.4 mmol·L-1)诱导5 h后离心去部分上清液,超声破碎裂解细胞。以转化空载体L4440的HT115菌液为对照,按照上述同样的方法进行培养。破碎后菌液加入500 μL 2×STE溶液(pH 8.0)、500 μL苯酚/氯仿/异戊醇(25﹕24﹕1)、15 μL-巯基乙醇、50 μL 10% SDS,涡旋3 min,8 000 r/min离心10 min,取上清用无水乙醇调至终浓度为17%,注入CF-11纤维素柱中。用含17%乙醇的1×STE溶液洗柱后,继续用不含乙醇的1×STE溶液洗柱,于核酸紫外检测仪下检测并收集核酸洗脱液。洗脱液加入等体积的预冷异丙醇,-20℃沉淀30 min。12 000 r/min离心15 min,沉淀用75%乙醇洗涤,溶于30 μL无菌水,取少量电泳检测,其余样品于-20℃保存。
柱提dsRNA的酶解与鉴定:提取菌液核酸后,用RNase-Free DNase处理,去除残存的DNA,然后加S1 Nuclease检验是否得到dsRNA,按照上述PCR方法对柱提dsRNA特异性进行检测。
三生烟枯斑试验:按照上述接毒试验操作,将柱提的核酸喷施在三生烟上,接TMV 3 d后观察叶片上出现的枯斑数量。
2 结果
2.1 TMV dsRNA的体外转录制备
选取TMV(基因序列号:NC_001367.1)的全基因组序列为参考序列,围绕TMV编码的3个基因,设计了6对引物,通过体外转录分别制备6段dsRNA,即CP、MP、P126、RdRP851-1238、RdRP1461- 1774、RdRP1573-2330(图2),片段大小分别为480、333、641、388、313和746 bp,与预期目的基因大小相符。

1: CP dsRNA; 2: MP dsRNA; 3: P126 dsRNA; 4: RdRP851-1238 dsRNA; 5: RdRP1461-1774 dsRNA; 6: RdRP1573-2330 dsRNA
2.2 不同dsRNA对TMV致病力的影响
为确定不同dsRNA对TMV的抑制效果,以TMV CP基因表达量为统一衡量标准,qRT-PCR检测结果表明,与空白对照(浸润缓冲液)相比,不同dsRNA浸润处理后,TMV侵染第3天的叶片中病毒CP基因表达量显著低于空白对照中TMV CP基因表达量,但不同dsRNA对病毒CP基因表达量的影响有明显差异,其中RdRP1461-1774 dsRNA、MP dsRNA和RdRP1573-2330 dsRNA对TMV CP基因的抑制作用更显著(图 3)。以上结果表明,本研究设计的TMV基因组不同区域dsRNA均可提升烟株抗TMV侵染的能力,暗示在TMV侵染早期,植株叶片中浸润dsRNA能够抑制和延缓靶向病毒的侵染。

利用邓肯氏多重极差测验法进行方差分析(SPSS 软件),柱上不同小写字母表示差异显著(α=0.05)Analysis of variance (SPSS software) was conducted using Duncan’s multiple range test, different lowercase letters on the bars indicate significant difference (α=0.05)
为进一步验证TMV基因组不同区域dsRNA对TMV CP蛋白表达量的影响,通过Western blot技术对TMV CP蛋白表达量进行了定量检测分析,结果表明(图4),TMV CP dsRNA、MP dsRNA、P126 dsRNA、RdRP851-1238 dsRNA、RdRP1461-1774 dsRNA、RdRP1573-2330 dsRNA处理后,TMV CP蛋白表达量显著低于正常对照组的表达量,这与CP基因在RNA水平的表达趋势基本一致。
为进一步验证TMV基因组不同区域dsRNA确实抑制TMV在烟草内的侵染复制,利用TMV-30B为抑制靶标,将CP基因水平和蛋白水平表达差异显著性最强的两个dsRNA,RdRP1461-1774 dsRNA和MP dsRNA分别浸润烟草后,接种TMV-30B,与空白对照(浸润缓冲液)相比,RdRP1461-1774 dsRNA和MP dsRNA两个处理组样本的绿色荧光区域明显少于对照组(图5),第5天对照组叶片开始萎蔫皱缩,而处理组未出现萎蔫现象,说明RdRP1461-1774 dsRNA和MP dsRNA能够延缓叶片萎蔫的时间,且RdRP1461-1774 dsRNA处理组叶片荧光区域更小。

1:Marker,2—8:分别为PBS、TMV CP dsRNA、MP dsRNA、P126 dsRNA、RdRP851-1238 dsRNA、RdRP1461-1774 dsRNA、RdRP1573-2330 dsRNA浸润后接毒的TMV CP蛋白表达量The expression of TMV CP protein after infiltration of PBS, TMV CP dsRNA, MP dsRNA, P126 dsRNA, RdRP851-1238 dsRNA, RdRP1461-1774 dsRNA, RdRP1573-2330 dsRNA
为进一步解释RdRP1461-1774 dsRNA可介导植物降解TMV基因组核酸,对初始侵染病毒RNA具有降解作用,利用TMV免疫枯斑寄主三生烟为研究材料,浸润RdRP1461-1774 dsRNA后,接种TMV病毒3 d后,结果显示浸润RdRP1461-1774 dsRNA的植株其枯斑数量明显低于空白对照组,且边缘并未出现萎蔫现象(图6),暗示RdRP1461-1774 dsRNA可介导植物降解TMV侵染初始RNA。
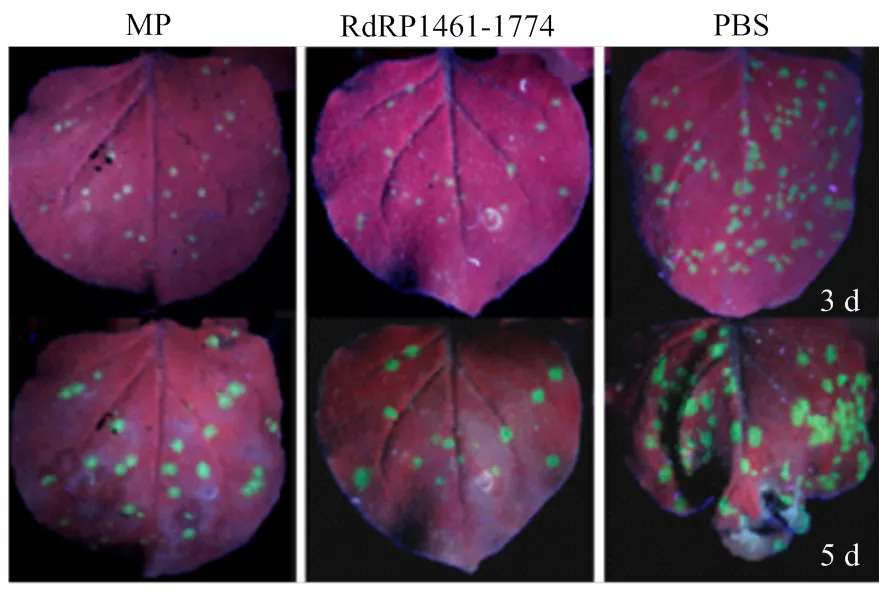
图5 本氏烟不同dsRNA处理后接种TMV-30B症状

图6 三生烟叶片浸润dsRNA后接种TMV 3 d的症状
2.3 dsRNA的原核表达及大量制备
重组构建了L4440-dsRdRP1461-1774原核表达质粒,经Ⅱ和Ⅰ双酶切后,可分别检测到约381、2 624 bp目的条带(图7中1泳道),片段大小与预期相符,结合序列测定,显示RdRP1461- 1774 dsRNA原核表达重组表达质粒构建成功。RdRP1461-1774 dsRNA原核表达重组表达质粒转化到DE3感受态细胞中,通过IPTG诱导,结果显示,与L4440空载体对照相比,由含重组L4440- dsRdRP1461-1774表达载体的菌液所提取的核酸经RNase-Free DNase和S1 Nuclease消化处理(图7中2—6泳道),目的条带(约400 bp处)明显,证明L4440-dsRdRP1461-1774菌液经诱导后成功表达出dsRNA,大小约为381 bp,PCR结果显示有特异性目的条带(图7中7泳道),以上结果证明RdRP1461-1774 dsRNA可通过原核表达体系实现大量制备和工业化生产。柱提的核酸喷施在三生烟叶上接种TMV 3 d后,处理组仅出现零星的斑点,而对照组叶片出现大范围密集斑点,处理组叶片枯斑数量少于对照组叶片(图8)。

Marker:2000 bp DNA marker;1:L4440-dsRdRP1461-1774重组载体的双酶切验证Identification of L4440-dsRdRP1461-1774 recombinant vector by double restriction endonuclease digestion;2:L4440-dsRdRP1461-1774菌液提取的核酸Nucleic acid extracted from L4440-dsRdRP1461-1774 bacterial solution;3:RNase-Free DNase处理过的L4440-dsRdRP1461-1774菌液核酸RNase-Free DNase treated L4440-dsRdRP1461-1774 bacterial solution nucleic acid;4:S1 Nuclease处理过的L4440-dsRdRP1461-1774菌液核酸S1 Nuclease treated L4440-dsRdRP1461-1774 bacterial solution nucleic acid;5:RNase-Free DNase、S1 Nuclease处理过的L4440- dsRdRP1461-1774菌液核酸RNase-Free DNase, S1 Nuclease treated L4440-dsRdRP1461-1774 bacterial solution nucleic acid;6:RNase-Free DNase、S1 Nuclease处理过的L4440菌液核酸样品RNase-Free DNase, S1 Nuclease-treated L4440 bacterial solution nucleic acid sample;7:菌液PCR检测 Fragments amplified by PCR from bacterial culture

图8 TMV接种3 d后的枯斑三生烟
2.4 RdRP1461-1774 dsRNA喷施烟草后生成的siRNA分析
近年来的小RNA组的高通量深度测序结果表明,植物细胞中80%以上的小RNA为siRNA[13],因此,为解释RdRP1461-1774 dsRNA通过物理浸润可在叶面内实现RNAi,以浸润PBS后TMV侵染烟叶为对照,通过small RNA深度测序,对RdRP1461- 1774 dsRNA浸润后接毒叶片进行了分析,正值和负值分别代表从正义链和反义链中提取的small RNA的覆盖数。结果显示,PBS浸润接毒后产生的小RNA峰度值为6 000(图9-A),而外源RdRP1461-1774 dsRNA浸润接毒后峰度值高达90 000(图9-B)。对照组的siRNA是由TMV感染引入的dsRNA前体加工而来,测序结果中正义链和反义链以大致相等的频率产生siRNA(图9-A),而RdRP1461-1774 dsRNA浸润处理组中,靶向核苷酸区域的small RNA峰度值显著高于对照组峰度值。以上数据证明Dicer酶成功酶解dsRNA,产生了大量siRNA,呈现高峰值表达。另外由图9-B可知,外源dsRNA浸润接毒后siRNA的反义链累积量骤增,对应的正义链累积量骤减。
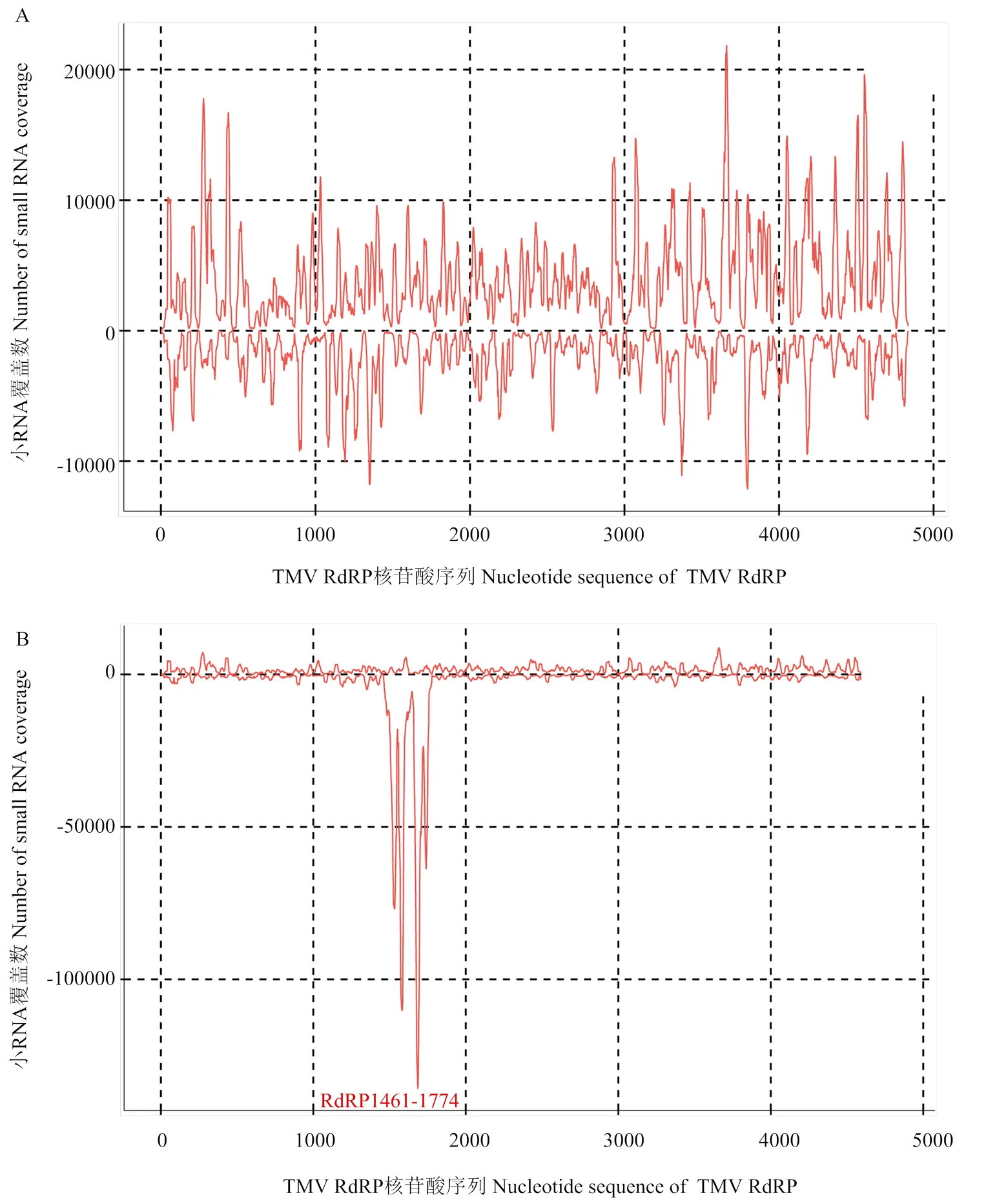
图9 small RNA测序与个性化分析图
3 讨论
RNAi技术在病毒防治方面早有研究[12,14],但在将这些应用产业化之前,对于高效作用片段的筛选研究较少,靶片段的选取仍然是RNAi的重点,在很大程度上影响RNAi的效果。本研究所使用的病毒靶标基因筛选的方法,可以作为同类型RNAi防治病毒病的方法参考,通过比较基因功能获得一批候选的dsRNA后,用生物学方法评估其抗病毒能力,在此基础上筛选高效降解TMV靶向核酸的dsRNA,最终筛选出TMV基因组中RdRP基因上一段长313 bp的高效作用片段。病毒核酸复制酶的核心功能是合成全长的病毒基因组RNA,是特异性依赖于病毒RNA的RNA聚合酶(RdRP)[15],有研究表明与植物病原病毒外壳蛋白相比,转病毒的复制酶基因能够赋予感病寄主植物相对较高的抗病毒能力[16],推测干扰RdRP段基因能够更好地抑制病毒的侵染[17],该片段dsRNA能够高效与靶基因结合,降低染病植株TMV的表达量,实现对植株的靶向RNAi保护。
利用RNAi技术防治植物病毒病,防治效果首先取决于高效dsRNA片段的筛选,另外如何将dsRNA高效递送至植物体内也是近年来的研究热点[18-19]。植物体内dsRNA酶解为小RNA诱导内源靶基因的沉默,引起植物抗病毒的RNAi过程[20]。双链RNA被Dicer识别降解,不会被翻译成蛋白质,避免了外源蛋白质在植株体内的积累,具有较高的生物安全性[21]。酶解成的siRNA一条链与AGO蛋白形成诱导沉默复合物,复合体通过碱基互补配对识别靶基因,介导降解、翻译抑制或组蛋白甲基化等,导致特异性的基因沉默,即使互补区不完全配对,也会导致翻译抑制[22]。而小RNA不仅可以从外源基因的表达中获得,植物本身也会产生内源RNA[23]。随着测序技术的进步,已经发现越来越多的内源性小RNA。这类小RNA前体一般有两种来源,一种是互补DNA的区段分别被转录下来形成的正义、反义双链,或者从染色体上不同位置转录来的互补双链[24],总之合成dsRNA的双链均是从基因组上复制下来,天然存在并互补,这种转录途径一般在高盐或者细菌病原体入侵时被诱导产生,当病毒成功侵染植物细胞后,病毒的核酸需要利用植物的蛋白质合成系统完成自我复制,病毒侵染的植物细胞内会产生病毒来源的小分子RNA(vsiRNA),vsiRNA对于宿主基因表达的调控程度可能取决于vsiRNA的丰度[25],本研究的测序结果也显示TMV侵染时正义链和反义链以大致相等的频率产生小RNA,小RNA参与了植物的免疫调节反应,作为效应分子在病毒进入植物体内后利用RNAi机制沉默病毒靶基因[26]。将RNAi技术应用于烟草抗TMV基因工程研究,必定会带动其他植物抗病毒的相关理论问题和应用实践研究。
利用T7启动子体外转录合成dsRNA是目前的主流合成技术,但该技术生产dsRNA具有成本高,操作繁琐等特点,严重限制了dsRNA的量化生产。考虑到体外转录制备的dsRNA量非常少,满足不了田间病毒防治的剂量需求,为此,针对RdRP1461-1774 dsRNA开展了原核表达体系构建,以期实现低成本制备[27-28],利用原核表达技术实现dsRNA的高效量产。利用原核系统表达dsRNA来干扰病毒的侵染,减轻病毒病的危害,通过叶面喷施dsRNA来防治病毒病是一种环境友好型思路[29],符合当下对绿色农业的推进政策。本研究仅限于浸润及喷施裸dsRNA的方法来防治病毒病,针对dsRNA可能存在的降解问题,后续可以考虑用纳米材料修饰以提高其稳定性[30],针对田间生长时常有多种病毒病混合发生的现象,也可以考虑混合多种病原dsRNA,防治多种病毒病,更加利于推广[31]。
4 结论
通过比较dsRNA介导植物靶向抗TMV侵染的效果,最终选定TMV基因中RdRP基因上一段长313 bp的高效作用片段RdRP1461-1774。同时构建了RdRP1461-1774基因片段的dsRNA原核表达系统,实现其低成本的高效量产,为后续研究dsRNA诱导RNAi防治植物病毒病提供了物质基础。通过小RNA深度测序技术,对外源性dsRNA干扰TMV侵染机理进行了探究,明确dsRNA通过物理浸润可在叶面内实现RNAi全过程,且物理浸润的外源性dsRNA会改变TMV侵染的small RNA表达特征和富集带。
[1] 杨德廉, 王凤龙, 钱玉梅, 陈德鑫, 张连峪, 刘春生, 孟凡刚, 苏世臣, 史文国, 李宗明. 我国烟草病毒病的防治研究策略. 中国烟草科学, 2001(1): 46-48.
YANG D L, WANG F L, QIAN Y M, CHEN D X, ZHANG L Y, LIU C S, MENG F G, SU S C, SHI W G, LI Z M. Research strategy of tobacco virus disease control in China. Chinese Tobacco Science, 2001(1): 46-48. (in Chinese)
[2] CHEN X. Small RNAs and their roles in plant development. Annual Review of Cell and Developmental Biology, 2009, 25: 21-44.
[3] GHILDIYAL M, ZAMORE P D. Small silencing RNAs: an expanding universe. Nature Reviews. Genetics, 2009, 10(2): 94-108.
[4] KIM V N, HAN J, SIOMI M C. Biogenesis of small RNAs in animals. Nature Reviews. Molecular Cell Biology, 2009, 10(2): 126-139.
[5] VAUCHERET H. Post-transcriptional small RNA pathways in plants: mechanisms and regulations. Genes and development, 2006, 20(7): 759-771.
[6] HAMEED A, TAHIR M N, ASAD S, BILAL R, VAN ECK J, JANDER G, MANSOOR S. RNAi-mediated simultaneous resistance against three RNA viruses in potato. Molecular Biotechnology, 2017, 59(2/3): 73-83.
[7] 栾颖, 梁晋刚, 周晓莉, 张正光. RNAi转基因作物安全评价研究进展. 生物安全学报, 2019, 28(2): 95-102.
LUAN Y, LIANG J G, ZHOU X L, ZHANG Z G. Discussion on safety evaluation of RNAi transgenic crops. Journal of Biosafety, 2019, 28(2): 95-102. (in Chinese)
[8] INCARBONE M, DUNOYER P. RNA silencing and its suppression: novel insights fromanalyses. Trends in Plant Science, 2013, 18(7): 382-392.
[9] TENLLADO F, MARTÍNEZ-GARCÍA B, VARGAS M, DÍAZ-RUÍZ J R. Crude extracts of bacterially expressed dsRNA can be used to protect plants against virus infections. BMC Biotechnology, 2003, 3: 3.
[10] AALTO A P, SARIN L P, VAN DIJK A A, SAARMA M, PORANEN M M, ARUMÄE U, BAMFORD D H. Large-scale production of dsRNA and siRNA pools for RNA interference utilizing bacteriophage phi6 RNA-dependent RNA polymerase. RNA, 2007, 13(3): 422-429.
[11] 解昆仑, 刘莉铭, 刘美, 彭斌, 吴会杰, 古勤生. 小西葫芦黄花叶病毒dsRNA的原核表达及其对ZYMV的防治效果. 中国农业科学, 2020, 53(8): 1583-1593.
XIE K L, LIU L M, LIU M, PENG B, WU H J, GU Q S. Prokaryotic expression of dsRNA of zucchini yellow mosaic virus and its control efficacy on ZYMV. Scientia Agricultura Sinica, 2020, 53(8): 1583-1593. (in Chinese)
[12] 徐滔明. 湖南地区烟草病毒病的发生情况及RNAi防治技术的研究[D]. 长沙: 湖南农业大学, 2014.
XU T M. Occurrence of tobacco virus disease in Hunan and prevention by novel RNAi technology[D]. Changsha: Hunan Agricultural University, 2014. (in Chinese)
[13] KASSCHAU K D, FAHLGREN N, CHAPMAN E J, SULLIVAN C M, CUMBIE J S, GIVAN S A, CARRINGTON J C. Genome-wide profiling and analysis ofsiRNAs. PLoS Biology, 2007, 5(3): e57.
[14] 解昆仑, 郭珍, 古勤生. “RNAi农药”防治植物病毒病的研究进展. 中国植保导刊, 2020, 40(1): 29-34, 54.
XIE K L, GUO Z, GU Q S. Research progress on the control of plant virus disease by RNAi pesticide.China Plant Protection, 2020, 40(1): 29-34, 54. (in Chinese)
[15] 律凤霞. RNA干涉技术在烟草抗TMV病毒育种中的应用[D]. 大庆: 黑龙江八一农垦大学, 2008.
Lü F X. The application of RNA interferential technology in tobacco breeding of resisting to TMV[D]. Daqing: Heilongjiang Bayi Agricultural University, 2008. (in Chinese)
[16] YAEGASHI H, TAMURA A, ISOGAI M, YOSHIKAWA N. Inhibition of long distance movement of RNA silencing signals inby apple chlorotic leaf spot virus 50 kDa movement protein. Virology, 2008, 382(2): 199-206.
[17] 宋晓丽. Malformin A1抗烟草花叶病毒机理研究[D]. 福州: 福建农林大学, 2019.
SONG X L. Anti-tobacco mosaic virus effect and action mechanism of malformin A1[D]. Fuzhou: Fujian Agriculture and Forestry University, 2019. (in Chinese)
[18] 王锐, 曲炳楠, 杨婧. 载siRNA的纳米制剂研究进展. 中国药房, 2017, 28(31): 4452-4455.
WANG R, QU B N, YANG J. Progress in research on siRNA nanoparticles. China Pharmacy, 2017, 28(31): 4452-4455. (in Chinese)
[19] DAS S, DEBNATH N, CUI Y J, UNRINE J, PALLI S R. Chitosan, carbon quantum dot, and silica nanoparticle mediated dsRNA delivery for gene silencing in: A comparative analysis. Applied Materials and Interfaces, 2015, 7(35): 19530-19535.
[20] 夏晓翠. 中华蜜蜂囊状幼虫病病毒在寄主体内的复制机制及其基于RNAi的防控策略[D]. 福州: 福建农林大学, 2014.
XIA X C. Replication mechanism of Chinese sacbrood virus in Eastern honeybee,and its control strategy based on RNA interference[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014. (in Chinese)
[21] 董丽, 郭惠珊. RNA沉默——植物基因组免疫的安全防线. 生物工程学报, 2012, 28(5): 521-530.
DONG L, GUO H S. RNA silencing, the fundamental security strategy of genomic immunity: A review. Chinese journal of biotechnology, 2012, 28(5): 521-530. (in Chinese)
[22] VAZQUEZ F, HOHN T. Biogenesis and biological activity of secondary siRNAs in plants. Scientifica, 2013, 2013: 783253.
[23] AXTELL M J. Classification and comparison of small RNAs from plants. Annual Review of Plant Biology, 2013, 64: 137-159.
[24] WEI W, BA Z, GAO M, WU Y, MA Y, AMIARD S, WHITE C I, DANIELSEN J M R, YANG Y G, QI Y. A role for small RNAs in DNA double-strand break repair. Cell, 2012, 149(1): 101-112.
[25] 朱慧, 郭惠珊. 植物中病毒来源的小RNA介导的RNA沉默. 中国科学: 生命科学, 2012, 42(1): 29-36.
ZHU H, GUO H S. virus-derived small interfering RNAs-mediated RNA silencing in plants. Scientia Sinica Vitae, 2012, 42(1): 29-36. (in Chinese)
[26] 张子杰, 肖文斐, 裘劼人, 忻雅, 刘庆坡, 柴伟国, 阮松林. 小RNA调节植物免疫应答反应研究进展. 植物生理学报, 2018, 54(4): 539-548.
ZHANG Z J, XIAO W F, QIU J R, XIN Y, LIU Q P, CHAI W G, RUAN S L. Advances in small RNA regulating of plant immune response. Plant physiology journal, 2018, 54(4): 539-548. (in Chinese)
[27] 张玉清. 小菜蛾免疫Bt动力学的DGE分析及其PGRP-LB基因的克隆[D]. 广州: 华南农业大学, 2016.
ZHANG Y Q. kinetics studies of DGE from(L.) immune responses againstand the cloning of PGRP-LB[D]. Guangzhou: South China Agricultural University, 2016. (in Chinese)
[28] 王嘉琪. 烟草花叶病毒RNAi制剂的研制[D]. 长沙: 湖南农业大学, 2018.
WANG J Q. Research on development of tobacco mosaic virus RNAi preparation[D]. Changsha: Hunan Agricultural University, 2018. (in Chinese)
[29] KONAKALLA N C, KALDIS A, BERBATI M, MASARAPU H, VOLOUDAKIS A E. Exogenous application of double-stranded RNA molecules from TMV p126 and CP genes confers resistance against TMV in tobacco. Planta, 2016, 244(4): 961-969.
[30] 王嘉琪, 刘勇, 李成刚, 张松柏, 孙书娥, 张德咏. 纳米材料及其相关产品在水稻上的应用. 杂交水稻, 2018, 33(3): 1-4, 15.
WANG J Q, LIU Y, LI C G, ZHANG S B, ZHANG S E, ZHANG D Y. Application of nanomaterials and related products on rice. hybrid rice, 2018, 33(3): 1-4, 15. (in Chinese)
[31] 郭依. 双链RNA介导的烟草抗病毒病(TMV, CMV, PVY)和靶斑病()的研究[D]. 沈阳: 沈阳农业大学, 2020.
GUO Y. DsRNA mediated tobacco resistance to virus disease (TMV, CMV, PVY) and target spot disease ()[D]. Shenyang: Shenyang Agricultural University, 2020. (in Chinese)
Screening and large-scale preparation of dsRNA for highly targeted degradation of tobacco mosaic virus (TMV) nucleic acids
XU Xiang1, XIE Yi1, SONG LiYun1, SHEN LiLi1, LI Ying1, WANG Yong2, LIU MingHong3, LIU DongYang2, WANG XiaoYan3, ZHAO CunXiao4, WANG FengLong1, YANG JinGuang1
1Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, Shandong;2Liangshan Company, SichuanTobacco Company, Xichang615000, Sichuan;3Zunyi City Company, Guizhou Tobacco Company, Zunyi 563000, Guizhou;4Qingyang Tobacco Company of Gansu Provincial Company, Qingyang 745099, Gansu
【】The objective of this study is to screen the dsRNAs with high efficiency and targeting degradation of tobacco mosaic virus(TMV), achieve its mass preparation, and to explore the mechanism.【】Using CP, MP and RdRp genes encoded by TMV as target sequences, dsRNAs were synthesizedand infiltrated into. After 24 h, TMV was inoculated, total RNA and protein were extracted from samples 2 and 3 d after TMV inoculation, and the mRNA level and protein level of CP gene were used as indicators, combined with the biological symptoms of TMV, to comprehensively evaluate the inhibitory effect of each dsRNA on TMV. The fluorescence expression of TMV-30B onand the hypersensitive necrosis reaction of TMV onvar. Samsun NN were also combined. The dsRNA fragments that efficiently inhibit TMV were screened by comparing the dsRNAs corresponding to the six target sequences on the TMV genome. In order to obtain a large number of dsRNAs, the corresponding gene fragments of dsRNAs were inserted between the double T7 promoters of the prokaryotic expression vector L4440 and transformed into RNase III deficientHT115 (DE3). And the siRNA generated after the prepared dsRNA spraying on tobacco was deeply sequenced to compare the effect of exogenous application of dsRNA on the small RNA expression characteristics and enrichment bands of TMV infestation.【】RdRP1461-1774 dsRNAs with high effect on TMV CP gene expression were screened, and l4440-dsRdRP1461-1774 prokaryotic expression vector was constructed, which could induce the formation of target dsRNAs. The dsRNA extracted from bacteria solution could significantly inhibit TMV, when TMV-30B was applied to infect tobacco, the number of fluorescence decreased, the time of leaf wilting prolonged, and the number of necrosis spots decreased significantly. The results of small RNA sequencing showed that in the RNAi process induced by TMV infection, the sense and antisense chains produced siRNA with approximately equal frequency, while the infiltration of exogenous dsRNA resulted in the enrichment of siRNA in the target area, and the accumulation of antisense chain of siRNA increased sharply, the cumulative value of the corresponding sense chain decreased sharply. The application of exogenous dsRNA could change the abundance of siRNA expression.【】The targeted anti-TMV dsRNA sequences were screened by comparing the effects of dsRNA on the targeted anti-TMV infection in plants. Finally, a 313 bp long effective segment of RdRP gene was selected. This fragment of dsRNA can efficiently bind to the target gene and reduce the expression of TMV in infected plants. At the same time, a dsRNA prokaryotic expression system of RdRP1461-1774 gene was constructed to achieve low-cost and high-efficiency production, which provided the basis for the follow-up application of dsRNAs in the control of plant virus.
tobacco mosaic virus(TMV); RNA interference (RNAi); dsRNA; small RNA sequencing; prokaryotic expression

10.3864/j.issn.0578-1752.2021.06.006
2020-06-10;
2020-07-11
烟草绿色防控重大专项(110201901041(LS-04))、四川省烟草公司科技项目(SCYC201804,SCYC202008)、甘肃省烟草公司科技项目(201862100020017,201862100020016)、贵州省烟草公司科技项目(201921)
徐翔,E-mail:17854233569@163.com。通信作者王凤龙,E-mail:wangfenglong@caas.cn。通信作者杨金广,E-mail:yangjinguang@caas.cn
(责任编辑 岳梅)

