vvi-miR172s及其靶基因响应赤霉素调控葡萄果实发育的作用分析
宣旭娴,盛子璐,解振强,黄雨晴,巩培杰,张川,郑婷,王晨,房经贵
vvi-miR172s及其靶基因响应赤霉素调控葡萄果实发育的作用分析
宣旭娴1,盛子璐1,解振强2,黄雨晴1,巩培杰1,张川1,郑婷1,王晨1*,房经贵1
1南京农业大学园艺学院,南京 210095;2江苏农林职业技术学院,江苏句容 212499
【】miR172是植物生长发育的重要调节因子,阐释vvi-miR172s及其靶基因应答赤霉素在葡萄果实不同组织发育过程中的作用,从miRNA角度认识GA调控葡萄果实发育的作用机制。以‘白罗莎里奥’葡萄为材料,以miR-RACE和PCR技术克隆vvi-miR172a/b/c/d的成熟体和前体序列,由psRNA Target软件预测vvi-miR172s的靶基因;利用RLM-RACE技术验证vvi-miR172s剪切靶基因的裂解作用及其作用位点;采用生物信息学软件对靶基因、靶蛋白进行系统进化、序列结构分析及亚细胞定位预测;通过在线软件PLANTCARE进行启动子作用元件分析;通过qRT-PCR和芯片数据分析vvi-miR172s和靶基因在不同器官、不同发育阶段的基因表达图谱,以及应答GA3在果实不同组织中的时空表达模式。克隆鉴定了vvi-miR172a/b/c/d的成熟体和前体序列,预测到和四个靶基因,验证到裂解产物及其裂解位点,证明它们为vvi-miR172s的真实靶基因。序列结构分析显示,均含有10个外显子和9个内含子,其motif元件的种类和数量相似,均含有两个排列顺序相近的AP2蛋白结构域,表明其结构和功能具有一定的保守性;且、和与杨树的亲缘关系较近,与大豆具有较高的同源性;靶基因蛋白二级结构均为-螺旋,可进一步折叠为稳定的三级结构;4个靶蛋白亚细胞定位主要位于细胞核内。启动子作用元件分析发现vvi-miR172c和中含有赤霉素响应元件,表明它们可能响应赤霉素调控葡萄生长发育;芯片数据分析显示vvi-miR172c和靶基因的表达模式具有组织或器官特异性,且它们之间呈现一定的负相关,表明它们之间存在负调控作用;RT-qPCR结果显示,随着葡萄果实的发育,果皮中vvi-miR172a/b/d呈下降的表达趋势,而靶基因的表达模式相反,表明vvi-miR172a/b/d对负调控;果肉中vvi-miR172d的表达水平降低,而靶基因的表达水平增加,表明vvi-miR172d与呈负相关性。另外,GA3处理改变了vvi-miR172s的靶模式,增强了果肉和果皮组织中vvi-miR172d与的负相关性,同时诱导了vvi-miR172c对的负调控作用。均为葡萄miR172a/b/c/d的真实靶基因,vvi-miR172家族可能通过vvi-miR172a/b/d和vvi-miR172d分别介导靶基因和调控果皮和果肉组织的发育过程,而vvi-miR172c和vvi-miR172d及其靶基因可能是GA调控葡萄果皮与果肉组织发育的主要作用因子。
葡萄;果实发育;赤霉素;miR172;靶基因
0 引言
【研究意义】葡萄(L.)是世界四大水果之一,在我国广泛栽培。生产上,通常利用GA3调控葡萄花果发育,提高果实品质从而增加其经济效益。miR172是一个重要的保守miRNA家族,其家族成员的功能具有多样性,在植物成花作用[1]、种胚发育[2]以及非生物胁迫的响应[3]等方面发挥重要作用。近期研究发现,miR172可能响应GA参与葡萄花果发育的调控[4],但其对葡萄果实不同组织的调控作用尚不清楚。从miR172角度研究GA调控葡萄果实发育的作用机制,为深入认识vvi-miR172s的功能及其应答GA的分子调控机制提供重要信息。【前人研究进展】miR172广泛存在于植物中,不同物种中具有多个,可以在不同的组织和不同的发育阶段形成保守的成熟miR172序列。模式植物拟南芥中5个加工后形成3个miR172成熟体[5];杨树有9个和4个miR172成员[6];水稻含4个和2个miR172[7];油菜含有4个miR172成员[1];玉米中仅包括一个miR172成员[8]。拟南芥中miR172的过表达会导致非正常花的发育,还会使植物提早开花[9];miR172对拟南芥果实(长角果)的生长具有促进作用;miR172的过表达会使苹果果实显著变小[10];麻疯树种JcmiR172a的过表达增强木质部的发育,减少韧皮部的发育[7];据报道,miR172调控小麦穗型和脱粒率研究中发现miR172的过表达会诱导穗的加长和降低脱粒率[10]。另有研究发现,OsmiR172b是调控水稻种子发育表型最显著的成员[2],对种子胚发育具有负调节作用。这些结果表明,miR172家族在不同植物中的功能具有多样性。成熟miR172可以通过序列互补靶向AP2基因家族的mRNA,并且可以通过抑制翻译或引发靶mRNA的降解来抑制靶基因的表达。目前,在拟南芥[5]、水稻[3]、油菜[1]等植物中均发现AP2家族转录因子是miR172的靶基因。miR172及其靶基因在开花时间和花器官分化中起关键作用。在拟南芥中,除外的所有miR172靶基因过量表达均延迟开花[11-13]。相反,花椰菜中双重突变体,四重突变体和六倍体突变体均导致提早开花,且开花时间随突变基因数量的增加而延长[14-15]。另有研究发现AP2类转录因子还参与番茄果实的转色[16]、成熟[17]及类胡萝卜素[18]积累过程,且拟南芥中、[19]可调控种子的发育。此外,AP2/ERF类转录因子还被视为植物激素信号连接的关键调节器,可参与赤霉素、生长素、细胞分裂素、茉莉酸、乙烯、脱落酸等多种激素信号转导途径[20]。【本研究切入点】赤霉素(GA)是调控葡萄果实发育如无核膨大等的关键生长调节剂,但其相关分子机制尚不甚清晰[21]。如上所述,miR172和AP2的研究主要集中在植物开花时间和花器官的发育方面。在拟南芥[22-23]和大豆[24]的研究中已证明AP2类转录因子与种子发育相关,但其参与果皮、果肉发育的研究甚少,更未见miR172通过应答GA靶向AP2类转录因子参与葡萄果皮、果肉等膨大发育关键组织调控的报道。【拟解决的关键问题】本试验以miRBase数据库为基础,鉴定葡萄中miR172c家族成员及其靶基因,系统分析miR172成员及其靶基因的染色体定位、进化关系、基因结构、保守基序和上游顺式作用元件;采用实时荧光定量PCR(qRT-PCR)技术,结合芯片数据,明确vvi-miR172成员及其靶基因应答GA3在葡萄果实不同组织中的表达特性,为深入研究其在果皮、果肉组织发育过程中的调控机制提供重要参考。
1 材料与方法
试验于2017年在江苏省句容农博园葡萄基地进行。
1.1 材料与处理
本试验以6年生优质‘白罗莎里奥’葡萄为试验材料,于盛花前10 d用50mg·L-1的GA3浸蘸花穗30s,以清水处理为对照。每组处理随机选定12株长势较为一致的植株,分别于幼果期(花后10 d,10 DAF)、硬核期(35 DAF)、第2次膨大期(60 DAF)、近成熟期(85 DAF)随机采集生长较为一致的葡萄果实,将果皮、果肉分离,用液氮速冻并保存于-80℃冰箱中。
1.2 葡萄miR172s成熟体序列及前体序列的克隆鉴定
在miRBase数据库(http://www.mirbase.org/)搜索并下载葡萄miR172s(vvi-miR172a/b/c/d)前体及成熟体序列。基于成熟体序列,参考Wang等[25]的方法,设计特异性引物,利用miR-RACE技术在‘白罗莎里奥’果实组织中克隆vvi-miR172a/b/c/d的成熟体序列,测序后鉴定其精确序列。在miRBase数据库下载水稻(Japonica)、玉米()、拟南芥()、大豆()、杨树()、烟草()、马铃薯()和番茄()miR172家族的成熟体序列,与葡萄miR172s(vvi-miR172a/b/c/d)进行序列比对。利用下载的vvi-miR172a/b/c/d前体序列,分别向上、向下扩展约200 bp,预测葡萄miR172a/b/c/d的前体基因序列,并设计特异性引物进行PCR扩增(表1)。反应体系为50 μL:上、下游引物各2 μL,cDNA 2 μL,10×PCR buffer(Mg2+plus)5 μL,dNTP Mixture 4 μL,Ex-Taq酶0.50 μL,ddH2O 34.5 μL。反应程序:95℃ 5 min;95℃ 30 s,59℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min。扩增产物用1.5%的琼脂糖凝胶电泳检测正确后回收目的片段,连接至pMD19T载体进行TA克隆,克隆后的纯化产物由上海生工生物工程股份有限公司进行测序。
1.3 葡萄miR172s靶基因预测及生物信息学分析
基于鉴定的vvi-miR172a/b/c/d成熟体序列,由在线软件psRNA Target(http://plantgrn.noble.org/psRNATarget/)进行靶基因预测,运行参数均为默认值。根据预测的结果,从葡萄基因数据库CRIBI(http://genomes.cribi.unipd.it/grape/index.php)获得靶基因的功能注释及基因序列。运用在线工具MG2C(http://mg2c.iask.in/mg2c_v2.0/)绘制染色体定位图;利用Gene Structure Display Server(GSDS)(http:// gsds.cbi.pku.edu.cn/index.php)进行基因序列结构分析,绘制基因结构示意图;利用DNAMAN 6.0和Clustal X 2.1软件进行多序列比对;使用MEGA37.0软件,选用邻接法(Neighbor-Joining)构建系统进化树;采用在线工具MEME(http://meme-suite.org/tools/ meme)鉴定蛋白保守基序,基序数量设置为15,其余参数为默认值;使用在线数据库CDD(http://www. ncbi.nlm.nih.gov/cdd)进行保守结构域分析,采用IBS软件作图[26];利用在线软件PRABI(http://www.prabi. fr/)进行蛋白质二级结构进行预测;根据在线软件SWISS-MODEL(https://swissmodel.expasy.org/interactive)进行蛋白质三级结构分析;运用在线软件BUSCA(http://busca.biocomp.unibo.it)进行亚细胞定位预测。
1.4 葡萄miR172s及其靶基因启动子作用元件分析
利用葡萄基因组数据库CRIBI(http://genomes.cribi.unipd.it/grape/index.php)和Grape Genome Browse(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)在线软件,确定vvi-miR172a/b/c/d前体基因上游1 500 bp及4个靶基因转录起始位点(ATG)上游1 500 bp序列,利用在线软件PLANTCARE (http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件分析。
1.5 芯片数据分析
从NCBI Genesis Expression Omnibus(GEO)下载GSE36128系列(https://www.ncbi.nlm.nih.govlgeo/ query/acc.cgi?acc=GSE36128)中葡萄不同组织、不同发育阶段的芯片表达谱[27]以及GSE59802系列(https:// www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE59802)中70个小RNA文库数据。两者表达数据都基于欧亚种葡萄品种‘Corvina’(clone 48)[28],将葡萄不同组织、不同发育阶段中每个基因的平均表达值进行归一化,按log2的值计算vvi-miR172s和靶基因的表达数据。
1.6 vvi-miR172家族成员及其靶基因的表达特性分析
采用CTAB法提取4个不同发育时期葡萄果皮、果肉中的RNA,利用Primer 3 Input(http://bioinfo.ut. ee/primer3-0.4.0/)设计引物(表1),以反转录后的cDNA为模板,以为内参基因,对vvi-miR172s前体基因及4个靶基因进行qRT-PCR检测。扩增体系及程序参考TaKaRa公司的SYBR® Premix Ex TaqTM Ⅱ试剂盒说明书,设置3次生物学重复。采用2-ΔΔCt计算各基因的相对表达量,采用SPSS软件对数据进行统计及差异显著性分析(<0.05)。

表1 引物序列及用途
下划线部分AAGCTT和GGATCC分别指dIII和H I酶切位点
The underlined sequences AAGCTT and GGATCC in the primers represent restriction enzyme sites ofdIII andH I, respectively
2 结果
2.1 赤霉素处理对‘白罗莎里奥’葡萄果实生长发育的影响
GA3处理后,果实横径无明显变化,果实纵径在花后10、35及60 d显著增长,且各时期没有明显的果核出现,仅在种子区域留下一条木质化的细线;而未经GA3处理的对照组种子正常发育,在花后35 d可观察到果核,说明GA3处理可以高效诱导‘白罗莎里奥’葡萄产生无核果实。另外,也观察到外源GA3处理诱导葡萄无核果实的同时,促进了无籽果实的膨大,使其发育成正常商品果大小,甚至更大(图1),表明GA3在果实发育过程中起着重要调控作用。
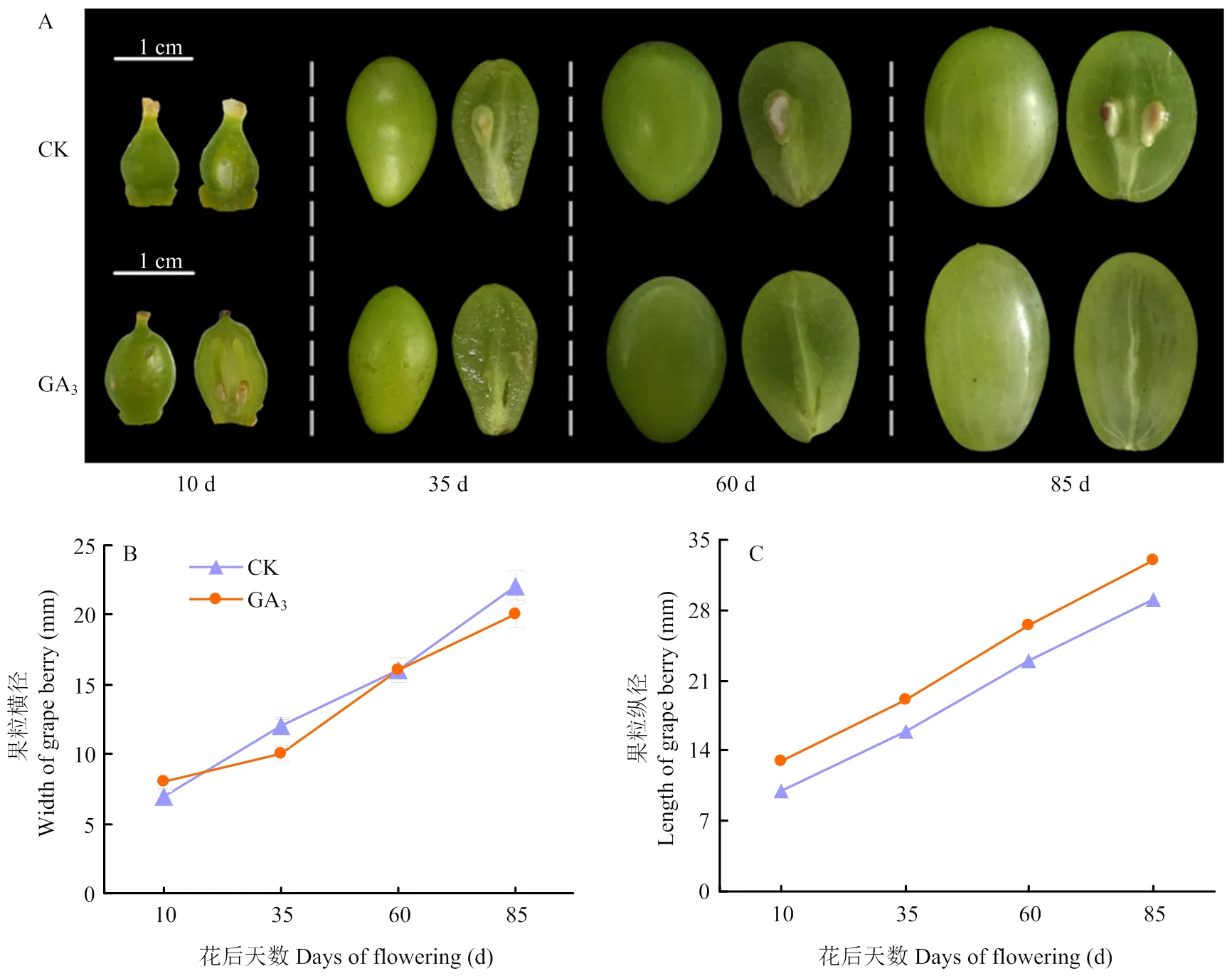
图1 GA3和CK处理下‘白罗莎里奥’葡萄果实生长发育情况
2.2 vvi-miR172家族成员成熟体及前体序列的克隆鉴定
为确定vvi-miR172家族成员在‘白罗莎里奥’葡萄中的真实序列,对其成熟体序列和前体序列进行克隆鉴定。通过miR-RACE获得vvi-miR172a/b/c/d的成熟体序列,克隆所得的序列与miRBase中的同源序列一致。克隆鉴定的vvi-miR172a/b/c/d前体基因分别为507、495、546和507 bp(图2-A)。染色体定位结果显示vvi-miR172家族成员分布在葡萄3条染色体上,vvi-miR172b和vvi-miR172c位于Chr13上,而vvi-miR172a和vvi-miR172d分别位于Chr6和Chr8上(图2-B)。4种miRNA前体结构显示出一定差异,但均可形成稳定的茎环结构,且成熟序列均位于茎环结构的3′臂上(图2-C),表明vvi-miR172a/b/c/d在前体基因上的位置高度保守。多序列比对结果显示,除vvi- miR172d含23个碱基外,vvi-miR172a、vvi-miR172b以及vvi-miR172c均为21个碱基,且vvi-miR172a和vvi-miR172b仅存在1个碱基的差异(图2-D)。vvi-miR172四个成熟体序列存在相对保守的区域,介于4—19 bp和21—22 bp,表明miR172成熟体高度保守。vvi-miR172c与ptr-miR172g和sly-miR172d的成熟体序列相同,表明其可能具有相似的生物学功能。
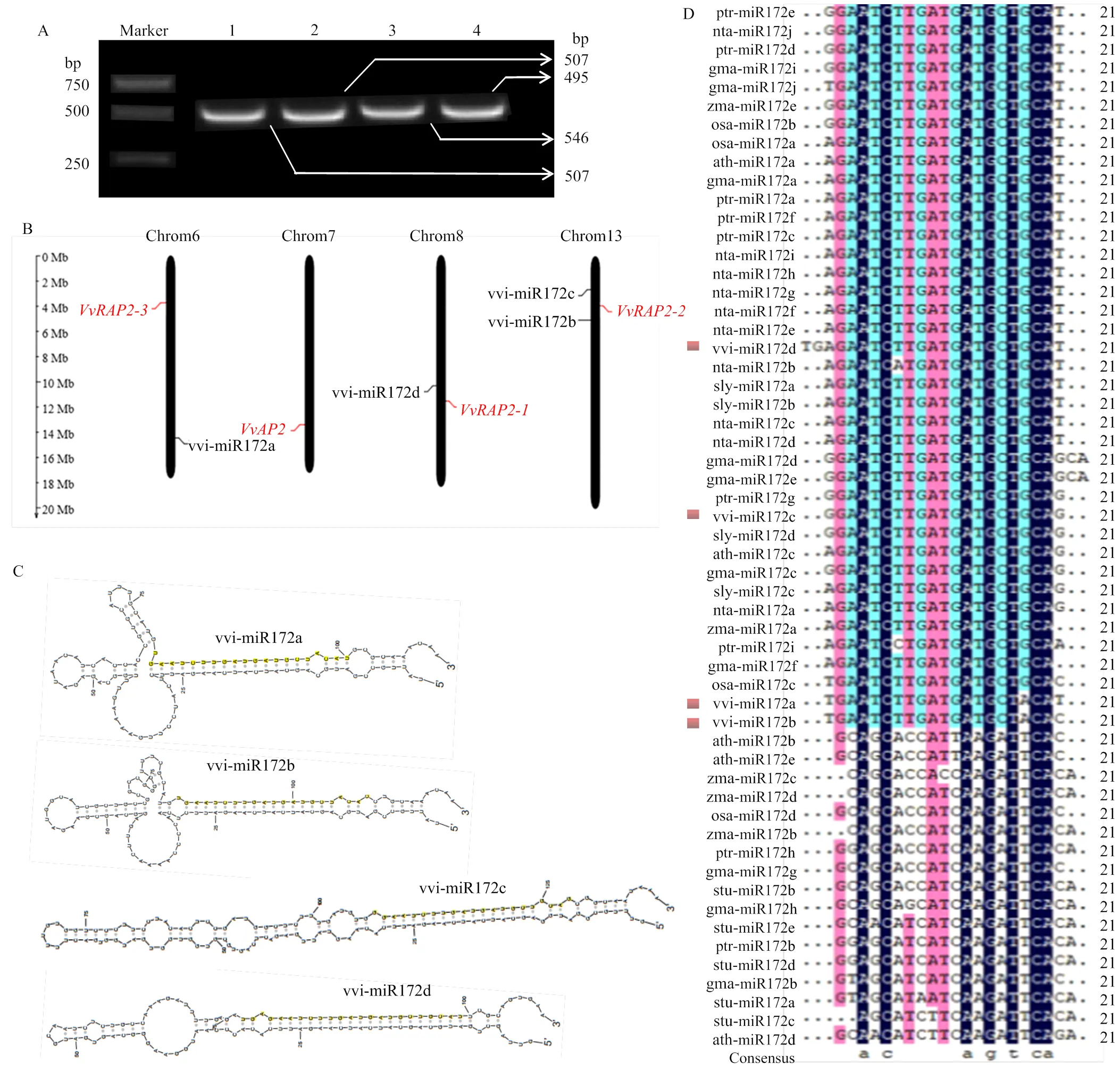
A:vvi-miR172a/b/c/d 前体基因的PCR克隆产物;1:vvi-miR172a;2:vvi-miR172b;3:vvi-miR172c;4:vvi-miR172d;B:vvi-miR172s及其靶基因在染色体上的定位;C:vvi-miR172s前体的二级茎环结构;D:不同物种miR172成熟体序列比对
2.3 vvi-miR172s靶基因的鉴定
2.3.1 vvi-miR172s靶基因的预测及匹配程度分析 根据所获得的vvi-miR172a/b/c/d成熟体序列,利用在线软件psRNA Target预测到4条靶基因、、和,分别分布于葡萄基因组的4条染色体上(Chr7、Chr8、Chr13、Chr6)(图2-B),分析发现vvi-miR172a/b/c/d的靶区都在其靶基因的CDS区,且均通过裂解作用于靶基因(表2)。对vvi-miR172a/b/c/d与其靶基因的匹配程度进一步分析(图3),发现vvi-miR172a、vvi-miR172b与预测所得靶基因的匹配程度相同,错配率均为2.5;vvi-miR172c与和的匹配程度最高,错配率为0.5,与和的错配率为1.0;vvi-miR172d与的错配率最高为2.5,与的错配率分别为0.5、1.5和2.0(表2),说明vvi-miR172家族成员与靶基因间的作用强度存在差异。
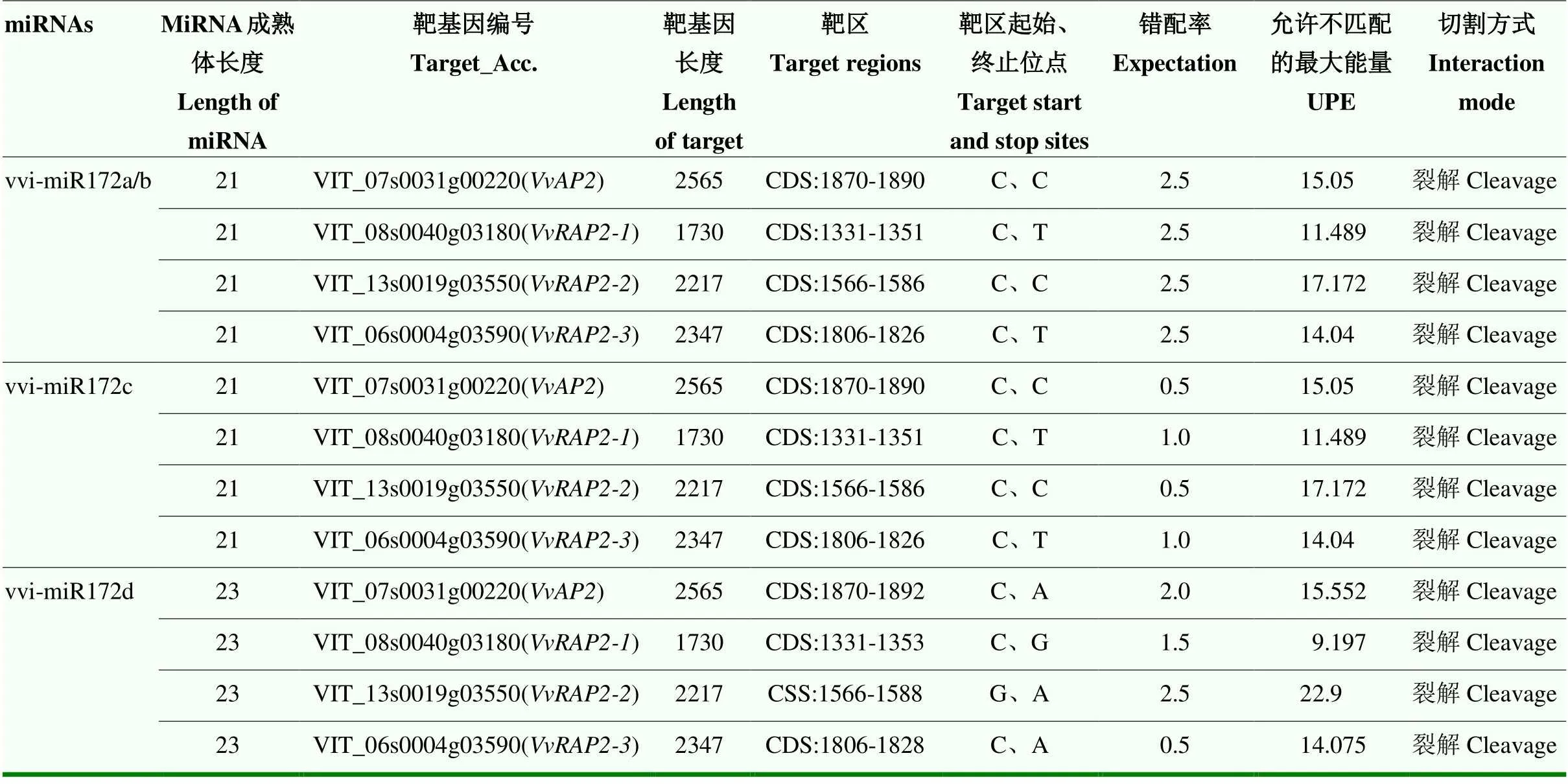
表2 葡萄vvi-miR172s及靶基因信息

图3 vvi-miR172s与靶基因的匹配程度
2.3.2 vvi-miR172s靶基因验证 利用RLM-RACE技术对vvi-miR172s剪切靶基因的作用位点进行验证,发现预测的4条靶基因(和)均被验证到裂解产物,表明它们为vvi- miR172s的真实靶基因(图4);同时发现vvi-miR172s在和上均只有一个酶切位点,4个靶基因的裂解位点位于vvi- miR172a/b 5′端的第9位碱基(U)和第10位碱基(A)之间,vvi-miR172c/d 5′端的第10位碱基(U)和第11位碱基(A)之间,表明miRNA切割位点的保守性。此外,切割频率最低,表明其与vvi-miR172a/ b/c/d间的作用强度较弱(图4)。

虚线代表裂解位点;数字代表mRNA片段5′末端克隆的频率
2.3.3 靶基因序列结构及其进化保守性分析 基于预测的4条靶基因cDNA编码的氨基酸序列,利用MEGA7.0软件对同源比对结果进行进化分析(图5-A),发现比对结果可分为3组,其中水稻成员和玉米成员分别聚集为一组;、和属于同一组,而在另一组。且和与杨树的亲缘关系较近,与大豆具有较高的同源性。利用在线软件GSDS对靶基因序列结构进行分析(图5-B),发现4个靶基因所含的内含子和外显子数量相同,均含有10个外显子和9个内含子。其中,与其他3个靶基因的外显子长度相似,但内含子长度不同。通过MEME在线软件预测motif元件(图5-C),发现各物种内蛋白基序存在一定差异,但各类元件的种类和数量较为稳定,表明AP2及RAP2具有一定的功能保守性。
2.3.4 靶蛋白的结构分析与亚细胞定位预测 利用在线软件PRABI对vvi-miR172s的靶蛋白进行二级结构预测,发现四者二级结构的表现形式均为-螺旋(图6-A)。利用SWISS-MODEL进行三维结构同源建模,结果表明其蛋白三维空间排列所形成的蛋白质分子构象具有多样性[26],其中和的蛋白构象更相似(图6-B),表明其可能具有功能的相似性。利用在线软件CDD对靶基因蛋白及其同源序列进行蛋白结构域预测,发现各序列均含有两个排列顺序相近的AP2蛋白结构域(图6-C),由位置和数量相似的氨基酸编码。对靶蛋白及同源序列进行亚细胞定位预测(图6-D),发现4条靶蛋白均位于细胞核中,而和编码的蛋白还存在于线粒体中。
2.4 vvi-miR172s及其靶基因潜在功能分析
2.4.1 vvi-miR172s前体及靶基因的启动子作用元件分析 通过分析vvi-miR172s前体基因及其靶基因启动子作用元件,发现其作用元件大致可分为4类:光信号响应(Gap-box、Box4、GAT-motif等)、激素相关响应(ABRE、TGACG-motif、TATC-box等)、胁迫相关响应(MBS、ARE、GC-motif等)和昼夜周期节律(circadian等)相关元件。葡萄vvi-miR172家族成员及靶基因中光信号响应元件数量最多,作用位点最丰富;激素和胁迫相关响应作用元件数量次之;昼夜周期节律相关元件数量最少(图7-A)。此外,vvi-miR172s及其靶基因启动子作用元件的数量和类型也各不相同。在元件数量上,最多,次之,而vvi-miR172a最少;在作用元件类型上,除含有昼夜周期节律相关元件外,其他基因只含有3种作用元件(图7-A)。为进一步认识vvi-miR172s及其靶基因应答激素反应的潜在机制,分析发现所有vvi-miR172家族成员及靶基因均含有激素响应作用元件,主要包括赤霉素(gibberellin,GA)、生长素(auxin,IAA)、水杨酸(salicylicacid,SA)、脱落酸(abscisic acid,ABA)及茉莉酸甲酯(methyljasmonate,MeJA)响应元件(图7-B)。但与激素相关的顺式作用元件的组成和数量在不同的vvi-miR172成员及其靶基因间均表现出一定的差异,其中,GA响应元件仅存在于和vvi-miR172c中;IAA响应元件仅存在于和中;ABA响应元件存在于4个靶基因中;MeJA和SA响应元件分布较为广泛(图7-B)。上述作用元件分析表明vvi-miR172s及其靶基因不仅能响应光、胁迫和昼夜周期节律等外界环境信号,还可能通过参与不同激素信号途径调控果实的生长发育。
2.4.2 vvi-miR172s及靶基因在葡萄不同器官组织中的时空表达模式分析 为认识vvi-miR172家族及靶基因在葡萄不同器官不同组织的时空表达特征,本研究基于葡萄54个器官组织的转录组数据[27]和70个miRNA测序数据[28]对vvi-miR172s及靶基因的表达模式进行分析,发现vvi-miR172c及靶基因在13个不同组织或器官中均有表达。vvi-miR172c在花器官(心皮、花粉、雄蕊和花序)中的表达水平相对较高,在运输器官(穗轴和茎)和生殖器官(果实和种子)的表达相对较低;相比之下,靶基因在所有组织中具有较高的表达水平,和在不同组织中的表达水平较低(图8-A)。进一步分析vvi-miR172c及其靶基因在花、果实、茎、叶基本组织中的表达,发现vvi-miR172c在茎、叶和果实中低表达,而靶基因和呈现相反的表达模式(图8-B),表明vvi-miR172家族可能主要通过vvi-miR172c介导靶基因和调控葡萄茎、叶、果实的发育过程。
2.4.3 vvi-miR172s及靶基因在果实不同组织中的时空表达图谱分析 vvi-miR172a/b/d在其发育前期表达量高,在发育后期表达量低(图9-A),其中,vvi-miR172a和vvi-miR172d呈现出相似的表达模式,在幼果期(10 DAF)表达量最高,在近成熟期(85 DAF)表达量最低(图9-A),而vvi-miR172b在硬核期(35 DAF)果皮中有最高的表达,表明前两个成员可能与幼果期果皮发育相关,而后者可能与硬核期果皮发育相关性更强。而vvi-miR172c在果皮发育的各个阶段都表现出较低的表达水平(图9-A)。相比之下,靶基因在果皮发育中呈现幼果期较高表达,而近成熟期最高表达的趋势,与vvi-miR172a/b/d的表达趋势相反;与vvi-miR172c呈相反的表达趋势,从幼果果皮到成熟期逐渐降低(图9-A)。这些结果表明,vvi-miR172s家族的不同成员可能分别参与葡萄果皮发育不同时期的调控
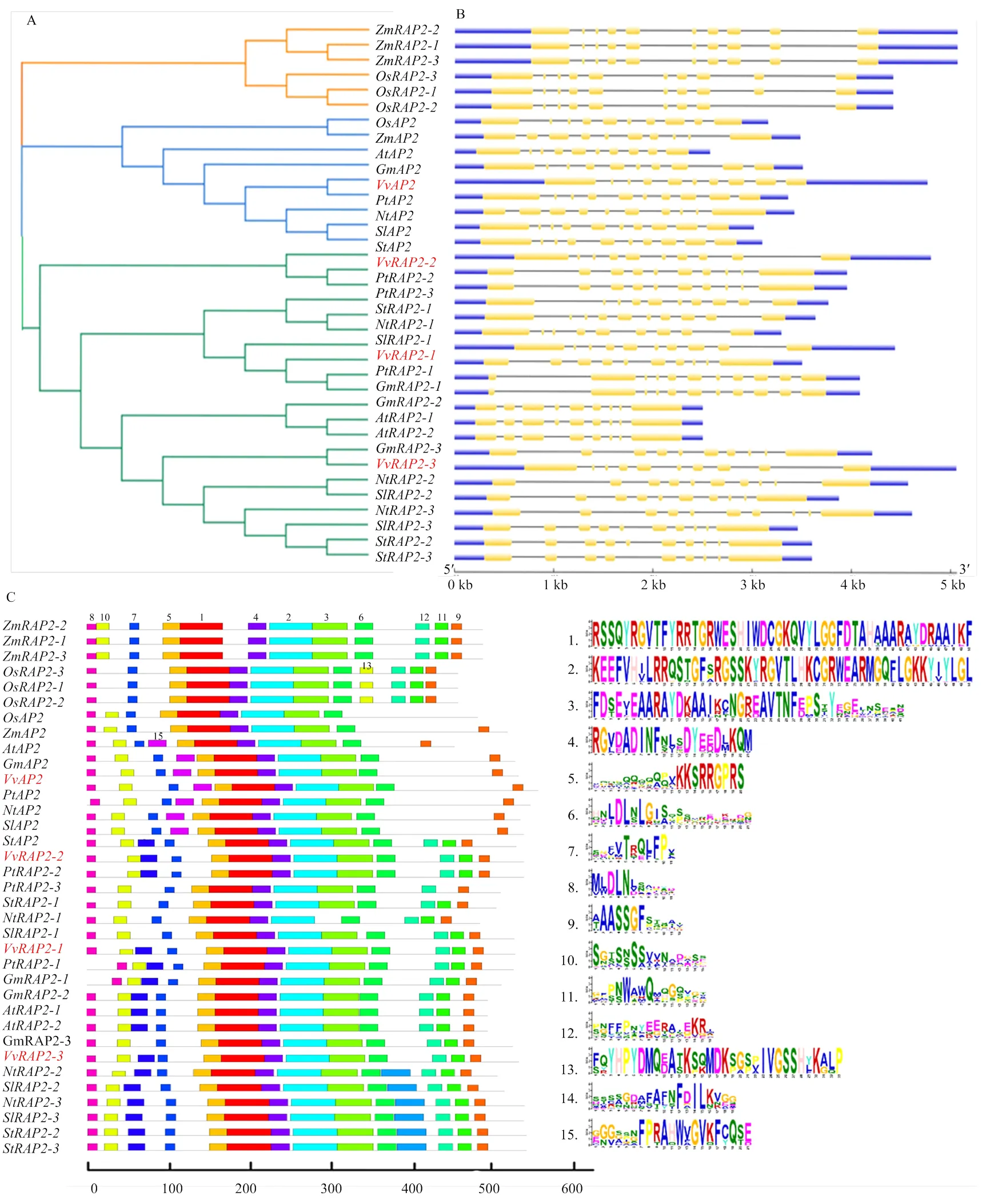
A:靶基因的系统进化;B:靶基因基因结构;C:靶基因保守基序
A:靶蛋白的二级结构预测;B:靶蛋白的三级结构预测;C:靶蛋白保守结构域分析;D:靶蛋白的亚细胞定位预测
A:vvi-miR172s及其靶基因启动子不同类型顺式作用元件汇总;B:vvi-miR172s及其靶基因激素相关顺式作用元件
如图9-B所示,与果皮中不同,果肉中vvi- miR172a/b具有相同的表达模式,均在果实第二次膨大期(60 DAF)表达水平最高,其他时期具有较低的表达;vvi-miR172d随着果肉发育逐渐降低,在幼果果肉中有最高表达,成熟期表达最低,而vvi- miR172c在整个果肉发育期的表达均较低。对比相关靶基因发现,在果肉不同发育时期均呈现较高表达,与vvi-miR172c呈相反表达趋势,而在果肉发育过程中表达逐渐升高,相反于vvi-miR172d的表达趋势,表明vvi-miR172c/d可能负调控其靶基因介导葡萄果肉发育,而vvi-miR172a/b可能与葡萄果实膨大发育相关。
对比vvi-miR172s和靶基因的表达模式发现,葡萄果皮中,vvi-miR172a/b/d与靶基因呈较显著的负相关,与其他靶基因的相关性较差;而在葡萄果肉中,vvi-miR172d显著负调控的表达(图9-B),表明vvi-miR172s及其靶基因的表达存在时空特异性。且在果实不同组织和不同发育时期,vvi-miR172家族成员对靶基因的调控作用存在差异,果皮组织中vvi-miR172家族可能主要通过vvi-miR172a/b/d介导起调控作用,而果肉中vvi-miR172d靶向的调控作用更强。
2.4.4 vvi-miR172s及靶基因在果实不同组织发育过程中应答GA3的模式分析 赤霉素处理可诱导葡萄产生无核果实,为认识vvi-miR172s及其靶基因在葡萄果实发育过程中应答GA3的模式,分析其在GA3处理下的表达水平。果皮中外源GA3的施用使vvi-miR172c在果实第二次膨大期(60 DAF)的表达水平显著上调,vvi-miR172a/b/d在幼果期和硬核期的表达量显著下降(图10-A)。GA3处理显著下调了靶基因的表达,但的表达在果实第二次膨大期显著上调。
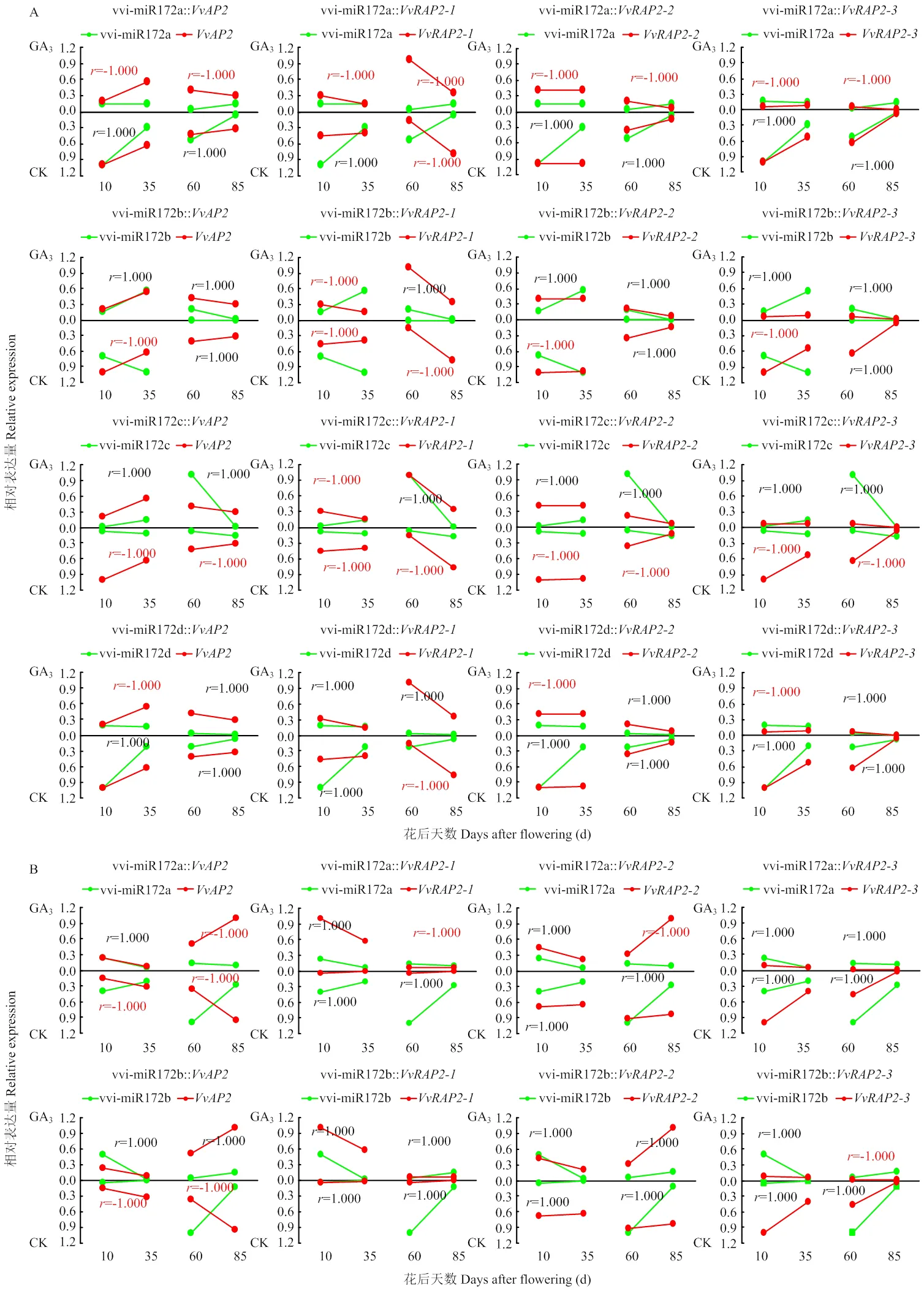
相关性分析显示,GA3处理增强了果皮组织中vvi-miR172d对的负调控作用(图11-A)。GA3处理使果肉中vvi-miR172d在各个发育阶段呈下降趋势,但显著增加vvi-miR172c在果实第二次膨大期(60 DAF)的表达。靶基因在60 DAF显著下调,的表达在GA3处理下显著上调(图10-B)。对比赤霉素处理后vvi-miR172s和靶基因表达水平的相关性,发现在果肉中GA3同样增强了果实发育前期vvi-miR172d与的负相关性,同时诱导了vvi-miR172c对的负调控作用(图11-B),表明vvi-miR172s及其靶基因可能存在不同的GA3应答模式参与葡萄果皮和果肉的发育过程,其中vvi-miR172c可能通过应答GA3介导相应靶基因参与葡萄果实第二次膨大发育的调控,而vvi-miR172d可能响应GA3介导其靶基因调控葡萄幼果期与硬核期果实的发育。
A:vvi-miR172c及其靶基因在葡萄不同器官、组织和发育阶段的表达谱;B:vvi-miR172c及其靶基因在葡萄不同组织的表达水平。Stamen:雄蕊;Bud-AB:萌发后的芽;Inflorescence-WD:发育良好的花序;Flower-FB:始花期;Flower-F:盛花期;Carpel:心皮;Pollen:花粉;Rachis-PFS:坐果后的穗轴;Stem-G:绿色的茎;Stem-W:木质化的茎;Seed-G:绿果的种子
*、**分别代表差异显著(<0.05)和极显著(<0.01)。下同
*,** represented significant difference (<0.05) and extremely significant difference (<0.01), respectively. The same as below
图9 vvi-miR172a/b/c/d及其靶基因在葡萄果皮(A)和果肉(B)中的表达水平
Fig. 9 Expression levels of vvi-miR172a/b/c/d and its target genes in berry pericarp (A) and flesh (B) of grape
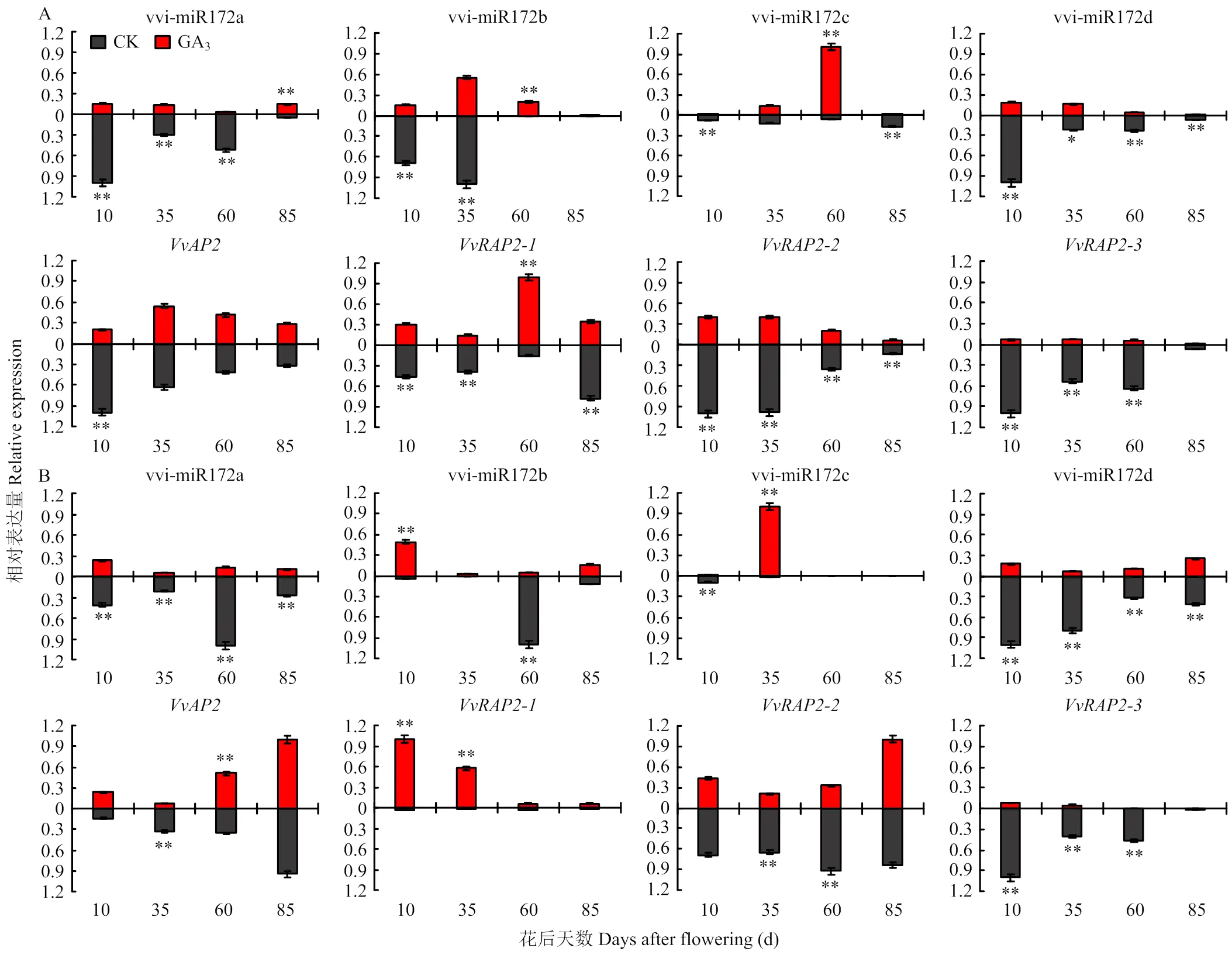
图10 GA3处理下vvi-miR172a/b/c/d及其靶基因在葡萄果皮(A)和果肉(B)中的表达水平
3 讨论
MicroRNAs是一类内源性的非编码小RNA,在基因表达的转录后水平起重要的调控作用。其中,高度保守的miR156和miR172被认为是植物营养生长阶段变化的主要调控因子[8]。而miR172最早是在拟南芥中通过小RNA测序获得,由于其具有高度保守性,目前已在许多植物中鉴定到miR172的存在。本研究发现葡萄中miR172有4个成员(miR172a/b/c/d),和水稻、油菜中的成员数量相同,拟南芥miR172有5个成员,麻疯树有2个成员,表明miR172家族成员在不同物种中存在很大的差异。miR172是第一个主要通过抑制翻译来调节其靶标的植物miRNA,但在葡萄中vvi-miR172s通过裂解作用介导其靶基因的表达。miR172s的靶基因主要为AP2转录因子基因家族成员,AP2/ERF蛋白是一个转录因子大家族,在生物和非生物胁迫以及发育阶段起关键的作用,目前已在拟南芥[29]、水稻[30]、大麦、小麦[31]、油菜[1]、杨树[32]和花生[33]中鉴定到其存在。MiR156-miR172-AP2被认为是一种调控营养生长向生殖生长转变的途径,进而影响植物开花时间和花的发育[34]。AP2蛋白含有一到两个AP2结构域,AP2域包括60—70个高度保守的氨基酸(aa)和两个保守的YRG和RAYD motif元件,分别在AP2域的N和C末端[1]。本研究中葡萄miR172s的4条靶基因(、和),均含有两个AP2蛋白结构域,但不同物种中靶基因存在差异,油菜和拟南芥中分别含有19和6个AP2类靶基因。靶基因的进化分析显示,相比于拟南芥和水稻,葡萄中miR172靶基因的亲缘关系较远,推测葡萄中miR172靶基因的进化程度较大,其功能可能更加多样化。
MicroRNA及其靶基因在不同组织中的表达具有时空特异性。Jofuku等[35]指出,与其他花同源基因不同,AP2在拟南芥的非花组织(茎和叶)和花组织(萼片、花瓣、雄蕊、心皮、发育中的胚珠和花序分生组织)中均有表达。GIL-HUMANES等[31]研究了AP2类基因在小麦和大麦不同发育阶段根、茎、幼叶和穗中的表达,发现AP2类基因在所有组织中都有表达,在穗发育的早期达到高峰,并随着穗的成熟而逐渐减少。油菜中的研究表明大部分在花器官中高表达,推测其在花发育过程中具有特殊的功能;且、和在晚花材料中的表达水平均高于早花材料,表明它们可能具有抑花作用[1]。本试验的荧光定量分析显示,vvi-miR172s及其靶基因在果实发育过程中的表达存在显著差异,vvi-miR172c在果皮和果肉中的表达水平较低,在拟南芥中,miR172a/b/c的表达在生殖生长阶段升高,而miR172d/e基因的表达很低,并且不会随着植物的发育而改变[34];在水稻中,miR172c在幼苗中表达,但在发育中的谷物中不表达[36],表明在不同物种中miR172c的表达存在显著差异。本研究发现,外源GA3增强了果皮和果肉组织中vvi-miR172d对的负调控作用,同时诱导了果肉组织中vvi-miR172c对//的负调控作用。该研究结果初步表明vvi-miR172c/d可能介导调控葡萄果实的发育,为深入研究vvi-miR172s及其靶基因响应GA信号调控葡萄果实发育的分子机制奠定了重要的基础。
4 结论
葡萄miR172家族含有vvi-miR172a/b/c/d四个成员,均可通过裂解、四条靶基因参与调控葡萄果皮、果肉发育。其中,vvi-miR172a/b/d和vvi-miR172c可能分别介导靶基因和在果皮和果肉组织发育中起着更为重要的作用,而vvi-miR172c可能主要响应GA3信号介导调控葡萄果实膨大期果皮、果肉的发育。
[1] Wang T Y, Ping X K, Cao Y R, Jian H J, GA3o Y M, Wang J, Tan Y C, Xu X F, Lu K, Li J N, Liu L Z. Genome-wide exploration and characterization of miR172/euAP2 genes inL. for likely role in flower organ development. BMC Plant Biology, 2019, 19(1): 336.
[2] XU Z S, CHEN M, LI L C, MA Y Z. Functions and application of the AP2/ERF transcription factor family in crop improvement. Journal of Integrative Plant Biology, 2011, 53(7): 570-585.
[3] LI J, LUAN Y S, ZHAI J M, LIU P, XIA X Y. Bioinformatic analysis of functional characteristics of miR172 family in tomato. Journal of Northeast Agricultural University (English edition), 2013, 20(4): 21-29.
[4] 王梦琦, 解振强, 孙欣, 李晓鹏, 朱旭东, 王晨, 房经贵. 葡萄miR159及其靶基因VvGAMYB在花发育过程中的作用分析. 园艺学报, 2017, 44(6):1061-1072.
Wang M Q, Xie Z Q, Sun X, Li X P, Zhu X D, Wang C, Fang J G. Function analysis of miR159 and its target genein grape flower development. Acta Horticulturae Sinica, 2017, 44(6): 1061-1072. (in Chinese)
[5] MATHIEU J, YANT L J, MURDTER F, KUTTNER F, SCHMID M. Repression of flowering by the miR172 target SMZ. PLoS Biology,2009, 7(7): e1000148.
[6] ZENG C Y, WANG W Q, ZHENG Y, CHEN X, BO W P, SONG S, ZHANG W X, PENG M. Conservation and divergence of microRNAs and their functions in Euphorbiaceous plants. Nucleic Acids Research,2010, 38(3): 981-995.
[7] TANG M Y, BAI X, NIU L J, CHAI X, CHEN M S, XU Z F. miR172 regulates both vegetative and reproductive development in the perennial woody plant. Plant and Cell Physiology,2018, 59(12): 2549-2563.
[8] ZHU Q H, HELLIWELL C A. Regulation of flowering time and floral patterning by miR172.Journal of Experimental Botany,2011, 62: 487-495.
[9] 侍婷, 高志红, 章镇, 庄维兵. MicroRNA参与植物花发育调控的研究进展. 中国农学通报, 2010, 26(13): 267-271.
SHI T, GAO Z H, ZHANG Z, ZHUANG W B. Advance of research on microRNA in flower development regulation. Chinese Agricultural Science Bulletin,2010, 26(13): 267-271. (in Chinese)
[10] YAO JL,TOMES S,XU J,GLEAVE A P. How microRNA172 affects fruit growth in different species is dependent on fruit type. Plant Signaling andBehavior,2016,11(4): e1156833.
[11] RIPOLL J J, BAILRY L J, MAI Q A, WU S L, HON C T, CHAPMAN E J, DITTA G S, YANOFSKY M E, YANOFSKY M F. microRNA regulation of fruit growth. Nature Plants, 2015, 1(4): 15036.
[12] CHEN X M. A microRNA as a translational repressor of APETALA2 inflower development. Science,2004, 303(5666): 2022-2025.
[13] JUNG J H, SEO Y H, SEO P J, REYES J L, JU Y, CHUA N H, PARK C M. The GIGANTEA-regulated microRNA172 mediates photoperiodic flowering independent of CONSTANS in. Plant Cell,2007, 19(9): 2736-2748.
[14] JUNG J H, SEO P J, KANG S K, PARK C M. MiR172 signals are incorporated into the miR156 signaling pathway at the SPL3/4/5 genes indevelopmental transitions. Plant Molecular Biology, 2011, 76(1): 35-45.
[15] YANT L, MATHIEU J, DINH T T, OTT F, LANZ C, WOLLMANN H, CHEN X, SCHMID M. Orchestration of the floral transition and floral development inby the bifunctional transcription factor APETALA2. Plant Cell,2010, 22(7): 2156-2170.
[16] BARTLEY GE, ISHIDA BK. Digital fruit ripening: Data mining in the TIGR tomato gene index. Plant Molecular Biology Reporter, 2002, 20(2): 115-130.
[17] ALBA R, PAYTON P, FEI ZJ, MCQUINN R, DEBBIE P, MARTIN GB, TANKSLEY SD, GIOVANNONI JJ. Transcriptome and selected metabolite analyses reveal multiple points of ethylene control during tomato fruit development. Plant Cell, 2005, 17(11): 2954-2965.
[18] CHUNG MY, VREBALOV J, ALBA R, LEE J, MCQUINN R, CHUNG JD, KLEIN P, GIOVANNONI J. A tomato () APETALA2/ERF gene, SlAP2a, is a negative regulator of fruit ripening. Plant Journal,2010, 64(6): 936-947.
[19] 滕飞. 拟南芥AP2/ERF基因ERF055调控茎端分生组织发育的功能研究[D]. 泰安: 山东农业大学, 2013.
Teng F. Functional study ofAP2/ERF family gene
[20] 张计育, 王庆菊, 郭忠仁. 植物AP2/ERF类转录因子研究进展. 遗传, 2012, 34(7): 835-847.
ZHANG J Y, WANG Q J, GUO Z R. Progresses on plant AP2/ERF transcription factors. Hereditas, 2012, 34(7): 835-847. (in Chinese)
[21] 王文然, 王晨, 解振强, 贾海锋, 汤崴, 崔梦杰, 房经贵. VvmiR397a及其靶基因VvLACs在葡萄果实发育中的作用分析. 园艺学报, 2018, 45(8): 1441-1455.
WANG W R, WANG C, XIE Z Q, JIA H F, TANG W, CUI M J, FANG J G. Function analysis of VvmiR397a and its target genesin grape berry development. Acta Horticulturae Sinica,2018, 45(8): 1441-1455. (in Chinese)
[22] KUNST L, KLENZ J E, MARTINEZ-ZAPATER J, HAUGHN G W. AP2 gene determines the identity of perianth organs in flowers of. Plant Cell, 1989, 1(12): 1195-1208.
[23] OKAMURO J K, BOER BGW, JOFUKU KD. Regulation of Arabidopsis flower development.Plant Cell, 1993, 5(10): 1183-1193.
[24] NIU X, HELENTJARIS T, BATE N J. Maize ABI4 binds coupling element1 in abscisic acid and sugar response genes. Plant Cell, 2002, 14(10): 2565-2575.
[25] WANG C, ShANGGUAN L F, NICHOLAS K K, WANG X C, HAN J, SONG C N, FANG J G. Characterization of microRNAs identified in a table grapevine cultivar with validation of computationally predicated grapevine miRNAs by miR-RACE. PLoS ONE, 2016(7): e21259.
[26] 张文颖, 王晨, 朱旭东, 马超, 王文然, 冷祥鹏, 郑婷, 房经贵. 葡萄全基因组DELLA蛋白基因家族鉴定及其应答外源赤霉素调控葡萄果实发育的特征. 中国农业科学, 2018, 51(16): 3130-3146.
ZHANG W Y, WANG C, ZHU X D, MA C, WANG W R, LENG X P, ZHENG T, FANG J G. Genome-wide identification and expression of DELLA protein gene family during the development of grape berry induced by exogenous GA.Scientia Agricultura Sinica, 2018, 51(16): 3130-3146. (in Chinese)
[27] 朱旭东. 葡萄蔗糖合酶基因VvSS3的初步功能研究[D]. 南京: 南京农业大学, 2017.
ZHU X D. The preliminary function analysis of the sucrose synthase gene VvSS3 in[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese)
[28] Akullan j b, pinto d l p, bertolinie, fasoli m, zenoni s, tornielli g b, pezzotti m, meyers b c, farina l, pe m e, mica e. miRVine: A microRNA expression atlas of grapevine based on small RNA sequencing. BMC Genomics, 2015, 16: 393.
[29] NAKANO T, SUZUKI K, FUJIMURA T, SHINSHI H. Genome-wide analysis of the ERFgene family inand rice. Plant Physiology, 2006, 140(2):411-432.
[30] TANG M F, LI G S, CHEN M S. The phylogeny and expression pattern of APETALA2-like genes in rice. Journal of Genetics and Genomics,2007, 34(10): 930-938.
[31] GIL-HUMANES J, PISTON F, MARTIN A, BARRO F. Comparative genomic analysis and expression of the APETALA2-like genes from barley, wheat, and barley-wheat amphiploids. BMC Plant Biology, 2009, 9(1): 66-79.
[32] ZHUANG J, CAI B, PENG R H, ZHU B, JIN X F, XUE Y, GAO F, FU X Y, TIAN Y S, ZHAO W, QIAO Y S, ZHANG Z, XIONG A S, YAO Q H. Genome-wide analysis of the AP2/ERF gene family in. Biochemical and Biophysical Research Communications, 2008, 371(3): 468-474.
[33] ZHANG G Y, CHEN M, CHEN X P, XU Z S, GUAN S, LI L C, LI A L, GUO J M, MAO L, MA Y Z. Phylogeny, gene structures, and expression patterns of the ERF gene family in soybean (L.). Journal of Experimental Botany, 2008, 59(15): 4095-4107.
[34] LI J P, CHEN F J, LI Y Q, LI P C, WANG Y Q, MI G H, YUAN L X. ZmRAP2.7, an AP2 transcription factor, is involved inroots development. Frontiers in plant science, 2019, 10: 820.
[35] JOFUKU K D, DEN BOER B D, VAN MONTAGU M, OKAMURO J K. Control offlower and seed development by the homeotic gene APETALA2. Plant Cell,1994, 6(9): 1211-1225.
[36] ZHU QH, HELLIWELLl CA. Regulation of flowering time and floral patterning by miR172. Journal of Experimental Botany, 2011, 62(2):487-495.
Function Analysis of vvi-miR172s and Their Target Genes Response to Gibberellin Regulation of Grape Berry Development
XUAN XuXian1, SHENG ZiLu1, XIE ZhenQiang2, HUANG YuQing1, Gong PeiJie1, ZHANG Chuan1, ZHENG Ting1, WANG Chen1*, FANG JingGui1
1College of Horticulture, Nanjing Agricultural University, Nanjing 210095;2Jiangsu Vocational College of Agriculture and Forestry, Jurong 212499, Jiangsu
【】 miR172 is an important regulator of plant growth and development. The purpose of this research was to clarify the roles and modes response to gibberellin (GA) of the miR172 family and its target genes in development of different tissues of grape berry. 【】The mature and precursor sequences of vvi-miR172a/b/c/d were cloned and identified by miR-RACE and PCR techniques from grapevine cv. Rosario Bianco. The target genes of vvi-miR172s were predicted by psRNA Target software, and the phylogenetic, structure analysis and subcellular localization were performed by bioinformatics tools. RLM-RACE verified the cleavage roles of four target genes by vvi-miR172s. The cis-elements analysis of their promoters was predicted by PLANTCARE software. The qRT-PCR method was used to detect the temporal and spatial expression patterns of vvi-miR172s and target genes in different tissues of grape berry induced by exogenous GA3application.【】The mature and precursor sequences of vvi-miR172a/b/c/d were cloned, and four target genes (,,and) were identified from grape genome. The cleavage sites of vvi-miR172s on target genes were detected by RLM-RACE, which proved that,,andwere the true target genes. Gene structure analysis result showed that all target genes contained 10 exons, 9 introns and 2 AP2 domains. The type and number of motif elements were similar, indicating that gene structures were highly conserved. Phylogenetic analysis showed thatandwere closer to poplar, andhad high homology with soybean. The secondary structure prediction of target proteins indicated that they existed in the form of alpha-helix and further folded into the stable tertiary structure. Subcellular localization results showed that all target proteins were mainly located in the nucleus. Both vvi-miR172c andhad the hormone related cis-elements response to GA3, suggesting that they might be involved in the regulation of grape berry development by responding to corresponding hormones. Microarray data analysis revealed that the expression patterns of vvi-miR172c and target genes were tissue or orGA3n specific. RT-qPCR analysis showed that vvi-miR172a/b/d showed a decrease expression trend in pericarp, whileexhibited a reverse expression trend to the former, indicating that vvi-miR172a/b/d neGA3tively regulatedHowever, in flesh,was contradictory to vvi-miR172d, with the increased expression during grape development, suggesting that there was a significant neGA3tive correlation between vvi-miR172d andInterestingly, GA3treatment promoted the neGA3tive regulation of vvi-miR172d onand induced the neGA3tive regulation of vvi-miR172c on//. 【】andwere the real target genes of vvi-miR172s. Among the vvi-miR172 family, vvi-miR172 a/b/d might mediateregulation of pericarp development, whereas vvi-miR172d might mediateinvolved in the development of grape flesh. vvi-miR172c/d and their target genes might participate in the regulation of grape pericarp and flesh development in response to exogenous GA.
grape; fruit development; gibberellin; miR172; target gene

10.3864/j.issn.0578-1752.2021.06.011
2020-06-01;
2020-11-19
国家重点研发计划(2018YFD1000106)、江苏省自然科学基金面上项目(BK20181318)、国家自然科学基金面上项目(31972373)、大学生国家创新创业计划(S20190012)
宣旭娴,E-mail:2019804199@njau.edu.cn。通信作者王晨,E-mail:wangchen@njau.edu.cn
(责任编辑 赵伶俐)

