有氧运动对糖尿病大鼠心脏自主神经病变的影响
邵承颖 苏冉 王琳 李扬 姚泽龙
摘 要:目的:探讨有氧运动对糖尿病大鼠心脏自主神经病变的影响。方法:42只健康雄性SD大鼠随机分为对照组、糖尿病组、糖尿病+有氧运动组,腹腔內注射链脲佐菌素制备糖尿病大鼠模型。糖尿病成模16周后有氧运动组大鼠进行12周跑台运动。之后所有成活大鼠分别利用心率变异性评估大鼠的电生理特性,利用免疫组化和RT-PCR法检测左心室心肌胆碱乙酰基转移酶(ChAT,标记迷走神经)和酪氨酸羟化酶(TH,标记交感神经)阳性神经纤维及其相应的mRNA表达水平。结果:与对照组大鼠相比,糖尿病大鼠心肌ChAT和TH阳性神经纤维的密度及mRNA明显降低(P<0.01),SDNN、LF、HF等指标均降低,反映交感神经活性的LF/HF比例显著增加。有氧运动干预后糖尿病大鼠心肌内ChAT和TH阳性神经纤维的密度仍低于对照组,但显著高于单纯糖尿病组(P<0.05),且ChAT/TH神经纤维比例显著增加,LF/HF比例降低。结论:有氧运动可降低持续高血糖状态对大鼠心脏交感、迷走神经的损伤,增加迷走神经支配比例,恢复迷走神经与交感神经的平衡状态,从而显著改善糖尿病心脏自主神经病变。
关键词:有氧运动; 糖尿病;心脏自主神经病变;交感-迷走神经平衡
中图分类号:G804.7 文献标识码:A 文章编号:1009-9840(2021)01-0055-05
Abstract:Objective: To investigate the role of aerobic exercise on diabetic cardiovascular autonomic neuropathy. Methods: 42 male Sprague-Dawley rats were randomly divided into three groups: Control, diabetes mellitus (DM) and DM with aerobic exercise (DM+ME). Diabetes was induced by intraperitoneal injection of streptozotocin. 16 weeks after induced DM, the rats in MI+ME group were assigned to 12 weeks of exercise. 12 weeks later, heart rate variability was used to assess electrophysiological characteristics. Immunohistochemistry and RT-PCR were used to measure choline acetyltransferase (ChAT) and tyrosine hydroxylase (TH) positive nerve fibers and the corresponding mRNA expression levels in the ventricular myocardium. Results: Compared with control rats, the density of ChAT and TH-positive nerve fibers and mRNA expressions were decreased in DM group, the SDNN (P<0.01), LF and Hf were decreased and LF/HF ratio was increased. The density of ChAT and TH-positive nerve fibers in DM+ME group was higher than that in DM group (P<0.05), especially, the ChAT/TH ratio in DM+ME group was higher and LF/HF ratio was lower than that in DM group. Conclusions: Aerobic exercise may ameliorate diabetes-induced sympatho-parasympathetic imbalance and increase the ratio of parasympathetic to sympathetic nerve fibers.
Key words:aerobic exercise; diabetes mellitus; cardiac autonomic neuropathy; sympatho-parasympathetic balance
糖尿病(diabetes mellitus, DM)是21世纪对人类健康最具挑战的疾病之一,其慢性并发症可损害全身各系统,是糖尿病患者致残、致死的主要原因。其中,糖尿病心脏自主神经病变(diabetic cardiovascular autonomic neuropathy, DCAN)是最为严重的类型之一,流行病学研究显示大约60%~90%的糖尿病患者并发DCAN。DCAN其主要临床表现为心动过速、运动耐力下降、体位性低血压、无痛性心肌缺血,其中最严重的表现为室性心律失常及心源性猝死[3]。近年来一系列研究证实,长期高血糖状态对心脏自主神经影响广泛,交感神经及迷走神经均有受累。由于迷走神经节前纤维较长,对缺氧耐受性差,故在DCAN中,迷走神经损伤较早且较重[4];而后期迷走神经、交感神经均不同程度受累,这种支配失衡势必打破心脏交感-迷走神经的平衡,改变心电稳定性,导致心律失常易感性的增加。但目前尚无针对糖尿病自主神经病变的特效治疗方法,传统药物治疗效果不佳。
近几年,有氧运动作为心血管疾病重要的康复手段逐渐成为运动医学领域研究的热点,2010年美国运动医学会/美国糖尿病学会糖尿病运动指南[6]中明确指出,规律的体育运动可以有效控制糖尿病患者血糖水平,增加胰岛素敏感性,还有利于减轻体重、控制血脂和血压、降低大血管和微血管等并发症发生风险,因此建议糖尿病患者应在医生指导下尽可能增加运动和日常活动。随着有氧运动相关研究的继续深入,有氧运动对糖尿病周围神经及心脏自主神经病变的改善作用也得到了越来越多的关注。意大利一项为期4年的研究[8]发现,长期有氧运动可显著提高2型糖尿病患者腓肠肌运动神经传导速度,并进一步延缓糖尿病周围神经病变的发生、发展进程。Pagkalo等[9]对17例2型糖尿病患者进行了为期6个月的每周3次的有氧运动训练,证实长期中等强度的有氧运动训练可提高心脏迷走神经活性,显著改善2型糖尿病患者的心脏自主神经功能。目前,有氧运动对心脏自主神经改善的探讨多集中在功能性研究,而其对心脏自主神经解剖方面的机制尚不明确。因此,本研究拟在DM大鼠模型基础上,观察12周有氧运动对心脏自主神经及心脏电生理特性的影响,以阐明有氧运动改善心脏自主神经功能解剖学机制,为DCAN的治疗提供新的思路及理论依据。
1 材料与方法
1.1 实验材料
健康雄性SD大鼠42只,体重200~250 g(购自山東大学实验动物中心)。Trizol试剂盒购于北京TransGen公司; Real-time RT-PCR试剂盒购于大连宝生物工程公司,引物由上海生工生物工程公司设计并合成;胆碱乙酰转移酶(choline acetyltransferase,ChAT) 及酪氨酸羟化酶(tyrosine hydroxylase,TH)一抗均购于美国Millipore公司,二抗均购于北京康为世纪生物科技有限公司。
1.2 实验方法
1.2.1 糖尿病模型制备
大鼠适应性喂养1周,随机分为3组:对照组(n=14),糖尿病组(n=14),糖尿病+有氧运动组(有氧运动组,n=14)。依照参考文献制备糖尿病大鼠模型:所有大鼠禁食不禁水12 h,腹腔内注射链脲佐菌素(50 mg/kg),对照组大鼠给予同等体积的生理盐水腹腔内注射。糖尿病定义为链脲佐菌素腹腔内注射后48 h连续2次尾静脉血测定空腹血糖>16 mmol/L。在模型制备后第16周检测空腹血糖及体重。
1.2.2 运动方案
糖尿病大鼠成模后第16周,有氧运动组参照Kemi OJ运动方案进行训练:动物跑台运动速度为15 m/min,大鼠进行适应运动10 min;将跑台运动速度增至20 m/min,持续运动50 min。大鼠运动60 min/d,5次/周,共计12周。对照组及糖尿病组正常笼内喂养不运动。
1.2.3 心率变异性(heart rate variability,HRV)分析
实验大鼠12周有氧运动干预后,所有成活大鼠参照Sgoifo等[12]的方法将小动物无线遥测植入子植入大鼠腹腔内。一个电极置于大鼠剑突下,另一个置于靠近右心房的纵膈内。利用LabChart Pro软件记录24 h动态心电图。选取一段15 min的心电图记录分析心率变异性。计算出正常R-R间期的标准差(standard deviation of normal-to-normal,SDNN)。同时记录低频(LF:0.04~0.15 Hz)和高频(HF:0.15~0.4 Hz)数据,计算低频和高频的比值。
1.2.4 心肌标本处理
HRV分析结束后,大鼠再次麻醉并迅速取下心脏,经主动脉灌注生理盐水清除残存血液。并选取左室近段(心底前壁)心肌组织,分别存放于中性甲醛及液氮中保存。
1.2.5 ChAT及TH阳性神经纤维密度测定
取甲醛固定后的心肌组织,石蜡包埋,切片,片厚4 μm,常规脱蜡、高压修复后加一抗4℃过夜,二抗37℃孵育30 min,DAB显色,复染后封片。采用Image Pro Plus 5图像处理分析软件定量分析ChAT、TH阳性神经纤维在所选区域中所占面积(以μm2/mm2表示),每张切片选取神经分布最集中的3个区域,取其平均值作为阳性神经纤维密度值。
1.2.6 ChAT及TH mRNA检测
按照Trizol 试剂盒提供的方法提取心肌组织总mRNA。采用上海生工生物工程公司设计的引物,GAPDH 作为内参。TH引物, 上游ACT GGA GGC TGT GGT ATT TGA G;下游GAG ACA AGG AGG AGG AGG GTT TTG。 ChAT引物,上游AGC CCC TCT GTA TGA AGC AAT ;下游GGA CGC CAT TTT GAC TAT CTT T; GAPDH引物, 上游ACA GCA ACA GGG TGG TGG AC;下游TTT GAG GGT GCA GCG AAC TT。按照RT-PCR 试剂盒的方法进行荧光定量PCR,使用GAPDH 标准化,采用2 –ΔΔCT法计算目的基因转录水平。
1.2.7 统计学分析
所有数据均采用SPSS17.0统计软件进行统计学分析。数据以均数±标准差(x2±s)表示,多组间比较采用单因素方差分析,然后采用最小显著差异法进行组间两两比较。P<0.05为统计学差异具有显著性。
2 结果
2.1 动物一般情况
实验过程中, 非糖尿病对照组大鼠精神状态良好,体重增加明显。糖尿病组大鼠出现多食、多尿和消瘦等症状,实验期间各组大鼠各阶段空腹血糖及体重变化情况见表1。
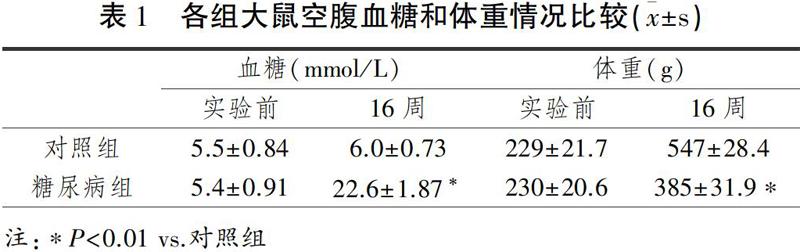
2.2 心肌中ChAT及TH阳性神经纤维分布及表达
如图1所示,对照组ChAT(迷走神经标志物)和TH(交感神经标志物)阳性的神经纤维均匀分布在心室肌周围,沿心肌纤维纵行分布,但ChAT阳性神经纤维较TH阳性神经纤维相比较为稀疏。糖尿病大鼠ChAT和TH阳性神经纤维的密度显著低于对照组,而有氧运动组ChAT和TH阳性神经纤维的密度显著高于糖尿病组,且ChAT/TH神经纤维比例明显升高(表2)。
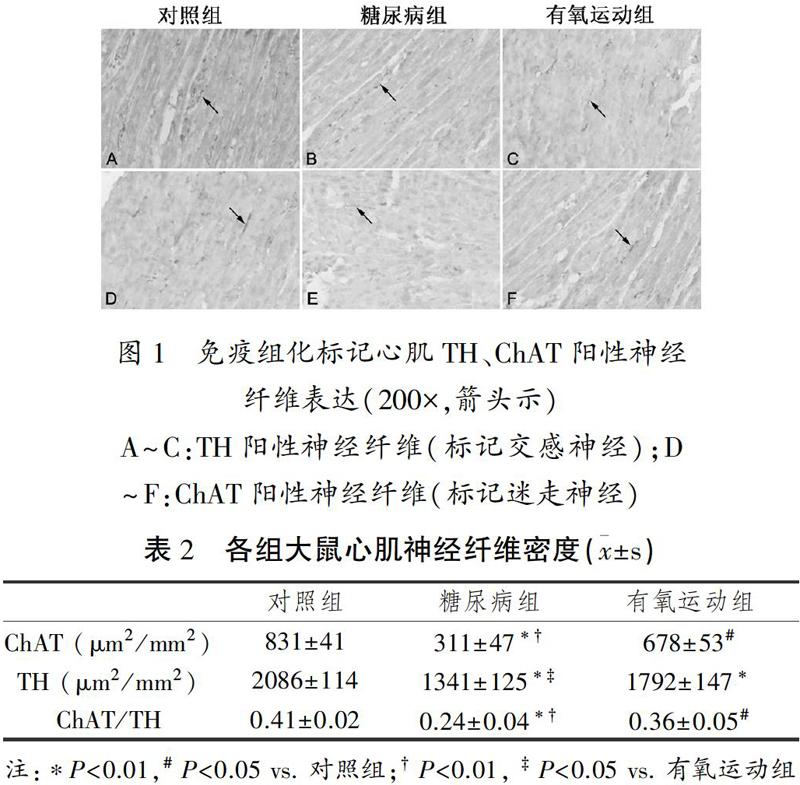
2.3 大鼠心肌中ChAT、TH相应mRNA表达水平
与对照组相关,糖尿病大鼠心肌组织中ChAT及TH mRNA均显著下调(ChAT:0.379±0.044 vs. 0.979±0.087, P<0.01;TH:0.523±0.066 vs. 0.997±0.092, P<0.01);而有氧运动干预后,ChAT及TH mRNA表达均有不同程度的上调(ChAT:0.531±0.071 vs. 0.379±0.044,P<0.05;TH:0.683±0.113 vs. 0.523±0.066, P<0.05)(图2)。
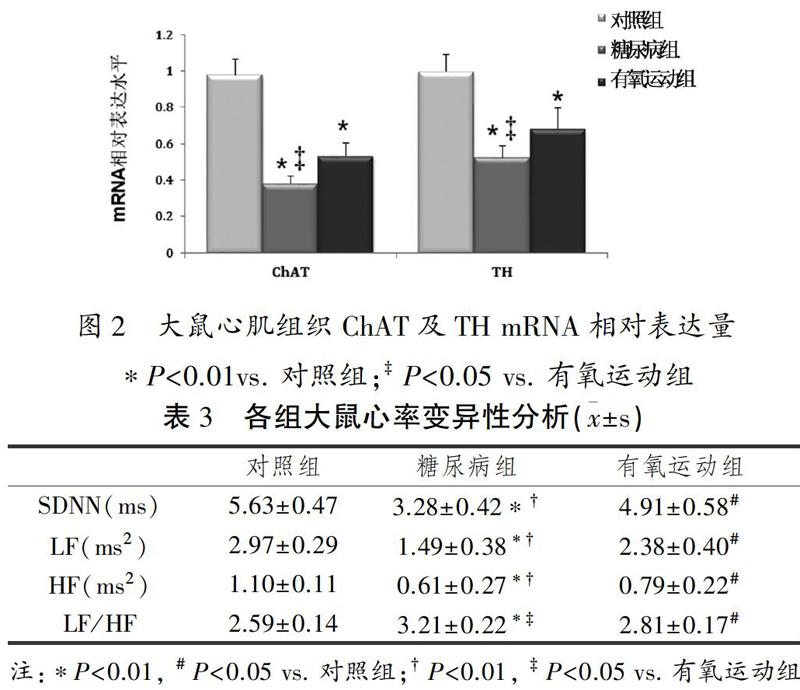
2.4 HRV分析
如表3所示,糖尿病大鼠SDNN显著低于对照组大鼠,而有氧运动组SDNN高于糖尿病组。记录LF和HF数值行频域分析,有氧运动组中二者均明显高于单纯糖尿病组,更重要的是,有氧运动组LF/HF明显低于糖尿病组。
3 讨论
在正常生理情况下,交感神经及迷走神经以其“固有”的形式分布于心脏,二者相互依存、相互对抗、相互协调,共同精细地调节心脏活动。其中,交感神经兴奋时表现为正性频率、正性传导和正性肌力的“三正”作用,其过度兴奋可诱发心律失常;而迷走神经兴奋时表现为相反的“三负”作用, 在一定程度上起到抗心律失常的作用。慢性高血糖可引发心脏自主神经病变,通过电镜观察,糖尿病自主神经损害表现为脱髓鞘病变(节段性脱髓鞘病变为主),可见轴索的神经微丝溶解及小泡性膜状细胞器出现。有研究发现DCAN的交感神经去神经化最先发生在左室的远端,然后逐渐向近端扩展,显示出交感神经病变严重程度自左室近端至远端呈逐渐加重的“阶梯状分布”。而迷走神经纤维也呈现不同程度的密度降低,由于迷走神经节前纤维较长,且对缺氧耐受性差,故DCAN中迷走神经损伤较早且较重,提示交感神经、迷走神经均不同程度受累,但以迷走神经损害为主。这种支配失衡势必打破心脏交感-迷走神经的平衡,改变心电稳定性,导致心律失常易感性的增加。
与既往研究结论一致,我们的结果显示,糖尿病大鼠心肌中ChAT和TH陽性神经纤维的密度及其相应mRNA表达明显降低,ChAT/TH神经纤维比例也显著下降,提示持续高糖状态对心脏交感及迷走神经损伤及失支配状态,尤以迷走神经损伤更为严重。HRV分析作为一种无创的检查方法,不仅对心脏交感神经功能可以做出评价,还可以对迷走神经功能以及迷走/交感神经功能之间的均衡性进行定量分析[16]。我们的研究结果显示,糖尿病组SDNN、LF、HF等指标均明显低于正常对照组,且LF/HF较正常对照组高,提示糖尿病对心脏自主神经造成交感、迷走神经功能不同程度受损,交感神经张力相对上调,最终导致心肌交感-迷走神经的功能失衡。
糖尿病心脏自主神经病变病理生理学机制涉及多种细胞及代谢途径[17],包括:糖代谢紊乱本身对心脏自主神经纤维产生的损伤;神经微循环障碍造成的神经元缺血、缺氧;氧化应激的参与;自身免疫机制引起的损害;神经生长因子水平的降低以及免疫因素的参与等。因其涉及机制繁多,临床上单一药物干预均未获得理想的防治效果。因此,如何改善DCAN成为临床工作的难点和热点。近年来,关于有氧运动对心脏自主神经调控的研究已有诸多报道,Hautala等[18]在校正受试者年龄、训练时间等因素后发现,每周进行3次30 min预计最大心率60%至80%强度范围的有氧运动,并持续4周以上,可显著增强心脏迷走神经张力;Zoppini等以2型糖尿病患者为研究对象,通过对心率变异性的动态监测发现有氧运动可降低LF/HF的比值,提示有氧运动可改善糖尿病患者心脏交感-迷走平衡,降低交感或增强迷走神经张力。Howorka等[20]的研究发现,对于合并早期心脏自主神经病变的糖尿病患者,3个月的运动训练可提高心率变异性并显著改善自主神经功能;然而,对于合并严重的心脏自主神经病变患者,运动训练对心率变异性影响相对较小。但是,上述研究多集中于有氧运动对自主神经功能性研究,其涉及的解剖以及分子学机制尚不明确。在本研究中,我们重点探讨有氧运动对心肌交感及迷走神经密度、支配的影响,以期提供最直接的解剖学证据。本研究结果发现,与单纯糖尿病组相比,有氧运动组大鼠心肌中ChAT和TH阳性神经纤维及其mRNA水平均明显增加,提示有氧运动可减缓或改善高糖状态对心肌交感-迷走神经的损伤;更重要的是,降低迷走神经过度损伤,进而升高迷走/交感神经支配比例,并显著降低LF/ HF,提示有氧运动不仅可以相对增加迷走神经数量,也同样上调迷走神经张力,逆转并改善糖尿病对心脏自主神经结构及功能的损害。因此,我们认为,有氧运动可降低持续高血糖状态对大鼠心肌中交感、迷走神经的不均衡损伤,改善自主神经失支配状态,并相对增加迷走神经支配比例,这也可能是有氧运动降低交感神经张力、增强迷走神经张力的可能机制之一。
但有氧运动如何发挥对自主神经的保护作用?其可能解释如下:第一,有氧运动可增加胰岛素敏感性,显著降低糖尿病患者血糖水平[6],降低高糖对心脏自主神经纤维产生的直接损伤,发挥神经保护作用。 第二,有氧运动通过上调延髓头端腹外侧区CuZn超氧化物歧化酶,抑制NAD(P)H氧化酶亚基gp91phox蛋白表达,发挥中枢性抗氧化应激作用,从而避免机体过度氧化应激对心脏自主神经纤维的持续损伤。我们的研究从解剖角度证实有氧运动对DCAN的逆转作用及改善心脏交感-迷走支配失衡的可能机制,为DCAN的预防及治疗提供新的思路及理论依据。
4 结论
本研究证实有氧运动可降低持续高血糖状态对大鼠心脏交感、迷走神经的损伤,增加迷走神经支配比例,恢复迷走神经与交感神经的平衡状态,改善DCAN所导致的心脏自主神经失衡,促进心脏电生理的稳定性。该结果提示在DCAN和由其继发的室性心律失常治疗方面,有氧运动可能成为一种潜在的有效预防及治疗措施。
参考文献:
[1]Pappachan, J.M., et al.Cardiac autonomic neuropathy in diabetes mellitus: prevalence, risk factors and utility of corrected QT interval in the ECG for its diagnosis[J].Postgrad Med J,2008,84(990):205-210.
[2]Pop-Busui, R., et al.Cardiovascular Autonomic Neuropathy and Cardiovascular Outcomes in the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study. Diabetes Care,2017,40(1):94-100.
[3]Siscovick, D.S., et al.Type 2 diabetes mellitus and the risk of sudden cardiac arrest in the community[J].Rev Endocr Metab Disord,2010,11(1):53-59.
[4]Pop-Busui, R.Cardiac autonomic neuropathy in diabetes: a clinical perspective[J].Diabetes Care,2010,33(2):434-441.
[5]Xuan, Y.L., et al.In rats the duration of diabetes influences its impact on cardiac autonomic innervations and electrophysiology[J].Auton Neurosci,2015(189):31-36.
[6]Colberg, S.R., et al.Exercise and type 2 diabetes: the American College of Sports Medicine and the American Diabetes Association: joint position statement executive summary[J].Diabetes Care,2010,33(12):2692-2696.
[7]Zilliox, L.A. and J.W. Russell.Physical activity and dietary interventions in diabetic neuropathy: a systematic review. Clin Auton Res,2019,29(4):443-455.
[8]Balducci, S., et al.Exercise training can modify the natural history of diabetic peripheral neuropathy[J].J Diabetes Complications,2006,20(4):216-223.
[9]Pagkalos, M., et al.Heart rate variability modifications following exercise training in type 2 diabetic patients with definite cardiac autonomic neuropathy[J].Br J Sports Med,2008,42(1):47-54.
[10]Schmid, H., et al.Heterogeneous cardiac sympathetic denervation and decreased myocardial nerve growth factor in streptozotocin-induced diabetic rats: implications for cardiac sympathetic dysinnervation complicating diabetes[J].Diabetes,1999,48(3):603-608.
[11]Kemi, O.J., et al.Moderate vs. high exercise intensity: differential effects on aerobic fitness, cardiomyocyte contractility, and endothelial function[J].Cardiovasc Res, 2005,67(1):161-72.
[12]Sgoifo, A., et al.Electrode positioning for reliable telemetry ECG recordings during social stress in unrestrained rats[J].Physiol Behav,1996,60(6):1397-1401.
[13]Herring, N., M. Kalla, and D.J. Paterson.The autonomic nervous system and cardiac arrhythmias: current concepts and emerging therapies[J].Nat Rev Cardiol,2019,16(12):707-726.
[14]Schneider, R., et al.Cardiovascular autonomic neuropathy in spontaneously diabetic rats with and without application of EGb 761[J].Histol Histopathol,2010,25(12):1581-1590.
[15]Wang, Y., et al.Risk of ventricular arrhythmias after myocardial infarction with diabetes associated with sympathetic neural remodeling in rabbits[J].Cardiology,2012,121(1):1-9.
[16]Stein, P.K., et al.Heart rate variability: a measure of cardiac autonomic tone[J].Am Heart J,1994,127(5):1376-1381.
[17]Vinik, A.I. and D. Ziegler.Diabetic cardiovascular autonomic neuropathy[J].Circulation,2007,115(3):387-397.
[18]Hautala, A.J., et al.Cardiovascular autonomic function correlates with the response to aerobic training in healthy sedentary subjects[J].Am J Physiol Heart Circ Physiol,2003,285(4):H1747-1752.
[19]Zoppini,G.,et al.Effect of moderate aerobic exercise on sympatho-vagal balance in Type 2 diabetic patients[J].Diabet Med,2007,24(4):370-376.
[20]Howorka, K., et al.Effects of physical training on heart rate variability in diabetic patients with various degrees of cardiovascular autonomic neuropathy[J].Cardiovasc Res,1997,34(1):206-214.
[21]Gao, L.,et al.Exercise training normalizes sympathetic outflow by central antioxidant mechanisms in rabbits with pacing-induced chronic heart failure[J].Circulation, 2007,115(24):3095-3102.

