主动脉左右冠窦小叶间三角起源特发性室性心律失常的心电图特征和射频消融疗效研究
李霞玲 ,郭馨竹,梁卓,张涛,吴永全,任学军,王云龙
主动脉根部是特发性室性心律失常(VAs)的重要起源部位,其在流出道特发性VAs中占比高达17%[1]。虽然既往有一些研究报道了主动脉根部起源VAs的电生理特点[1-6],但是关于主动脉左冠窦(LCC)与右冠窦(RCC)小叶间三角(ILT)起源VAs电生理特征的研究甚少[7]。本研究观察分析了一组RCC、LCC之间ILT起源VAs,重点探讨其心电图特征、电生理特点和射频消融治疗的有效性及安全性。
1 资料与方法
1.1 研究对象2016年1月至2019年1月连续就诊于首都医科大学附属北京安贞医院心内科的231例接受射频消融的特发性VAs患者中,经心内电生理检查明确诊断为RCC、LCC之间ILT来源VAs 28例,其中,男性17例,女性11例。年龄28~63岁,平均年龄(43.7±11.2)岁。28例患者均有VAs相关症状,症状持续时间(19.6±6.5)个月。所有患者接受射频消融治疗前均使用过至少一种抗心律失常药物,且药物治疗难以控制VAs。消融术前所有患者停用抗心律失常药物5个半衰期以上,签署知情同意书后接受电生理检查及射频消融治疗。
1.2 电生理检查、标测和消融本研究应用Bard电生理记录系统记录患者窦性心律及VAs时的心电图,走屏速度为100 mm/s,测量并分析VAs时12导联的QRS波形态;Ⅰ、Ⅱ、Ⅲ、aVF、V1导联的R波振幅;aVL、aVR导联Q波振幅;V1导联S波振幅;V1导联R、S波振幅比;V2导联S波与V3导联R波振幅比;V5、V6导联有无S波;Ⅱ导联QRS波时程;胸前导联最大偏转指数(MDI,IDT/QRS时限的比值)和R波类本位曲折偏移时间(IDT,V2导联R波起始点至R波顶峰的时限),观察胸前导联R/S移行比。
术前确保准确放置心电图电极片,所有患者均在局部麻醉下首先穿刺右股静脉,采用压力导管在三维系统(CARTO,BiosenseWebster,Dia-mondBar,CA,USA)下标测右室流出道(RVOT),采用激动顺序标测为主起搏标测为辅的方法进行消融靶点的确认,以最早激动点为消融靶点,消融靶点表现为提前体表QRS波的最早双极激动(较体表心电图QRS波提前≥20 ms)和/或局部单极心电图呈QS型。起搏标测起搏周长为500 ms,刺激电流选择能够夺获局部心肌的最低电流(5~20 mV),满意的起搏心电图应与临床PVCs/VT心电图相似度≥11/12。若患者术中无或极少有自发VAs,则采用早搏和Burst快速短阵刺激诱发心律失常,必要时静脉滴注异丙肾上腺素后重复刺激。如RVOT标测找不到合适靶点或消融效果不佳,则改行主动脉逆行途径行主动脉根部标测,必要时于GCV或AIV处行心外膜标测。所有患者在主动脉根部消融前行主动脉根部造影或冠状动脉造影,在造影影像下通过左前斜及右前斜测量消融靶点与左右冠状动脉开口的距离。消融预设为温控模式43℃,消融功率30~35 W,盐水灌注模式,灌注速度为17 ml/min。有效消融靶点应在放电10 s内临床VAs消失或放电过程中出现与自身VAs形态相同的室性期前收缩(PVC)或短阵室速(VT),停止消融后很快消失。继续巩固放电60~180 s。如放电10~15 s后PVC未消失或VT不能终止,则重新标测靶点。介入操作过程中肝素首次静脉注射2000~3000 U,以后每小时补充1000 U。
1.3 随访方法射频消融术后常规心电监护至少24 h,所有患者术后停用抗心律失常药物,术后1个月及术后3个月复查超声心动图及24 h动态心电图。
1.4 消融成功标准即刻成功标准:放电后即刻和观察30 min后程序刺激及异丙肾上腺素均不能诱发与临床VAs相同的PVC/VT。远期成功标准:术后患者停用抗心律失常药物,无VAs相关的症状,且术后3个月内24 h动态心电图示VAs消失或VAs负荷较前减少90%以上。
1.5 统计学方法使用SPSS 19.0统计软件包进行统计分析,计量资料以平均值±标准差()表示,两组间均数的比较采用独立样本t检验;计数变量以例数(构成比)表示,组间比较采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征及心电图特征共入选28例患者,其中5例表现为非持续性室性心动过速(NVT)合并室性期前收缩(PVC),23例单纯表现为PVC,所有PVC患者平均室性期前收缩负荷为(14877.2±3539.1)次/24 h,所有患者均无明显心脏结构和功能异常,窦性心律下体表心电图完全正常。RCC、LCC间ILT起源心电图Ⅱ,Ⅲ、aVF导联QRS波呈高大直立的R波;Ⅱ,Ⅲ、aVF 导联R波振幅分别为(2.09±0.3)、(2.12±0.4)和(2.13±0.3)mV。QRS波时限为(155.33±19.64)ms。aVR和aVL导联呈QS形态,且aVL/aVR导联的Q波振幅比为0.84±0.24。Ⅰ导联最具特征性,其形态低平,QRS波主波常向上,多呈rsr'、Rsr'、rsR'型,振幅为(0.41±0.26)mV,78%(22/28)患者Ⅰ导联呈多相M型。68%(19/28)患者V1导联为类左束支阻滞(LBBB)图形,V1导联多呈rS型,V1导联中R/S为0.48±0.34,所有患者胸前导联正负移行早于V3,通常移行在V1或V1~V2导联之间,26例(93%)患者SV2/RV3<1.5,25例(86%)患者V5、V6导联无S波。SV2/RV3指数为0.68±0.76,IDT为(64±15.96)ms,MDI为0.41±0.08(表1,图1)。
2.2 右室流出道标测及消融所有患者均行RVOT标测,在RVOT标测最早激动点(EAS)均位于中后间隔,领先体表QRS波起始(26±15.83)ms,19例(68%)患者局部电位表现为双电位,RVOT间隔区域的激动标测示激动自中间隔向上、下传导。20例患者在RVOT进行了起搏标测,其中14例在RVOT的EAS起搏心电图与自发VAs心电图不一致。6例患者在肺动脉左窦标测到EAS,提前体表QRS起始(44.5±5.97)ms,起搏标测与自发VAs心电图图形一致(≥11个导联),该6例患者在EAS处进行了放电消融,4例呈一过性有效,自发VAs均在放电10 s内消失,但均在(6±2)min内恢复。这4例患者在该部位反复放电均不能获得完全的成功,遂改行主动脉根部标测及消融(图2,图3)。

表1 临床室性心律失常体表心电图数据分析

图1 RCC、LCC间ILT起源VAs体表12导联心电图
2.3 主动脉根部标测及消融28例患者中,27例经主动脉逆行途径行主动脉根部标测及消融,1例患者因双侧髂动脉狭窄,血管入路困难,行房间隔穿刺经房间隔行主动脉根部标测及消融。经主动脉根部造影、三维电解剖标测证实,RCC、LCC间ILT起源的VAs患者中21例(75%)成功消融靶点位于ILT的上部,7例(25%)成功靶点位于ILT中下部,平均放电(5.3±2.44)次,RCC、LCC间ILT内成功消融靶点领先体表QRS波起始(38.5±15.7)ms,Carto系统测量RCC、LCC间ILT内成功消融靶点距离RVOT处EAS仅(13.9±2.3)mm(图4)。

图2 RVOT激动标测图

图3 RVOT处EAS及RVOT起搏标测图

图4 RCC、LCC间ILT临近三维电解剖图
所有患者行主动脉瓣下标测前先行主动脉窦标测,术中通过综合应用三维电解剖标测、X线透视下主动脉根部和冠状动脉造影来准确定位消融靶点在主动脉根部的位置。7例患者于RCC处标测到满意EAS,提前体表QRS波起始(29.3±6.24)ms,局部双极电位呈双电位,其中5例患者RCC EAS处可标测到提前的收缩期前电位,于RCC内EAS处起搏均不能获得满意图形,于RCC处行放电消融,6例患者呈一过性有效,后VAs恢复,此6例于主动脉瓣下行LVOT标测无满意EAS,后此6例中4例经心大静脉(GCV)行心外膜标测,在GCV远端行激动标测,心外膜EAS提前体表RQS起始(38.5±3.43)ms,双极电位呈双电位,在电解剖三维图像可见远端GCV与主动脉根部相邻,再次仔细行主动脉瓣下标测,未标测到满意电位,此4例患者于RCC、LCC间ILT顶部行解剖消融,放电10 s内VAs消失,消融成功(图5)。
与RVOT的EAS相比,RCC、LCC间ILT内成功消融靶点领先QRS波起始程度明显增加[(26±15.83)vs.(38.5±15.7)]ms,且二者所记录到的局部电位明显不同,9例(32%)患者RVOT处EAS局部双极电位呈单电位,其前无收缩期前电位,而RCC、LCC间ILT内100%(28/28)成功消融靶点局部双极电位呈双电位或复合电位,17例(60.7%)成功消融靶点处可见非常提前的收缩期前电位,放电前26例患者在RCC、LCC间ILT的EAS处进行起搏标测,3例起搏一致,23例未获得良好的起搏图形。在X线透视下,左右前斜消融靶点均位于左右冠状动脉开口的下方,距离左右冠状动脉开口距离大于2 cm以上。28例患者成功消融靶点消融反应良好,64%患者放电5 s内自发VAs消失;27例经逆行主动脉途径消融的病例中,使用压力导管于瓣下U形弯曲即可达到稳定贴靠,成功消融(图6~9)。

图5 RCC、LCC间ILT解剖位置

图6 RCC、LCC间ILT起源VAs无效靶点、一过性有效靶点及成功靶点图
2.4 RCC、LCC间ILT心内电图分析28例成功消融靶点处的局部电位可见2种电位,一种为高频的近场电位P1,另一种为远场的心室电位P2。窦性心律时,23例患者在RCC、LCC间ILT靶点处均可见P1、P2电位,其余少部分病例P2电位融于心室波中。所有28例患者在RCC、LCC间ILT靶点处均记录到明显P1电位,成功消融靶点处的P1电位平均领先QRS波起始(29±12.3)ms。在60.7%的成功消融靶点P1电位前可见非常提前振幅较低的收缩期前电位(图6,图8)。

图7 RVOT及GCV处EAS电位

图8 主动脉根部各部分标测电位
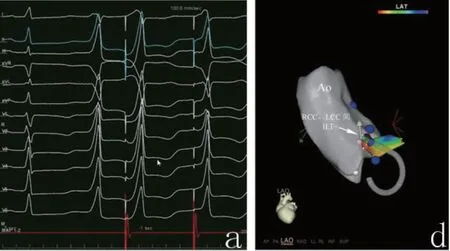
图9 RCC、LCC间ILT 处EAS 起搏标测图
2.5 消融疗效及随访结果28例患者均消融成功(成功率为100%),所有患者均无卒中、心包填塞、冠状动脉损伤、急性心肌梗死或心脏瓣膜损伤等。术后定期随访,所有患者均停用抗心律失常药物且无VAs复发。
3 讨论
主动脉根部由主动脉瓣小叶组成,主动脉瓣小叶由主动脉窦支撑,小叶间三角(ILT)就位于相邻主动脉瓣小叶基底部之间,是相邻冠状动脉窦窦底与心室壁共同组成的三角形区域[8]。本研究对RCC、LCC间ILT解剖位置的定义是结合三维电解剖图像、主动脉根部造影完成的。本文通过对RCC、LCC间ILT起源VAs的心电图及电生理特征研究发现:①RCC、LCC间ILT可成为VAs起源点,此处起源VAs多数激动顺序标测早,起搏标测不满意,消融反应良好;②成功消融靶点部位多位于ILT顶部,少部分位于ILT中底部;③RCC、LCC间ILT起源VAs I导联多呈多相“M”型,胸导R/S移行均早于V3导联;④非常提前振幅较低的收缩期前电位可能是RCC、LCC间ILT起源VAs成功消融的预测因素;⑤手术使用压力导管于瓣下U形弯曲即可达到稳定贴靠,成功消融。
本文首次报道起源于RCC、LCC间ILT的VAs,此处起源的VAs并不少见,本文统计该种室早约占所有起源室早的12%(28/231)。RCC、LCC间ILT起源VAs心电图下壁导联Ⅱ、Ⅲ、aVF主波均向上,呈高振幅的R波形态,aVR和aVL导联呈QS形态;由于VAs起源于RCC与LCC之间,其整体除极向量仍指向左下,I导联QRS波主波常向上,其中多数患者I导联呈多相M型,为其最具特征性的表现,这与之前Bala等[3]所得出的研究结果一致;所有患者胸前导联移行均早于V3导联,通常移行在V1或V1~V2导联之间。
考虑到复杂的解剖关系,于RCC、LCC间ILT消融成功VAs的真正起源尚不完全清楚,本研究共28例患者,其中21例在ILT顶部消融成功,另7例在ILT中下部消融成功;RCC、LCC间ILT自身属于主动脉根部,由纤维组织组成,其基底部与左心室顶部重合。我们认为,在RCC、LCC间ILT成功消融VAs可能的机制有两个:①RCC、LCC间ILT前部解剖证实有心室肌纤维的插入,可成为VAs的起源。Hasdemir等[9]报道,多数心室心肌延伸与流出道的心室肌连续,且心室心肌延伸入肺动脉和主动脉之间,并超出了心室-动脉交界水平;Gami等[10]对603例人体心脏标本进行解剖研究,发现57%标本的心室肌延伸至主动脉瓣以上水平,故RCC、LCC间ILT前部解剖证实存在心室肌的插入,其可以成为VAs的起源。②RCC、LCC间ILT消融成功的VAs可能起源于周围临近解剖结构。RCC、LCC间ILT处于心脏的中心位置,临近解剖结构繁多复杂,其前部紧邻RVOT后部,中下部与左心室顶部重合,临近AIV。研究报道,LCC瓣下心室肌可能存在斜行延伸,于靶点处消融成功的VAs,其起源不一定位于LCC瓣下,也可能在相邻区域如LCC瓣上、RCC或RVOT[11-13],该观点在本研究中同样适用。本研究部分患者于RVOT间隔部、RCC处可标测到满意EAS,消融一过性有效,后均于RCC、LCC间ILT处消融成功,以上均提示,位于RCC、LCC间ILT的成功消融靶点处可能并非VAs真正起源,真正起源可能位于RCC、或RVOT。另有部分患者在GCV远端可标测到较满意EAS,但既往研究表明,GCV、AIV附近心外膜起源VAs Ⅰ导联主波多呈负向[14],与本研究中I导主波正向不符,且本研究中QRS波时限并无明显延长,提示本文VAs起源心外膜可能性较小。本研究中所有成功消融靶点消融反应良好,64%患者成功消融靶点放电5 s内VAs消失,可能与消融靶点中下部与左室顶部相接,此处心肌较其他部位更为菲薄相关。本研究中关于起搏标测,主动脉根部解剖及毗邻结构复杂,不同输出可能夺获起搏部位附近不同心肌,从而产生不同的QRS波形态,因此使用起搏标测来判定主动脉根部VAs靶点时,应持谨慎态度[15];起搏标测稳定夺获困难及VAs真正起源点的不同可能是本研究中多数成功消融靶点起搏标测不满意的主要原因。既往文献报道,主动脉窦起源VAs成功消融靶点可记录到P1及P2电位,P1电位领先QRS起始≥50 ms提示消融可能成功[3,16]。本研究中大部分病例在RCC、LCC间ILT处可见明显延迟出现的P2电位,其余部分P2电位融于心室波中。所有28例患者在RCC、LCC间ILT成功消融靶点均记录到明显P1电位,但无效消融靶点及一过性有效消融靶点中也可记录到P1电位,二者P1电位记录率无明显差别,因此记录到P1及P2电位无法帮助判断消融点能否成功,但本研究中多数成功消融靶点存在特殊电位,60.7%成功消融靶点P1电位前可见非常提前振幅较低的收缩期前电位,该电位在部分患者RCC处也可记录到,该电位可能是成功消融靶点的预测因素。本研究中仅1例患者因双侧髂动脉狭窄,血管入路受限,后经房间隔穿刺途径消融成功,余27例患者均经逆行主动脉入路,本研究中所有患者均应用压力导管,在主动脉瓣下使用U形导管形态以达到稳定贴靠,成功消融。本研究中我们使用两种方法来使导管呈U形并在ILT处进行稳定贴靠,第一种使用普通逆行法跨主动脉瓣,进入左室后回撤即可到达;第二种是消融导管直接进入心室,行左室建模,在LAO及RAO三维视图下使消融导管到达左室心腔中部,送入导管同时弯曲导管即可到达。在三维电解剖图像上可观察到导管头端明显高于RCC及LCC窦底,导管压力辅助判断导管是否稳定贴靠,同时使用主动脉根部造影或消融导管造影来明确导管处于主动脉瓣下位置,所有患者均于RCC、LCC间ILT消融成功。
本研究解剖部位确定主要依赖于X射线及三维电解剖标测结果,未使用心腔内超声精确定位RCC、LCC间ILT具体消融靶点,故在解剖定位上存在一定局限性。本研究为观察性研究,入选样本量少,结论仍需更大规模临床数据支持。

