血管紧张素Ⅱ对血管平滑肌细胞迁移的影响及分子机制
帅 维 张 伟 范致星
(武汉大学 人民医院 心血管内科, 湖北 武汉 430061)
动脉粥样硬化等阻塞性血管疾病的发生发展与血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的迁移密切相关[1]。现有研究表明,VSMCs的迁移水平受细胞内外多种生物学信号的调节,其中炎症通路的激活发挥了至关重要的作用[2]。血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)是肾素-血管紧张素系统中最重要的炎症递质,可以诱导动脉粥样硬化斑块中多种炎症因子的表达[3,4]。Ang Ⅱ作为一种化学诱导物[5],可通过结合AngⅡ-1型受体(Ang Ⅱ-type 1 receptor,AT1R),激活细胞内的信号转导通路(如MAPK、JNK、NF-κB),诱导免疫和炎症反应,进而刺激VSMCs迁移[6]。但由于AT1R下游分子信号复杂,涉及多种调控通路,Ang Ⅱ促VSMCs迁移的具体分子机制仍未完全阐明。磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Akt)是参与动脉粥样硬化发生发展的重要信号通路,在调控VSMCs功能状态中发挥重要作用[7]。PI3K/Akt通路同时受到了多种上游信号分子的调控,研究表明AT1R与PI3K/Akt通路亦有交互效应[8,9]。因此,本实验将通过体外培养大鼠胸主动脉VSMCs,以探讨AT1R依赖的PI3K/Akt通路激活是否参与了AngⅡ介导的VSMCs迁移。
1 材料与方法
1.1 主要试剂
重组人Ang Ⅱ(Sigma公司);脂质体2000转染试剂(Invitrogen公司);PI3K抑制剂(LY294002,Calbiochem公司);Akt抗体和磷酸化Akt抗体(Cell Signaling 公司);Control siRNA、AT1R siRNA、AT1R抗体、PI3K抗体和GAPDH 抗体(Santa Cruz公司)。
1.2 VSMCs的培养、鉴定
取雄性SD大鼠(约150 g)的胸主动脉,分离培养原代VSMCs。DMEM培养基中加入青霉素(100 U/mL)和链霉素(100 μg/mL),于37℃的5%CO2培养箱中培养,取3~5代VSMCs用于后续研究。根据细胞形态学及特异抗体SM-α-Actin对VSMCs进行鉴定。
1.3 细胞活性测定
采用不同浓度的Ang Ⅱ(0.1~1000 ng/mL)刺激VSMCs,然后用0.4%台盼蓝染液处理Ang Ⅱ刺激后的VSMCs,5 min后光镜下观察细胞染色情况。未染色细胞占总细胞数的比例即细胞活性,用于评估Ang Ⅱ对于VSMCs的细胞毒性。
1.4 细胞迁移实验
Transwell小室的上室接种胰酶消化后的VSMCs(密度约5×104/孔);下室加入含0.1~1 000 ng/mL浓度梯度的Ang Ⅱ,37℃的5% CO2培养箱中孵育12 h。取出滤膜,甲醇固定并苏木素染色,光镜下观察迁移到滤膜下室面的VSMCs并计数。
1.5 实验分组
分为Control对照组、AT1R siRNA转染组、Control siRNA转染组和PI3K抑制剂(LY294002)干预组。运用Lipofectamine 2000将等量的AT1R siRNA或Control siRNA转染至VSMCs,48 h后RT-PCR与Western blot检测AT1R的表达情况。
1.6 RT-PCR检测AT1R基因的表达
Trizol法抽提总RNA,并逆转录成cDNA。RT-PCR由ABI Prism7500完成,RT-PCR 反应条件为95℃ 10 s,60℃ 10 s,75℃ 20 s;共40个循环,使用2-ΔΔCt方法进行结果分析。实验中所用引物序列如下:
AT1R:上游5′-AAGGGCTACCAGAGCGATCA-3′,下游5′-GGTATTGCCAGGTGCACAAA-3′;
GAPDH:上游5′-GACAACTTTGGCTCGTGGA-3′,下游5′-ATGCAGGGGTTCTGG-3′。
1.7 Western blot检测相关蛋白的表达
PBS洗涤细胞后,提取细胞蛋白,凝胶电泳后将蛋白转移至硝酸纤维素膜。5%脱脂奶粉封闭后,加入AT1R、磷酸Akt(Ser-473)、Akt及GAPDH的一抗4℃孵育过夜,漂洗后加入辣根过氧化物酶标记的二抗进行孵育。采用ECL化学发光检测试剂盒进行显影,并采集图像。
1.8 PI3K的活性测定
100 ng/mL的Ang Ⅱ处理AT1R siRNA和Control siRNA转染后的VSMCs, 6 h后裂解VSMCs并测定PI3K活性[10]。在各组样本(500 μg)中加入PI3K抗体4℃孵育过夜。将获得的免疫复合物采用蛋白琼脂糖小体处理2 h,离心后收集样本。采用竞争性ELISA试剂盒检测PI3K的活性。
1.9 统计学分析
采用SPSS 22.0软件包进行数据分析,计量资料以均数±标准差表示。组间比较采用单因素方差分析,各组间的两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Ang Ⅱ对VSMCs迁移的影响
显微镜下观察到VSMCs呈典型的“峰谷”样生长。SM-a-Actin免疫染色证实细胞纯度大约为90%。细胞活性证实,0.1~1000 ng/mL的Ang Ⅱ未对VSMCs造成细胞毒性(见图1A)。Ang Ⅱ可明显促进VSMCs迁移(均P<0.05),且VSMCs迁移效应在Ang Ⅱ浓度为100 ng/mL时达到最大(见图1B)。
2.2 AT1R在Ang Ⅱ介导VSMCs迁移中的作用
为探讨AT1R在Ang Ⅱ介导VSMCs迁移中的作用,本实验首先用AT1R siRNA转染VSMCs 48 h,然后用Ang Ⅱ(100 ng/mL)刺激12 h。检测发现,AT1R siRNA组中的AT1R表达水平显著下降(P<0.05,见图2A),Ang Ⅱ诱导的VSMCs迁移也明显受抑(见图2B)。
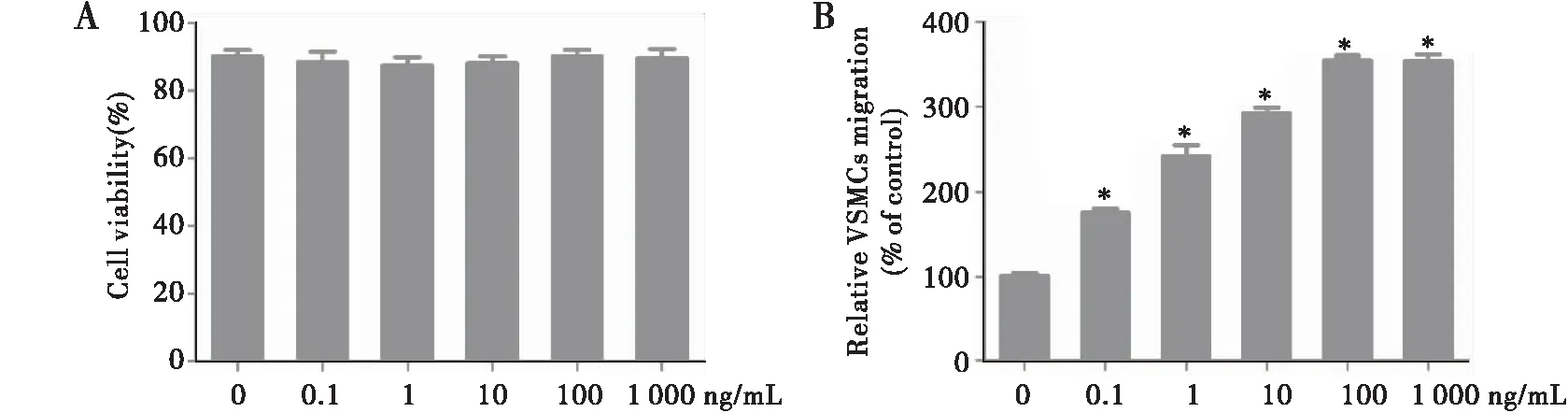
注:A:细胞活性实验检测0.1~1000 ng/mL的Ang Ⅱ对VSMCs的细胞毒性作用;B:Transwell小室法检测0.1~1 000 ng/mL的Ang Ⅱ对VSMCs迁移的影响;与对照组相比,*P<0.05图1 Ang Ⅱ对VSMCs迁移的影响

注:A:Control siRNA和AT1R siRNA转染VSMCs 48 h后,RT-PCR和Western blot检测AT1R的mRNA及蛋白表达水平,与Control siRNA转染组相比,*P<0.05;B:Control siRNA或AT1R siRNA转染VSMCs后, 100 ng/mL Ang Ⅱ刺激12 h后所测得的VSMCs迁移活性。与Control组相比,*P<0.05;与AngⅡ+ Control siRNA转染组相比,#P<0.05图2 AT1R在AngⅡ介导VSMCs迁移中的作用
2.3 PI3K/Akt信号通路在AngⅡ介导VSMCs迁移中的作用
VSMCs经100 ng/mL的 AngⅡ处理后,PI3K活性和Akt(Ser-473)磷酸化水平均显著增加(均P<0.05)。但Ang Ⅱ刺激AT1R siRNA预先处理的VSMCs,PI3K/Akt信号通路却被明显抑制(P<0.05,见图3)。上述结果提示,Ang Ⅱ可能依赖AT1R激活PI3K/Akt信号通路而介导VSMCs迁移。
2.4 PI3K在AngⅡ介导Akt 激活和VSMCs迁移中的作用
上述结果已表明PI3K与VSMCs的迁移有关。为进一步验证PI3K参与了AngⅡ介导的Akt激活和VSMCs迁移,我们用Ang Ⅱ刺激经PI3K抑制剂LY294002(10 μM)预处理后的VSMCs。结果表明,LY294002预处理能抑制Akt磷酸化活化(P<0.05,图4A),同时能明显拮抗VSMCs迁移(P<0.05,图4B)。上述结果进一步证实,PI3K在AngⅡ介导的Akt活化和VSMCs迁移中发挥重要作用。

注: A:PI3K的活性测定;B:总Akt及磷酸化Akt(Ser-473)的表达水平。与Control组相比,*P<0.05;与An gⅡ+ Control siRNA转染组相比,#P<0.05图3 AngⅡ通过AT1R激活PI3K/Akt途径介导VSMCs迁移
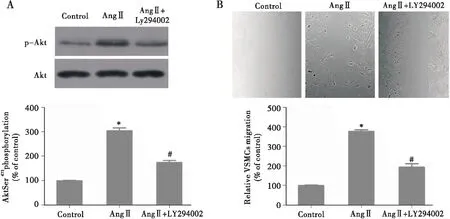
注:A:LY294002对Akt(Ser-473) 磷酸化水平的影响;B:LY294002对Ang Ⅱ介导VSMCs迁移的影响。与Control组相比,*P<0.05;与Ang Ⅱ组相比,#P<0.05图4 LY294002抑制Ang Ⅱ介导的Akt磷酸化和VSMCs迁移
3 讨论
动脉粥样硬化等阻塞性血管疾病涉及多种细胞、多种因子的参与,其中VSMCs的迁移是该类疾病发生的病理基础。VSMCs的病理性活化促进动脉粥样硬化斑块的进展和最终斑块的破裂。研究发现,动脉粥样硬化等阻塞性血管疾病患者体内Ang Ⅱ的水平明显升高,而Ang Ⅱ的上升,一方面能够通过促进血管内皮细胞的损伤,增加内皮下胶原成分的暴露,促进粥样斑块的形成;另一方面,Ang Ⅱ还能通过激活其受体AT1R介导的炎症反应来促进VSMCs的迁移,加速粥样斑块的形成[11,12]。
既往研究表明,抑制目前已证实的炎症相关信号通路并不能完全有效地抑制Ang Ⅱ介导的VSMCs迁移,提示有更多未阐明的分子通路参与了此过程[13]。因此,有必要更加深入探究Ang Ⅱ介导VSMCs迁移的分子机制。PI3K/Akt信号通路作为一种经典的信号通路参与了多种病理生理过程,在细胞迁移、增殖等过程中发挥了重要作用,已有研究证实其与动脉粥样硬化疾病密切相关[10]。Akt作为PI3K下游信号分子,可被PI3K磷酸化,磷酸化的Akt又可介导VSMCs迁移[14],同样有研究发现PI3K/Akt也是AT1R下游信号通路[8,9]。鉴于已有研究,我们推测:Ang Ⅱ与AT1R结合后可通过激活PI3K/Akt介导VSMCs迁移。本研究结果表明,VSMCs在Ang Ⅱ处理后迁移能力显著增加,而AT1R siRNA可显著抑制该效应,这与已有的结果一致,证实AT1R参与了这一过程。与此同时,我们还发现AT1R siRNA处理后,VSMCs的PI3K活性和Akt磷酸化亦被明显抑制。而且,LY294002抑制PI3K后,VSMCs迁移能力及Akt的磷酸化均可被抑制。因此,Ang Ⅱ可通过激活AT1R/PI3K/Akt信号通路介导VSMCs迁移。
然而,从已有的结果中我们还可以发现,Ang Ⅱ介导的VSMCs迁移并不会因沉默AT1R或是抑制PI3K的表达而完全被抑制。由此,我们推测Ang Ⅱ介导的VSMCs迁移机制复杂,可能有多种的受体及信号通路参与其中,需要进一步研究证实。
综上所述,本研究发现Ang Ⅱ介导的VSMCs迁移与AT1R/PI3K/Akt信号通路的激活密切相关。相关研究结果进一步揭示了Ang Ⅱ介导VSMCs 迁移的分子机制,也为阻塞性血管疾病的治疗提供了新靶点和新思路。

