56例肾淀粉样变性的病理分型及临床分析
覃乔静 常凯利 赵仲华刘学光,3△
(1复旦大学附属上海市第五人民医院肾内科 上海200240;2复旦大学基础医学院病理学系 上海200032;3上海市肾脏疾病与血液净化重点实验室 上海200032;4复旦大学社区健康研究中心(筹) 上海200240)
淀粉样变性是蛋白经异常折叠后形成β-片层构型的淀粉样物并发生异常沉积的一类代谢性疾病,肾脏是最常受累器官[1-2]。肾淀粉样变性多见于中老年人,主要临床表现为蛋白尿或肾病综合征,最终进展为终末期肾病。随着经济发展以及人口老龄化,慢性肾脏病的发病率及死亡率呈逐年升高的趋势[4],我国肾淀粉样变性发病率已从0.56%升高至1.5%~2%[5]。
根据发生异常折叠的蛋白即前体蛋白的类型不同[1-3],淀粉样变性被分为不同病理分型,常见者包括AL型、AA型、遗传性淀粉样变性等。目前随着基因诊断技术、蛋白质组学及质谱分析技术的发展及应用,已发现近36种前体蛋白[6],因此淀粉变性的病理分型表现为复杂性及多样化。肾淀粉样变性的病理分型与临床治疗方案及判断预后密切相关[1-3,5],因此早期确诊及明确病理分型尤为重要。我们收集了复旦大学基础医学院病理学系自2007年1月至2016年7月期间56例肾淀粉样变性,对其病理形态学特点、病理分型及临床表现进行总结、分析,旨在提高临床正确诊断本病的能力、降低漏诊率及误诊率。
资料和方法
病例选择选取复旦大学基础医学院病理学系自2007年1月至2016年7月确诊为肾淀粉样变性的所有56例肾活检病例,进行回顾性分析。
病理学检查所有病例均行常规光镜观察,包括HE染色、PAS染色、PASM染色以 及Trichrome Masson染色;免疫荧光染色包括免疫球蛋白IgG、IgA、IgM,补体C1q、C3、C4及纤维蛋白原;刚果红染色、偏振光显微镜及透射电镜检查。对肾小球荧光染色结果按阴性(-)、弱阳性(1+)、阳性(2+)、较强阳性(3+)、强阳性(4+)进行半定量分析。刚果红染色切片5μm。
免疫染色对所有病例行免疫球蛋白轻链κ、λ及淀粉样蛋白A(amyloid A,AA)的免疫染色。由于在2012年12月之前送检病例均无冰冻组织,故对其石蜡切片经两步法SupervisionTM免疫组化检测系统进行免疫组化染色;对2013年起送检病例的冰冻组织行两步法免疫荧光染色。所用一抗包括兔抗人κ、λ多抗(1∶500,上海优宁维生物科技有限公司)、鼠抗人AA单抗(1∶400,美国DAKO公司)。
临床资料分析收集患者于肾活检时的临床资料,包括年龄、性别、症状、体征、实验室检查等,肾脏损害指标(包括尿常规、尿蛋白定量及肾功能改变)以及肾外器官受累情况,进行回顾性分析。
统计学方法计量资料用±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验,采用GraphPad Prism 5.0软件完成。P<0.05为差异有统计学意义。
结 果
一般资料本研究期间,除外移植肾、重复肾活检者,肾活检数总计3 494例,其中56例(1.6%)确诊为肾淀粉样变性。男性31例(55.4%),女性25例(44.6%),男/女比例约为1.2。患者平均年龄为(58.6±9.3)岁(39~78岁),其中38例(67.9%)为50~69岁。患者均无肾脏病家族史。
肾组织病理学特点HE染色显示,淀粉样物呈云雾状、均质样,弱嗜伊红性,可广泛沉积于肾小球、肾小管基底膜、间质及血管壁;肾小球系膜区扩大可呈结节样改变,基膜不规则增厚伴睫毛样突起形成。淀粉样物经PAS、PASM染色或Trichrome Masson染色呈弱阳性,刚果红染色呈砖红色,偏振光显微镜下呈苹果绿折光(图1)。
免疫荧光染色显示,免疫球蛋白及补体在肾小球内可有不同程度的沉积,表达强度多在2+及以下,呈细颗粒样分布于肾小球系膜区或沿毛细血管袢沉积,多数经电镜观察未发现典型的电子致密物沉积;仅1例临床伴有慢性淋巴细胞性白血病者,IgA及IgG分别于肾小球系膜区及沿毛细血管袢沉积,电镜观察分别于肾小球系膜区及上皮下区见颗粒性电子致密物沉积。电镜检查显示,淀粉样物呈纤维丝状,排列紊乱、僵硬、不分支,直径为8~12 nm,广泛沉积于肾小球系膜区和基底膜、肾小球球囊壁、肾小管基底膜、间质及血管壁等处(图1)。

图1 肾淀粉样变性的病理形态学Fig 1 Pathology of renal amyloidosis
病理诊断误诊情况分析4例肾组织形态改变轻微者,光镜诊断为肾小球轻微病变,刚果红染色阴性或可疑,经电镜检查发现在肾小球系膜区及基膜内有直径约10 nm的纤维丝沉积,最终确诊为肾淀粉样变性(图2)。
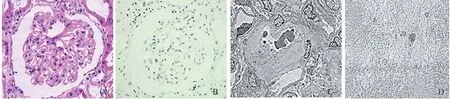
图2 早期肾淀粉样变性Fig 2 Early renal amyloidosis
病理分型免疫染色结果显示,56例肾淀粉样变性中,43例(76.8%)为AL型,其中36例仅λ阳性,7例仅κ阳 性,ALλ型 与κ型之比 约 为5.1;3例(5.4%)仅AA阳性,为AA型;其余10例均为阴性,列入无法分类型。在已明确病理分型的46例中,AL型占93.5%(43/46),AA型占6.5%(3/46)。
免疫阳性染色分布于肾小球、肾小管基底膜、间质或及血管壁等,与其刚果红染色阳性沉积部位一致。其中,12例(21.4%)仅见肾小球内沉积,包括8例ALλ型、2例ALκ型 和2例 无 法 分 类 型;11例(19.6%)仅见肾小球及血管壁沉积,包括9例ALλ型和2例无法分类型;33例(58.9%)见淀粉样物广泛沉积于肾小球内、肾小管基底膜、间质或血管壁,包括19例ALλ型、5例ALκ型、3例AA型及6例无法分类型(图3,表1)。
病理分型与免疫球蛋白、补体及纤维蛋白原的沉积免疫球蛋白及补体在各型肾淀粉样变性肾小球内均有不同程度的沉积,其中33例(58.9%)伴IgM沉积,19例(33.9%)伴C3沉积,16例(28.6%)分别伴IgA、C1q沉积。在43例AL型中,IgM、IgA、C3沉积率分别达62.8%、34.9%、30.2%。在3例AA型、10例无法分类型中,IgG、C3沉积率分别达66.7%、40%。
病理分型与临床表现患者表现为不同程度的蛋白尿,24 h尿蛋白定量1.48~11.5 g,其中AL型(5.08±2.40)g,AA型(4.32±1.32)g,无法分类型(4.77±2.02)g;42例(75.0%)诊断为肾病综合征。根据肾小球刚果红染色结果,将43例AL型分为轻度沉积组(1+~2+,18例)和重度沉积组(3+~4+,25例),轻度沉积组24 h尿蛋白定量为(3.45±1.64)g,重度沉积组为(5.75±2.80)g,两组差异具有统计学意义(P<0.05)。此外,10例(17.9%,包括9例AL型、1例无法分类型)伴镜下或肉眼血尿;8例(14.3%,均为AL型)伴肾功能不全;13例(23.2%,均为AL型)血或尿液检查发现异常升高的单克隆性蛋白;10例(17.9%,均为AL型)经活检证实胃肠道淀粉样变;7例(12.5%,包括6例AL型、1例无法分类型)影像学检查高度怀疑存在心脏淀粉样物沉积。
多数患者存在肾外器官病变。43例AL型患者中29例(67.4%)存在肾外病变,包括12例(27.9%)血液系统疾病,其中8例多发性骨髓瘤,2例浆细胞增生性疾病,1例慢性淋巴细胞性白血病,1例血小板增多症;其余病变包括1例(2.3%)伴甲状腺功能低下,2例(4.7%)伴限制性心肌病,1例(2.3%)伴慢性支气管炎,1例(2.3%)伴肺癌手术史,1例(2.3%)伴类风湿性关节炎,3例(7.0%)伴慢性乙型肝炎,3例(7.0%)伴糖尿病病史,5例(11.6%)伴高血压。3例AA型患者中,1例伴有糖尿病、高血压,2例伴有慢性血吸虫性肝病。10例无法分类型中,1例伴肥厚性心肌病,4例伴高血压,2例伴糖尿病,1例伴类风湿性关节炎,1例伴溃疡性结肠炎。
讨 论
我国肾淀粉样变性的发病率呈逐年上升趋势[5]。复旦大学基础医学院病理学系郭慕依对2006年以前近8 000例肾活检资料行统计发现,肾淀粉样变性检出率为0.58%[7];本研究进一步分析该系近10年资料,发现其检出率上升至1.6%。国外学者报道肾活检病例中肾淀粉样变性检出率为1.0%~1.5%,患者平均年龄多为60~70岁[8-9]。Jin等[10]对我国65岁以上肾病患者进行研究发现,5.99%确诊为肾淀粉样变性,占继发性肾小球疾病的16.88%。本研究对10年间确诊的56例肾淀粉变临床资料进行统计发现,患者平均年龄为58.6岁,男性略多于女性;75.0%表现为典型的肾病综合征;由于老年人的病理生理学特点,较多患者存在肾外病变,包括心血管系统疾病、糖尿病、肿瘤等,且17.9%存在2个或以上器官的淀粉样物质沉积,故临床表现较为复杂且缺乏特异性。因此,临床对肾淀粉样变性可能存在一定的漏诊或误诊,应及时行肾活检病理检查。最近我国肾脏疾病临床研究中心发布《系统性轻链型淀粉样变性诊断和治疗指南》,对临床表现为肾病综合征、体位性低血压、肾体积增大、左心室肥厚且伴不明原因N端脑钠肽前体(N-terminal B-type natriuretic peptide,NTproBNP)升高等的中老年患者,应注意淀粉样变性的可能[11]。
前体蛋白在发生构象改变形成β折叠的过程中,获得一致的形态学特点,包括对刚果红染料的亲和性,在偏振光显微镜下呈绿色双折射光性,以及电镜下纤细的纤维丝状结构,因此通过结合上述检查手段可显著提高淀粉样变性的确诊率[3,6]。本研究中有4例光镜检查呈肾小球病变轻微、刚果红染色呈阴性或可疑者,在电镜检查时发现少量淀粉样原纤维沉积,但由于沉积物较少,偏振光检查呈阴性结果。因此,虽然刚果红染色及偏振光显微镜检查仍是确诊淀粉样变性的金标准[2,6],但在疾病早期当淀粉样物沉积较少或切片过薄时可出现假阴性结果,因此电镜检查对确诊早期肾淀粉样变性有极大价值[12-13]。此外,当肾小球淀粉样物沉积形成结节样改变时,应注意与其他形成结节性病变的肾小球疾病进行鉴别诊断,例如糖尿病肾病、膜增生性肾炎、轻链肾病、致密沉积物病等,根据病理学特征及临床表现其鉴别诊断并不困难。
虽然不同类型淀粉样前体蛋白具有不同的发病机制及发生率,但由于临床表现缺乏特异性且治疗方案主要针对所沉积的特异性淀粉样蛋白,因此必须明确肾淀粉样变性的病理类型[1,6,10,14]。常规检测方法是采用免疫组化或免疫荧光染色法确定淀粉样蛋白类型包括轻链κ、λ及AA等。淀粉样变性最常见病理类型为AL型,其前体蛋白为轻链κ或λ(light chain,L),临床常有多发性骨髓瘤或浆细胞增生性疾病[1-2]。本研究经免疫染色发现,56例肾淀粉样变性病例中43例为AL型(76.8%),占已明确病理分型的93.5%(43/46),其中36例仅λ阳性,提示ALλ型是本组肾淀粉样变性的主要类型。13例(23.2%)在肾活检时血液或尿液检查发现异常升高的单克隆性免疫球蛋白,12例(占AL型患者27.9%)伴有血液系统疾病,包括多发性骨髓瘤、浆细胞增生性疾病等,上述检出比例较国内学者报道偏低[12,15],可能是由于部分病例在肾活检时临床未及时确诊,或者伴有单克隆性免疫球蛋白血症患者尚未出现相应的临床症状或体征。第二大类病理类型为AA型,其前体蛋白为血清淀粉样蛋白A(serum amyloid A protein,SAA),临床常继发于慢性感染或炎症疾病[2],与炎症时肝脏合成SAA增多导致其发生异常构型改变并沉积于器官组织内相关。本研究3例AA型中2例临床伴慢性血吸虫性肝病,可能与肝脏损伤造成SAA蛋白代谢异常相关。AA型肾淀粉样变性构成比在各国报道大有不同,德国肾淀粉样变性病例中40.3%为AA型[8],法国AA型构成比为39.1%[16],日本AA型构成比为41.7%[17]。本研究结果显示AA型仅占肾淀粉样变性的5.4%,占已明确病理分型的6.5%(3/46),与其他国内学者报道极为接近[12,15]。
本研究中淀粉样物在肾小球内及球外有较广泛沉积,所有病例均显示肾小球内沉积,23例(41.1%)淀粉样物仅沉积于肾小球和/或血管壁,33例(58.9%,包括24例AL型及3例AA型)均显示淀粉样物在肾小球、肾小管基底膜、间质、血管壁等处广泛沉积。Nishi等[8]通过刚果红染色及偏光显微镜观察发现,AL型淀粉样物更常沉积于肾小球毛细血管袢基膜形成触须样改变;而AA型病例中淀粉样物则更常出现于肾小管基底膜及间质中。本研究中虽AA型病例数少,但均显示淀粉样物在肾小球内及球外广泛沉积,且肾小球内淀粉样物重度沉积病例的尿蛋白定量显著高于轻度沉积者,与Li等[12]研究结果相似。
肾小球内淀粉样物沉积常同时伴有免疫球蛋白和补体的沉积。Nishi等[8]报道在AL型和AA型肾淀粉样变性中,IgG和C3的阳性率分别达60%和45%;50%~60%的AA型伴有肾小球内IgA、IgM和C3的沉积,较AL型更为常见,可能与多数AA型患者伴有类风湿性关节炎相关。本研究中几乎所有病例均存在肾小球内免疫球蛋白和补体免疫荧光染色阳性,尤以ALλ型更常见,其中IgM阳性率达60%,其次为C3、IgA和IgG,阳性率分别为33.9%、28.6%和12.5%;然而,电镜检查显示98.2%的病例未发现肾小球内典型的电子致密物沉积,提示免疫球蛋白及补体在肾淀粉样变性肾小球内的沉积以 非 特 异 性 沉 积可能性 大[2,9,17]。但是 由 于 电镜观察范围较为局限,在免疫球蛋白沉积较少时可能不易被发现,故可能造成肾淀粉样变性合并其他类型肾病的漏诊,如合并我国最常见肾病类型——IgA肾病。
本研究中10例石蜡组织经免疫组化染色结果为阴性,导致其病理分型困难,原因可能包括:(1)石蜡包埋过程中抗原决定簇被屏蔽;(2)前体蛋白包括轻链、重链等存在断裂,不能被抗体识别;(3)目前市售商品化抗体均以未形成异常构型之前的天然蛋白作为抗原进行制备,抗体敏感性及特异性有限,以致无法成功识别相应的淀粉样蛋白[2-3,14];(4)可能存在检测范围之外的病理类型,例如遗传性淀粉样变性。遗传性淀粉样变性与前体蛋白的编码基因突变相关,常见者包括纤维蛋白原(fibrinogen,AFib)、载脂蛋白AI/AII(apolipoprotein AI/AII,Apo AI/AII)、转甲状腺素蛋白(transthyretin,TTR)等。英国学者对350例确诊为AL型肾淀粉样变性且无肾病家族史者行研究发现,34例(9.7%)存在前体蛋白基因突变,包括18例AFib基因突 变、13例TTR基因突变[18]。有关我国遗传性肾淀粉样变性的研究仅见少数个案报道且多为AFib[19-20]。本研究中3例ALλ型及1例无法分类型伴纤维蛋白原沉积,行基因检测分析均未见突变位点,故除外AFib可能。由于遗传性淀粉样变并非罕见且散发病例患者无家族史,因而容易造成临床医师忽视。此外,由于中老年人可能存在基因突变,对遗传性淀粉样变的确诊不能仅仅依赖于DNA分析,应经免疫染色、蛋白质组学或质谱分析确定淀粉样蛋白类型[2-3,6]。因此在常规病理诊断工作中,应及时应用冰冻组织进行免疫荧光染色[2,10],必要时进行氨基酸测序或基因分析。在本研究中我们试图对10例无法分类型进行质谱分析但未能成功,主要原因包括:(1)肾活检组织量少,部分病例在反复切片用于免疫染色后所剩组织极为有限;(2)4%甲醛水溶液致蛋白交联,改变肽段理化性质,增加了蛋白裂解、酶切难度,需多次预实验以获得最佳工作条件;(3)酶切需去除SDS等不兼容质谱的小分子物质,进一步造成微量样本的损耗;(4)胰蛋白酶的酶切不充分,非酶消化肽段多。
本研究的局限性在于:回顾性研究;时间跨度较大;由于部分临床资料缺失,未能分析肾淀粉样变性的肾脏病理改变与血压、血清生化、肾脏影像学等检查结果的相关性,亦未行随访。
综上所述,ALλ型是本组肾淀粉样变性最常见病理类型;结合刚果红染色、电镜检查及偏光显微镜检查可显著提高肾淀粉样变性的确诊率;免疫染色对确定其病理分型尤为重要,基因分析有助于鉴别是否存在遗传性淀粉样变性;对临床表现为肾病综合征的中老年人及时行肾活检穿刺有助于该病的早期诊断及治疗。
作者贡献声明覃乔静数据采集,数据分析和论文撰写。常凯利数据统计,免疫染色,论文修订。赵仲华病理技术支持。刘学光论文构思,撰写和修订。
利益冲突声明所有作者均声明不存在利益冲突。

