离子液体/低共熔溶剂用于NH3分离过程的热力学分析
张盈盈,郭淑娜,宋帅龙,杨许召,吴诗德,田俊峰,韩光鲁,张静静,李亚坤,张建强
(郑州轻工业大学材料与化学工程学院,河南郑州450002)
引 言
氨气(NH3)是一种无色、有毒、具有强烈刺激性气味的碱性气体,对人的身体和环境具有不良影响。NH3作为化学原料,主要来源于氨、尿素等的工业合成过程以及氮肥等农业肥料的使用[1-3]。目前,NH3捕集方法有吸收法[4]、催化转化法[5]、生物降解法[6]等。吸收法中的水洗法和酸洗法是最广泛应用的NH3捕集方法[7-8]。但水洗法存在水挥发性高、NH3吸收率低、传统氨-水吸收系统需要昂贵的精馏装置[9]等诸多缺陷。酸洗法中酸与NH3有强烈化学反应,吸收过程不可逆。因此,亟需开发低能耗且分离操作规模小的新型NH3分离技术。
新型NH3分离技术离不开性能优越的NH3吸收剂。离子液体是由有机阳离子和无机或有机阴离子构成的、在室温或室温附近温度下呈液体状态的盐类。离子液体具有几乎不挥发、良好的热稳定性以及灵活的可调控性,被认为是气体分离过程的潜在吸收剂。低共熔溶剂作为一种新型的绿色溶剂,不仅具有离子液体的特点,还具有低廉的价格、低毒性和良好的生物降解性。近几年,离子液体和低共熔溶剂在气体分离方面表现出巨大潜力,例如CO2/N2[10]、CO2/CH4[11]等。目前,用于NH3分离的离子液体和低共熔溶剂的研究大多聚焦于NH3溶解度[12]、密度[13]、黏度[14]等基础物性数据,关于NH3分离过程的研究还比较欠缺,且离子液体和低共熔溶剂数量众多,筛选依据片面,导致筛选新型NH3吸收剂、开发新型NH3分离技术较为困难。
本研究采用热力学分析方法,在给定吸收塔温度和解吸塔压力的情况下,根据Gibbs 自由能变,拟合出最佳操作条件,并得出总能耗和离子液体/低共熔溶剂用量,将总能耗和离子液体/低共熔溶剂用量综合考虑,筛选出性能良好的离子液体/低共熔溶剂。需要指出的是,本研究所得到的最佳操作条件,最低吸收剂用量和最低总能耗均是在热力学可逆条件下得到的。将离子液体/低共熔溶剂用量和总能耗分别与离子液体/低共熔溶剂的临界性质拟合得到规律,为开发新型NH3分离技术提供依据。
1 分离过程
氨、尿素等工业合成过程的尾气排放是NH3的主要来源之一。以合成氨驰放气为气源,吸收分离NH3过 程 中 压 力 为16 bar(1 bar=105Pa),温 度 为308.15 K,合成氨驰放气的组成如表1所示。

表1 合成氨驰放气的组成[15-16]Table 1 The composition of synthetic ammonia purge gas[15-16]
以离子液体/低共熔溶剂为吸收剂,吸收分离NH3的过程如图1所示。NH3摩尔分数为yNH3的合成氨驰放气经压缩机从P 压缩至Pa后,输送至吸收塔底部,吸收塔内温度、压力分别为Ta、Pa。合成氨驰放气经离子液体吸收后产生NH3溶解度为xa的富液,除去NH3后的气体混合物经冷凝排出。溶解NH3的富液通过热交换器加热后,由顶部输送至解吸塔,解吸塔内温度、压力分别为Ts、Ps。在解吸塔内经解吸过程生成NH3溶解度为xs的贫液。解吸过程需要的热量由再沸器提供。解吸出的NH3进入纯化系统。解吸出NH3后的贫液经热交换器冷却后输送到吸收塔循环使用。
2 热力学分析
为筛选出NH3分离过程中性能良好的吸收剂——离子液体/低共熔溶剂,本研究采用热力学分析方法,根据Gibbs自由能变,分析NH3分离过程。
2.1 热力学框架
NH3分离过程的热力学框架如图2 所示。在体系1 中,合成氨驰放气在等温等压下分离成纯NH3气体和N2、H2、CH4气体混合物,气体分离过程为非自发过程,其Gibbs 自由能变为正值,即ΔG1>0。要使分离过程自发进行,需要外界环境2(ΔG2<0)提供一定的能量,使得整个体系3的Gibbs自由能变小于或等于0,即ΔG3≤0。体系3 包含体系1 和环境2,假设体系1 的分离过程是绝热可逆过程,则外界环境2提供给体系1的最小能/功就等于分离过程的Gibbs自由能变(ΔG1),即当体系3的Gibbs自由能变刚好等于0的时候,过程恰好自发,此时可得到极限条件下的最佳操作条件、最低能耗以及最低的吸收剂用量。
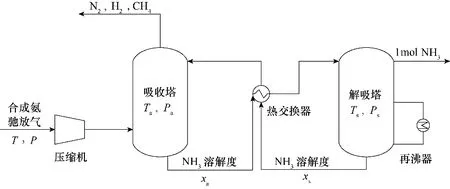
图1 NH3分离过程的简要流程图Fig.1 Simplified process flow diagram of NH3 separation process

图2 采用离子液体/低共熔溶剂分离合成氨驰放气中NH3的热力学框架图Fig.2 Thermodynamic framework for of NH3 separation from synthetic ammonia purge gas with ILs/DESs
假设从合成氨驰放气中完全分离出1 mol NH3,合成氨驰放气的状态为298.15 K、1 bar,其中NH3、H2、N2和CH4的摩尔分数分别为0.45、0.34、0.13 和0.08。基于热力学框架,如图3 所示,NH3分离过程可设计为以下几个步骤:
(1)气体混合物由T、P 状态压缩到Ta、Pa状态的等温可逆压缩过程ΔGcomp;
(2)离子液体/低共熔溶剂在Ta、Pa状态下吸收NH3的可逆吸收过程ΔGabs;
(3)离子液体/低共熔溶剂与NH3富液由Ta、Pa状态到Ts、Ps状态的绝热可逆膨胀过程和可逆升温过程ΔGT;
(4)离子液体/低共熔溶剂与NH3富液在温度Ts下解吸出NH3的可逆过程ΔGdes;
(5)除去NH3后的气体混合物到T、P 状态的等温可逆膨胀过程ΔGexp;
(6)NH3气体从Ts、Ps状态到T、P 状态的绝热可逆膨胀过程和等温可逆压缩过程ΔG′T。
基于此,分离过程的Gibbs自由能变可写为:
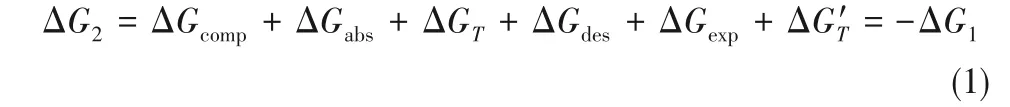
2.2 NH3解吸焓
对于物理吸收的离子液体/低共熔溶剂,NH3在离子液体/低共熔溶剂中的汽-液相平衡方程可用式(2)表示:

式中,P 为压力,φNH3表示气相中NH3的逸度系数,yNH3为NH3在气相中的摩尔分数,HNH3为NH3的亨利系数,xNH3为NH3在液相中的溶解度,γNH3为NH3在液相中的活度系数。
由于离子液体和低共熔溶剂的饱和蒸气压基本为0,假定NH3在液相中的活度系数为1,因此式(2)可简化为:

NH3在离子液体/低共熔溶剂中的亨利系数可用式(4)计算:
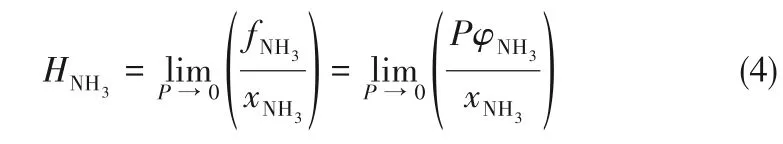
NH3的逸度系数可通过Redlich-Kwong (RK)状态方程[17]计算:
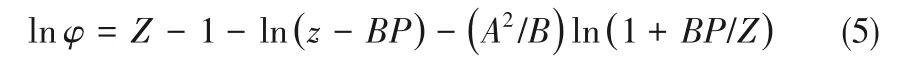
式(5)中所涉及各项参数计算过程如下:
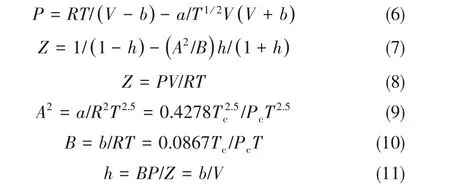
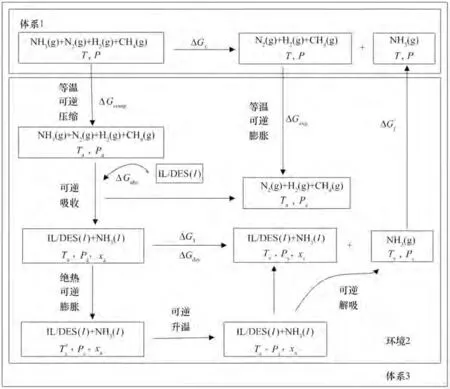
图3 采用离子液体/低共熔溶剂分离合成氨驰放气中NH3的热力学分析及过程耦合图Fig.3 The process coupling thermodynamic analysis of NH3 separation from synthetic ammonia purge gas with ILs/DESs
式中,Tc、Pc分别为NH3的临界温度和临界压力;A2和B 的单位为atm-1(1 atm=101325 Pa);R 为理想气体常数,8.314 J·mol-1·K-1。
根据式(5)~式(11),计算出不同温度下的NH3亨利系数后,将亨利系数与温度拟合得到[18]:
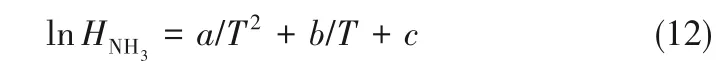
式中,a、b、c均为拟合参数。
NH3在离子液体/低共熔溶剂中的溶解焓与其吸收焓和过量焓有关,忽略过量焓的影响,则溶解焓近似等于吸收焓。根据Van’t Hoff 方程[19],可知NH3在离子液体/低共熔溶剂中溶解焓可以表示为:
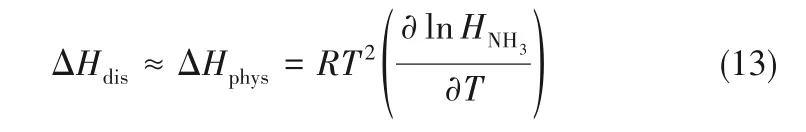
式中,ΔHdis表示NH3在离子液体/低共熔溶剂中的溶解焓,ΔHphys表示NH3在离子液体/低共熔溶剂中的吸收焓。
将式(12)代入到式(13),则离子液体/低共熔溶剂溶解1 mol NH3的溶解焓可以表达为:
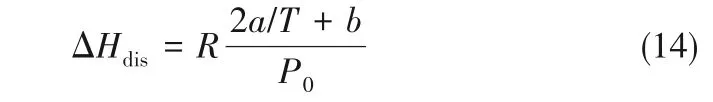
式中,P0为标准压力。
2.3 离子液体/低共熔溶剂用量
在NH3溶解度为xa的IL/DES-NH3富液中,nNH3和nIL/DES分别代表NH3和离子液体/低共熔溶剂的物质的量,可得:

从解吸塔中分离1 mol NH3,在NH3溶解度为xs的IL/DES-NH3贫液中,nNH3-1 和nIL/DES分别代表NH3和离子液体/低共熔溶剂的物质的量,可得:

由此可推得:
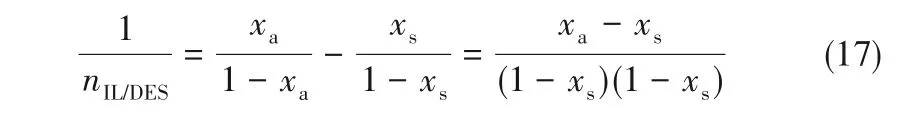
考虑离子液体/低共熔溶剂和NH3的摩尔质量,离子液体/低共熔溶剂用量(mIL/DES,单位g IL/DES·(g NH3)-1)可以用式(18)计算:
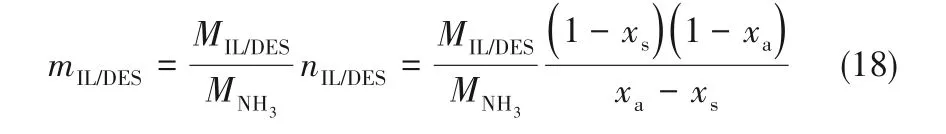
式中,MIL/DES和MNH3分别为离子液体/低共熔溶剂和NH3的摩尔质量,xa、xs分别代表NH3在吸收塔、解吸塔中的摩尔分数。
由于离子液体蒸气压小,可以认为气相中NH3的逸度系数φNH3为1。NH3在离子液体/低共熔溶剂的溶解度可由式(3)简化为:

2.4 比定压热容
通过文献调研可知,比定压热容与温度相关,将离子液体/低共熔溶剂的比定压热容与温度拟合,可以得到:

式中,cp为离子液体/低共熔溶剂的比定压热容,d和e为拟合参数。
2.5 Gibbs自由能变
2.5.1 纯组分的Gibbs 自由能变 对于纯气体组分i,其Gibbs自由能变为:

式中,Hig和Sig分别代表组分i的焓和熵,本研究中NH3、H2、N2和CH4的焓、熵均取自NIST数据库[20]。
对于纯液体组分j,其Gibbs自由能变为:
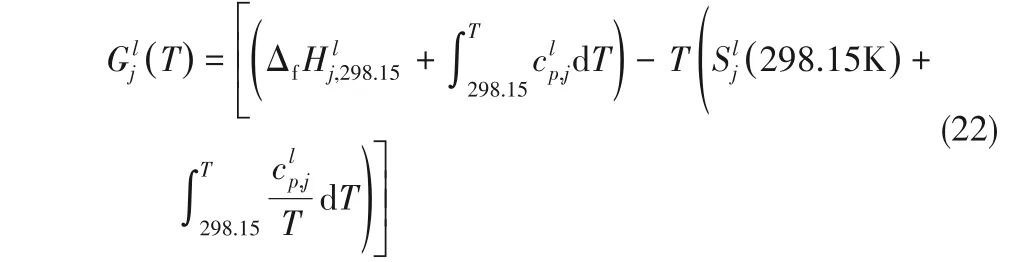
式中,标准摩尔生成焓ΔfHlj,298.15在计算Gibbs 自由能变时可被抵消,液相中溶解的NH3对离子液体/低共熔溶剂的标准摩尔熵Slj(298.15 K)和比定压热容clp,j的影响忽略不计,那么Gibbs 自由能Glj(T)的计算就需要每个离子液体/低共熔溶剂的标准摩尔熵Slj(298.15 K)。离子液体/低共熔溶剂的标准摩尔熵可通过Glasser理论[21-22]预测:
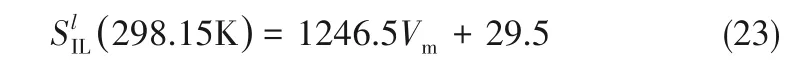
式中,Vm为分子体积(nm3):

式中,ρ 代表离子液体/低共熔溶剂在298.15 K下的密度,N为Avogadro常数。
2.5.2 气体混合物的Gibbs 自由能变 采用离子液体/低共熔溶剂分离NH3的过程中,压缩气体混合物的Gibbs 自由能变ΔGcomp(kJ·mol-1),H2、N2和CH4气体膨胀的Gibbs 自由能变ΔGexp(kJ·mol-1)以及气体温度升高的Gibbs 自由能变ΔG′T(kJ·mol-1)均可以通过式(25)计算:

式中,Ggi(Tini,Pini)、Ggi(Tfin,Pfin)分别代表气体组分i在初态和终态下的Gibbs自由能。k代表k种组分。
吸收过程和解吸过程的Gibbs 自由能变可分别用式(26)、式(27)计算:
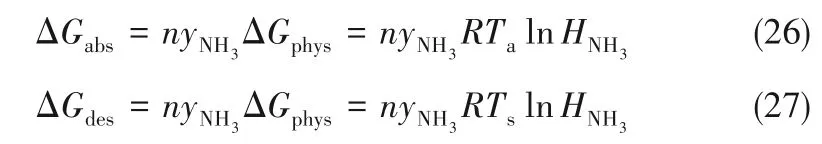
离子液体/低共熔溶剂-NH3富液从状态(Ta,Pa,xa)变化到状态(Ts,Ps,xs)时的Gibbs自由能变为:
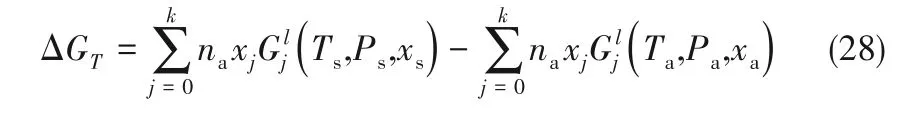
式中,na为离子液体/低共熔溶剂-NH3溶液的物质的量,xj为离子液体/低共熔溶剂-NH3溶液中液体组分j 的摩尔分数,Glj(Ta,Pa,xa)和Glj(Ts,Ps,xs)分别代表液体组分j 在状态(Ta,Pa,xa)和状态(Ts,Ps,xs)下的Gibbs自由能。
假设忽略压力以及离子液体/低共熔溶剂中溶解的NH3对Gibbs 自由能变的影响,则离子液体/低共熔溶剂-NH3溶液的Gibbs自由能就等于纯离子液体/低共熔溶剂的Gibbs自由能,即式(28)可简化为:
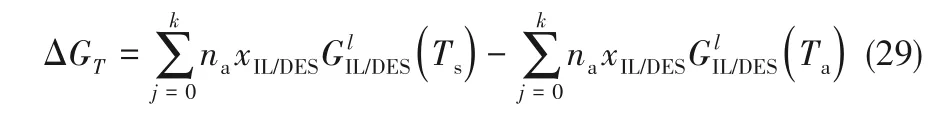
2.6 总能耗
采用离子液体/低共熔溶剂分离NH3过程的总能耗主要包括将气体混合物从压力P升高到压力Pa的压缩功,离子液体-NH3富液从状态Ta、Pa到状态Ts、Ps的显热,从离子液体-NH3富液中解吸出NH3的解吸热。NH3分离的热力学分析中各状态变化为可逆变化,其总能耗计算如下。
以解吸1mol NH3为例,气体混合物从压力P 升高到压力Pa的压缩功为:

温度升高带来的显热计算过程为:
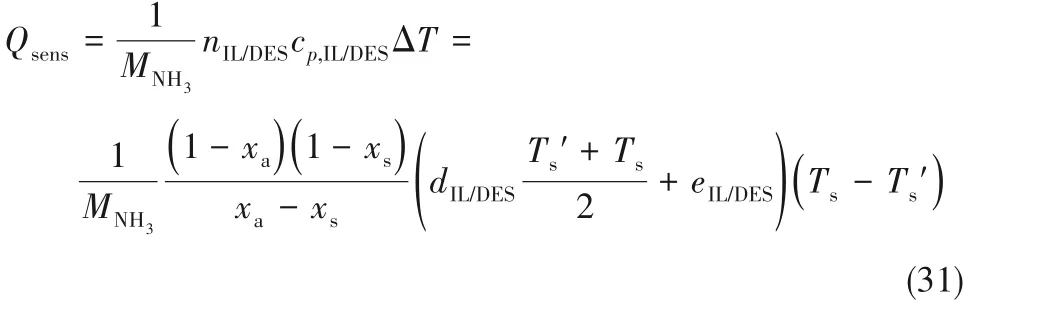
式中,Ts′代表离子液体/低共熔溶剂-NH3富液经绝热可逆压缩后的温度,如忽略绝热可逆过程,Ts′可假设等于Ta。
在温度Ts下从离子液体/低共熔溶剂-NH3富液中解吸出NH3的解吸热与NH3在离子液体/低共熔溶剂中的解吸焓直接相关,因此根据式(14)可得到从离子液体/低共熔溶剂-NH3富液中解吸出NH3的解吸热的计算式:
3 离子液体/低共熔溶剂的搜集
完成上述热力学分析,得到离子液体/低共熔溶剂用于NH3分离过程的能耗与用量,需要离子液体/低共熔溶剂中NH3的溶解度、离子液体/低共熔溶剂的密度、比定压热容等数据。其中离子液体/低共熔溶剂的密度用于计算标准摩尔熵,通过NH3溶解度拟合可得到亨利常数,比定压热容可用于计算纯组分的Gibbs自由能变。规律的探索需要离子液体/低共熔溶剂的临界性质。通过文献调研,表2列出了8种离子液体/低共熔溶剂的NH3溶解度、密度、比定压热容和临界性质等数据。
4 结果与讨论
根据上述热力学分析,假定吸收温度和解吸压力分别为298.15 K 和1 bar,基于Gibbs 自由能,可以进一步确定离子液体/低共熔溶剂用量和总能耗。以[Bmim][BF4]为例,初步探讨了解吸温度的设定对吸收压力、离子液体/低共熔溶剂用量和能耗的影响,并确定解吸温度的范围,进而研究了其他离子液体/低共熔溶剂,并筛选出性能良好的离子液体/低共熔溶剂。将筛选出的离子液体/低共熔溶剂和商业NH3吸收剂水对比,分析离子液体/低共熔溶剂的优越性。最后,拟合得到离子液体/低共熔溶剂用量、总能耗与临界性质间的规律,为筛选与合成新的NH3吸收剂、开发新的分离技术提供依据。
4.1 [Bmim][BF4]
初步设定[Bmim][BF4]的解吸温度上限为329.15 K。当解吸温度为298.15 K 时,ΔG2不可能为负,这是由于压缩气体混合物的Gibbs 自由能变ΔGcomp(正值)大于氮气、氢气和甲烷气体混合物膨胀过程的Gibbs 自由能变ΔGexp(负值)。因此,在计算过程中,解吸温度的范围设定为299.15~329.15 K。
基于上述操作条件,离子液体[Bmim][BF4]的吸收压力、离子液体用量和总能耗的计算结果如图4所示。解吸温度为299.15~329.15 K,[Bmim][BF4]的吸收压力为3.06~10.72 bar,离子液体用量为16.83~269.40 g·g-1,能耗为1.54~2.65 GJ·t-1。随着解吸温度的升高,吸收压力和总能耗逐渐升高,而离子液体用量逐渐降低,且在解吸温度较低时,离子液体用量下降趋势明显。当解吸温度高于319.15 K 时,离子液体用量和总能耗变化趋势逐渐趋于平稳,同时,在实际操作中,物理吸收剂通常采用降低压力而非升高温度的方法来解吸NH3。因此,离子液体和低共熔溶剂的解吸温度考察范围为299.15~319.15 K。
4.2 其他离子液体/低共熔溶剂
其他7 种离子液体/低共熔溶剂经过相同的热力学分析过程,吸收温度和解吸压力分别为298.15 K和1 bar,解吸温度范围设定为299.15~319.15 K。
4.2.1 吸收压力 基于设定的解吸温度范围,通过热力学分析拟合得到离子液体/低共熔溶剂的吸收压力,进而得到NH3分离过程的最佳操作条件。将吸收压力和解吸温度结合考虑是为了考察最佳操作条件的状态。
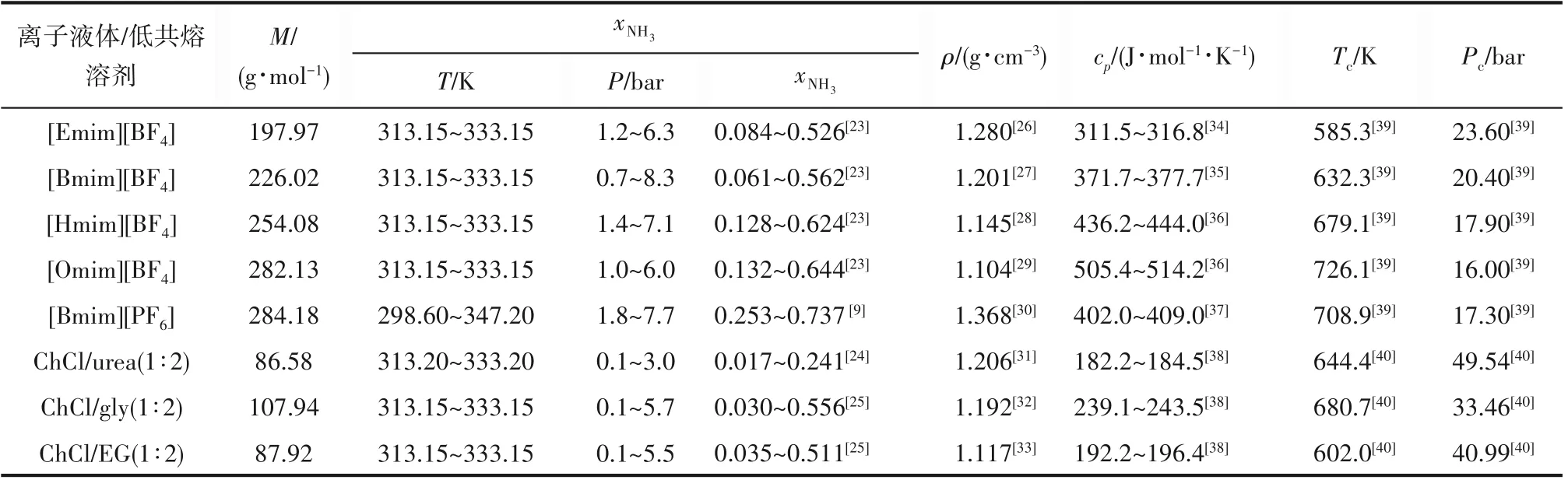
表2 8种离子液体/低共熔溶剂的分子量、NH3溶解度、密度、比定压热容和临界性质Table 2 The molecular weight,NH3 solubility,density,isobaric heat capacity and critical properties of 8 ILs/DESs

图4 [Bmim][BF4]的吸收压力、离子液体用量、总能耗与解吸温度的关系Fig.4 The relationship between absorption pressures,the amounts of ILs needed,the energy uses and desorption temperature of[Bmim][BF4]
如图5 所示,离子液体和低共熔溶剂的吸收压力均高于1 bar,这说明离子液体和低共熔溶剂的NH3解吸需要同时改变温度和压力来实现。离子液体和低共熔溶剂的吸收压力一般随着解吸温度的升高而升高,但低共熔溶剂的吸收压力低于离子液体的吸收压力。图5(a)所示6 种离子液体/低共熔溶剂,吸收压力随着解吸温度的升高而升高。图5(b)所示2 种离子液体/低共熔溶剂,吸收压力随着解吸温度的升高先降低后升高。这是由于式(1)所示的ΔG2计算式中,ΔG2、ΔGabs为定值;ΔGdes、ΔG′T与解吸温度为一次项性关系;ΔGT绝对值较大,且与解吸温度呈二次项关系,对ΔG2影响较大,导致ΔGcomp、ΔGexp与解吸温度呈二次项关系。吸收压力Pa与ΔGcomp、ΔGexp直接相关,则Pa与解吸温度也呈二次项关系。
4.2.2 离子液体/低共熔溶剂用量 在最佳操作条件下,计算得到的离子液体用量是NH3分离过程中所需的最小用量。如图6 所示,离子液体用量随解吸温度的上升而减小。在解吸温度较低时,解吸温度对离子液体用量的影响更为明显。例如,当解吸温度从299.15 K 升高到300.15 K 时,[Bmim][PF6]的用量下降了45%。而当解吸温度从318.15 K升高到319.15 K时,[Bmim][PF6]的用量仅下降了3%。
低共熔溶剂的离子液体用量低于传统离子液体。例如,ChCl/urea(1∶2)离子液体用量为17.34~224.58 g·g-1,[Bmim][BF4]离子液体用量为21.86~269.40 g·g-1。ChCl/urea(1∶2)的离子液体用量明显低于[Bmim][BF4],这主要是由于[Bmim][BF4]的摩尔质量高于ChCl/urea(1∶2)的摩尔质量。
离子液体的阴、阳离子会影响NH3分离过程中所需的离子液体用量。离子液体咪唑环烷基取代基越长,阴、阳离子之间的孔越大,所容纳的气体分子就越多,离子液体用量就越小。例如,[Hmim][BF4]离子液体用量为21.05~264.70 g·g-1,[Omim][BF4]离子液体用量为20.12~257.05 g·g-1,[Hmim][BF4]离子液体用量大于[Omim][BF4]。表明NH3分离过程中所需的离子液体用量随离子液体阳离子上烷基链侧链长度的增长而降低。离子液体的阴离子也会影响离子液体用量。例如,[Bmim][BF4]的离子液体用量为21.86~269.40 g·g-1,[Bmim][PF6]的离子液体用量为26.51~316.47 g·g-1。
4.2.3 总能耗 在最佳操作条件下,计算得到的总能耗是环境2 提供给系统1 的最小能耗。8 种离子液体的总能耗变化如图7 所示。NH3分离过程的总能耗与吸收压力、解吸温度等操作条件以及比定压热容、NH3溶解度等离子液体的性质有关。
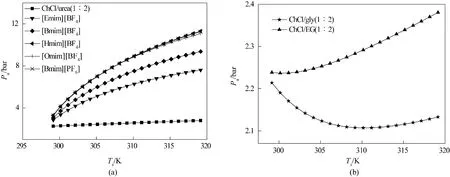
图5 8种离子液体/低共熔溶剂的吸收压力与解吸温度的关系Fig.5 The relationship between absorption pressures and desorption temperature of 8 ILs/DESs
总能耗包含气体混合物的压缩功、温度升高带来的显热和解吸NH3的解吸热。不同离子液体/低共熔溶剂的压缩功和显热相差不大,解吸热数值较大,所占比重为64%~75%,对总能耗具有较大影响。例如,ChCl/urea(1∶2)的能耗最高,是由于其较高的解吸热,为29.01~34.85 kJ·mol-1。[Omim][BF4]的能耗最低,是由于其极低的解吸热,仅为3.48~6.37 kJ·mol-1。除[Emim][BF4]外,其余离子液体/低共熔溶剂的总能耗均随着解吸温度的升高而升高,其中,[Bmim][BF4]、[Omim][BF4]随解吸温度升高呈上升趋势且斜率最大,主要是由于它们的压缩功、显热和解吸热均呈上升趋势。[Emim][BF4]的总能耗随解吸温度的升高先升高后降低,在304.15 K下达到最大,这是由于随着解吸温度的升高,解吸热的下降渐渐抵消压缩功和显热的上升,当温度达到304.15 K时,解吸热的下降占主导作用。
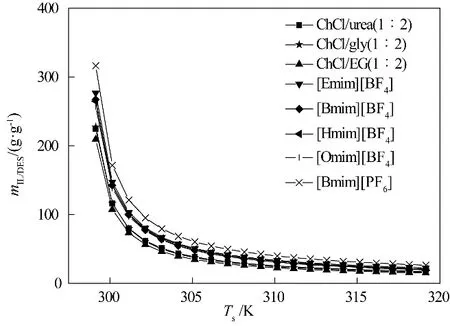
图6 8种离子液体/低共熔溶剂的吸收剂用量与解吸温度的关系Fig.6 The relationship between amounts of absorbents needed and desorption temperature of 8 ILs/DESs
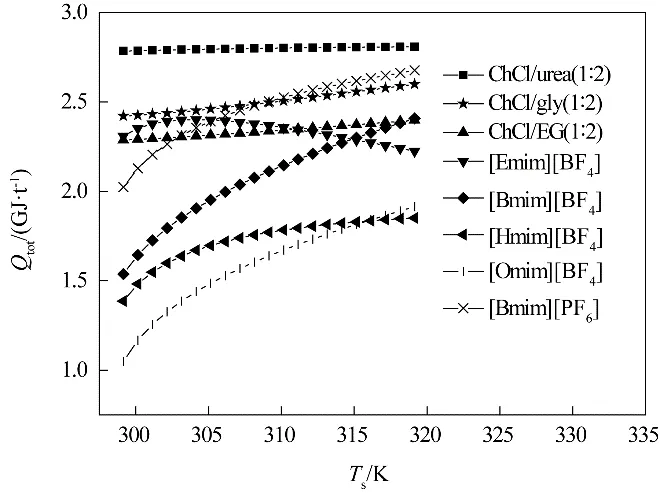
图7 8种离子液体/低共熔溶剂的总能耗与解吸温度的关系Fig.7 The relationship between total energy uses and desorption temperature of 8 ILs/DESs
4.3 吸收剂筛选
基于上述分析,将总能耗和吸收剂用量综合考虑以筛选出性能良好的离子液体/低共熔溶剂。本研究将解吸温度分为两个区域,将低用量和低能耗作为指标进行筛选,在两个解吸温度范围内吸收剂用量和总能耗均较低的吸收剂即为NH3分离过程性能良好的吸收剂。
根据上述计算可知,离子液体/低共熔溶剂用量和总能耗均与解吸温度有关。当解吸温度范围为299.15~314.85 K时,根据离子液体/低共熔溶剂用量小于270 g·g-1、总能耗低于2.3 GJ·t-1的标准可以筛选出三种离子液体,分别为[Omim][BF4]、[Hmim][BF4]和[Bmim][BF4],这三种离子液体的用量和总能耗大小顺序均为[Omim][BF4] <[Hmim][BF4] <[Bmim][BF4]。当解吸温度范围为314.85~319.15 K 时,根据离子液体/低共熔溶剂用量小于25 g·g-1、总能耗低于2.37 GJ·t-1的标准筛选出三种吸收剂,分别为[Omim][BF4]、[Hmim][BF4]和ChCl/EG(1∶2),这三种吸收剂的用量排序为ChCl/EG(1∶2) <[Omim][BF4] <[Hmim][BF4],总能耗大小顺序为[Hmim][BF4] <[Omim][BF4]<ChCl/EG(1∶2)。以低用量和低能耗为指标,在整个解吸温度范围299.15~319.15 K 内筛选出的离子液体是[Omim][BF4]和[Hmim][BF4]。比较[Omim][BF4]和[Hmim][BF4]发现,在温度低于316.15 K 时,[Omim][BF4]的离子液体用量和总能耗均低于[Hmim][BF4],表现更为优异,NH3分离过程筛选出的性能良好的吸收剂即为离子液体[Omim][BF4]。表3列出了不同解吸温度下筛选出的吸收剂及其用量和总能耗。
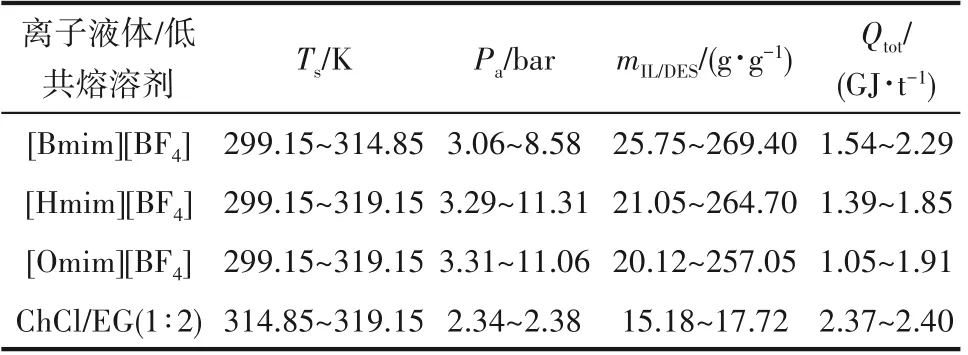
表3 筛选出的离子液体/低共熔溶剂的解吸温度、吸收压力、吸收剂用量和总能耗Table 3 The desorption temperature,absorption pressure,amounts of absorbents needed and total energy uses of the screened ILs/DESs
4.4 与商业NH3吸收剂对比
为研究筛选出的离子液体在NH3分离过程中的表现,将筛选出的离子液体[Omim][BF4]与商业NH3吸收剂对比。水洗是目前最广泛应用的NH3捕集方法,采用热力学分析方法,得到商业NH3吸收剂——水用于NH3分离过程的用量和总能耗。热力学分析所需要的水的摩尔质量、水中NH3的溶解度、水的密度和比定压热容数据列于表4。
表4 水的摩尔质量、密度、NH3溶解度和比定压热容Table 4 The molecular weight,density,NH3 solubility and isobaric heat capacity of water
如图8 所示,在整个解吸温度范围299.15~319.15 K 内,水和离子液体[Omim][BF4]的用量分别为9.49 ~125.54 g·g-1和20.12~257.05 g·g-1;总能耗分别为1.72~2.04 GJ·t-1和1.05~1.91 GJ·t-1。水与筛选出的离子液体[Omim][BF4]相比,[Omim][BF4]的总能耗低于水,但离子液体用量高于水的用量。在缺水地区,离子液体[Omim][BF4]由于其能耗低、不挥发的特点表现更为优异。
4.5 规律
建立离子液体/低共熔溶剂用量、总能耗与离子液体临界性质之间的规律,对于开发新型NH3吸收剂具有重要意义。经研究分析,除ChCl/gly(1∶2)和ChCl/EG(1∶2)外,符合吸收压力随解吸温度升高而逐渐升高的6 种离子液体/低共熔溶剂,吸收压力Pa、离子液体/低共熔溶剂用量与性质之间的关系如式(33)~式(35)所示。

图8 [Omim][BF4]和水的吸收剂用量、总能耗与解吸温度的关系Fig.8 The relationship between the amounts of absorbents needed,the total energy uses and desorption temperature of[Omim][BF4]and water
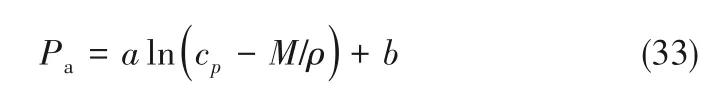
式中,cp、M、ρ分别为离子液体/低共熔溶剂的比定压热容、摩尔质量、密度。拟合度R2均大于0.96。
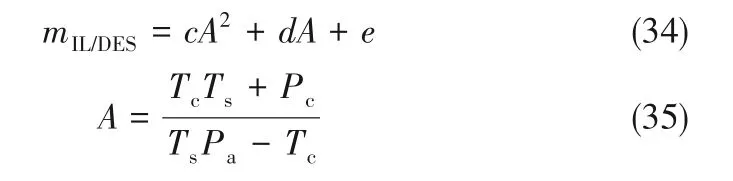
拟合度R2均大于0.99。
8 种离子液体/低共熔溶剂分离NH3过程的总能耗与临界性质之间的关系为:
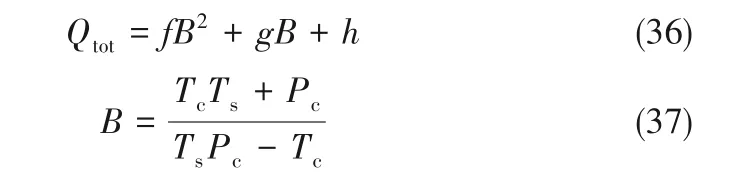
拟合度R2均大于0.95。
规律的平均相对偏差AARD计算方法为:
式中,ycal和yexp分别代表计算值与实验值。表5列出了规律的拟合系数与平均相对偏差AARD。
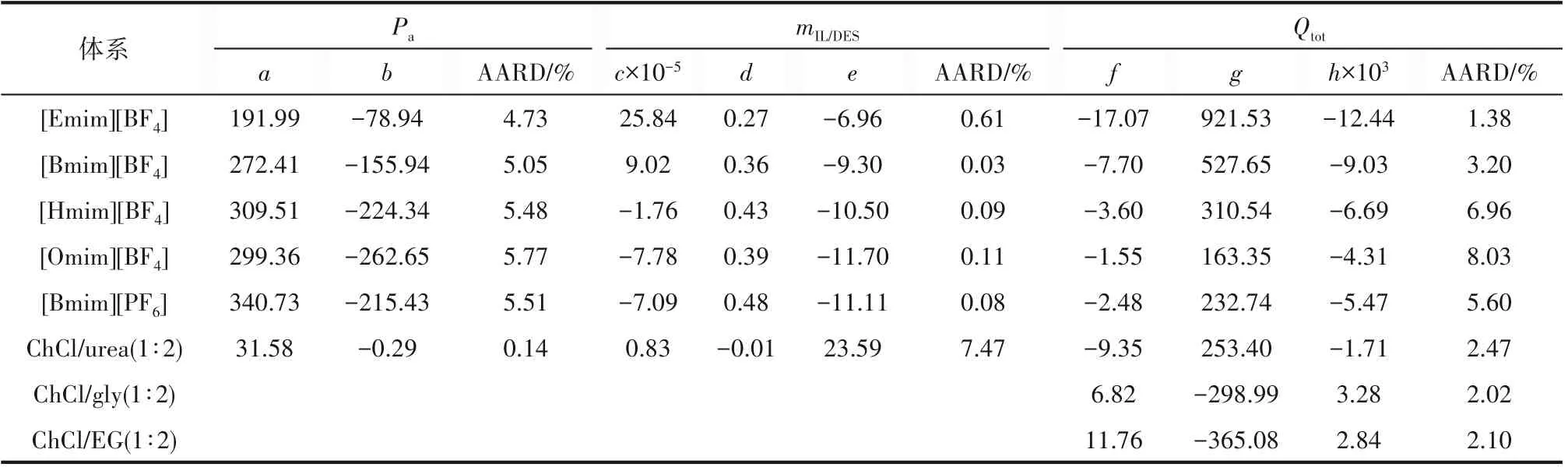
表5 规律的拟合系数与平均相对偏差Table 5 The fitting coefficients and average absolute relative deviation of the law
从表5 中可以看出,6 种离子液体/低共熔溶剂的吸收压力和吸收剂用量的平均相对偏差分别低于5.8%和7.5%,8种离子液体/低共熔溶剂的总能耗的平均相对偏差均低于8.1%,均在可接受范围内。
5 结 论
本研究采用热力学分析方法研究离子液体/低共熔溶剂用于NH3分离过程的表现,进而筛选出性能良好的离子液体,最后总结出离子液体用量、总能耗与临界性质间的规律,具体结论如下。
(1)采用热力学分析法,假定吸收温度和解吸压力分别为298.15 K 和1 bar,基于Gibbs 自由能变,通过单变量求解,确定8 种离子液体/低共熔溶剂用于NH3分离过程的用量和总能耗。
(2)以低用量和低能耗为指标,在整个解吸温度范围299.15~319.15 K 内筛选出唯一的离子液体[Omim][BF4]。将[Omim][BF4]与商用NH3吸收剂——水对比发现,在缺水地区,[Omim][BF4]由于其能耗低、不挥发的特点表现更为优异。
(3)通过将NH3分离过程的离子液体/低共熔溶剂用量、总能耗与临界性质、操作条件建立联系,得到规律,这种规律对于大多数离子液体都比较合适,拟合度较高。通过这些规律的探索为开发新型NH3吸收剂、扩大筛选范围寻找适合于不同气体分离过程的吸收剂及开发新的NH3分离过程提供了依据。

