滇中亚高山不同森林土壤酶活性对模拟N 沉降的响应
郑兴蕊,王克勤,宋娅丽,张转敏,张雨鉴,潘 禹
(西南林业大学生态与环境学院,云南 昆明 650224)
化石燃料与化学N 肥大量施用引起的N 沉降现象已成为不容忽视的全球变化问题之一[1]。N 沉降的急剧增加,直接威胁着水域生态系统和陆地生态系统的平衡[2],而森林生态系统作为陆地生态系统的主体,以其复杂的组成与结构,不可避免地受全球气候变化的影响。森林土壤作为森林生态系统的主要C 库、N 库[3],约将N 沉降中2/3 固定在土壤有机质中[4]。其中,土壤酶作为森林土壤生态系统的组成部分,其活性高低在很大程度上反映了物质循环的快慢[5],并在一定程度上反映了森林土壤状况,包括有机质的分解能力和简单物质的再合成能力[6]。为研究N 添加对土壤酶活性的影响,可将其分为两大类:(1) 负责获得C、N、P 以维持初级代谢的水解酶,包括蔗糖酶、脲酶、酸性磷酸酶、β-葡萄糖苷酶等;(2) 负责降解复杂化合物以提供营养物质的氧化还原酶,包括过氧化氢酶、过氧化物酶和酚氧化酶等[7]。这些土壤酶可能对N 添加有不同的反应,而研究更多种类的土壤酶有助于我们更全面的了解N 添加后土壤有机质的周转过程。
N 沉降对不同森林生态系统下土壤酶活性存在促进、抑制和无影响3 种影响,主要原因在于森林中的土壤理化性质受气候、林地类型、林龄及模拟N 沉降时间长短等多个因素共同作用[8-10]。目前关于N 沉降下土壤酶活性的研究,土壤酶的种类较少,且多集中在同一林型[11],如张艺等[12]对北京市辽东栎(Quercus mongolicaFisch.ex Ledeb.)施N 后,N 沉降显著促进了土壤脲酶、酸性磷酸酶活性,对土壤过氧化氢酶和多酚氧化酶活性无显著差异;李吉玫等[13]对天山云杉林(Picea schrenkianaFisch.et Mey.)进行模拟施N,结果表明N 沉降显著抑制了过氧化物酶和多酚氧化酶活性,而对土壤脲酶活性有较小促进作用;Cusack 等[7]对实验森林的研究表明,N 沉降可提高热带山地森林土壤多酚氧化酶和过氧化物酶活性。但不同土壤酶活性对外源N 添加如何响应,哪种酶活性对不同施N 浓度的响应最为敏感仍具有不确定性。
滇中亚高山区域位于我国云贵高原、青藏高原和横断山地三大自然地理区域相结合的部位,植被以半湿性常绿阔叶林为主[14]。本研究选取国内外常用于研究模拟N 沉降下土壤活动的8 种代表性土壤酶[11-13,15-18],以该地区不同森林生态系统云南松(Pinus yunnanensisFranch.) 林、高山栎(Quercus semecarpifoliaSmith) 林、华山松(Pinus armandiiFranch.)林和常绿阔叶(Evergreen broad-leaf)林为研究对象,分析林下不同土壤酶活性对不同N 沉降的响应差异,旨在为研究N 沉降对区域森林生态系统的土壤生态学过程及维护土壤生态系统的稳定性提供理论依据。
1 研究地区与研究方法
1.1 研究区概况
在云南省新平县磨盘山森林生态系统国家定位观测研究站(23°46′18″~23°54′34″ N,101°16′06″~101°16′12″ E)设置试验样地。该地区属于中亚热带气候,年降水量1 050 mm,年平均气温15 ℃,极端最高气温为33.0 ℃,极端最低气温为-2.2 ℃。磨盘山海拔1 260.0~2 614.4 m,以第三纪古红土发育的山地红壤、玄武岩红壤和黄棕壤为主[19]。该区植被类型随海拔的升高呈明显的垂直分布特征,主要分布的森林类型为针叶林(华山松林、云南松林)、亚热带常绿阔叶林和高山矮林(高山栎林)等。
1.2 试验设计
2017 年10 月,在研究站内4 种典型森林类型(云南松林、华山松林、常绿阔叶林和高山栎林)中(表1),设置3 个20 m × 20 m 的样地,在每个样地中随机设置4 个3 m × 3 m 的小样方,对应4 种不同施N 浓度,根据林地实际情况,将高浓度样地设置在下坡面,以尽量减小坡面径流泥沙引起的氮素迁移对土壤酶活性的影响。样方之间距离大于1 m,防止相互干扰。
本实验参考美国Harvard Forest 模拟氮沉降和华西雨屏区模拟氮沉降等试验中的实验设置[14-17],结合我国西南地区,如四川盆地西缘[20]、昆明东郊[21]及西双版纳[22]等地的年N 沉降量水平,以推测该地区未来可能的N 沉降趋势。本实验设定N 沉降处理分4 个水平:对照(CK,0 g N·m-2·a-1)、低N(LN,5 g N·m-2·a-1)、中N(MN,15 g N·m-2·a-1)、高N(HN,30 g N·m-2·a-1),每个水平3 个重复。将年施用量均分成12 份,从2018 年1 月初开始,每月用不同浓度N 对各样方进行定量模拟N 沉降处理。方法为在750 mL 去离子水中溶解各N 浓度水平所需NH4NO3(相当于全年新增降水1.0 mm),用喷雾器在3 个水平样方中来回均匀喷洒,为减少水分增加对土壤环境与土壤酶活性的影响,对照组同时段喷洒750 mL 去离子水。
1.3 样品采集、处理与测定
于施N 一年后(2019 年1 月)采集0~5、5~10 和10~20 cm 土壤样品,每个样方用随机数字定位法随机取3 钻后混合,带回实验室,过2 mm筛,置于无菌袋中。用四分法将样品均分,分别进行保存:一份室温自然风干保存,用于天门冬酰胺酶、脲酶、蔗糖酶的测定;一份冷藏于4 ℃冰箱,用于磷酸酶、过氧化氢酶、多酚氧化酶的测定;另一份冷冻于-40 ℃冰箱,用于蛋白酶、淀粉酶的测定。
土壤酶活性的测定:实验通过自主添加基质进行土壤培养,测定反应产物和消耗基质量来表示酶活性,为了排除土壤本身含有的基质成分影响,每个实验都设置无基质-纯水和无土壤两种对照,蔗糖酶活性采用3,5-二硝基水杨酸比色法测定;淀粉酶活性采用3,5-二硝基水杨酸比色法测定;脲酶活性采用靛酚比色法测定;酸性磷酸酶活性采用磷酸苯二钠比色法测定;过氧化氢酶活性采用高锰酸钾滴定法测定;蛋白酶活性采用茚三酮比色法测定;天门冬酰胺酶活性采用扩散法测定;多酚氧化酶采用碘量滴定法测定[6]。
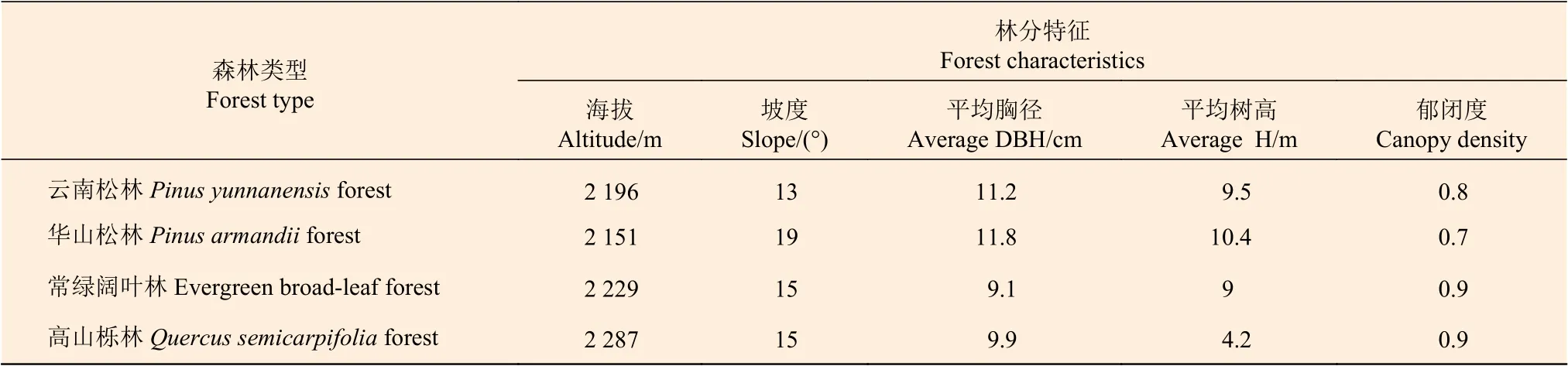
表1 4 种森林类型立地特征Table 1 Site characteristics of four forest types
1.4 数据处理
统计数据、绘制图表采用Microsoft Office Excel 2010。数据分析采用SPSS 23.0 中,其中,单因素方差分析法(One-way ANOVA)用以分析不同林分间、不同土层间及不同N 沉降处理间土壤酶活性差异特征;多因素方差分析法(Multivariate ANOVA)用以分析土壤深度、施N 水平和森林类型对土壤酶活性的影响。显著性水平设定为ɑ= 0.05。
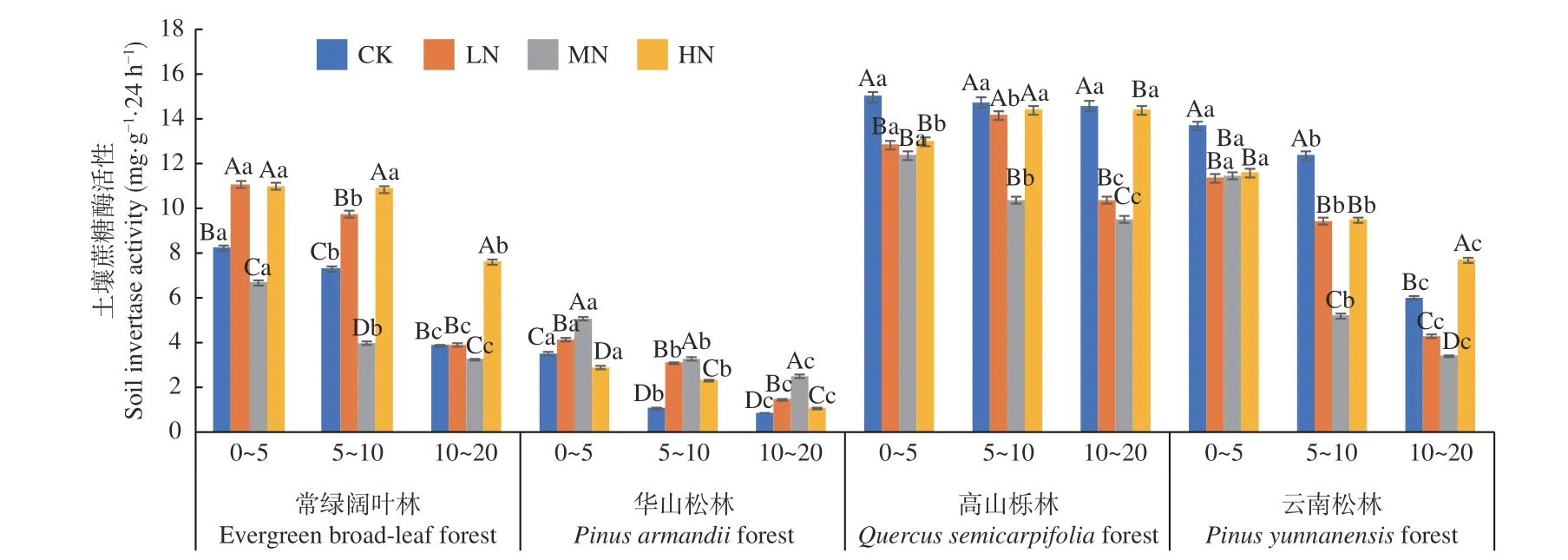
图1 不同施N 水平4 种林地各土层土壤蔗糖酶活性变化Fig. 1 Changes of soil invertase activities in different soil layers of four forest types under different N deposition
2 结果与分析
2.1 不同施N 水平4 种林地各土层土壤酶活性的变化特征
在土壤深度、施N 水平和森林类型三者交互作用下,高山栎林CK 处理下0~5 cm 土层蔗糖酶活性最高(15.035 mg·g-1·24 h-1),华山松林CK 处理下10~20 cm 土层活性最低(0.878 mg·g-1·24 h-1)。常绿阔叶林、华山松林和云南松林下土壤蔗糖酶活性均表现为随土层深度增加逐渐降低(图1),3 种林分不同土层平均值为0~5 cm (12.04~3.91 mg·g-1·24 h-1) > 5~10 cm (9.14~2.43 mg·g-1·24 h-1) >10~20 cm (5.37~1.48 mg·g-1·24 h-1),降幅分别在64.7%~30.5%、75.2%~50.7% 和70.4%~33.5%,其中华山松林0~5 cm 土层降幅最高。高山栎林中除LN 处理下随着土层深度增加呈现先增加后降低的趋势,HN 下随着土层深度增加逐渐增加(增幅为10.8%),其他土层蔗糖酶活性均表现为随土层深度增加逐渐降低。华山松林土壤蔗糖酶活性低于高山栎林80.0%,变化范围为0.878~13.704 mg·g-1·24 h-1,且存在显著差异(P< 0.05)。在不同施N浓度下,常绿阔叶林土壤蔗糖酶活性在LN 与HN 下显著高于CK 处理(P< 0.05);华山松林表现为先促进,后在HN 抑制,林下土壤蔗糖酶活性在LN 与MN 显著高于CK 处理(P< 0.05);高山栎林与云南松林表现为先抑制,后在HN 促进,林下土壤蔗糖酶活性在LN、MN 处理下显著低于CK 处理(P< 0.05)。其中,高山栎林土壤蔗糖酶活性表现最高,总体平均值为:高山栎林(13.01 mg·g-1·24 h-1) > 云南松林(8.85 mg·g-1·24 h-1) > 常绿 阔 叶 林(7.31 mg·g-1·24 h-1) > 华 山 松 林(2.61 mg·g-1·24 h-1)。
从图2 可以看出,在土壤深度、施N 水平和森林类型三者交互作用下,云南松林LN 处理下0~5 cm 土 层 淀 粉 酶 活 性 最 高(1.437 mg·g-1·24 h-1),云南松林MN 处理下10~20 cm 土层活性最低(0.103 mg·g-1·24 h-1)。常绿阔叶林、华山松林、云南松林、高山栎林土壤淀粉酶活性均表现为随土层深度增加逐渐降低,降幅分别在66.1%~22.1%、76.8%~21.7%、67.7%~21.5%和70.9%~21.9%,其中华山松林MN 处理降幅最高,4 种林分不同土层平均值为0~5 cm (0.91~0.40 mg·g-1·24 h-1) > 5~10 cm(0.71~0.33 mg·g-1·24 h-1) > 10~20 cm(0.52~0.22 mg·g-1·24 h-1),且存在显著差异(P< 0.05)。在不同施N 浓度中,常绿阔叶林表现为先抑制,后在HN 促进,林下土壤淀粉酶活性在LN、MN 处理下显著低于CK 处理(P< 0.05);华山松林也表现为先抑制,后促进,林下土壤淀粉酶活性在MN 与HN 处理下显著高于CK 处理(P<0.05);高山栎林表现为施氮则抑制,但随着土层深度的增加,HN 处理抑制程度降低,林下土壤淀粉酶活性在LN、MN 和HN 处理下均低于CK 处理;云南松林表现为先促进,后抑制,林下土壤淀粉酶活性在LN 处理下显著高于CK 处理(P<0.05)。其中,云南松林表现最高,总体平均值为:云南松林(0.71 mg·g-1·24 h-1) > 高山栎林(0.52mg·g-1·24 h-1) > 华山松林(0.39 mg·g-1·24 h-1) > 常绿阔叶林(0.32 mg·g-1·24 h-1)。
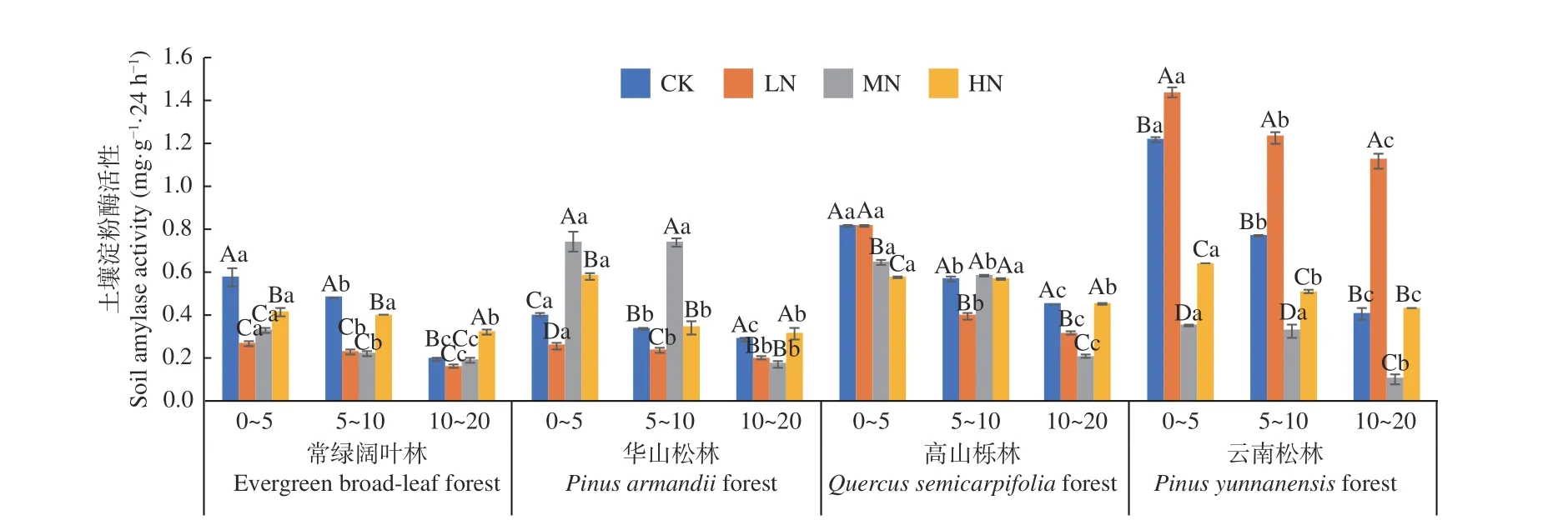
图2 不同施N 水平4 种林地各土层土壤淀粉酶活性变化Fig. 2 Changes of soil amylase activities in different soil layers of four forest types under different N deposition
图3 表明,在土壤深度、施N 水平和森林类型三者交互作用下,华山松林LN 处理下0~5 cm土层脲酶活性最高(0.777 mg·g-1·24 h-1),高山栎林CK 处理下10 ~20 cm 土层活性最低(0.251 mg·g-1·24 h-1)。4 种林分不同土层间脲酶活性差异不显著(P> 0.05),但各土层平均值表现为随土层深度增加逐渐降低,不同土层平均值为0~5 cm (0.62~0.50 mg·g-1·24 h-1) > 5~10 cm (0.61~0.45 mg·g-1·24 h-1) > 10~20 cm (0.58~0.37 mg·g-1·24 h-1)。在不同施N 浓度中,除高山栎林外,3 种林分土壤脲酶活性均表现为先增加后降低,但常绿阔叶林土壤脲酶活性在各处理下差异均不显著(P> 0.05),华山松林则在LN 处理下显著高于CK 处理(P< 0.05),高山栎林与云南松林在LN、MN 和HN 处理下均显著高于CK 处理(P< 0.05),增幅分别在36.9%~86.7% 和40.7%~62.2%。其中,华山松林表现最高,总体平均值为:华山松林(0.60 mg·g-1·24 h-1) >常绿阔 叶 林(0.51 mg·g-1·24 h-1) > 高山栎林(0.49 mg·g-1·24 h-1) > 云南松林(0.44 mg·g-1·24 h-1),华山松林土壤脲酶活性高于云南松林36.4%。
图4 表明,在土壤深度、施N 水平和森林类型三者交互作用下,华山松林LN 处理下0~5 cm 土层天门冬酰胺酶活性最高(0.434 mg·g-1·24 h-1),常绿阔叶林CK 处理下10~20 cm 土层活性最低(0.007 mg·g-1·24 h-1)。4 种林分下土壤天门冬酰胺酶活性均表现为随土层深度增加逐渐降低,降幅分别在98.1%~48.3%、88.6%~30.7%、83.4%~37.3%和83.6%~55.8%,其中常绿阔叶林CK 处理降幅最高,4 种林分不同土层平均值为0~5 cm(0.36~0.19 mg·g-1·24 h-1) > 5~10 cm (0.17~0.06mg·g-1·24 h-1) > 10~20 cm (0.09~0.05 mg·g-1·24 h-1),且存在显著差异(P< 0.05),其变化范围为0.007~0.434 mg·g-1·24 h-1。在不同施N 浓度中,常绿阔叶林和华山松林土壤天门冬酰胺酶活性随着施N 水平的增加均表现为先增加,后减少,高山栎林和云南松林则表现为先增加,后减少,再增加。4 种林分在LN 处理促进,其中华山松林在0~5 cm 土层对比CK 处理增幅最大,为75.8%。常绿阔叶林表现最高,总体平均值为:常绿阔叶林(0.20 mg·g-1·24 h-1) > 高山栎林(0.16 mg·g-1·24 h-1) > 华 山 松 林(0.14 mg·g-1·24 h-1) > 云 南 松林(0.10 mg·g-1·24 h-1),常绿阔叶林土壤天门冬酰胺酶活性高于云南松林50.0%。
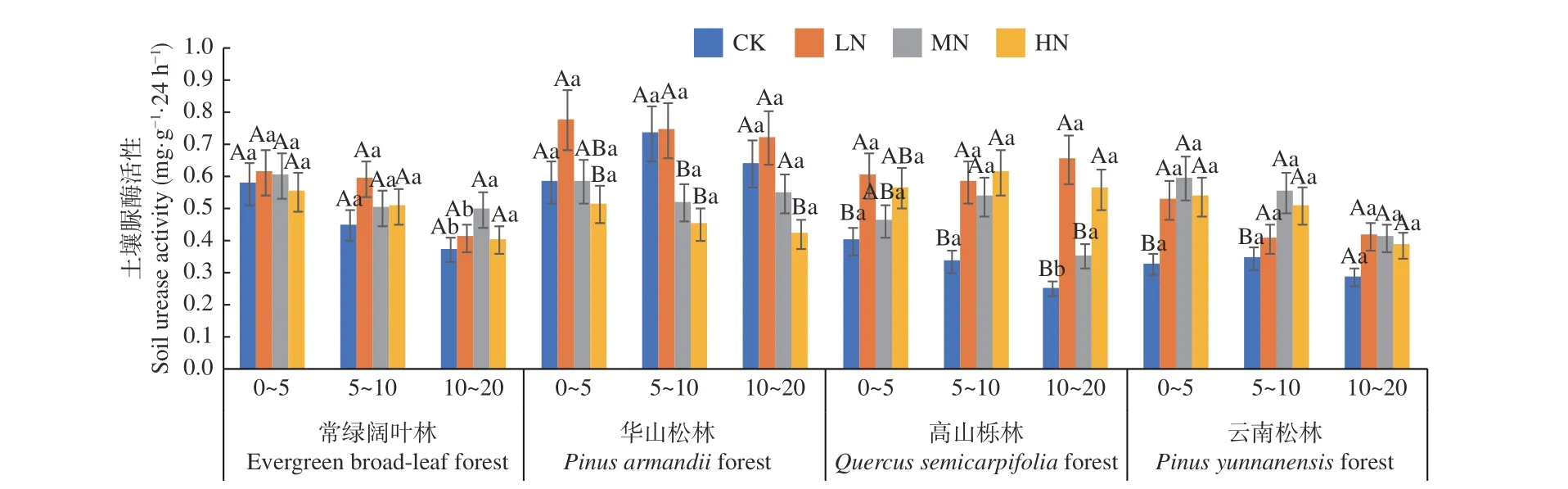
图3 不同施N 水平4 种林地各土层土壤脲酶活性变化Fig. 3 Changes of soil urease activities in different soil layers of four forest types under different N deposition
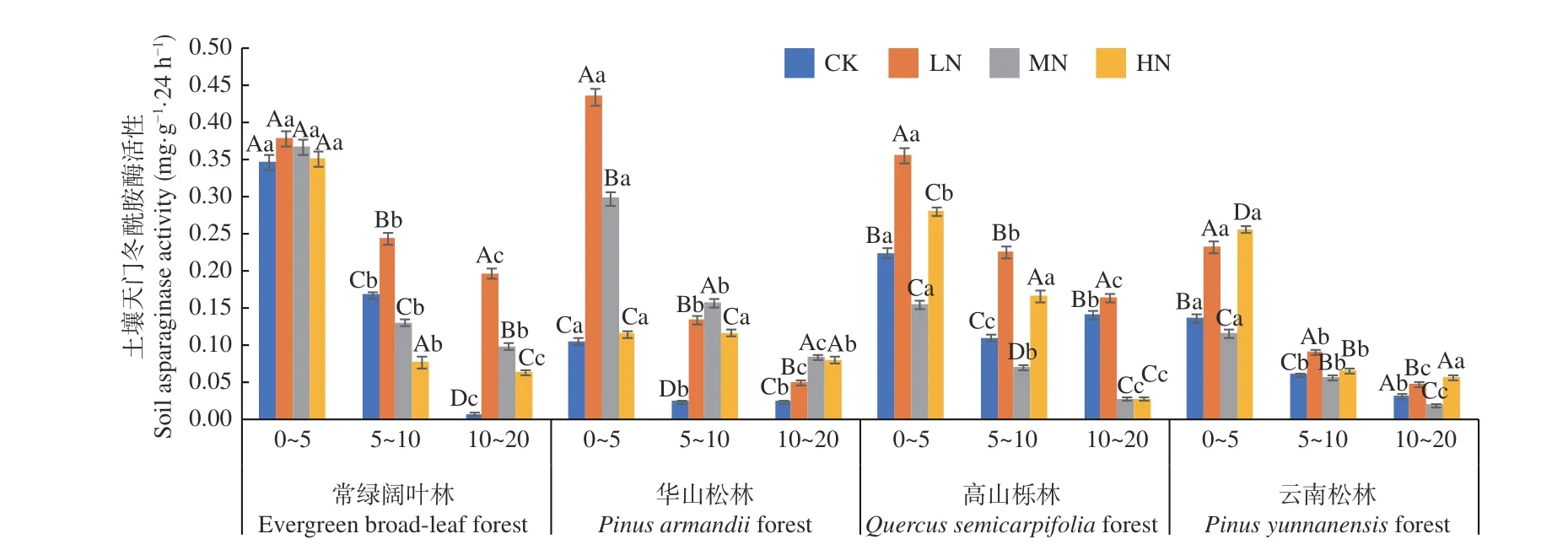
图4 不同施N 水平4 种林地各土层土壤天门冬酰胺酶活性变化Fig. 4 Changes of asparaginase activity in different soil layers of four forest types under different N deposition
图5 表明,在土壤深度、施N 水平和森林类型三者交互作用下,常绿阔叶林CK 处理下0~5 cm 土层酸性磷酸酶活性最高(2.879 mg·g-1·24 h-1),高山栎林LN 处理下10~20 cm 土层活性最低(1.372 mg·g-1·24 h-1)。酸性磷酸酶活性在4 种林分中均表现为随土层深度增加逐渐降低,降幅分别在34.0%~5.6%、35.0%~13.6%、41.0%~10.9%、和40.2%~11.1%,其中高山栎林LN 处理降幅最高,4 种林分不同土层平均值为0~5 cm (2.47~2.14 mg·g-1·24 h-1) > 5~10 cm (2.23~1.74 mg·g-1·24 h-1) > 10~20 cm (1.92~1.54 mg·g-1·24 h-1),其变化范围为1.372~2.879 mg·g-1·24 h-1,且存在显著差异(P< 0.05)。在不同施N 浓度中,4 种林分土壤酸性磷酸酶活性在各处理下存在显著差异(P< 0.05)。其中常绿阔叶林在HN 处理下受到抑制,降幅在15.1%~5.1%;华山松在HN 处理下受到促进,增幅在1.9%~22.1%;高山栎林与云南松林LN 处理在10~20 cm 土壤酸性磷酸酶受到抑制,降幅为17.2%和11.8%,在其他土层则表现为促进作用,增幅为20.0%~20.7%和6.7%~9.3%。常绿阔叶林表现最高,总体平均值为:常绿阔叶林(2.21 mg·g-1·24 h-1) > 华山松林(2.04 mg·g-1·24 h-1) >高山栎林(1.96 mg·g-1·24 h-1) >云南松林(1.81 mg·g-1·24 h-1),常绿阔叶林土壤酸性磷酸酶活性高于云南松林22.1%。
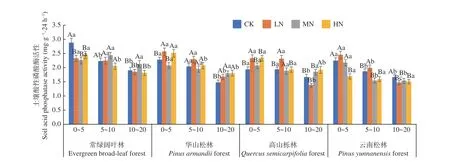
图5 不同施N 水平4 种林地各土层土壤酸性磷酸酶活性变化Fig. 5 Changes of soil acid phosphatase activity in different soil layers of four forest types under different N deposition
图6 表明,在土壤深度、施N 水平和森林类型三者交互作用下,高山栎林LN 处理下0~5 cm 土 层 蛋 白 酶 活 性 最 高(1.297 mg·g-1·24 h-1),云南松林MN 处理下10~20 cm 土层活性最低(0.625 mg·g-1·24 h-1)。除HN 处理下的华山松林和高山栎林外,其他土层蛋白酶活性均表现为随土层深度增加逐渐降低,降幅分别在33.8%~22.8%、17.4%~13.4%、41.5%~3.2%、和27.3%~4.9%,其中高山栎林MN 处理降幅最大,4 种林分不同土层 平 均 值 为0 ~5 cm (1.21~0.85 mg·g-1·24 h-1) >5~10 cm (1.14~0.80 mg·g-1·24 h-1) > 10~20 cm(1.02~0.73 mg·g-1·24 h-1),其变化范围为0.625~1.297 mg·g-1·24 h-1,且存在显著差异(P< 0.05)。在不同施N 浓度中,常绿阔叶林土壤蛋白酶活性表现为先增加后降低的趋势,在LN 与MN 处理下高于CK 处理,增幅在8.4%~30.2%。高山栎林在LN 处理下表现为促进作用,增幅在9.5%~23.8%。华山松林与云南松林在各处理下差异不显著。其中,高山栎林表现最高,总体平均值为:高山栎林(1.12 mg·g-1·24 h-1) > 常绿阔叶林(0.91 mg·g-1·24 h-1) > 华山松林(0.83 mg·g-1·24 h-1) >云南松林(0.80 mg·g-1·24 h-1),高山栎林土壤蛋白酶活性高于云南松林34.9%。
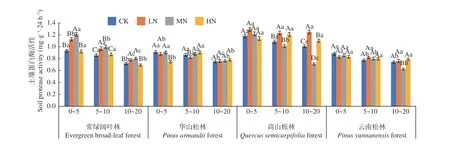
图6 不同施N 水平4 种林地各土层蛋白酶活性变化Fig. 6 Changes of protease activities in different soil layers of four forest types under different N deposition
图7 表明,在土壤深度、施N 水平和森林类型三者交互作用下,华山林LN 处理下0~5 cm 土层过氧化氢酶活性最高(0.973 mg·g-1·20 min-1),云南松林LN 处理下0~5 cm 土层活性最低(0.209 mg·g-1·20 min-1)。常绿阔叶林与云南松林土壤过氧化氢酶活性表现为5~10 cm 土层显著高于0~5 cm 土层(P< 0.05),不同土层平均值为5~10 cm (0.48~0.45 mg·g-1·20 min-1) > 0~5 cm (0.44~0.33 mg·g-1·20 min-1) > 10~20 cm (0.41~0.29 mg·g-1·20 min-1)。华山松林与高山栎林土壤过氧化氢酶活性则表现为随土层深度增加逐渐降低,降幅分别在55.6%~14.4%和28.1%~14.4%,两种林分不同土层平 均 值 为0~5 cm (0.47~0.36 mg·g-1·20 min-1) >5~10 cm (0.32~0.30 mg·g-1·20 min-1) > 10~20 cm(0.28~0.27 mg·g-1·20 min-1),且存在显著差异(P<0.05)。4 种林分土壤过氧化氢酶活性变化范围为0.209~0.673 mg·g-1·20 min-1。在不同施N 浓度中,常绿阔叶林与华山松林土壤过氧化氢酶活性随着施N 水平的增加先增加后减小。高山栎林在HN 处理下显著高于CK 处理(P< 0.05),增幅为3.9%、16.9%、21.1%。云南松林在HN 处理下显著高于CK处理,增幅为30.1%、57.9%、9.1%(P<0.05)。其中,常绿阔叶林表现最高,总体平均值为:常绿阔叶林(0.45 mg·g-1·20 min-1) > 云南松林(0.36 mg·g-1·20 min-1) > 华山 松林(0.34 mg·g-1·20min-1) > 高山栎林(0.32 mg·g-1·20 min-1),常绿阔叶林土壤过氧化氢酶活性高于高山栎林40.6%。
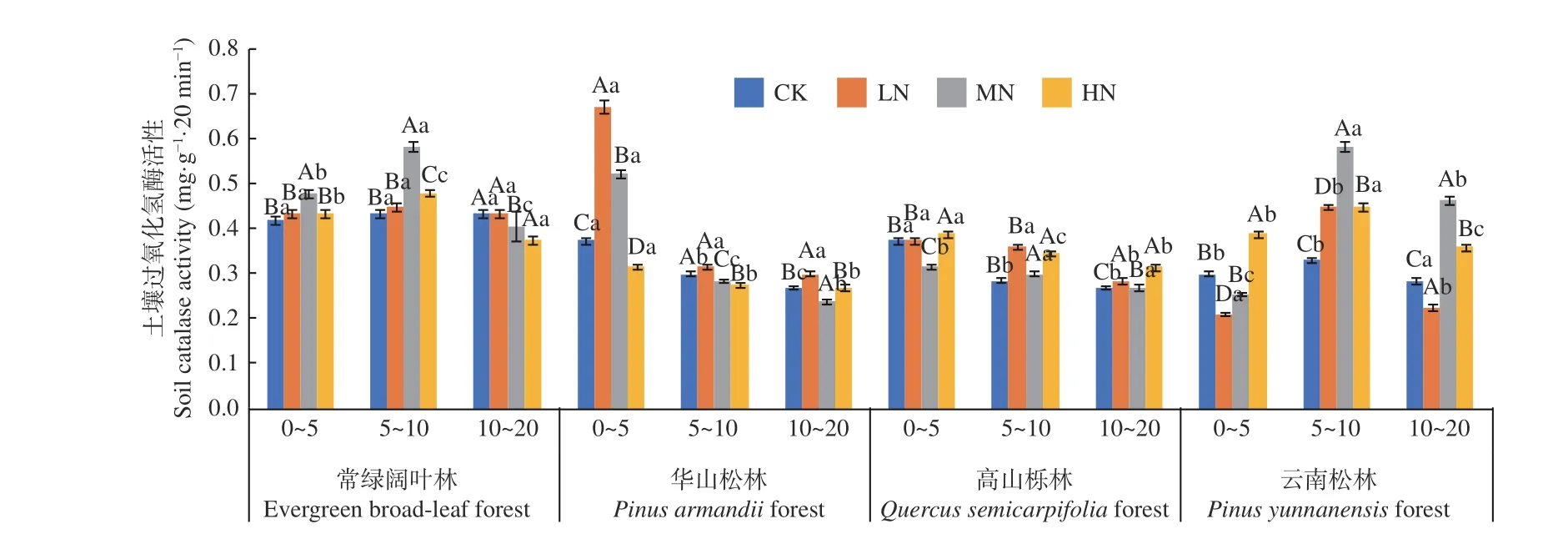
图7 不同施N 水平4 种林地各土层过氧化氢酶活性变化Fig. 7 Changes of catalase activity in different soil layers of four forest types under different N deposition
图8 表明,在土壤深度、施N 水平和森林类型三者交互作用下,云南松林CK 处理下0~5 cm土层多酚氧化酶活性最高(1.969 mg·g-1·20 min-1),高山栎林MN 处理下0~5 cm 土层活性最低(0.156 mg·g-1·20 min-1)。常绿阔叶林与华山松林土壤多酚氧化酶活性表现为随土层深度增加逐渐降低,降幅分别在73.3%~52.6%和50.0%~11.1%,两种林分不同土层平均值为0~5 cm (1.49~1.23 mg·g-1·20 min-1) > 5~10 cm (1.02~0.87 mg·g-1·20 min-1) >10~20 cm (0.73~0.59 mg·g-1·20 min-1),且存在显著差异(P< 0.05)。高山栎林与云南松林则大部分表现为5~10 cm > 0~5 cm > 10~20 cm,10~20 cm 土 层 为5 ~10 cm 的23.6%~74.4%,0~5 cm 土层为5~10 cm 的15.4%~94.7%。4 种林分土壤多酚氧化酶变化范围为0.156~1.969 mg·g-1·20 min-1。在不同施N 浓度中,常绿阔叶林土壤多酚氧化酶活性在HN 处理下显著抑制(P < 0.05),降幅为42.7%~35.7%;华山松林与高山栎林在LN、MN 和HN 处理下基本表现为抑制,降幅在49.4%~9.1%;云南松林在HN 处理下高于CK 处理,增幅在80.0%~27.7%。其中,常绿阔叶林表现最高,总体平均值为:常绿阔叶林(1.03 mg·g-1·20 min-1) >华山松林(0.94 mg·g-1·20 min-1) > 云南松林(0.89mg·g-1·20 min-1) > 高山栎林(0.84 mg·g-1·20 min-1),常绿阔叶林土壤过氧化氢酶活性高于高山栎林22.6%。

图8 不同施N 水平4 种林地各土层多酚氧化酶活性变化Fig. 8 Changes of polyphenol oxidase activities in different soil layers of four Forest types under different N deposition
2.2 不同土壤深度、不同施N 水平和不同森林类型对土壤酶活性的影响
多因素方差分析表明(表2):除施N 水平对酸性磷酸酶以及土壤深度、施N 水平和森林类型三者交互作用对脲酶无显著影响外(P>0.05),土壤深度、施N 水平、森林类型和三者交互作用对土壤蔗糖酶、淀粉酶、脲酶、天门冬酰胺酶、酸性磷酸酶、蛋白酶、过氧化氢酶和多酚氧化酶均具有极显著影响(P< 0.01)。其中,蔗糖酶、淀粉酶、蛋白酶和过氧化氢酶表现为:森林类型的影响最大,土壤深度次之,施N 水平和三者交互作用最小;脲酶表现为:森林类型影响最大,施N 水平次之,土壤深度和三者交互作用最小;天门冬酰胺酶和酸性磷酸酶表现为:土壤深度影响最大,森林类型次之,施N 水平和三者交互作用最小;多酚氧化酶表现为:土壤深度的影响最大,施N 水平次之,森林类型和三者交互作用最小。
土壤深度对土壤酶活性的影响力为:天门冬酰胺酶>蔗糖酶>淀粉酶>多酚氧化酶>过氧化氢酶>蛋白酶>酸性磷酸酶>脲酶;施N 水平对土壤酶活性的影响力为:蔗糖酶>天门冬酰胺酶>淀粉酶>多酚氧化酶>过氧化氢酶>蛋白酶>脲酶>酸性磷酸酶;森林类型对土壤酶活性的影响力为:蔗糖酶>淀粉酶>天门冬酰胺酶>过氧化氢酶>蛋白酶>多酚氧化酶>酸性磷酸酶>脲酶。三者交互作用对土壤酶活性的影响力为:天门冬酰胺酶>过氧化氢酶>淀粉酶>蔗糖酶>多酚氧化酶>蛋白酶>酸性磷酸酶>脲酶。

表2 不同土壤深度、不同施N 水平和不同森林类型对土壤酶活性的多因素方差分析Table 2 Multivariate ANOVA of soil enzyme activity by different soil depth,different N treatments and different forest types
3 讨论
3.1 土壤酶活性对不同土壤深度的响应特征
本研究中,土层深度对8 种土壤酶活性均表现为极显著影响。其中4 种林分下土壤淀粉酶、脲酶、天门冬酰胺酶、酸性磷酸酶活性影响均表现为:随着土层加深而逐渐降低,N 沉降并未改变土壤酶活性的垂直分布格局。这与陈影[23]对枫杨-桑树混交林(Pterocarya stenopteraC. DC.-Morus albaLinn.)、柳树纯林(Salix babylonicaL.)、女贞纯林(Ligustrum lucidumAit.)和栾树纯林(Koelreuteria paniculataLaxm.)4 种温带树种下土壤蔗糖酶、过氧化氢酶、蛋白酶活性研究,以及江玉梅[24]对江西马尾松纯林(Pinus massonianaLamb.)、马尾松-枫香-木荷混交林(Pinus massonianaLamb.-Liquidamber formosanaHance-Schima superbaGardn. )、 木 荷 纯 林(Schima superbaGardn.)和枫香纯林(Liquidambar formosanaHance)4 种人工林林分下土壤天门冬酰胺酶活性的垂直性变化研究结果一致。这可能是因为随着土层加深,土壤物理性质发生变化,微生物含量降低,进而导致土壤酶活性降低;同时土壤全N 含量的表聚性,使表层土壤含氮有机物转化速率增加,从而使土壤酶活性进一步增强[25]。
不同林分下土壤脲酶活性垂直分布差异不显著,但总体上仍表现为随土层深度增加而降低。李佳等[26]和刘星[27]分别对罗甸县米槁(Cinnamomum migaoH. W. Li)及油松天然林(Pinus tabuliformisCarriere)模拟N 沉降下土壤酶的研究同样表明,不同土层之间脲酶活性差异不显著(P> 0.05)。有研究表明,当森林土壤N 含量较高时,外源N 抑制土壤脲酶活性;反之,则促进土壤脲酶活性,在本研究中,土壤脲酶活性未受到N 处理的显著影响,推测施N 前后土壤N 浓度均处于平均范围内,今后研究可考虑适当增加施N 浓度,以研究N 沉降增加对土壤脲酶活性的影响。而HN 处理下华山松林和高山栎林土壤蛋白酶活性、各施N 处理下常绿阔叶林和云南松林土壤过氧化氢酶活性、各施N 处理下高山栎林与云南松林土壤多酚氧化酶活性则多表现出0~5 cm、5~10 cm和10~20 cm 土层先降低后升高的现象,这可能是由于过量的N 施入土壤表层使土壤发生负反馈机制[28],从而抑制了土壤蛋白酶、过氧化氢酶和多酚氧化酶的活性,但其抑制机理还有待进一步研究。
3.2 土壤酶活性对不同施N 水平的响应特征
本研究对8 种酶的研究中,蔗糖酶、天门冬酰胺酶与淀粉酶对施N 水平的响应最显著。土壤蔗糖酶活性与土壤有机质、氮、磷含量,微生物数量及土壤呼吸强度有关[6],土壤淀粉酶则是碳素循环中的一种重要的酶。其中,LN 处理显著增加了常绿阔叶林土壤蔗糖酶活性和云南松林土壤淀粉酶活性(P< 0.01),这与肖永翔等[29]对四川雅安常绿阔叶林土壤蔗糖酶活性变化的研究结果一致,原因可能是相对较低的N 沉降促进了林下植被的生长,进而向土壤中提供了更多的C;MN 与HN 处理对土壤蔗糖酶与淀粉酶活性多表现为抑制作用,如HN 处理抑制了高山栎林、云南松林土壤蔗糖酶与土壤淀粉酶活性,但未达到显著性(P>0.05),可能是高浓度的N 抑制了植物根系活性,使土壤pH降低,土壤硝化作用增强,土壤有效C降低[30],从而抑制了土壤蔗糖酶与淀粉酶活性,而土壤蔗糖酶活性的降低,减少了土壤植物与微生物营养源,进一步影响了土壤生物学活性强度。此外,不同森林类型的植株对碳的吸收和利用能力不同[31],也可能是造成土壤蔗糖酶与淀粉酶活性随着N 浓度的增加出现不同的变化趋势的原因。土壤天门冬酰胺酶在氮代谢中起着重要作用,能够反映土壤中含氮有机化合物的转化能力。4 种N 处理对4 种林分土壤天门冬酰胺酶活性均造成了显著影响,其中,LN 处理显著提高了4 种林分表层土壤的天门冬酰胺酶活性。可能是表层土壤很大程度上受土壤有机质和微生物含量的影响[26],而LN 处理下N 的输入提高了土壤N 含量,促进酶活性,但土层的增加使土壤通透性下降,微生物量降低,抑制了土壤天门冬酰胺酶活性。
本研究对8 种酶的研究中,脲酶、酸性磷酸酶与蛋白酶对施N 水平的响应最低。土壤脲酶在土壤中较为活跃,其活性与土壤中尿素、有机质含量和微生物含量有关。脲酶能将土壤中的尿素水解为NH3和CO2,为植物直接提供N 素营养,是促进土壤N 循环的重要组成部分,可以反应土壤的供氮能力[32]。本研究中不同林分下土壤脲酶活性在各施N 处理间差异不显著。李瑞瑞等[33]对墨西哥柏 (Cupressus lusitanicaMiller) 模拟N 沉降下土壤酶的研究同样表明,不同N 沉降处理之间脲酶活性差异不显著(P> 0.05)。这可能是由于土壤脲酶对环境条件的抗性,即脲酶具有较强稳定性。有研究表明土壤脲酶的保护容量是相对恒定的值[6],外界因子对脲酶保护容量的改变具有时效性,最终都会恢复到初始状态[34],使不同处理间土壤脲酶活性差异较小。
土壤酸性磷酸酶与土壤碳、氮、磷含量有关,是评价土壤磷素生物转化方向与强度的指标。LN 处理促进了华山松林、高山栎林和云南松林土壤酸性磷酸酶活性,HN 则抑制了常绿阔叶林与云南松林土壤酶活性。可能是由于亚热带森林中有效N 富集,使LN 处理的N 增加量直接作用于土壤酶,促进酶活性[35],而高N 下抑制则可能是因为高N 盐的毒害作用,使土壤微生物群落功能受到影响[36]。土壤蛋白酶能够水解蛋白质肽链,促进土壤微生物氮素代谢,可促进土壤N 循环,是土壤中氮矿化过程的限速酶[37]。本研究中N 沉降对土壤蛋白酶活性影响并不显著,随着N 浓度的增加,酶活性峰值出现在LN、MN 下,这与于济通[38]等的研究结果,土壤蛋白酶活性随着N 沉降量的增加逐渐增强相一致。而HN 下抑制则可能是因为土壤N 含量超出N 饱和点,酶活性受到过量N 沉降的抑制作用;也可能是因为高氮盐的毒害作用,使土壤微生物群落功能受到影响,降低了酶活性[39]。
土壤过氧化氢酶有利于防止过氧化氢对生物体的毒害作用,其活性与土壤有机质含量、微生物数量有关[40]。Frey 等[38]与本研究中常绿阔叶林研究结果类似,N 沉降对土壤过氧化氢酶活性影响不显著。本研究中,LN 处理促进了华山松林、高山栎林下土壤过氧化氢酶活性,MN 处理促进了常绿阔叶林、云南松林下土壤酶活性。从不同研究中可以发现,施N 浓度不同会对土壤过氧化物酶活性造成促进[41]或抑制[27,42]作用,原因可能是N 沉降虽然在一定程度上对微生物活性产生了影响,但由于不同森林类型下土壤环境、土壤生物及森林类型的差异性,使微生物活性的变化方向具有不确定性,进而使土壤过氧化氢酶活性变化不同[43]。土壤多酚氧化酶属于木质素分解酶,其活性与凋落物分解密切相关。本研究中,N 沉降对常绿阔叶林、华山松林和高山栎林下土壤酶活性有显著抑制作用,并且随着N 浓度的升高,抑制作用逐渐增强。这与孙宇等[44]对湿性常绿阔叶次生林的研究结果一致。原因可能是N 沉降下微生物中有关木质素分解基因的表达和丰度的相关基因下降[45],而N 水平的逐级增加,抑制了土壤多酚氧化酶的生产作用,使木质素在土壤中大量堆积,引起进一步的抑制作用[46]。
3.3 土壤酶活性对不同森林类型的响应特征
本研究结果表明森林类型对土壤蔗糖酶、淀粉酶、脲酶、天门冬酰胺酶、酸性磷酸酶、蛋白酶过氧化氢酶和多酚氧化酶活性均表现为极显著影响,且为蔗糖酶、淀粉酶、脲酶、蛋白酶和过氧化氢酶影响最大的因素,原因可能是不同森林类型下土壤通透性和微生物种类与数量等差异,造成4 种林分对N 沉降的转化程度各不同,施N 前后土壤N 含量出现差异,进而极大程度上影响了不同土壤酶活性的变化。其中土壤天门冬酰胺酶、酸性磷酸酶、过氧化氢酶和多酚氧化酶活性在常绿阔叶林中表现最高,可能原因是常绿阔叶林中植物种类较多,包括米槠(Castanopsis carlesii(Hemsl.) Hayata.)、光叶柯(Lithocarpus mairei(Schottky) Rehder)、毛蕊红山茶(Camellia mairei(Lévl.) Melch.)等,凋落物积累较为丰富,相比其他树种土壤碳储量较高[47],能够促进土壤微生物活性。脲酶在华山松林中活性最高,原因可能是脲酶能为植物直接供N,而华山松林为人工林,土壤通透性较高,且处于中幼龄林阶段(20 年生),生长较快需要合成大量干物质,对N、P 的需求相对较高[48]。
3.4 土壤酶活性对不同土壤深度、不同施N 水平和不同森林类型交互作用的响应特征
由森林类型、土壤深度和施N 水平对土壤酶活性的多因素方差分析结果可知:森林类型和土壤深度是影响N 沉降下土壤蔗糖酶、淀粉酶、脲酶、天门冬酰胺酶、酸性磷酸酶、蛋白酶和过氧化氢酶活性变化差异的重要因素。土壤多酚氧化酶对施N 水平反应敏感,对森林类型反应较不敏感,这将有利于对比研究不同区域对N 沉降的响应特征。天门冬酰胺酶对不同土壤深度的响应最为敏感,蔗糖酶对不同施N 水平和不同森林类型的响应最为敏感;天门冬酰胺酶对不同土壤深度、不同施N 水平和不同森林类型三者交互作用的响应最为敏感。
天门冬酰胺酶来源于植物根系,能酶促天门冬酰胺生成天门冬氨酸和氨,和氮循环密切相关,也是土壤中最活跃的水解酶类之一[49]。本研究中土壤天门冬酰胺酶的垂直差异表现出极显著水平,而LN 处理显著提高了4 种林分各土层土壤天门冬酰胺酶活性,原因可能是细根作为林木根系中最活跃的部分,其分布主要集中于土壤表层,并随着土壤深度增加逐渐减小[50],使土壤天门冬酰胺酶活性随土壤深度的增加而逐渐降低,穆兰[51]对茶园生态系统的研究也证明了这一观点;而土壤C 库中的活性C 库能够直接影响水解酶活性,外源N 的输入通过影响微生物活性与数量,从而改变了土壤C 储量[52],使天门冬酰胺酶对N 沉降的敏感性较高,但具体的作用机理还有待进一步研究。
4 结论
(1)土壤酶活性的垂直分布存在明显规律,8 种土壤酶活性均表现为5~10 cm 土层土壤酶活性大于10~20 cm 土层,降幅最高达76.8%,常绿阔叶林与云南松林土壤过氧化氢酶和高山栎林与云南松林土壤多酚氧化酶活性均在0~5 cm 土层受到抑制,活性最低时仅为5~10 cm 土层活性的15.4%。
(2)施N 条件下不同林分土壤酶活性变化存在差异:LN 显著抑制了高山栎土壤蔗糖酶与淀粉酶活性;脲酶、蛋白酶在各N 处理下差异不显著;除常绿阔叶林土壤酸性磷酸酶外LN 处理均显著提高了天门冬酰胺酶和酸性磷酸在0~10 cm 土层土壤酶活性;N 沉降抑制了华山松林土壤过氧化氢酶活性,促进了高山栎林、云南松林土壤过氧化氢活性;对土壤多酚氧化酶则表现为抑制。
(3)土壤蔗糖酶、淀粉酶、脲酶、天门冬酰胺酶、酸性磷酸酶、蛋白酶、过氧化氢酶和多酚氧化酶在不同林分中表现出明显差异性(P< 0.01);其中土壤天门冬酰胺酶、酸性磷酸酶、过氧化氢酶和多酚氧化酶活性在常绿阔叶林中表现最高,蔗糖酶和蛋白酶在高山栎林中表现最高,淀粉酶在云南松林中表现最高,脲酶在华山松林中表现最高。
(4)8 种土壤酶中,蔗糖酶分别对不同施N 水平和不同森林类型的响应最为敏感,天门冬酰胺酶分别对不同土壤深度及不同土壤深度、施N 水平和森林类型三者交互作用的响应最为敏感。

