鉴别PRRSV经典、高致病性和类NADC30毒株PCR方法的建立及初步应用
商佳亮,腾召剑,陈立功,倪福太,宋勤叶*,周双海 (.河北农业大学 动物医学院,河北 保定 07000;.吉林师范大学 生命科学学院,吉林 四平 36000;3.北京农学院 动物科学技术学院,北京 006)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)可引起妊娠母猪厌食、发热,怀孕后期流产、产死胎、木乃伊胎儿或弱仔,仔猪和生长肥育猪呼吸困难、间质性肺炎以及免疫功能抑制等临床症状与病理变化。该病毒是当今危害全球养猪生产最重要的病原之一[1-4]。20世纪80年代中后期,PRRSV在北美洲和欧洲几乎同时暴发,随后在世界各地相继流行,1996年郭保清等[5]首次从我国猪场的流产胎儿体内分离鉴定到该病毒。自PRRSV暴发流行以来,每年该病毒均给我国和世界其他国家的养猪业造成重大经济损失。
PRRSV属于动脉炎病毒科(Arteriviridae)动脉炎病毒属(Arterivirus)成员,是一种单股正链RNA病毒。依据病毒的核苷酸序列和血清学反应特征,PRRSV可分为PRRSV-1型(欧洲型)和PRRSV-2型(北美洲型)两个基因型,其中PRRSV-2型为我国流行的主要基因型[6-7]。PRRSV容易变异,从1995年我国首次暴发PRRSV至今,猪场流行的PRRSV毒株历经经典毒株、高致病性毒株(highly pathogenic PRRSV,HP-PRRSV)及类NADC30毒株的明显变异[6,8-9]。目前猪场流行的PRRSV以类NADC30毒株和HP-PRRSV毒株为主,经典毒株在一些猪场零星散发[8,10-11]。对临床PRRS疑似病例做出快速诊断、了解猪群的感染状况对于PRRSV的有效防控具有重要意义。已有鉴别PRRSV经典毒株、高致病性毒株或欧洲毒株的多重PCR方法[12-13],但尚未见到鉴别类NADC30、高致病性与经典PRRSV毒株的PCR检测方法的研究报道。本研究建立了应用1对引物即可鉴别PRRSV类NADC30、高致病性与经典毒株的PCR检测方法,并进行初步应用,以期为临床病例的快速诊断与流行病学调查提供可靠的检测工具。
1 材料与方法
1.1 毒株与菌株高致病性PRRSV弱毒疫苗株JXA1购自中牧实业股份有限公司成都药械厂;猪经典PRRSV弱毒疫苗株CH-1R购自哈尔滨维科生物技术开发公司;PRRSV类NADC30毒株HBDZ2019、猪流行性腹泻病毒(PEDV)、猪圆环病毒2型(PCV2)、猪伪狂犬病病毒(PRV)为河北农业大学动物传染病实验室分离鉴定;猪瘟病毒(CSFV)弱毒疫苗株(细胞源)购自辽宁益康生物股份有限公司;猪传染性胃肠炎病毒(TGEV)购自中国兽药监察所;大肠杆菌(E.coli)感受态细胞DH5α购自天根生化科技(北京)有限公司。
1.2 主要试剂病毒DNA/RNA核酸提取试剂盒购自深圳真瑞生物科技有限公司;2×Taq MasterMix(含染料)购自北京康为试剂生物科技有限公司;M-MLV反转录试剂盒购自Promega公司。
1.3 病料2017-2019年从河北保定、石家庄、邢台、邯郸等地采集的PRRSV感染患病猪的淋巴结、脾脏和肺脏等组织,共38份。
1.4 引物设计与合成根据GenBank中公布的PRRSV经典毒株(GenBank收录号:AY032626)、高致病性毒株(GenBank收录号:EF112445)与NADC30毒株(GenBank收录号:JN654459)的核苷酸序列,运用Oligo6.0软件设计3条针对PRRSV ORF1a核苷酸序列的特异性引物(表1),引物由生工生物工程(上海)股份有限公司合成。
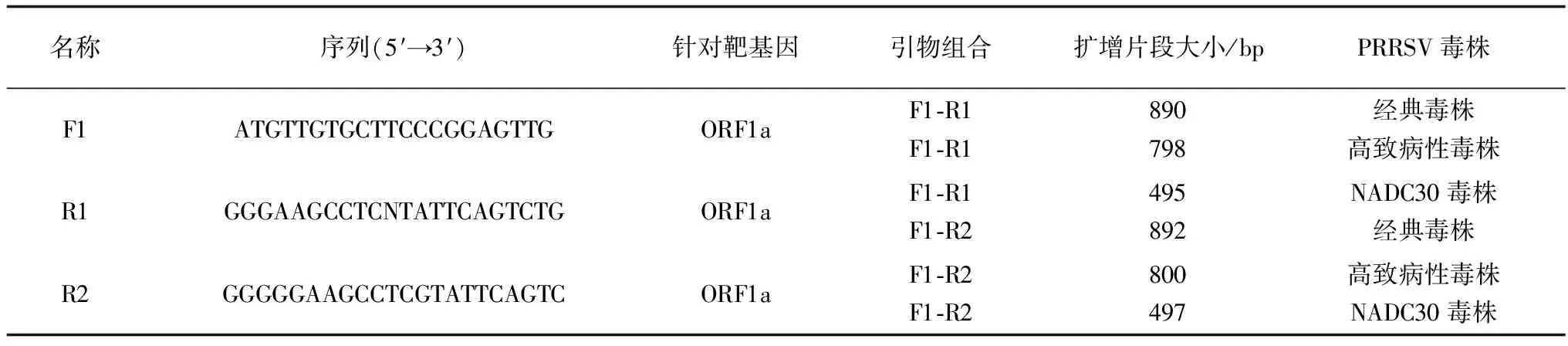
表1 设计的PCR引物列表
1.5 病毒核酸提取与cDNA的合成根据病毒DNA/RNA核酸提取试剂盒说明,提取PRRSV CH-1R、JXA1-R和类NADC30株细胞毒的RNA,然后按照RNA反转录试剂盒说明,将提取的RNA反转录为cDNA。RNA反转录过程:在灭菌的无RNA酶的1.5 mL离心管内分别加入不同病毒的RNA 9 μL和随机引物(25 pmol/L)1 μL,混匀,置71℃水浴锅内反应5 min;取出离心管,立即冰浴5 min,瞬时离心,加入5 × 反转录缓冲液4 μL、dNTP(10 mmol/L)4 μL、RNA 酶抑制剂(20 U)1 μL、M-MLV(200 U)1 μL,混匀,置37℃反转录1 h,70℃作用5 min后备用。
1.6 引物的筛选以PRRSV CH-1R、JXA1-R、类NADC30株或3个毒株的核酸cDNA混合物为模板,分别用引物F1-R1或F1-R2进行PCR。PCR体系为20 μL,包括2×Taq MasterMix 10 μL、上下游引物各0.5 μL(25 pmol/L)、模板2 μL与灭菌双蒸水(ddH2O)7 μL,瞬时离心混匀后进行PCR扩增。PCR扩增参数:94℃预变性3 min;94℃变性45 s,59℃ 1 min,72℃延伸45 s,共35个循环后72℃总延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳后,检查不同引物的扩增效率,筛选最佳引物。同时纯化回收用所筛选引物扩增的目的条带,送往生工生物工程(上海)股份有限公司进行序列测定。
1.7 退火温度的优化在不同退火温度下,以PRRSV CH-1R、JXA1-R或类NADC30株的核酸cDNA为模板,用筛选的引物进行梯度PCR。PCR反应体系为20 μL,其中各成分组成与1.6中所述的一致。梯度PCR参数:94℃预变性3 min;94℃变性45 s,58~62℃ 1 min,72℃延伸45 s,共35个循环;最后72℃总延伸10 min。通过1.5%琼脂糖凝胶电泳,分析比较不同退火温度下的PCR扩增效率,确定最佳退火温度。
1.8 引物含量的优化将上、下游引物分别稀释为40、30、20、10 pmol/L,然后以PRRSV CH-1R、JXA1-R、类NADC30株以及三者的核酸cDNA混合物为模板,分别进行PCR。PCR反应体系为20 μL,包括2×Taq MasterMix 10 μL、上下游引物各0.5 μL、模板2 μL与ddH2O 7 μL。扩增参数:94℃预变性3 min;94℃变性45 s,58℃ 1 min,72℃延伸45 s,共35个循环;最后72℃总延伸10 min。通过1.5%琼脂糖凝胶电泳,比较不同引物浓度下的PCR扩增结果,确定最佳引物用量。
1.9 敏感性检测将CH-1R(0.608 mg/L)、JXA1-R(6.93 mg/L)与类NADC30(29.67 mg/L)毒株的cDNA混合,用ddH2O做101~106倍系列稀释。以稀释后的cDNA作为模板(2 μL/反应)进行PCR,测定方法的敏感性。
1.10 特异性检测提取PCV2、CSFV、PRV、PEDV、TGEV核酸,用建立的PCR方法检测,同时设立PRRSV CH-1R、JXA1-R和类NADC30株以及三者的核酸cDNA混合物模板对照。扩增产物经1.5%的琼脂糖凝胶电泳,判定方法的特异性。
1.11 临床样本检测用建立的PCR方法检测2017-2019年收集的38份临床PRRSV感染病猪的淋巴结、脾脏和肺脏等组织,分析不同毒株的感染情况。
2 结果
2.1 引物的选择分别以PRRSV CH-1R、JXA1-R或类NADC30毒株的核酸cDNA为模板,用引物F1-R1或F1-R2进行PCR扩增。结果两对引物均能针对毒株CH-1R、JXA1-R或类NADC30扩增出预期大小的核酸片段。序列测定显示,各个片段的核酸序列与相应参考毒株的序列一致。当模板中同时含有PRRSV经典、高致病性和类NADC30毒株核酸时,均可以同时扩增出3个不同大小的DNA片段,但使用引物F1-R1进行PCR时,扩增效率更高(图1),故选择F1-R1用于后续试验。

1.DL100 DNA Ladder Marker;2~5.引物F1-R1,模板分别为毒株CH-1R、JXA1-R、类NADC30及其核酸混合物;6~9.引物F1-R2,模板分别为毒株CH-1R、JXA1-R、类NADC30及及其核酸混合物;10.水对照
2.2 确定退火温度以PRRSV CH-1R、JXA1-R或类NADC30株的核酸cDNA为模板,用引物F1-R1进行梯度PCR。结果如图2所示,退火温度在58~62℃时能扩增出预期大小的目的条带,但当退火温度在59.8~62℃时,针对JXA1-R毒株的扩增效率显著下降;当退火温度高于60℃时,针对CH-1R株和类NADC30株的扩增效率也明显下降;因此,选择58℃为该PCR的退火温度。
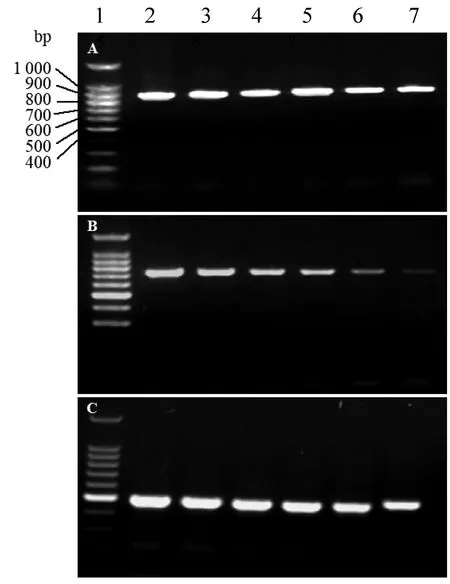
A.CH-1R株;B.JXA1-R株;C.类NADC30株(1.DL100 DNA Ladder Marker;2~7.退火温度分别为58.0、59.0、59.8、60.0、61.0和62.0℃)
2.3 确定引物含量当上、下游引物浓度为20、30或40 pmol/L,即PCR反应体系中引物含量为10、15或20 pmol时,均能扩增出针对CH-1R、JXA1-R、类NADC30株的预期大小的DNA产物,扩增效率高。但是当引物浓度降低到10 pmol/L,即体系中引物含量为5 pmol时,扩增效率显著下降(图3),故将该PCR扩增体系中引物的最适含量为10 pmol。
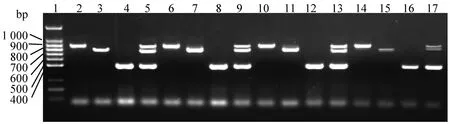
1.DL100 DNA Ladder Marker;2~5、6~9、10~13、14~17.引物量分别为20、15、10和5 pmol,用每个引物浓度进行PCR扩增时的模板依次为PRRSV CH-1R、JXA1-R、类NADC30毒株及其混合物
2.4 敏感性检测将CH-1R株、JXA1-R株、类NADC30毒株的cDNA混合模板系列稀释后进行PCR,结果如图4所示,CH-1R株、JXA1-R株与类NADC30株的cDNA最低检出量分别为12.16、138.70和59.30 pg。
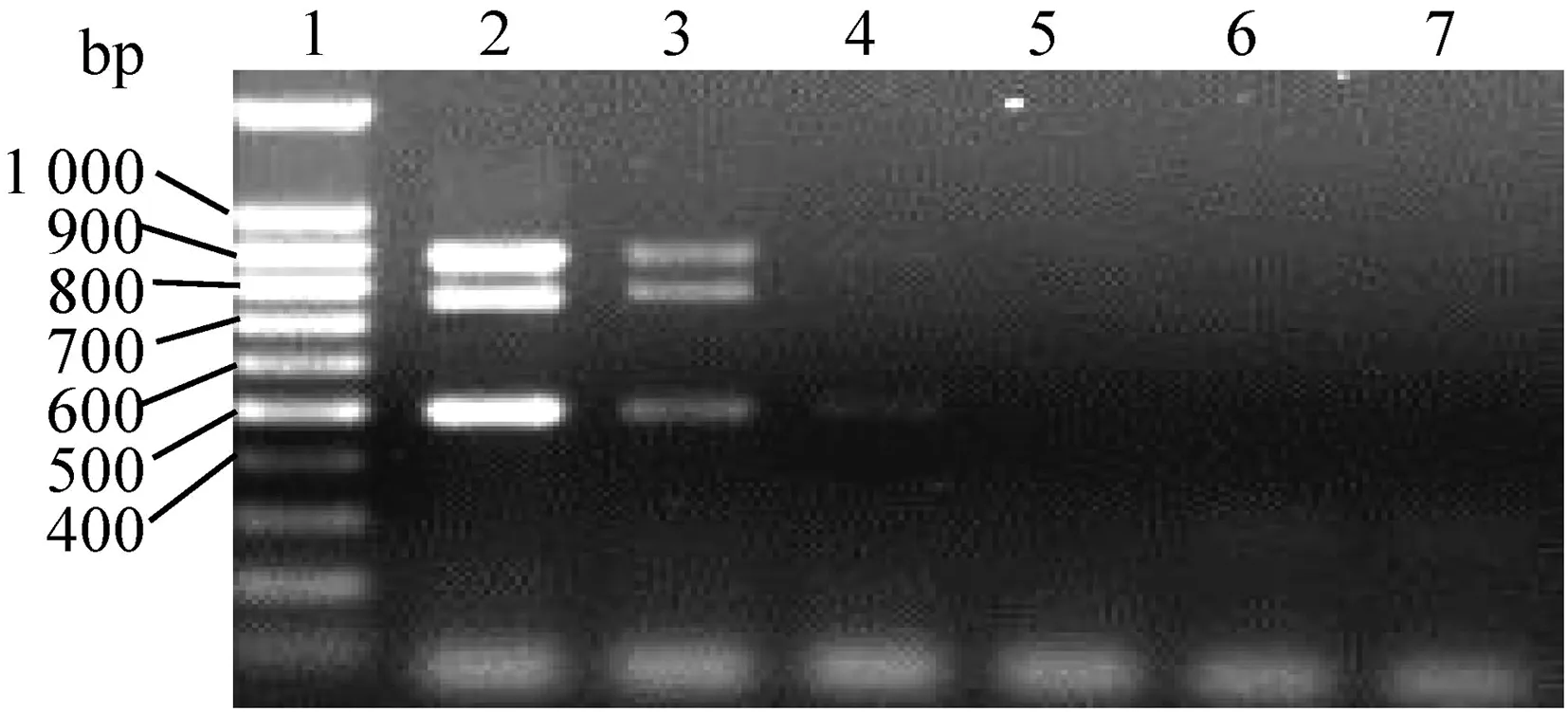
1.DL100 DNA Ladder Marker;2~7.模板稀释101、102、103、104、105、106倍(2 μL/反应);CH-1R株、JXA1-R株和类NADC30毒株的cDNA起始质量浓度分别为0.608、6.930与29.670 mg/L
2.5 特异性检测以PCV2、CSFV、PRV、PEDV、TGEV等病毒的核酸为模板,用建立的PCR方法检测,结果均没有扩增到预期大小的核酸产物(图5),而单一PRRSV CH-1R、JXA1-R、类NADC30毒株或三者核酸混合的模板均扩增到了相应目的片段,表明建立的方法具有很高的特异性。
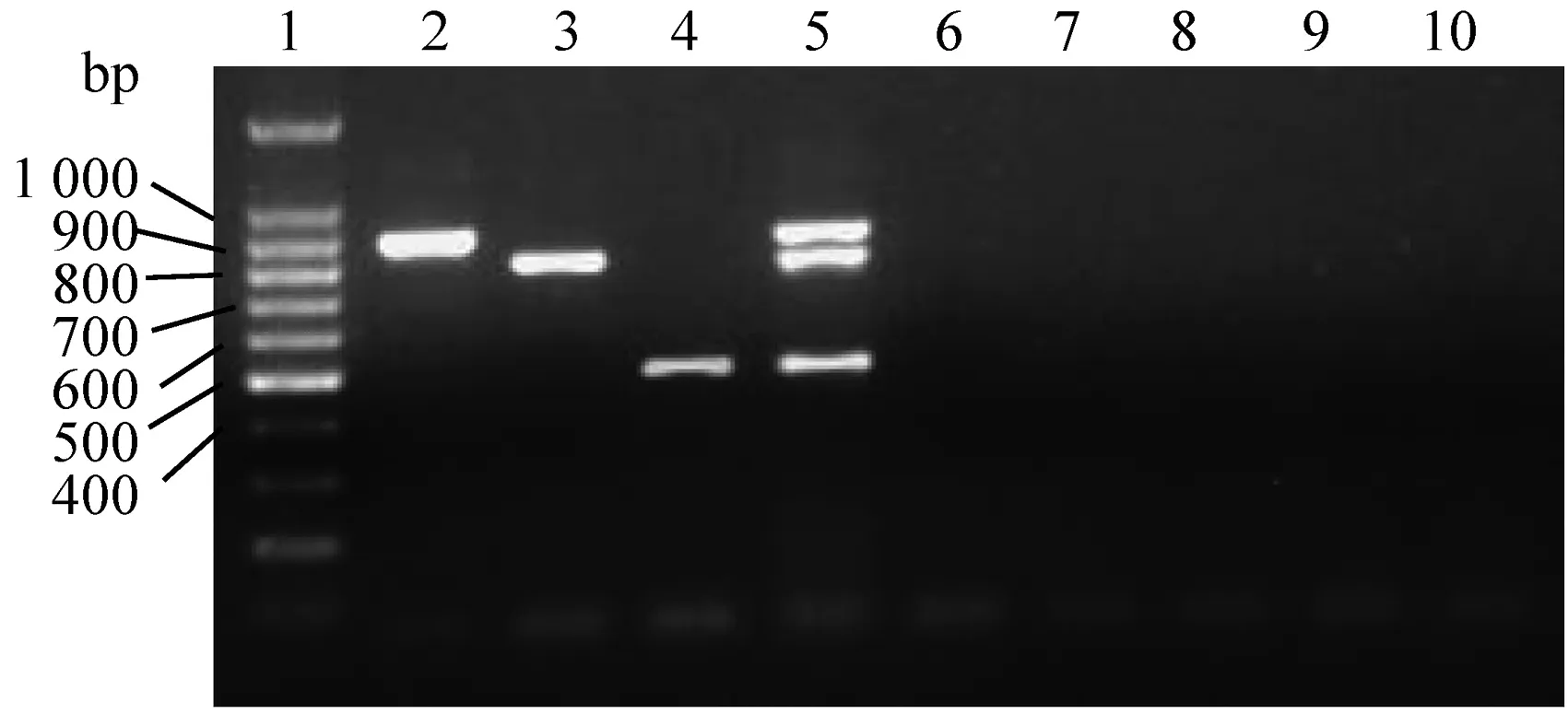
1.DL100 DNA Ladder Marker;2.CH-1R;3.JXA1-R;4.类NADC30;5.不同PRRSV毒株混合;6.PCV2;7.CSFV;8.PRV;9.PEDV;10.TGEV
2.6 临床应用用建立PCR检测38份病料显示,PRRSV全部阳性,其中类NADC30毒株、高致病性毒株与经典毒株的检出率分别为89.5%(34/38)、26.3%(10/38)和7.9%(3/38);类NADC30毒株与高致病性毒株、高致病性毒株与经典毒株以及类NADC30毒株、高致病性毒株与经典毒株混合感染的检出率分别为18.4%(7/38)、7.9%(3/38)和2.6%(1/38)。该检测结果表明,当前河北省猪场类NADC30毒株的感染率超过了高致病性毒株,成为当地流行的优势毒株,并且呈现在一个猪场内同时有不同毒株流行的复杂感染状态。
3 讨论
遗传多样性是PRRSV的主要特征,PRRSV-1型和PRRSV-2型在我国猪场均有流行,但各地流行的毒株以PRRSV-2型为主,1型主要处于零星散发状态[7-8,11]。从1995年以来,我国猪场流行PRRSV优势毒株经历了2次明显变化,即2006年的第1次变化,经典毒株(以CH-1a或BJ-4为代表毒株)的检出率逐渐降低,取而代之的是高致病性毒株(以JXA1为代表毒株),该毒株引起20%~80%的生猪死亡[8-9];2013年的第2次变化,类NADC30毒株暴发,此后其在猪群中的感染率逐渐增加,目前在某些地区类NADC30毒株已成为优势毒株,其次为HP-PRRSV,经典毒株感染或与类NADC30、HP-PRRSV毒株混合感染也时有发生[8-9,11]。猪场PRRSV感染的复杂性增加了临床病例诊断和有效防控的困难。病毒分离鉴定、免疫组化、PCR等技术常用于PRRSV的实验室检测或诊断,其中PCR具有敏感性高、操作简单、成本低、快捷等优点,广泛应用于病原学的快速诊断与流行病学监测。因此,建立鉴别PRRSV经典、高致病性与类NADC30毒株的PCR方法,对于PRRSV感染的快速诊断及有效防控具有重要意义。
PRRSV基因变异表现为碱基的突变、置换、缺失、重组等多种形式,基因组中ORF1a、ORF3和ORF5是高变区[3,6-7]。PRRSV毒株的2次大的突变以ORF1a的Nsp2区域最显著[3,15]。因此,本研究以ORF1a的Nsp2区域为靶基因,通过比对经典毒株、高致病性毒株与类NADC30毒株的基因序列,设计合成PCR所需引物。引物设计思路与文献[12-14,16]的思路相似,但本研究融入了对类NADC30毒株的检测。已知引物的特异性是决定PCR特异性与敏感性的重要因素。因此,本研究首先比较分析了2对引物的扩增效率与特异性,筛选出1对最优引物,进而优化了退火温度。此外,由于试验中使用的是标准化的PCR反应混合缓冲液,故本研究没有对缓冲液成分及dNTPs浓度进行优化,而是重点优化了反应体系中的引物含量。经过对引物与退火温度的优化,该PCR对3个毒株核酸cDNA的检测敏感性均达到pg级,对PCV2、CSFV、PRV等常见病毒没有非特异性扩增,说明本研究中建立的PCR方法的敏感性和特异性均很高,并且反应体系中只用到1对引物,即可同时鉴别检测3个毒株,避免了引物之间的干扰,同时节约了检测时间与检测成本。
为了评价方法的对临床样本的检测效果,本试验用该PCR方法检测了2017—2019年间采集的已知PRRSV感染病猪的组织样本,显示类NADC30毒株的检出率最高,其次是高致病性毒株,而经典毒株的检出率很低,同时检测到2个或3个不同毒株的混合感染病料。说明类NADC30毒株在河北省部分地区猪场已成为优势流行毒株,同时存在1个猪场内同时流行不同毒株的复杂感染状态。这些结果与国内其他地区的流行情况基本相似[8,11],同时提示当地猪场应加强对PRRSV的防控力度,严格生物安全防控措施,以降低该病毒给猪场造成的经济损失。
总之,本研究建立的PCR方法能够用1对引物同时检测PRRSV经典、高致病性和类NADC30毒株。该方法不仅能够用于临床PRRSV感染的快速诊断,而且可以为PRRSV疫情监测与预警以及流行病学调查提供重要技术支撑。

