共表达PCV2 Cap蛋白和IL-2重组变异株伪狂犬病病毒构建及对小鼠的免疫原性
时庆贺,马宁宁,刘 占,邓梦梦,郭子仪,史志斌,陈 陆,王川庆 (河南农业大学 动物医学院,河南 郑州 450002)
猪圆环病毒2型(porcine circovirus type 2,PCV2)主要引起断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)。PCV2感染能够引起机体产生严重的免疫抑制,易并发和继发其他传染病,从而增加猪群的发病率和死亡率。ORF2编码的Cap蛋白可与宿主细胞的病毒受体结合,是PCV2主要的免疫原蛋白[1-3]。自2011年底以来,伪狂犬病病毒(pseudorabies virus,PRV)变异株在我国大部分地区流行造成猪伪狂犬病(porcine pseudorabies,PR)再次暴发,已有的PR基因缺失活疫苗不能对PRV变异毒株提供100%保护的报道[4]。白介素2(interleukin 2,IL-2)作为免疫佐剂能诱导T淋巴细胞增殖和分化,增强自然杀伤细胞的杀伤作用,提高单核巨噬细胞吞噬和抗原识别能力,在细胞和体液免疫反应中起关键作用,克服了传统佐剂的缺点[5-7]。因此,IL-2有望成为一种安全、经济、高效的新型免疫佐剂。基于PR基因缺失活疫苗的成功应用以及PRV大部分基因如TK基因[8]是病毒复制非必需的。因此,将PRV流行变异株作为载体,在其基因组上插入外源基因,构建病毒活载体疫苗可达到“一针多防”的效果[9]。本研究拟将PCV2 YY株ORF2和猪IL-2基因插入到前期用PRV QYY变异株构建的rPRV-gE-/TK-/EGFP+缺失的TK基因位点,评价重组病毒免疫原性,以期获得有效预防PMWS及PR的重组活载体疫苗株。
1 材料与方法
1.1 质粒、细胞及毒株含有CMV启动子和polyA尾的pZJ-1真核表达载体及以pMD18-T为载体含有PRV TK基因上下游同源臂的重组质粒pTK、rPRV-gE-/TK-/EGFP+毒株和rPRV-gE-/TK-/ORF2+重组病毒为本实验室构建并保存;E.coliDH5α感受态细胞、非洲绿猴肾细胞(Vero)、人肾上皮细胞(293T)、仓鼠肾细胞(BHK-21)、PRV QYY株(2012年分离流行株)和PCV2 YY毒株(PCV2d)为实验室保存。
1.2 主要试剂羊抗猪IL-2多克隆抗体购自Novus公司;HRP-羊抗兔IgG、HRP-兔抗羊、HRP-羊抗鼠IgG和FITC-羊抗鼠IgG购自三鹰生物技术有限公司;Lipofectamine 2000 Reagent购自Invitrogen公司;抗鼠CD3-FITC、CD4-PE、CD8-PercP、IFN-γ-APC、IL-4-APC 和IL-12单克隆抗体、Brefeldin A、Fixation Buffer、Perm Wash Buffer和Cell Staining Buffer为Biolegend公司产品;细胞增殖与活性检测试剂盒(CCK-8)购自武汉博士德有限公司;抗PCV2 Cap鼠单克隆抗体和原核表达的Cap蛋白为本实验室制备。
1.3 重组病毒rPRV-gE-/TK-/ORF2+/IL-2+的构建据GenBank收录 PCV2(KU960941.1)和 IL-2(X58428.1)基因序列,应用Primer Primer 5.0设计特异性引物F1/R1和F2/R2,分别用于扩增PCV2 ORF2和IL-2基因;在TK基因上游同源臂(TKU)及下游同源臂(TKL)设计1对特异性引物F3/R3,扩增含有TK基因上、下游同源臂和ORF2-IL-2基因表达框的片段TKU-CMV-ORF2-IL-2-polyA-TKL(表1)。相应限制性内切酶分别双酶切ORF2和IL-2基因扩增片段,KpnⅠ、HindⅢ双酶切pZJ-1质粒,酶切产物纯化连接,得到重组质粒pZJ-ORF2-IL-2。NheⅠ和SpeⅠ双酶切pZJ-ORF2-IL-2得到CMV-ORF2-IL-2-polyA片段,与用SpeⅠ酶切并进行去磷酸化处理的pTK连接,得到重组质粒pTK-ORF2-IL-2并进行酶切鉴定。用高保真酶以pTK-ORF2-IL-2为模板通过PCR扩增出TKU-CMV-ORF2-IL-2-polyA-TKL,经1%TAE琼脂糖凝胶电泳鉴定及分离纯化。在6孔细胞培养板中培养293T细胞单层长至80%时,参照脂质体LipofectamineTM2000试剂盒说明,将TKU-CMV-ORF2-IL-2-polyA-TKL基因片段与rPRV-TK-/gE-/EGFP+基因组DNA共转染,细胞病变80%时收毒、离心取上清接种Vero细胞,待细胞出现病变,在荧光倒置显微镜下挑取无荧光蚀斑并连续纯化鉴定,得到重组病毒rPRV-gE-/TK-/ORF2+/IL-2+。

表1 引物序列信息
1.4 Western blot鉴定重组病毒Cap蛋白和IL-2表达重组病毒rPRV-gE-/TK-/ORF2+/IL-2+接种BHK-21细胞,细胞病变80%时弃上清,RIPA(含1 mmol/L蛋白酶抑制剂)裂解细胞后收取蛋白;取 20 μL SDS-PAGE电泳。电泳结束后,转膜,封闭,分别加入抗Cap蛋白单抗和抗IL-2多克隆抗体,37℃反应2 h;TBST洗3次,分别加入HRP-兔抗鼠二抗和HRP-兔抗羊二抗,摇床中60 r/min孵育1 h;TBST洗3次,ECL显色试剂盒显色。
1.5 重组病毒一步生长曲线测定分别将重组病毒rPRV-gE-/TK-/ORF2+/IL-2+、rPRV-gE-/TK-/EGFP+和PRV QYY亲本株按1 MOI接种于6孔板中单层Vero细胞,每隔6 h收取病毒液,冻融3次,测定不同时间点病毒滴度,按Reed-Muench法计算TCID50,绘制病毒一步生长曲线。
1.6 重组病毒对小鼠的安全性试验选择25只6~8周龄健康且PRV、PCV2血清学检测均为阴性的昆明鼠,随机分为5组,每组5只。1~3组分别以每只105TCID50、106TCID50、107TCID50剂量接种rPRV-gE-/TK-/ORF2+/IL-2+;第4组接种 PRV QYY毒株,105TCID50/只;第5组注射100 μL DMEM作为阴性对照背部皮下注射,每天观察鼠的临床变化,观察期为14 d。
1.7 重组病毒对鼠的免疫原性评价将25只雌性昆明鼠随机分成5组,每组5只,免疫方案见表2。首免时及随后每周对小鼠进行断尾采血并分离血清,分别用前期建立的间接ELISA方法[10]和中和抗体试验检测各组小鼠血清中抗PCV2抗体及PRV中和抗体水平;二免后4周,无菌分离并制备3×106个/mL的各免疫组鼠脾脏淋巴细胞悬液,并加入Cap蛋白刺激(5 mg/L),利用细胞增殖及细胞活性检测试剂盒(CCK8)检测各组鼠淋巴细胞增殖活性,以刺激指数(SI)作为淋巴细胞增殖的标准。参考文献[11-12]方法进行改进,取专用流式管分别加入1 mL上述各组细胞悬液;加入 Cap蛋白(5 mg/L)刺激1 h;加入蛋白转运抑制剂Brefeldin A(1 000×),1 μL/管,作用4 h;Cell Staining Buffer洗涤细胞,每管加入1 μg 抗鼠CD3-FITC、0.25 μg CD4-PE和0.25 μg CD8-PerCP,轻轻混匀4℃避光孵育30 min;洗涤细胞,室温避光下用0.5 mL Fixation buffer固定20 min;充分洗涤细胞,室温避光下加入1 mL Perm Wash Buffer进行细胞打孔10 min;分别加入1 μg 抗鼠IFN-γ-APC、0.25 μg IL-4-APC或0.25 μg IL-12-APC,室温避光孵育30 min;Perm Wash Buffer充分洗涤细胞,用500 μL 1%多聚甲醛固定液重悬固定细胞,BD FACS Aria Ⅲ流式细胞仪检测,FlowJo 7.6软件分析各免疫组小鼠脾脏CD3+、CD4+和CD8+T淋巴细胞变化及IFN-γ、IL-4和IL-12细胞因子的分泌水平。

表2 小鼠分组与免疫方案
1.8 统计学方法数据统计应用SPSS 20.0进行分析,差异比较采用t检验,以P<0.05 具有统计学意义。
2 结果
2.1 重组病毒的构建与鉴定TKU-CMV-ORF2-IL-2-polyA-TKL基因片段与rPRV-TK-/gE-/EGFP+基因组DNA共转染293T细胞进行同源重组,转染混合液离心取上清接种Vero细胞,倒置荧光显微镜下挑取无荧光蚀斑并连续纯化。Western blot检测重组病毒Cap和IL-2蛋白表达结果见图1。PCV2 Cap蛋白大小为27.8 kDa,IL-2大小约为15.0 kDa,与预期相符,重组病毒rPRV-gE-/TK-/ORF2+/IL-2+能够表达Cap和IL-2蛋白,表明重组病毒构建成功。

M.预染蛋白Marker;A1.PCV2 YY株接种PK15细胞作为阳性对照;A2/B1.未接毒细胞空白对照;A3/B2.rPRV-gE-/TK-EGFP+接毒阴性对照;A4/B3.rPRV-gE-/TK-/ORF2+/IL-2+接种BHK-21细胞收取蛋白
2.2 重组病毒一步生长曲线rPRV-gE-/TK-/ORF2+/IL-2+、rPRV-gE-/TK-/EGFP+和PRV QYY亲本株在Vero细胞上一步生长曲线见图2。结果显示,重组病毒与PRV QYY株及双缺失毒株有相类似的生长动力学,随着时间的增加病毒滴度逐渐增加,42 h时达到最高,随后开始下降,增殖速度和病毒滴度与双缺失毒株相似。

图2 重组病毒和亲本毒株的一步生长曲线
2.3 重组病毒对小鼠的安全性PRV QYY接种小鼠出现精神沉郁、角弓反张、奇痒等症状,3 d内全部死亡。接种3种不同剂量重组病毒的试验小鼠及阴性对照组在14 d的观察期内均没有发病症状,状态良好,说明重组病毒rPRV-gE-/TK-/ORF2+/IL-2+的毒力大大减弱,致病性降低。
2.4 免疫小鼠抗PCV2抗体间接ELISA方法测定各组鼠血清中抗PCV2抗体水平见图3。rPRV-gE-/TK-/ORF2+/IL-2+、rPRV-gE-/TK-/ORF2+与PCV2亚单位疫苗免疫小鼠的抗体水平在首免后3周内迅速升高,在二免后抗体水平呈现持续上升趋势,三者抗体水平变化趋势一致,且在二免后rPRV-gE-/TK-/ORF2+/IL-2+与PCV2亚单位疫苗免疫组抗体水平相差不大,但均高于rPRV-gE-/TK-/ORF2+免疫组。DMEM和PR活疫苗免疫小鼠均没产生抗PCV2抗体。结果表明,rPRV-gE-/TK-/ORF2+/IL-2+能诱导免疫小鼠产生抗PCV2抗体,猪IL-2可以增强机体特异性体液免疫。
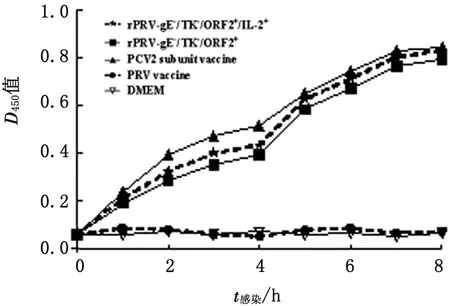
图3 免疫小鼠抗PCV2抗体水平变化
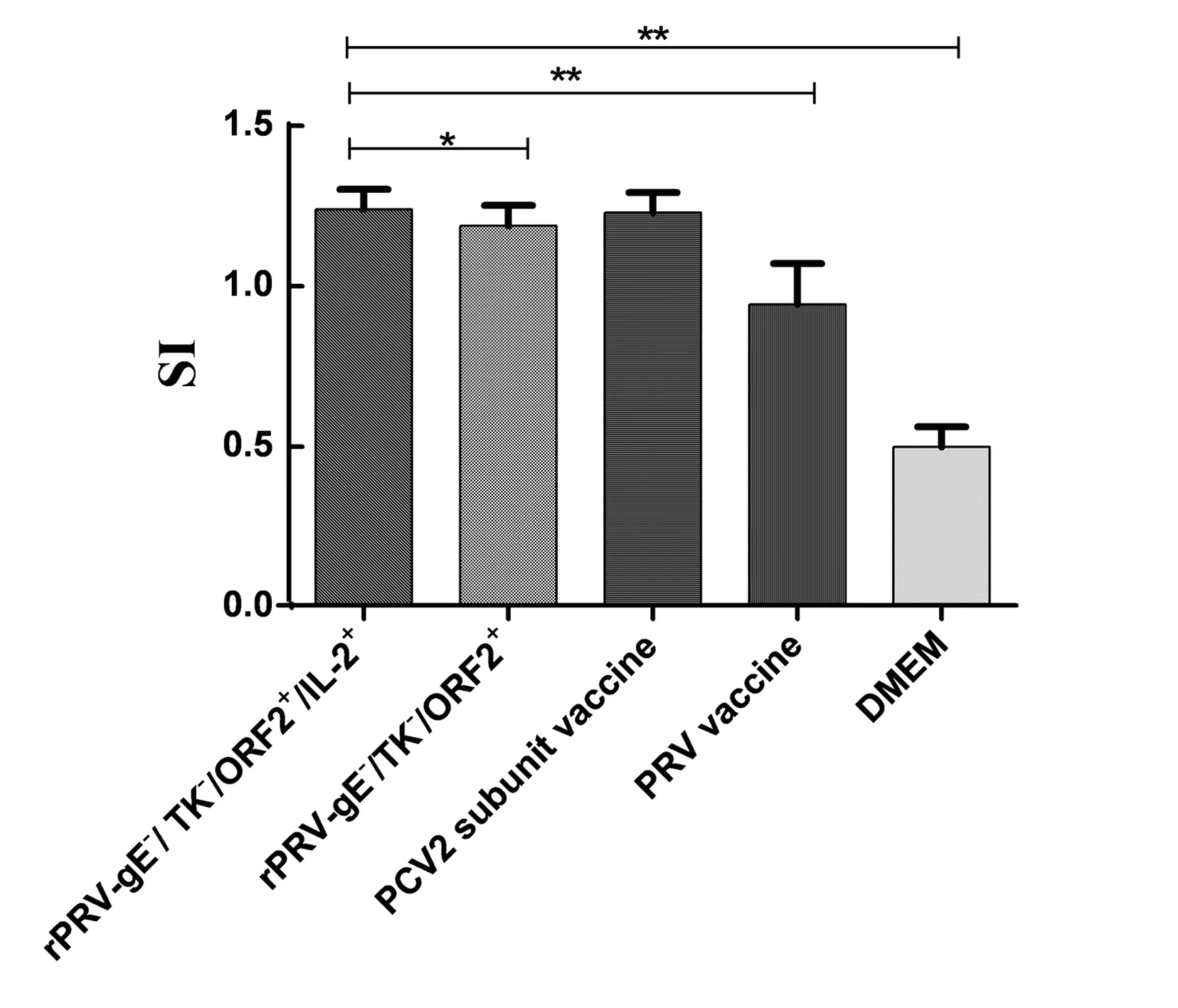
2.5 免疫小鼠抗PRV中和抗体水平免疫小鼠抗PRV中和抗体结果见图4,rPRV-gE-/TK-/ORF2+/IL-2+与PRV活疫苗免疫组在首免后2周均产生了抗PRV中和抗体,且中和抗体水平与rPRV-gE-/TK-/ORF2+免疫组相比差异显著(0.01 注:*.0.01 2.6 免疫小鼠脾脏T淋巴细胞转化试验及细胞因子的检测 2.6.1免疫小鼠脾脏T淋巴细胞转化试验 免疫小鼠脾脏淋巴细胞增殖活性结果显示,rPRV-gE-/TK-/ORF2+/IL-2+和PCV2亚单位疫苗免疫组的脾脏淋巴细胞受Cap蛋白刺激后增殖最为明显,淋巴细胞体积变大、数量增多,DMEM组淋巴细胞状态没有明显变化,说明重组病毒能诱导T淋巴细胞的增殖。从图5可知,rPRV-gE-/TK-/ORF2+/IL-2+免疫组与DMEM对照组和PRV活疫苗免疫组相比小鼠脾脏淋巴细胞增殖活性差异极显著(P<0.01),与rPRV-gE-/TK-/ORF2+免疫组相比差异显著(0.01 图5 免疫小鼠T淋巴细胞增殖活性 2.6.2免疫小鼠脾脏T淋巴细胞亚群及相关细胞因子检测 免疫小鼠脾脏CD3+、CD4+和CD8+T淋巴细胞亚群变化及细胞因子的分泌水平见图6。与DMEM对照组相比,rPRV-gE-/TK-/ORF2+/IL-2+、rPRV-gE-/TK-/ORF2+、PCV2亚单位疫苗及PRV活疫苗免疫组的CD3+、CD4+和CD8+T淋巴细胞的百分比及分泌特异性IFN-γ、IL-4和IL-12的水平均明显升高,且rPRV-gE-/TK-/ORF2+/IL-2+免疫组最高,说明重组病毒rPRV-gE-/TK-/ORF2+/IL-2+能引发小鼠的细胞免疫应答,诱导产生针对Cap蛋白的Th1型和Th2型免疫应答。 A~C.为CD3+、CD4+和CD8+T淋巴细胞水平;D.PCV2 Cap蛋白特异性T淋巴细胞因子表达 2011年底,PRV变异株在我国猪场出现,现有商品化疫苗的保护效力显著下降,不能有效阻断其传播和流行[13]。PRV宿主范围广、基因组大,可供外源基因插入或替代,缺失一个或多个病毒复制非必需基因,病毒毒力可减弱,而自身繁殖和免疫原性不受影响,携带外源抗原基因进入机体内,可刺激机体同时产生对PRV和外源抗原的免疫应答,且免疫原性持久,克服了灭活疫苗和弱毒疫苗的缺点[14-15]。动物机体出现淋巴细胞减少和免疫功能抑制等特征是感染PCV2的重要标志[16]。CD3+代表全T淋巴细胞,包括辅助型T细胞CD4+和杀伤型T细胞CD8+。CD8+可直接杀伤靶细胞,CD4+协调免疫细胞间的相互作用。Th1分泌IFN-γ和IL-12促进细胞免疫,Th2分泌IL-4促进体液免疫。因此CD3+、CD4+和CD8+T淋巴细胞及特异性IFN-γ、IL-4和IL-12细胞因子的水平变化趋势可以间接反映机体免疫功能。 本研究中PCV2间接ELISA和PRV血清中和试验结果显示,IL-2基因可以有效增强机体特异性体液免疫作用,但ELISA试验中抗体水平略低于PCV2亚单位疫苗免疫组。由于本研究PCV2亚单位疫苗是用杆状病毒表达系统表达Cap VLPs,通过纯化和浓缩后研制的商品化疫苗,其抗原量要高于rPRV-gE-/TK-/ORF2+/IL-2+重组病毒表达的Cap蛋白量,所以导致PCV2亚单位疫苗免疫组的抗PCV2抗体水平高于rPRV-gE-/TK-/ORF2+/IL-2+免疫组,因此要提高重组病毒中外源蛋白的表达量和提高病毒的纯度。鼠脾淋巴细胞增殖试验显示,rPRV-gE-/TK-/ORF2+/IL-2+免疫组小鼠脾淋巴细胞增殖反应明显高于同等条件下的其他免疫组。细胞亚群及相关因子检测显示,与其他组相比 rPRV-gE-/TK-/ORF2+/IL-2+免疫组的小鼠脾淋巴细胞中的CD3+、CD4+和CD8+T淋巴细胞的百分比明显增加,且IFN-γ、IL-4和IL-12细胞因子的分泌水平明显升高。 综上,PCV2 YY株ORF2和猪IL-2插入到rPRV-gE-/TK-/EGFP+病毒缺失的TK基因位点,获得的重组病毒rPRV-gE-/TK-/ORF2+/IL-2+接种小鼠后均能诱导机体产生不同程度的体液和细胞免疫。重组病毒rPRV-gE-/TK-/ORF2+/IL-2+比无 IL-2的rPRV-gE-/TK-/ORF2+免疫组在抗PCV2抗体水平、抗PRV中和抗体水平、T淋巴细胞增殖反应及T淋巴细胞亚群和相关因子水平均显著增加,进一步证实了同时携带细胞因子和保护性抗原的疫苗明显比单独含有抗原的疫苗诱导产生更强的免疫。本试验所用动物为小鼠而并非本属动物猪,对IL-2作为免疫佐剂的效果是否有一定影响,还需进一步开展对猪的免疫原性试验进行验证。本研究以猪IL-2基因作为免疫佐剂,为研发同时预防PR和PCV感染相关疾病的疫苗提供候选疫苗株。

3 讨论

