mgrB和mcr-1在耐多黏菌素猪大肠杆菌中的作用
邝启红,李文娅,李垠树,贾雅婷,胡功政,苑 丽 (河南农业大学 动物医学学院,河南 郑州 450046)
多黏菌素是一种广谱抗革兰阴性菌的阳离子多肽,主要用于治疗多重耐药革兰阴性菌感染,尤其是产碳青霉烯酶肠杆菌科细菌导致的感染。近年来,耐多黏菌素的肠杆菌科细菌日益增多,导致人医和兽医临床防控耐药革兰阴性菌感染更加困难。目前已阐明多黏菌素的耐药机制主要有2种:染色体介导的双组分信号转导系统PmrAB和PhoPQ的表达量升高及其上游阻遏蛋白MgrB的特异性突变和质粒介导的多黏菌素耐药基因mcr[1-2]。mcr基因具有磷酸乙醇胺转移酶活性,细菌产mcr后会导致菌体内磷酸乙醇胺合成增多,从而修饰类脂A,并最终导致细菌对黏菌素耐药[1]。MgrB是一种47个氨基酸编码的跨膜蛋白[3],是MgrB-PhoPQ-PmrHFIJKLM信号通路中的负性调控蛋白[4-5],可通过抑制PhoQ组氨酸激酶的活性,阻遏磷酸基团转移给PhoP,从而抑制下游操纵子的表达[6]。近来有研究表明:mgrB基因的缺失、变异、插入或截断失活以及mgrB启动子区突变或插入失活,都会导致PhoPQ系统和pmrHFIJKLM操纵子过表达[7-9],进而造成细菌对多黏菌素耐药。
细菌的mgrB基因变异或携带mcr基因都会导致其对多黏菌素耐药,但目前尚不清楚在耐多黏菌素大肠杆菌中这两种机制存在的差异。本试验对收集的165株猪源大肠杆菌采用微量肉汤稀释法测定多黏菌素的敏感性,并对耐药菌株的mcr-1~mcr-5基因以及mgrB基因进行检测及测序比对分析,进而评估mgrB和mcr-1在大肠杆菌对多黏菌素耐药的贡献,为防控多黏菌素耐药的传播和延缓耐药趋势提供试验数据和依据。
1 材料与方法
1.1 菌株和质粒165株大肠杆菌由本实验室于2016—2017年自安徽、河南、湖南、湖北、江西、山西、陕西7省不同地区猪病料样本(肠、肺脏、淋巴、脾脏、肝脏等)和健康猪肛门拭子采集分离保存;大肠埃希菌ATCC25922(购自中国普通微生物菌种保存中心)为质控菌;pBAD/HisA质粒(由本实验室保存)具有氨苄西林抗性。
1.2 主要试剂和药品LB肉汤、LB琼脂等培养基均购自北京奥博星生物技术有限责任公司;质粒小提试剂盒和DNA胶回收试剂盒购自美国OMEGA公司;Primer STAR高保真酶,XholⅠ和Hind Ⅲ内切酶,T4DNA连接酶和荧光染料Mix等均购自TaKaRa公司;DL2000、DL5000 Marker为北京擎科新业生物科技有限公司产品;氨苄西林钠购自北京索莱宝科技有限公司;多黏菌素(含量90%)是由河南牧翔动物药业有限公司提供。
1.3 菌株复苏取甘油保存的菌种并充分振荡,按1∶100比例无菌接种于3 mL新鲜的LB肉汤,置于37℃振荡培养12 h,用无菌接种环蘸取一环菌液划线接种于LB琼脂平板上,倒置于37℃温箱中培养12 h,后挑取单个菌落接种于LB肉汤,37℃振荡培养12 h后备用。
1.4 质粒提取pBAD/HisA质粒的提取按照美国OMEGA公司的质粒小量提取试剂盒说明书进行,将收集的液体置于-20℃保存。
1.5 药物敏感性测定
1.5.1药液的配制 用分析天平称取多黏菌素和氨苄西林钠适量,无菌配制为5 120 mg/L,0.22 μm滤膜过滤分装至1.5 mL EP管中,置于-20℃保存备用。
1.5.2MIC值测定 采用微量肉汤稀释法[10]测定多黏菌素对165株猪大肠杆菌的最小抑菌浓度(minimal inhibitory concertration,MIC),结果按照美国临床实验室标准化协会(CLSI)标准判读,大肠杆菌ATCC25922为质控菌。
1.6 多黏菌素耐药基因的检测
1.6.1菌株DNA提取 采用常规煮沸法[11]提取各菌株的DNA,-20℃保存备用。
1.6.2引物设计 根据GenBank公布的mgrB核苷酸序列,应用primer 5.0分析软件设计引物,mcr-1~mcr-5引物序列参考相关文献,由上海生物工程有限责任公司合成。其中,mgrB-F/mgrB-R包含mgrB基因及其上游启动子区,引物序列见表1。

表1 多黏菌素耐药基因PCR扩增的引物序列
1.6.3多黏菌素耐药基因比对分析 PCR检测并测序分析耐药猪源大肠杆菌的mcr-1~mcr-5流行情况。mgrB基因全序列及其启动子区经PCR扩增后,产物经胶回收、纯化后,用T4DNA Ligase 4℃过夜连接至pBAD/HisA质粒,连接产物用化学转化法转入DH5α感受态细胞,用引物mgrB-F/mgrB-R进行PCR验证,并提取重组质粒经XhoⅠ和Hind Ⅲ双酶切鉴定,送至上海生物工程股份有限公司测序,测序结果用DNAStar软件分析,以大肠杆菌K-12 MG1655为参照菌,进行同源性比对分析。
2 结果
2.1 猪大肠杆菌对多黏菌素的敏感性测定多黏菌素对165株猪大肠杆菌的MIC值分布见图1,其中147株(89.1%)对多黏菌素耐药,MIC的范围为4~32 mg/L,且MIC=16 mg/L时菌株数最多,有82株。MIC值≤1 mg/L共有18株,敏感率为10.9%。
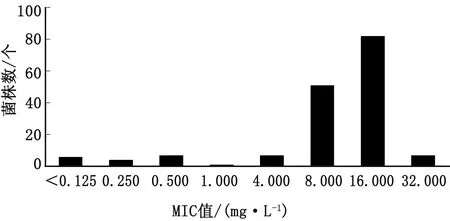
图1 165株猪源大肠杆菌对多黏菌素的MIC值分布
2.2mcr耐药基因的鉴定PCR检测耐多黏菌素猪大肠杆菌的mcr-1~mcr-5基因。结果显示,147株耐多黏菌素的猪大肠杆菌中除EPF25菌未检出mcr基因外,其余146株菌都仅携带mcr-1基因(图2),所有菌株均未检出mcr-2~mcr-5基因。
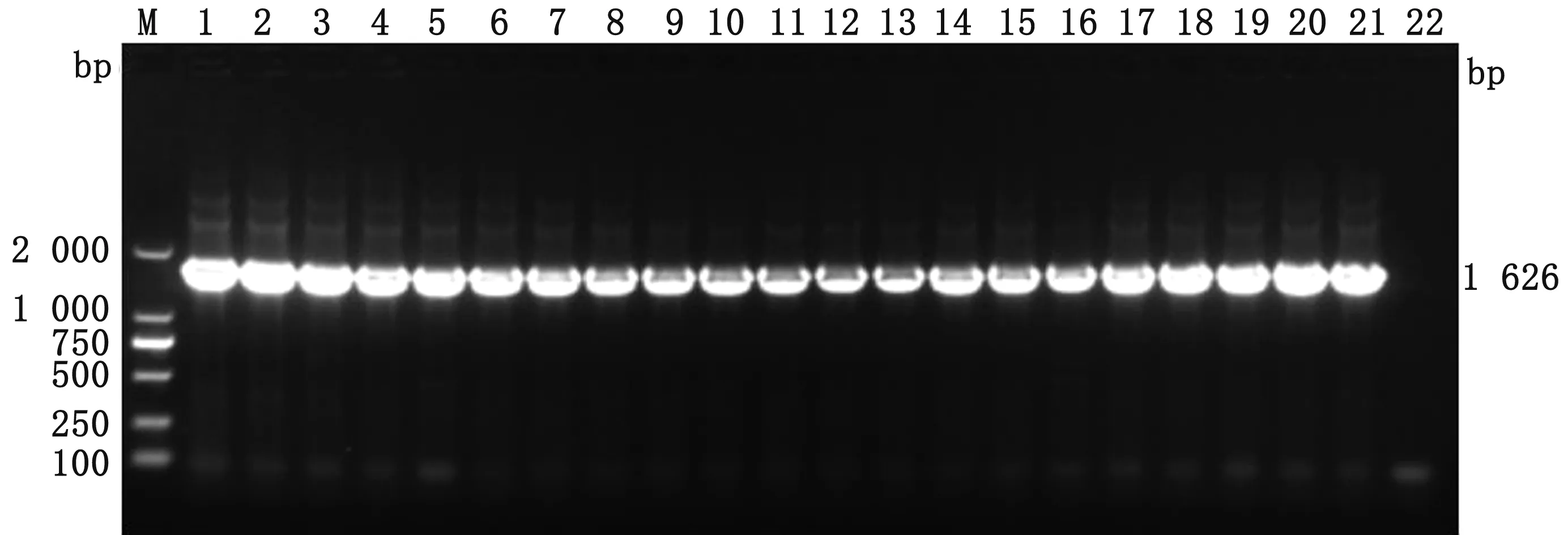
M.DL2000 DNA Marker;1~20.部分多黏菌素耐药菌;21.阳性对照;22.阴性对照
2.3mgrB基因的突变将mgrB基因及其启动子区连接pBAD/HisA载体并转入感受态细胞DH5α后,提取重组质粒,PCR鉴定扩增出预期大小的片段并经XhoⅠ和HindⅢ双酶切证实为mgrB-pBAD/HisA重组质粒(图3)。
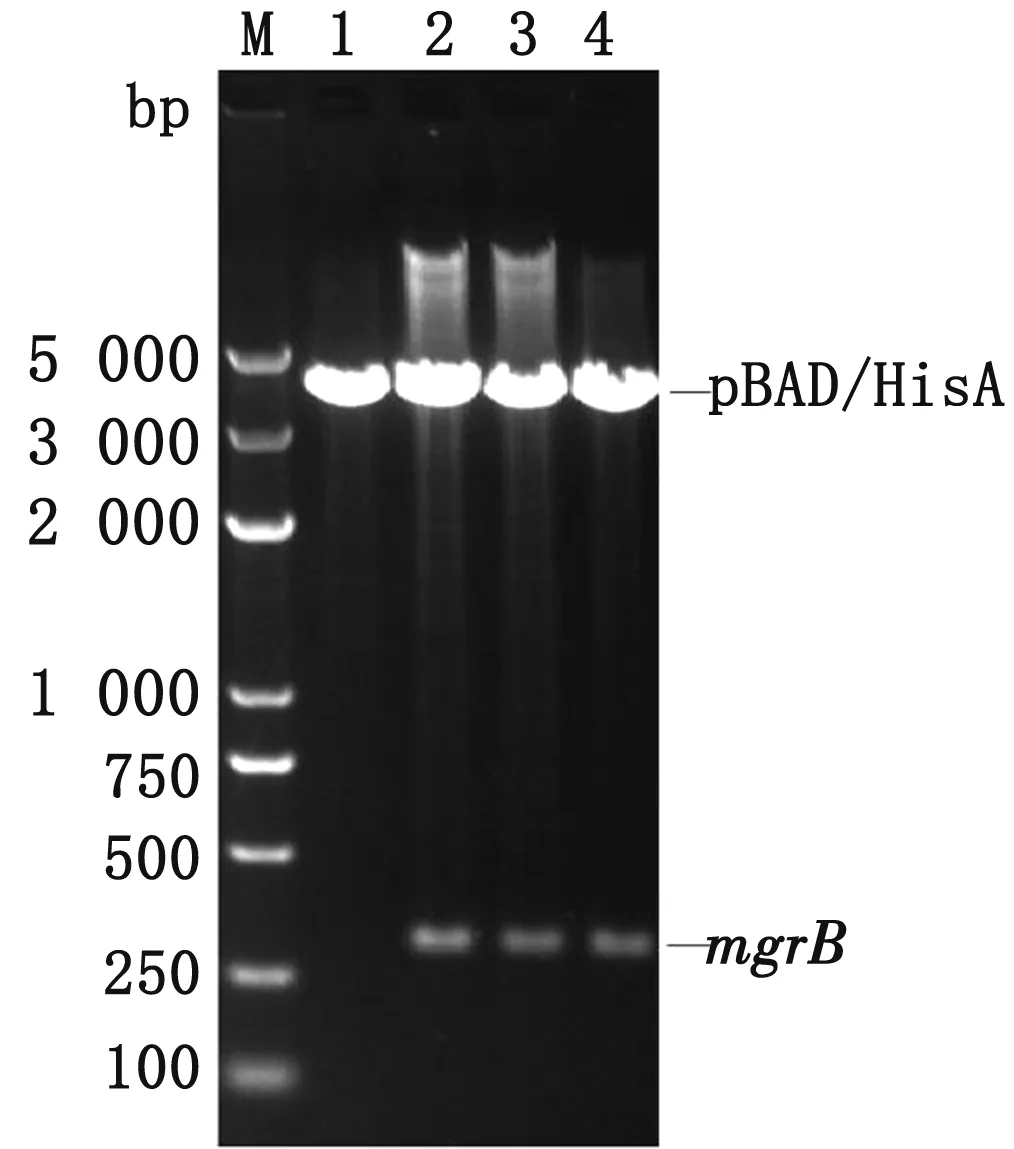
M.DL5000 DNA Marker;1.pBAD/HisA;2~4.pBAD/HisA-mgrB
以大肠杆菌K-12MG1655(GenBank号:NZ_CP014348.1)为参照菌株,mgrB基因经PCR检测并测序比对分析。结果表明,mgrB启动子区变异的有104株(70.7%,104/147),且均携带mcr-1基因,其中99株菌有相同的碱基突变位点,均为mgrB编码区上游12 bp处的A→G碱基;3株菌(E176、E186、E224)含2个碱基突变位点:编码区上游12 bp 处的AG碱基和27 bp处的C→T碱基突变;E193菌(编码区上游44 bp处G→A碱基突变)和EPD04菌(编码区上游38 bp处C→G碱基突变)仅含1个突变位点,且与上述不同。mgrB编码区氨基酸突变的有11株(0.07%,11/147),其中仅有EPF25菌不含mcr基因;有6株菌(EPA05、EPA06、EPA09、EPA25、EPA27和EPD11)均为33位的谷氨酰胺突变为精氨酸,有3株菌(E8、E180、E221)是31位的天冬氨酸突变为甘氨酸,EPD23菌为33位的谷氨酰胺突变为组氨酸,EPF25菌为42位的天冬酰胺突变为丝氨酸。代表性菌株mgrB基因及其启动子区序列已提交至NCBI,获得的GenBank序列号见表2。比较多黏菌素对受试菌的MIC值及耐药菌mcr-1基因、mgrB变异之间的关系发现它们之间的相关性不明显,猪大肠杆菌对多黏菌素耐药是由于mcr基因和mgrB变异共同作用的结果。

表2 耐多黏菌素的大肠杆菌mgrB(与K-12MG1655相比)的突变位点
3 讨论
近年来,mgrB基因的突变、缺失或者插入序列在多黏菌素耐药肺炎克雷伯菌中已有报道,且已被证明在肺炎克雷伯菌黏菌素耐药中起重要作用[4,14-15]。大肠杆菌多黏菌素耐药机制的相关研究主要集中于质粒介导的mcr基因[8,16]。肺炎克雷伯菌的mgrB启动子区插入类IS903序列可引起mgrB表达量显著下降,从而导致PhoPQ系统和pmrHFIJKLM操纵子过表达,最终使该菌对多黏菌素表现耐药[17]。同时,OLAITAN等[18]在患者中分离的耐多黏菌素肺炎克雷伯菌中的mgrB启动子区也发现IS903插入序列。HAEILI等[19]在mgrB启动子区发现IS插入序列。但有关mgrB启动子区碱基突变的相关报道尚未见。本研究在多黏菌素耐药的147株菌中检测到104株mgrB启动子区碱基突变,推测mgrB启动子区突变可能会导致mgrB基因表达减少,进而导致PhoPQ系统上调,降低大肠杆菌对多黏菌素的敏感性,但尚须要进一步研究证实。
本试验结果表明有11株耐多黏菌素猪大肠杆菌的mgrB编码区氨基酸发生突变,且以往研究已证明这3处氨基酸突变与细菌对多黏菌素耐药相关。EPF25菌的mgrB基因发生N42S突变,该突变与DAGHER等[20]在黎巴嫩医院中分离的耐多黏菌素阴沟肠杆菌的mgrB基因中的突变相同;2017年,POIREL等[21]也在耐多黏菌素动物源肺炎克雷伯菌中的mgrB中发现了N42Y突变。2019年,HUANG等[22]从中国食用动物收集的大肠杆菌分离株中检出mgrB基因的D31G突变,该突变也同样发生在本试验的E8、E180和E221等3菌株中。2019年,KIM等[23]在韩国猪源大肠杆菌mcr基因阴性分离株中检出mgrB的Q33R突变,而本试验在大肠杆菌EPA05、EPA06、EPA09、EPA25、EPA27和EPD11等6株菌中检出存在同样的氨基酸突变。推断mgrB基因的31、33和42位的氨基酸突变与细菌对多黏菌素产生耐药密切相关。
2018年,ZHANG等[24]发现当肺炎克雷伯菌中因mgrB失活而呈现对多黏菌素高度耐药后,既使该菌株再获得mcr-1基因也不会引起其对多黏菌素耐药程度的改变,故猜测失活的MgrB可能掩盖了mcr-1基因的功能。而齐小梅等[7]在大肠杆菌耐药菌中未检测到mgrB突变,并认为大肠杆菌对黏菌素耐药的主要原因是获得mcr-1基因。本试验比较多黏菌素对受试菌的MIC值及耐药菌mcr-1基因、mgrB变异之间的关系发现它们之间的相关性不明显,说明猪大肠杆菌对多黏菌素耐药是由于mcr基因和mgrB变异共同作用的结果。

