转移性心包黏液样脂肪肉瘤1例报道并文献复习
冯润林,华 结,奎 翔,李如懿,易晓佳,王 燕,陶燕萍
1.昆明医科大学第二附属医院病理科,云南 昆明 650101;2.昆明市第三人民医院急诊科,云南 昆明 650000
原发性心包恶性肿瘤较为少见,以心包恶性间皮瘤居多,原发性心包脂肪肉瘤极为罕见,目前国内外报道甚少[1-2],而继发性心脏恶性病变的患病率是原发性心脏恶性肿瘤的20~40倍。为进一步提高对原发性心包恶性肿瘤的认识,避免临床漏诊及误诊,现结合相关文献,就1例转移性心包黏液样脂肪肉瘤(myxoid liposarcoma,MLPS)的临床病理学特征、鉴别诊断及相关预后予以报道。
1 病例资料
患者为女性,39岁,因反复胸痛、胸闷2年,于2017年10月13日到昆明医科大学第二附属医院就诊。患者无明显诱因出现胸闷、胸痛不适,休息后可缓解,不伴咳嗽、咳痰等症状,夜间平卧入睡无憋醒,正常活动未受影响,上述症状反复出现。既往史:患者曾于2年前行四肢CT检查(图1),示左下肢中下段混杂密度肿块影,其内见脂肪密度影,部分突入皮下,考虑肌肉恶性肿瘤可能性大。四肢体检显示,左下肢大腿外侧可见一肿物,大小约28 cm×15 cm×6 cm,靠近膝关节处肿物明显,质软,活动度差,无压痛,表浅静脉显露。曾行左大腿包块切除术,术后病理学检查诊断为MLPS。2017年10月13日,胸部CT示左前纵隔点片状囊状低密度灶,多考虑心包囊肿(图2)。门诊以心包囊肿入院,胸部体检未见明确异常,左下肢大腿外侧可见一条长约24 cm的手术瘢痕,未扪及肿物。术中见肿块位于心肌与心包之间,心包外血管增粗,切开部分心包后,有鱼肉状组织突出,肿瘤组织自左右心室分隔处表面长出,遂将心包肿瘤切除送去进行病理学检查。
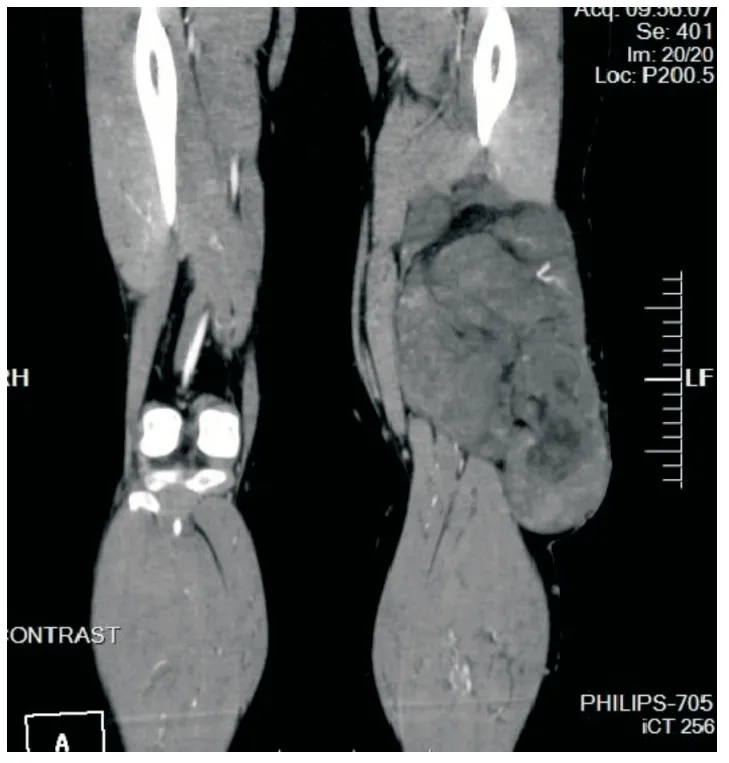
图1 MLPS位于左下肢中下段,呈混杂密度肿块影,部分突入皮下(大腿CT)Fig.1 The tumor is located in the middle and lower part of the left lower limb,showing a mixed density mass,partially protruding into the skin (thigh CT)

图2 MLPS位于左前纵隔,呈点片状囊状低密度灶(心脏CT)Fig.2 The tumor is located in the left anterior mediastinum with a patchy saclike low density lesion (heart CT)
2 病理学检查结果
巨检见灰白、灰褐色胶冻状质软碎组织一堆,总大小19.0 cm×18.0 cm×3.6 cm,为多结节状,切面灰黄色,未见出血及坏死病变。镜检见肿瘤细胞由疏松区和相对密集区构成,疏松区黏液样基质丰富,周边细胞受压形成类似“肺水肿”或淋巴管瘤结构(图3A),密集区由小而圆的小圆细胞构成,间质内无黏液或含有少量黏液。肿瘤细胞内可见分支状的血管网,类似于鸡爪状。部分区域见原始间叶细胞向接近成熟的脂肪细胞分化。部分瘤细胞为圆形,核位于中央,呈现空泡状或泡沫状,部分瘤细胞的细胞质及细胞核被内含的脂滴推向一侧而呈印戒样脂肪母细胞(图3B)。高倍镜下见不同程度分化的脂肪母细胞及数量不等的病理性核分裂象。免疫组织化学标记显示,CD31、CD34呈阳性表达,S100呈局灶弱阳性表达(图3C),其余D2-40、CKpan、EMA、Bcl-2、WT-1、P53、SMA、P53、MC、CR、CK7、CD117均为阴性表达,Ki-67增殖指数为15%。病理学检查诊断为MLPS,因肿瘤形态与大腿包块肿瘤形态类似,多考虑大腿MLPS伴心包转移可能。患者术后进行随访,截至2018年11月已随访13个月,患者健在,未见肿瘤复发或转移。

图3 显微镜下MLPS组织形态及免疫组织化学图像Fig.3 Morphology and immunohistochemical image of MLPS under microscope
3 讨 论
MLPS是一种由圆形至卵圆形间叶源性细胞组成的肿瘤,属于脂肪肉瘤的一种亚型。MLPS在所有软组织肉瘤中,也仅占5%~10%[3]。脂肪肉瘤亚型常分为高分化、去分化、黏液样、多形性及非特殊类型4种[4]。其中MLPS为最常见的类型,占脂肪肉瘤的15%~20%[5]。MLPS发病高峰年龄段为30~50岁,而发生在22岁以下儿童及青少年脂肪肉瘤主要为MLPS。男女性均会发生,无明显的性别差异。肿瘤好发于下肢深部软组织内,特别是大腿肌肉和腘窝,占60%~70%,而发生在心包者仅占7.7%。亦有研究[6]报道,该肿瘤可发生在眼眶下、舌、食管、乳腺、脊柱及卵巢等部位。发生于肢体者,临床表现为体积较大的无痛性肿块。临床易误诊为良性肿瘤,常因肿瘤切除不干净而引起局部复发或远处转移。与发生在肢体的其他类型的黏液样肉瘤不同的是,MLPS常转移到一些不常见的部位,如腋窝、胸膜、卵巢和心包等处[7-8]。本病例是左大腿MLPS转移至心包所致,与文献记载一致。
MLPS体积通常较大,位于大腿深部肌肉者可达15 cm或更大,位于上肢者可小于5 cm。肿瘤边界清楚,多为结节状,切面呈胶冻状,黄色或灰黄色,含有圆细胞时,可呈实性、灰白色。出血及坏死一般少见。低倍镜下肿瘤常呈结节状分布,由圆形、卵圆形至短梭形的原始间叶细胞、大小不等的印戒样脂肪母细胞、分支状的毛细血管网和富含酸性糖胺聚糖的黏液样基质组成。间质内的薄壁毛细血管网呈丛状或分支状。细胞核无异型性,核分裂象罕见,无巨噬细胞及多核细胞。当细胞质内无脂质时,镜下以前脂肪细胞为主;当细胞质内出现空泡状的脂质时,镜下以印戒样脂肪母细胞为主。Evans[9]报道,根据圆细胞成分在肿瘤内所占比例,将MLPS分为三级:Ⅰ级为<10%;Ⅱ级为10%~25%;Ⅲ级为>25%。典型MLPS中黏液样基质非常丰富,可形成黏液湖改变,类似于“肺水肿”或淋巴管瘤。除此之外,部分区域还会出现软骨化生或血管外皮瘤的区域[10]。对于分化差的MLPS,因形态学不够典型,可以借助MDM2、P16、DDIT3免疫组织化学染色来帮助诊断和鉴别诊断[11-12]。
瘤细胞主要表达S100,最新研究[13]报道,由CTAGB1基因编码的NY-ESO-1在MLPS中阳性率约95%,而在其他一些软组织黏液样肉瘤中不表达。所以NY-ESO-1可与S100联用,用于对MLPS进行诊断和鉴别诊断。90%的MLPS病例遗传学分析显示,特异性的t(12;16)(q13;p11),使得位于12q13上的DDIT3基因(以往称为CHOP基因)与位于16p11上的FUS基因(也称TLS基因)发生融合,产生FUSDDIT3融合性基因,故在实际工作中亦可以采用荧光原位杂交(fluorescencein situhybridization,FISH)检测DDIT3基因相关易位来进一步鉴别MLPS[12,14]。
MLPS需要与发生在心包上的其他肿瘤进行鉴别:①心脏黏液瘤,瘤细胞为细长的梭形或星芒状结构,细胞有时会出现空泡状,与MLPS具有重叠性,但黏液瘤还会出现淋巴细胞、多核巨细胞、肥大细胞及树突状细胞,部分区域会出现含铁血黄素沉着,瘤细胞内无印戒样脂肪母细胞,血管稀疏,无丛状毛细血管网结构。②黏液纤维肉瘤,因肿瘤间质亦呈黏液变形,有的区域可见泡状脂肪母细胞样细胞,有的区域血管也呈丛状排列,因此容易误诊为MLPS,但黏液纤维肉瘤的空泡状细胞为假脂肪母细胞,细胞质内为黏液而非脂滴,故AB-PAS染色为阳性,脂肪染色为阴性。③脉管瘤,MLPS的部分区域因大量黏液样基质聚集而形成黏液糊,形态学类似于脉管瘤,但在黏液糊周边区域及实性区域可见印戒样脂肪母细胞,而脉管瘤无此类细胞。④黏液样软骨肉瘤,其瘤细胞为圆形或卵圆形,有时可见空泡状基质为大量的黏液样或黏液软骨样,与MLPS具有一定重叠性,但该肿瘤不具有印戒样脂肪母细胞及丛状毛细血管网,且65%的黏液样软骨肉瘤可检测到EWSR1-NR4A3融合性基因,可通过FISH进行鉴别[15]。
鉴于本例患者2年前曾有左大腿MLPS病史,并与本次心包肿瘤切除标本病理学形态对比,认为心包肿瘤是因左大腿MLPS转移所致。目前,手术切除对心包肿瘤是最为有效的治疗方法。但由于该肿瘤与周边组织粘连严重,无法进行彻底切除,因此有复发的可能。MLPS对放疗较为敏感,特别是不含有圆细胞成分者,术后辅以化疗,具有较好的局部控制率[16],有学者认为手术切除加放疗对延长转移性MLPS患者的生存期非常有效[17]。MLPS患者的预后取决于圆细胞成分在肿瘤之内所占的比例,比值越高,预后越差。肿瘤体积大、核分裂指数高被认为是预后不良的病理学独立指标[18]。本例患者术后未行放疗,截至2018年11月已随访13个月,患者仍健在。由于MLPS目前报道甚少,对其临床特征、生物学行为及病理组织学之间的关系还需进一步探讨。

