新型冠状病毒M 蛋白结构和B 细胞表位预测
叶晓鲜,李明洋,朱珊丽,崔怀瑞,王昱,张丽芳
温州医科大学仁济学院基础医学部解剖教研室
分子病毒与免疫研究所,浙江温州325035
2019 年12 月,部分地区陆续出现感染新型冠状病毒(SARS-CoV-2)的肺炎患者,2003 年 2 月,我国广东暴发 SARS,2012 年 9 月,沙特暴发 MERS,这 3 次疫情均由冠状病毒(coronavirus,CoV)引发,患者均表现出严重的急性呼吸系统综合征。SARS-CoV-2 迅速在全世界范围内传播,截至目前,国内确诊病例超过10 万例,国外确诊病例超过1.3 亿例,疫情十分严峻,严重危害了人类健康,目前尚无特效药物进行防治[1]。
冠状病毒为具有衣壳(螺旋形状)和外套膜的线性单股正链 RNA 病毒,其基因大小为29 800 bp[2-3],是已知RNA 病毒中最长的。冠状病毒间存在4 种较为保守的结构蛋白,由基因组的3′端编码,分别为S 蛋白(表面刺突蛋白)、E 蛋白(小包膜蛋白)、M蛋白(外膜蛋白)、N 蛋白(核衣壳蛋白[2,4]),主要参与病毒复制与感染过程。M 蛋白为一种跨膜糖蛋白,长222 个aa,在双层脂包膜的外表面有N-亲水性末端突出,可使宿主产生中和性抗体,其后面有3 个疏水的跨膜区,在第3 个跨膜区后面存在一段高度保守的氨基酸序列SmWSFNPE(SARS-CoV 中的也为SmWSFNPE)。C-末端亲水区位于病毒粒子内部,在病毒粒子出芽时进入病毒粒子核心,促进膜的弯曲变形,作用于病毒核壳体[5]。
本研究以SARS-CoV-2 M 蛋白的氨基酸序列为基础,应用计算机网络生物信息学软件,对其结构及B 细胞表位进行预测,为该蛋白的功能研究及疫苗研发奠定理论基础。
1 材料与方法
1.1 SARS-CoV-2 M 蛋白氨基酸序列获得及理化性质预测 通过NCBI GenBank 数据库检索获得SARS-CoV-2 M 蛋白的氨基酸序列,应用ExPASy 在线软件中的ProtParam 预测其理化性质。
1.2 SARS-CoV-2 M 蛋白的二级结构及三级结构预测 应用ExPASy 在线软件中的SOPMA 与GOR综合预测M 蛋白的二级结构;应用ExPASy 在线软件中的SWISS-MODEL 预测其三级结构。
1.3 SARS-CoV-2 M 蛋白的跨膜区域预测 应用ExPASy 在线软件中的 TMHMM、Phobius 预测 M 蛋白的跨膜区域。
1.4 SARS-CoV-2 M 蛋白的亲水性、表面可及性、抗原性、极性、柔韧性参数预测 应用ExPASy 在线软件中的 PROSCALE 与 DNASTAR 预测 M 蛋白的 HOOPWOODS 亲水性[6]、Janin 表面可及性、Jameson-Wolf抗原性、Zimmerman 极性[7]与柔韧性。
1.5 SARS-CoV-2 M 蛋白的B 细胞表位与其他冠状病毒属的同源性分析 应用吴玉章等[8]建立的抗原性指数(antigenic Index,AI)方法,并结合上述得到的多种参数综合预测SARS-CoV-2 M 蛋白的B 细胞优势表位。应用Vector NTI 对SARS-CoV-2 M 蛋白与其他RNA 冠状病毒的M 蛋白进行同源性比对。
2 结 果
2.1 SARS-CoV-2 M 蛋白氨基酸序列及理化性质 M 蛋白由222 个氨基酸组成,相对分子质量为25 150,初步推断分子式为C1165H1823N303O301S8,等电点(theoretical pI)为9.51,不稳定系数(instability index)为39.14,表明该蛋白为稳定性蛋白,疏水性平均值(grand average of hydropathicity,GRAVY)为 0.446,大于0,表明该蛋白亲水性较差,为疏水性蛋白。氨基酸序列见图1。

图1 SARS-CoV-2 M 蛋白的氨基酸序列(QHD43419.1)Fig.1 Amino acid sequence(QHD43419.1)of SARS-CoV-2 M protein
2.2 SARS-CoV-2 M 蛋白的二级结构及三级结构GOR 预测结果显示,SARS-CoV-2 M 蛋白的二级结构由 46.85% α-螺旋(alpha helix,Hh)、13.51% β-片层(extended strand,Ee)、39.64%无规卷曲(random coil,Cc)组成;SOPMA 预测结果显示,其二级结构由34.68% α-螺旋、21.17% β-片层、37.39%无规卷曲组成。两组参数进行综合分析,M 蛋白主要以α 螺旋为主,主要序列为10-70、80-104。见图2。SWISSMODEL 软件预测SARS-CoV-2 M 蛋白的空间结构见图3。
2.3 SARS-CoV-2 M 蛋白的跨膜区域 TMHMM、Phobius 在线软件预测结果表明,SARS-CoV-2 M 蛋白为跨膜蛋白,见图4。这两种预测软件结果较一致,进行综合分析,膜外区域为1-19、74-77,跨膜区域为 20-39、52-73、79-100,膜内区域为 41-50、104-222,其中跨膜区域的氨基酸序列结构基本以α-螺旋为主。
2.4 SARS-CoV-2 M 蛋白的亲水性、表面可及性、抗原性、极性与柔韧性参数 应用ProtScale 在线软件与DNASTAR 中的protean 综合预测HOPP-WOODS亲水性参数、Zimmerman 极性参数与柔韧性参数、E mini 表现可及参数、Jameson-Wolf 抗原性参数和线性表位预测,各种参数预测结果见图5 和表1。
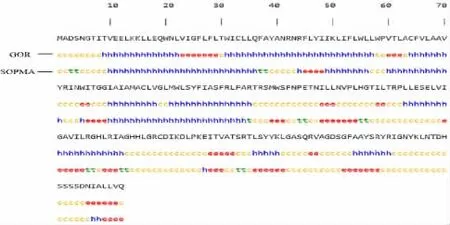
图2 SARS-CoV-2 M 蛋白的二级结构Fig.2 Secondary structure of SARS-CoV-2 M protein
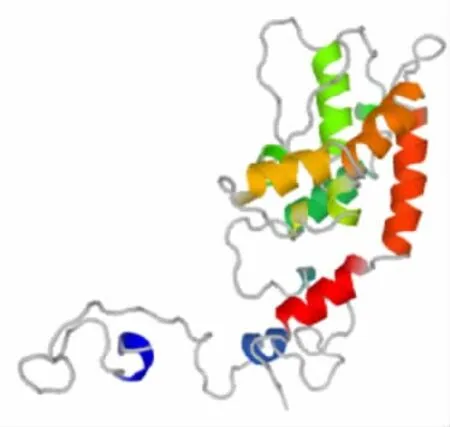
图3 SARS-CoV-2 M 蛋白的三级结构Fig.3 Tertiary structure of SARS-CoV-2 M protein
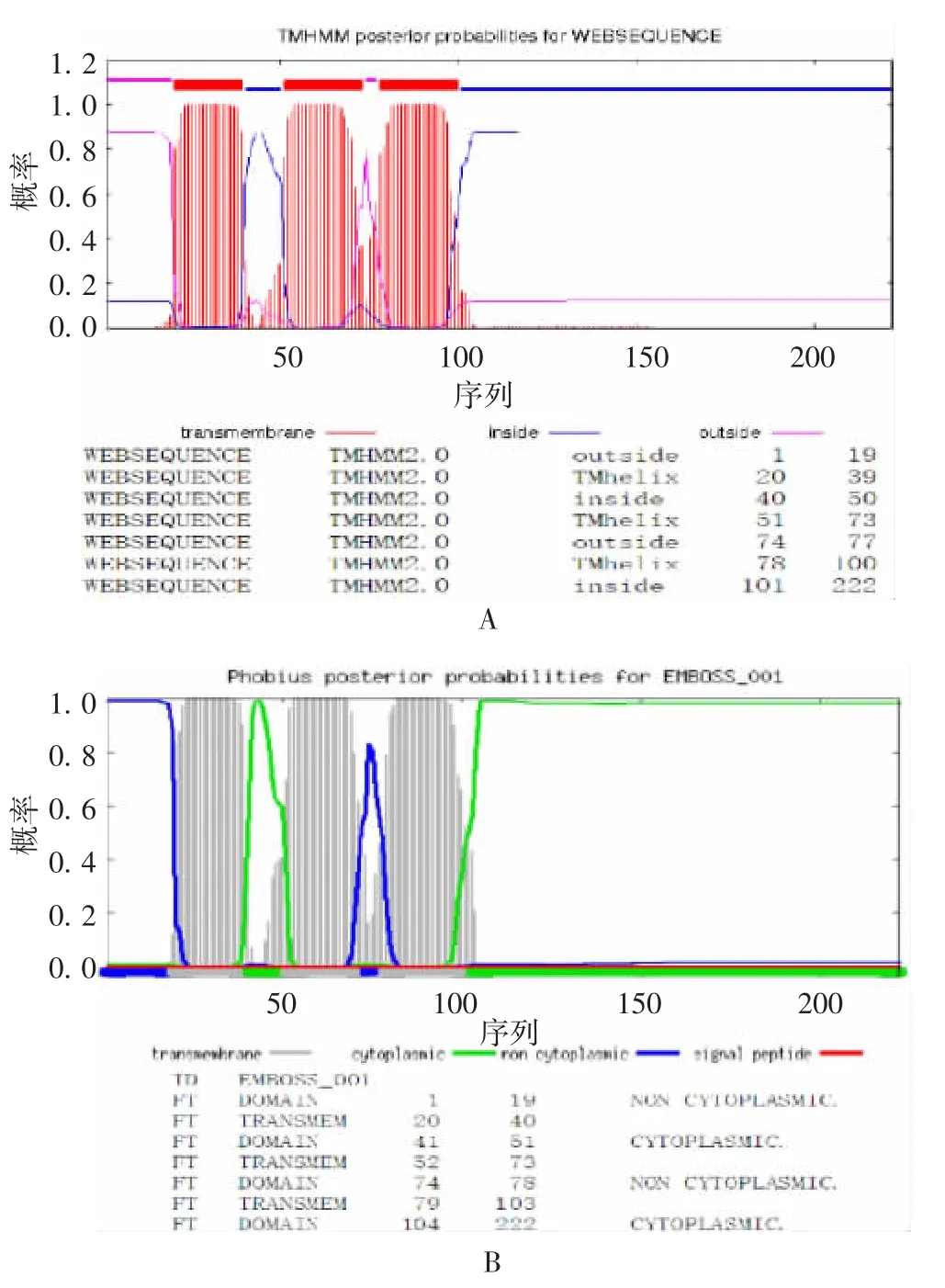
图4 SARS-CoV-2 M 蛋白的跨膜区域预测Fig.4 Prediction of transmembrane region of SARS-CoV-2 M protein

图5 SARS-CoV-2 M 蛋白不同参数预测结果Fig.5 Prediction of various parameters of SARS-CoV-2 M protein
2.5 SARS-CoV-2 M 蛋白的B 细胞优势表位与其他冠状病毒属的同源性 预测结果表明,SARS-CoV-2 M 蛋白可能的B 细胞优势表位肽段为NGTITVEELK(5-14),位于膜外区域,平均AI 为0.177。同源性分析显示,SARS-CoV-2 M 蛋白与SARS-CoV M 蛋白的同源性匹配高达90%,与Bat SARS-like-CoV M 蛋白的同源性匹配高达90%,与MERS-CoV M 蛋白的同源性匹配为40%,与HCoV-229E M 蛋白的同源性为27%,与IBV M 蛋白的同源性为28%,其他同源性匹配结果见表2,序列比对结果见图6。

表1 不同方法预测SARS-CoV-2 M 蛋白B 细胞表位的肽段位置Tab.1 Prediction of peptide location of B cell epitope of SARS-CoV-2 M protein by various methods
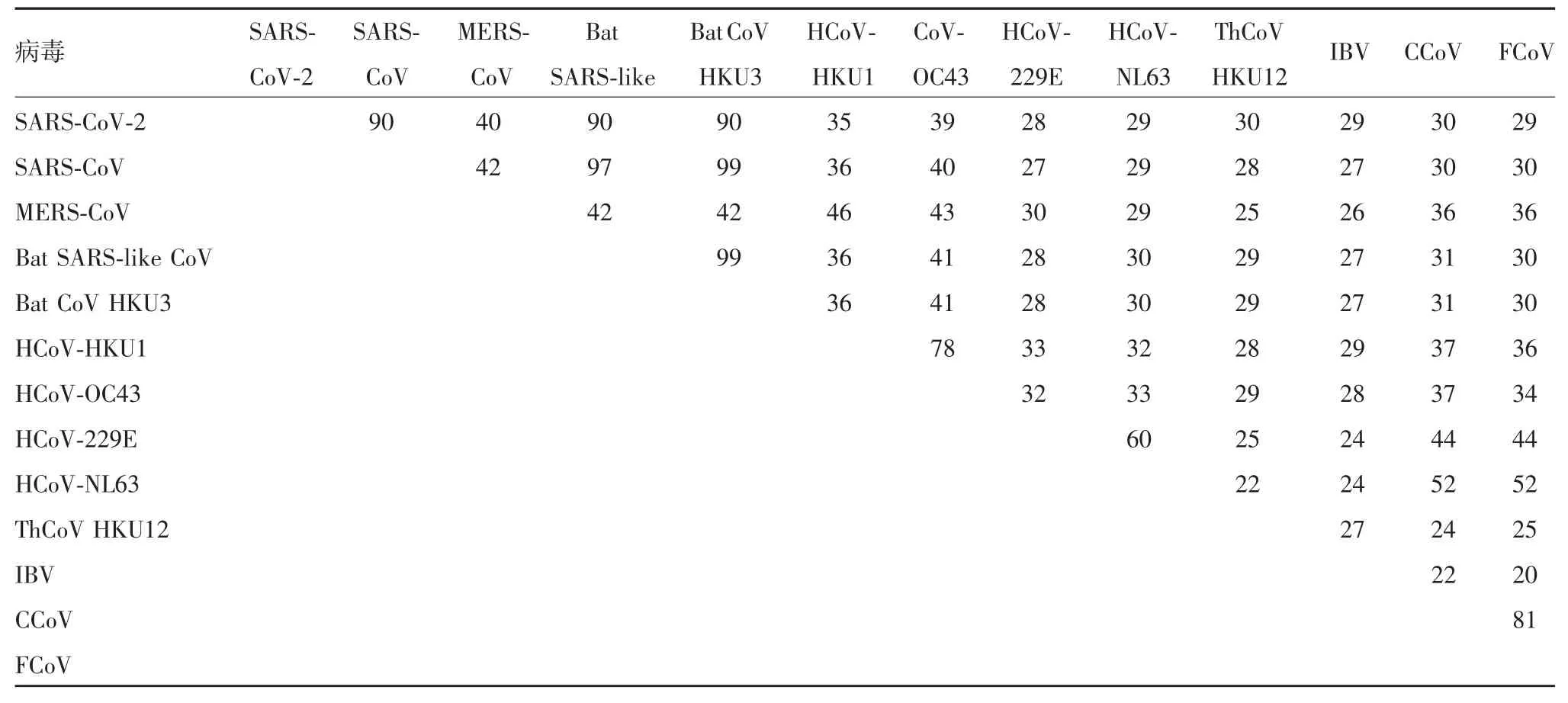
表2 M 蛋白同源性分析(%)Tab.2 Homology of M protein(%)

图6 M 蛋白多序列比对结果Fig.6 Comparison of various sequences of M protein
3 讨 论
长期以来,冠状病毒一直与人类和动物关系密切,2019 年前,已发现6 种冠状病毒能引起人类感染,分别是:引起轻微自限性疾病的HCoV-229E[9]、HCoV-OC43[10]、HCoV-NL63[11]、HCoV-HKU1[12]以及引起人类严重急性呼吸系统综合征的SARS-CoV和 MERS-CoV[13]。SARS-CoV-2 是在 SARS-CoV 和MERS-CoV 后出现的第3 个同样引起人类严重急性呼吸系统综合征的冠状病毒,是唯一在全球广泛传播的非流感病毒。SARS-CoV-2 造成的死亡率低于SARS(9.6%)和 MERS(34.4%),但其在宿主体内的病毒载量模式更接近于流感病毒[14],传染性更强,有长期潜伏在人体内的风险,会出现一定数量的无症状或轻症患者,增大了防控难度[15]。目前我国通过高效严谨的防控,短短2 个月,疫情得到明显控制,而国外90%以上的国家感染人数快速上升,已成为全球公共卫生机构面临的一个艰巨挑战。面对新发传染病,目前最有效方法是采取隔离措施,但只适用于短期,从可能会再次暴发或季节性流行的潜在风险来看,研发与储备安全、有效的疫苗对于疫情防控具有重大意义[16]。
在广泛的进化过程中,许多病毒从其宿主细胞中获得了脂质双层,由此形成具有整合到膜包膜中的病毒结构蛋白的特殊保护性和功能性镶嵌结构。病毒膜蛋白通常在结构和功能上类似于其宿主对应物[17]。M 蛋白是冠状病毒的主要膜蛋白之一,是具有多种生物学功能的主要跨膜糖蛋白,同时也是病毒颗粒中最丰富的糖蛋白[18]。在研究其他冠状病毒的情况下,发现M 蛋白与E、S 和N 蛋白在病毒形态中相互作用,并在病毒装配中起重要作用[19-21]。N 蛋白与病毒RNA 结合形成核衣壳,M 与E 蛋白是病毒组装过程中病毒样颗粒的必要组成部分[20,22-24],M 和E 蛋白与核衣壳之间的相互作用导致病毒出芽。M蛋白胞质尾中的单个酪氨酸对于与SARS-CoV 的S蛋白有效相互作用非常重要,S 蛋白可被掺入病毒包膜,成熟的病毒粒子从细胞中释放出来。IBV 和严重急性呼吸系统综合症 SARS-CoV[19,23]中也已鉴定出M 和S 蛋白之间的相互作用。因此,M 蛋白是病毒装配和形态发生中的关键成分之一,参与复制的调控并将基因组RNA 包装到病毒颗粒。
迄今为止,关于M 蛋白抗原特性的信息有限。冠状病毒的M 蛋白能在感染或由表达M 蛋白的减毒重组病毒免疫的宿主中诱导抗体应答[25-29]。小鼠肝炎病毒(一种小鼠冠状病毒)M 蛋白的单克隆抗体可在体外中和病毒的感染性[30-31],并保护动物免受体内致命病毒的攻击[31]。这些特征使M 蛋白成为开发诊断测试和亚单位疫苗的有吸引力的靶标[25-29,32-35],尽管其抗原决定簇尚待确定。后期有实验对SARSCoV 进行研究,确定了分别位于极端N-末端区域(残基1-31)和内部C-末端区域(残基132-161)的M 蛋白上的两个主要免疫显性表位[36],采集了SARS 患者的半数血清和病毒免疫小鼠及家兔的抗血清,发现来自N-末端抗原决定基的合成肽M1-31 和来自C-末端抗原决定基的M132-161 与来自40 名SARS患者的所有恢复期血清高度反应,但与来自健康献血者的30 份对照血清样品无反应,提示其在SARS血清学诊断中的潜在应用价值,显示两种肽(M1-31和M132-161)均能在免疫兔中诱导高滴度的抗体反应,从而突出了它们的抗原性和免疫原性。这些发现为开发SARS 诊断制剂和疫苗提供了重要信息。多种证据表明,即使蛋白大部分被埋在病毒膜中,其也能在感染或免疫过程中诱导抗体反应[25-29]。尽管尚未定义冠状病毒M 蛋白上的抗原位点,但推测其N-端亲水性胞外域包含负责免疫反应的主要抗原决定簇[37]。尚未确定α 干扰素对病毒感染免疫作用的重要性,但已证明可传播的胃肠炎病毒M蛋白的N-末端暴露区域是α 干扰素在淋巴细胞中的诱导剂。因此,可借助在SARS-CoV 的M 蛋白上发现的免疫优势表位来理解SARS-CoV-2 M 蛋白的免疫原性。
本研究应用生物信息学技术预测SARS-CoV-2 M 蛋白的B 细胞表位,经综合上述参数分析,其可能的B 细胞优势表位位于肽段5-14,位于膜外区域。Vector NTI Advance 11 同源性匹配分析显示,SARSCoV-2 M 蛋白与SARS-CoV M 蛋白的同源性匹配为90%,鉴于其M 蛋白之间的高度相似性,可以目前对SARS-CoV M 蛋白的相关研究结果为研发SARSCoV-2 疫苗提供思路,最终结果需进行实验来鉴定。

