新型冠状病毒2019-nCoV 核酸检测试剂盒(荧光PCR 法)最低检测限的确定
董江锴,黄青红,范娟,黄迎燕,张云涛,杨晓明,3
1.上海捷诺生物科技有限公司,上海201700;2.中国生物技术股份有限公司,北京100029;3.国家联合疫苗工程技术研究中心武汉生物制品研究所有限责任公司,湖北武汉430207
自新型冠状病毒(2019 new coronavirus,2019-nCoV)肺炎疫情暴发以来,各国监管机构和体外诊断试剂(in vitro diagnosis,IVD)企业陆续采取措施,积极助力疫情防控。疫情初期,针对武汉市不明原因肺炎病例快速增多的情况,上海捷诺生物科技有限公司采用独家引进的22 重肺炎微生物核酸检测系统,率先了解到引起本次肺炎疫情可能为一种新型病原体。国内多个研究机构随即确认引起本次肺炎疫情爆发的病原体为一种新型的冠状病毒[1-2]。2020 年1 月22 日国家卫生健康委员会发布《新型冠状病毒感染的肺炎实验室检测技术指南(第二版)》,指导IVD 企业积极投入研发新型冠状病毒2019-nCoV核酸检测试剂盒[3]。国家药品监督局医疗器械技术审评中心于2020 年2 月12 日对外发布《2019 新型冠状病毒核酸检测试剂注册技术审评要点》对核酸检测试剂盒检测性能提出相应要求[4]。同时世界卫生组织(WHO)紧急修订了Emergency Use Listing Procedure(《紧急使用清单(EUL)程序》)后发布《SARSCoV-2 核酸检测试剂申报要求指南》[5]。鉴于2019-nCoV 高传染性的特征,其核酸检测试剂盒的检测准确度和敏感度在疾病诊断和疫情监测方面显得尤为重要。
我国与WHO、FDA 在检测试剂最低检测限研究方法中,制定的要求均采用核酸梯度稀释、多次重复测定并获得 ≥ 95%阳性检出率的浓度水平[6-7]。另外,我国要求至少采用不同来源的3 个具有代表性的2019-nCoV 样本或假病毒,以及另外3 个不同真实临床样本或核酸提取液,分别进行最低检测限确定和验证[3-4]。
由于目前国内外尚无2019-nCoV 病毒核酸定量标准品,本研究将经数字PCR 法进行核酸绝对定量的不同类型临床样本作为定量参考品,通过多样本、多次重复测定的方法,确定了上海捷诺生物科技有限公司研制生产的新型冠状病毒2019-nCoV 核酸检测试剂盒(荧光PCR 法)的最低检测限,并对其进行验证。
1 材料与方法
1.1 样本 来自全国不同省份CDC 及临床医院的45份2019-nCoV 核酸阳性患者的痰液、鼻咽拭子及口咽拭子样本(所有样本均用数字PCR 进行浓度定值)。
1.2 主要试剂及仪器 连续5 批新型冠状病毒2019-nCoV 核酸检测试剂盒(荧光PCR 法)(nCoV20-20001,失效日期:2020-08-26;nCoV2020002,失效日期:2020-09-03;nCoV2020003,失效日期:2020-09-04;nCoV-20-20004,失效日期:2020-09-20;nCoV2020005,失效日期:2020-09-20)均由上海捷诺生物科技有限公司生产;QIAamp Viral RNA Mini Kit(50)提取试剂盒(货号:52904)购自德国QIAGEN 公司;核酸提取或纯化试剂(货号:DA0591)购自中山大学达安基因股份有限公司;实时荧光PCR 仪(ABI 7500 型)购自美国应用生物系统公司。
1.3 估计最低检测限的确定 20 份不同阳性样本核酸(5 份痰液样本、5 份鼻咽拭子样本和10 份口咽拭子样本)分别稀释至 62 500、12 500、2 500、500、100 copies / mL 5 个浓度梯度,用 nCoV2020002 批新型冠状病毒2019-nCoV 核酸检测试剂盒进行检测,均重复3 次,具体操作按试剂盒说明书进行。结果判定:当Ct 值 ≥ 37 或无Ct 值判定为阴性,当Ct值<37 判定为阳性,同1 份样本中2019-nCoV ORF 1ab和N 基因检测同时阳性,则该样本判定为阳性,2个基因中任意一基因检出为阳性,另一基因为阴性时,复检结果至少有1 个基因为阳性,则该样本判定为阳性。
1.4 最低检测限的确定 在初步最低检测限浓度附近设置5 个浓度梯度,将20 份不同阳性样本核酸(5份痰液样本、5 份鼻咽拭子样本和10 份口咽拭子样本)分别稀释至 1 500、700、500、300、150 copies/mL 5 个浓度梯度,用 nCoV2020002、nCoV2020004 及 nCo-V2020005 批新型冠状病毒2019-nCoV 核酸检测试剂盒进行检测,均重复20 次,具体操作按试剂盒说明书进行。结果判定:当Ct 值≥37 或无Ct 值判定为阴性,当Ct 值<37 判定为阳性,同1 份样本中2019-nCoV ORF1ab 和N 基因检测同时阳性,则该样本判定为阳性,2 个基因中任意一基因检出为阳性,另一基因为阴性时,复检结果至少有1 个基因为阳性,则该样本判定为阳性。
1.5 最低检测限的验证 另取25 份不同阳性样本核酸(5 份痰液样本、10 份鼻咽拭子样本和10 份口咽拭子样本)分别稀释至确定的最低检测限浓度(500 copies / mL),用 nCoV2020001、nCoV2020002及nCoV2020003 批新型冠状病毒2019-nCoV 核酸检测试剂盒进行检测,均重复20 次,具体操作按试剂盒说明书进行。结果判定:当Ct 值 ≥ 37 或无Ct 值判定为阴性,当Ct 值<37 判定为阳性,同一份样本中2019-nCoV ORF1ab 和N 基因检测同时阳性,则该样本判定为阳性,2 个基因中任意一基因检出为阳性,另一基因为阴性时,复检结果至少有1 个基因为阳性,则该样本判定为阳性。
2 结 果
2.1 估计最低检测限的确定 20 份阳性样本检测结果显示,样本浓度 ≥ 500 copies / mL 时,ORF1ab和N 基因3 次检测结果均为阳性,且阳性检出率均为100%;病毒核酸浓度为 100 copies / mL 时,阳性检出率均≤55%。因此估计最低检测限水平应在500 copies / mL 附近。见表1。
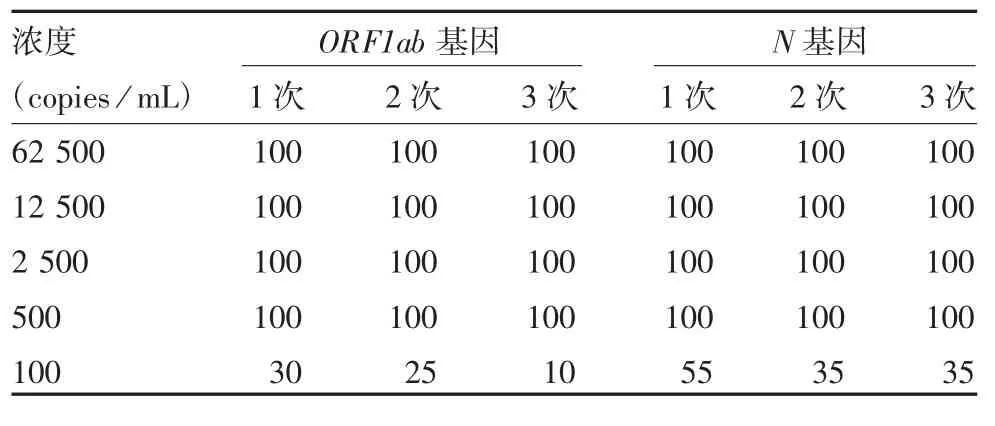
表1 估计最低检测限阳性检出率结果统计(%,n = 20)Tab.1 Positive rate of samples for estimation of minimum detection limit(%,n = 20)
2.2 最低检测限的确定 20 份阳性样本检测结果显示,样本浓度为 500 copies/mL 时,3 批试剂盒的阳性检出率均≥95%,样本浓度为300 及150 copies/mL时,3 批试剂盒阳性检出率均 ≤ 35%,见表2 ~4。因此确定最低检测限为500 copies / mL。
2.3 最低检测限的验证 25 份阳性样本3 批试剂盒重复20 次检测结果显示,3 种不同采样途径样本的阳性检出率均≥95%,见表5。因此,本试剂盒对最低检测限水平的病毒样本可有效检出,验证合格。
表2 nCoV2020002 批试剂盒确定最低检测限阳性检出率结果统计(%,±s,n = 20)Tab.2 Positive rate of samples for determination of minimum detection limit of kit of Lot nCoV2020002(%,±s,n = 20)
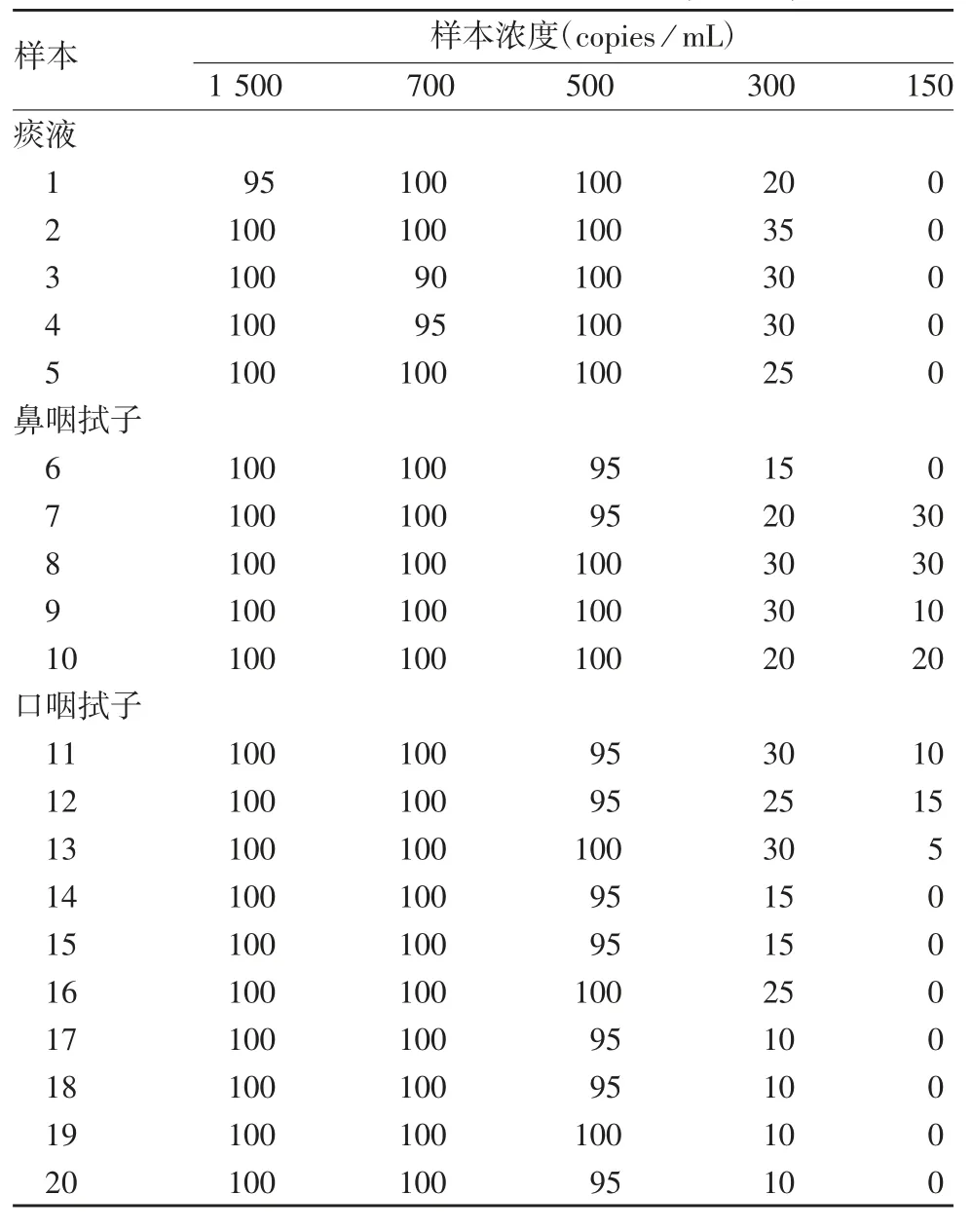
表2 nCoV2020002 批试剂盒确定最低检测限阳性检出率结果统计(%,±s,n = 20)Tab.2 Positive rate of samples for determination of minimum detection limit of kit of Lot nCoV2020002(%,±s,n = 20)
样本浓度(copies / mL)1 500 700 500 300 150痰液1 95 100 100 20 0 2 100 100 100 35 0 3 100 90 100 30 0 4 100 95 100 30 0 5 100 100 100 25 0鼻咽拭子6 100 100 95 15 0 7 100 100 95 20 30 8 100 100 100 30 30 9 100 100 100 30 10 10 100 100 100 20 20口咽拭子11 100 100 95 30 10 12 100 100 95 25 15 13 100 100 100 30 5 14 100 100 95 15 0 15 100 100 95 15 0 16 100 100 100 25 0 17 100 100 95 10 0 18 100 100 95 10 0 19 100 100 100 10 0 20 100 100 95 10 0样本
表3 nCoV2020004 批试剂盒确定最低检测限阳性检出率结果统计(%,±s,n = 20)Tab.3 Positive rate of samples for determination of minimum detection limit of kit of Lot nCoV2020004(%,±s,n = 20)
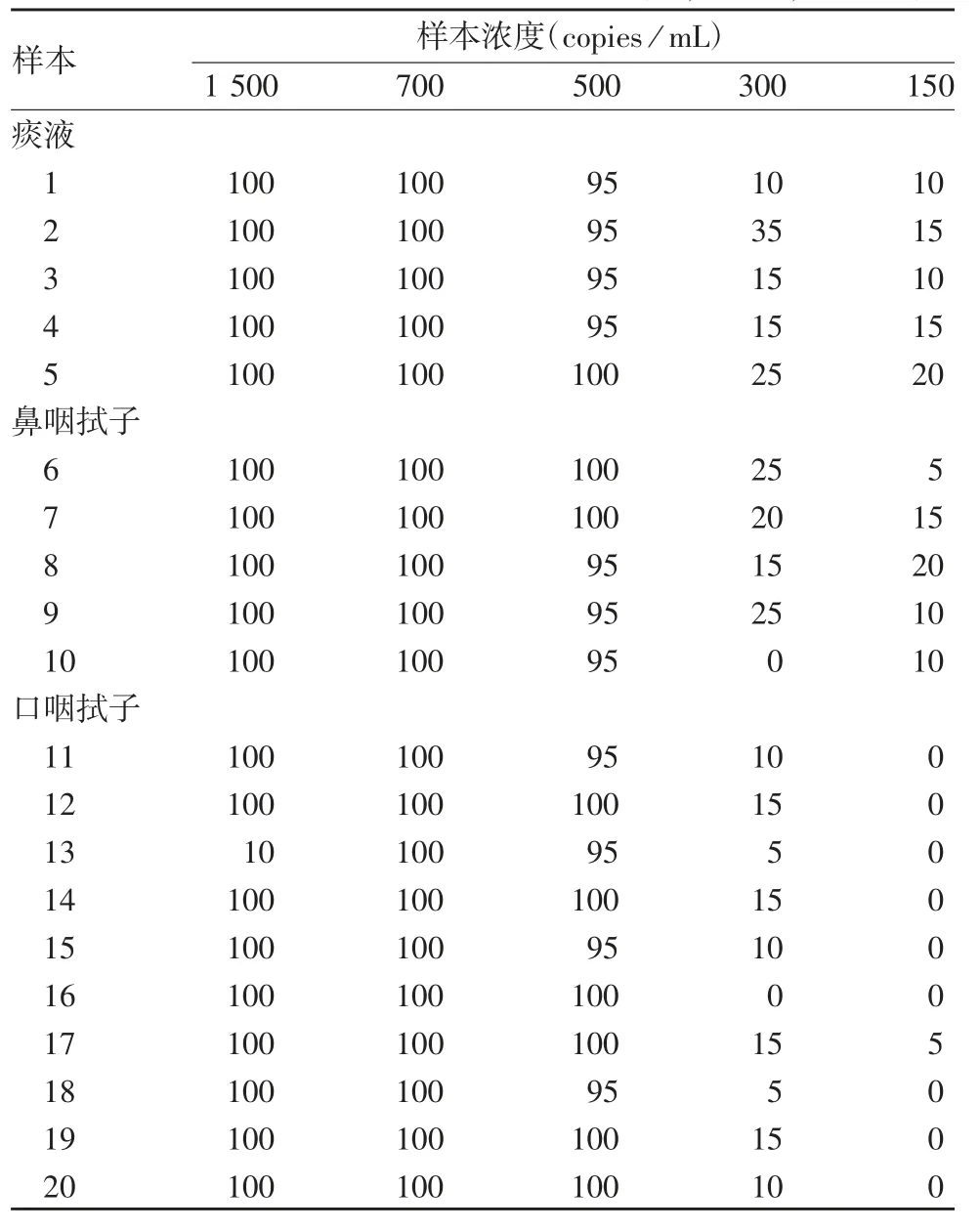
表3 nCoV2020004 批试剂盒确定最低检测限阳性检出率结果统计(%,±s,n = 20)Tab.3 Positive rate of samples for determination of minimum detection limit of kit of Lot nCoV2020004(%,±s,n = 20)
样本浓度(copies / mL)1 500 700 500 300 150痰液1 100 100 95 10 10 2 100 100 95 35 15 3 100 100 95 15 10 4 100 100 95 15 15 5 100 100 100 25 20鼻咽拭子6 100 100 100 25 5 7 100 100 100 20 15 8 100 100 95 15 20 9 100 100 95 25 10 10 100 100 95 0 10口咽拭子11 100 100 95 10 0 12 100 100 100 15 0 13 10 100 95 5 0 14 100 100 100 15 0 15 100 100 95 10 0 16 100 100 100 0 0 17 100 100 100 15 5 18 100 100 95 5 0 19 100 100 100 15 0 20 100 100 100 10 0样本
表4 nCoV2020005 批试剂盒确定最低检测限阳性检出率结果统计(%,±s,n = 20)Tab.4 Positive rate of samples for determination of minimum detection limit of kit of Lot nCoV2020005(%,±s,n = 20)
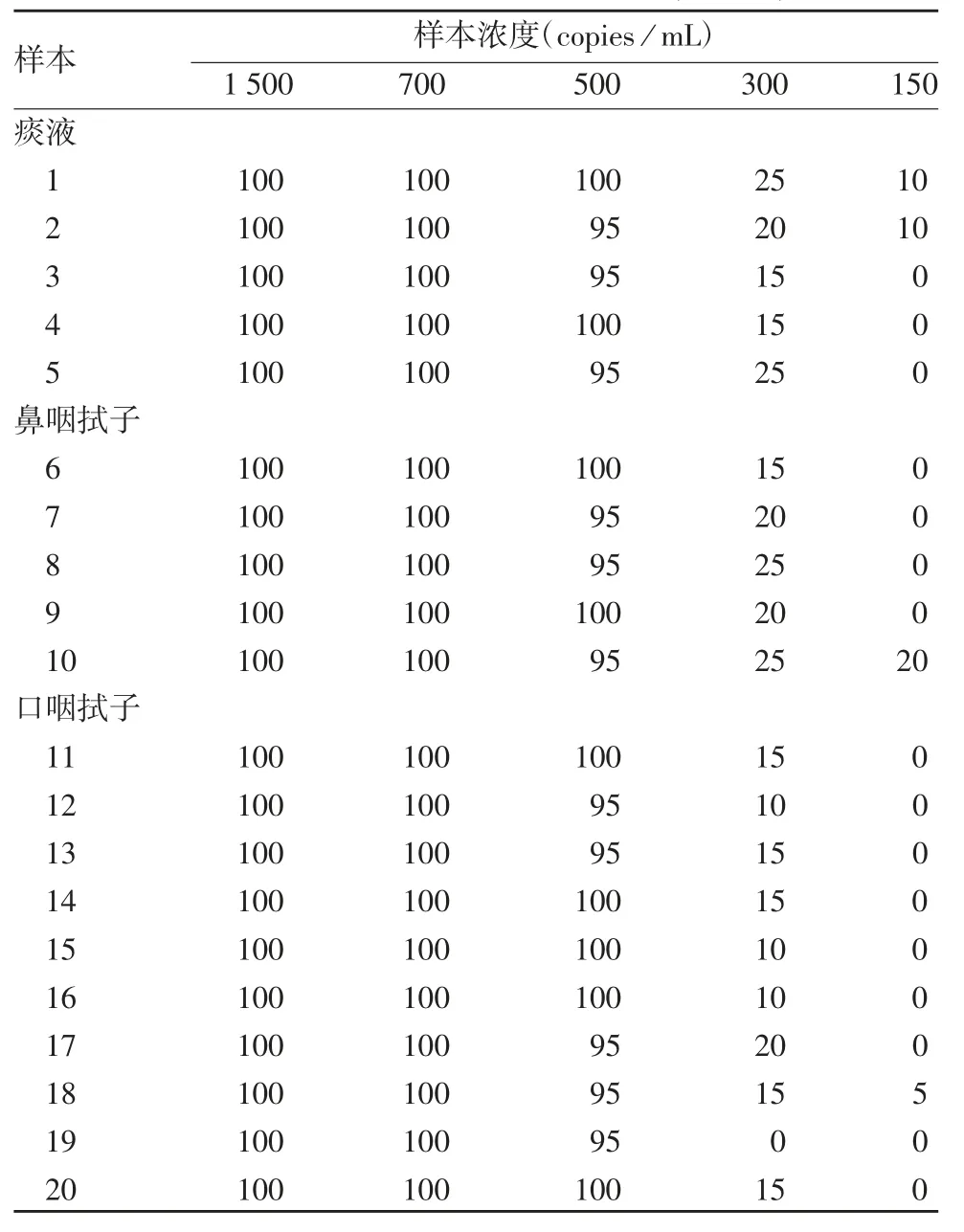
表4 nCoV2020005 批试剂盒确定最低检测限阳性检出率结果统计(%,±s,n = 20)Tab.4 Positive rate of samples for determination of minimum detection limit of kit of Lot nCoV2020005(%,±s,n = 20)
样本浓度(copies / mL)1 500 700 500 300 150痰液1 100 100 100 25 10 2 100 100 95 20 10 3 100 100 95 15 0 4 100 100 100 15 0 5 100 100 95 25 0鼻咽拭子6 100 100 100 15 0 7 100 100 95 20 0 8 100 100 95 25 0 9 100 100 100 20 0 10 100 100 95 25 20口咽拭子11 100 100 100 15 0 12 100 100 95 10 0 13 100 100 95 15 0 14 100 100 100 15 0 15 100 100 100 10 0 16 100 100 100 10 0 17 100 100 95 20 0 18 100 100 95 15 5 19 100 100 95 0 0 20 100 100 100 15 0样本
表5 最低检测限验证结果(%,±s,n = 20)Tab.5 Verification for minimum detection limit(%,±s,n=20)
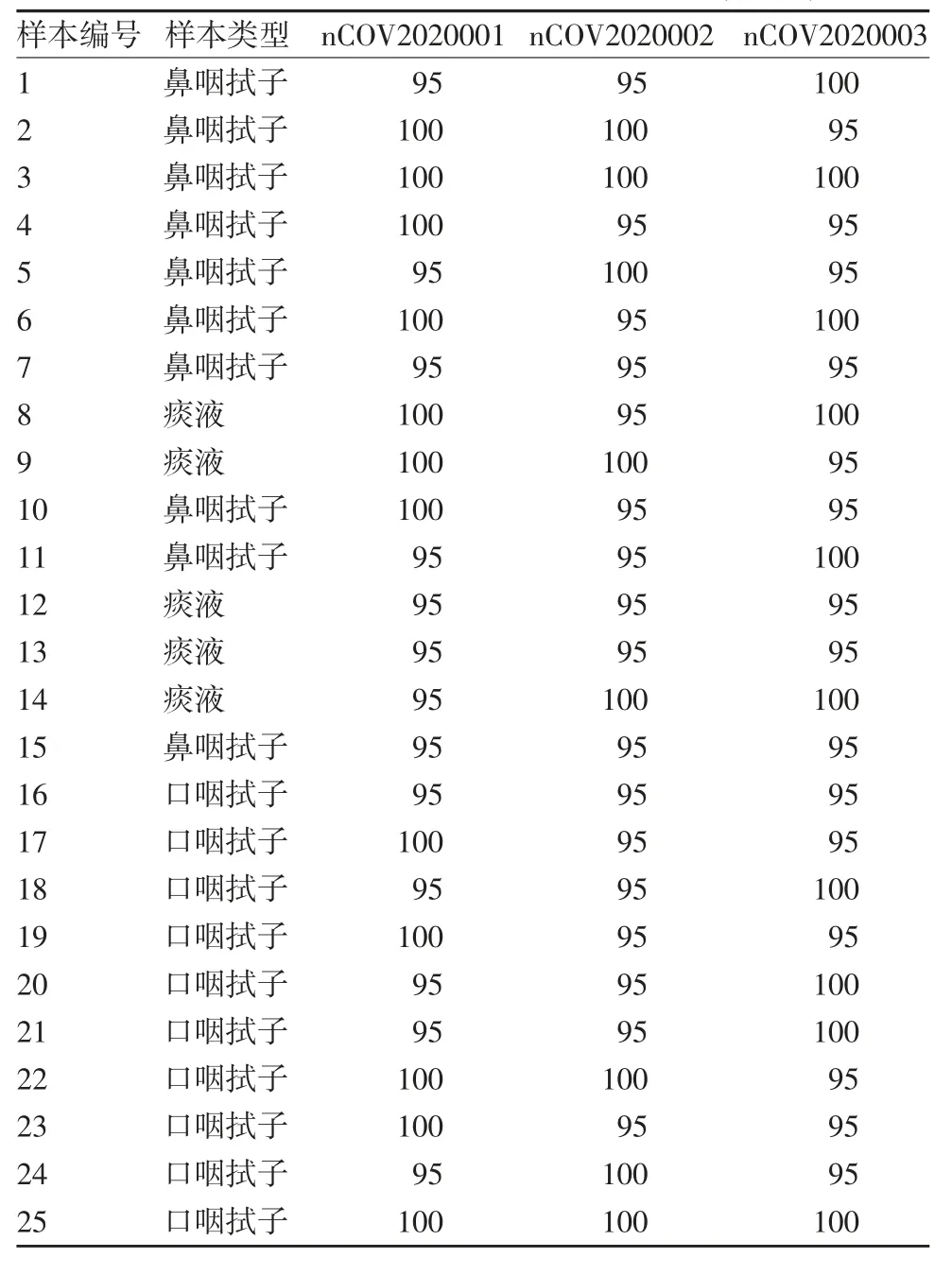
表5 最低检测限验证结果(%,±s,n = 20)Tab.5 Verification for minimum detection limit(%,±s,n=20)
样本编号 样本类型 nCOV2020001 nCOV2020002 nCOV2020003 1 鼻咽拭子 95 95 100 2 鼻咽拭子 100 100 95 3 鼻咽拭子 100 100 100 4 鼻咽拭子 100 95 95 5 鼻咽拭子 95 100 95 6 鼻咽拭子 100 95 100 7 鼻咽拭子 95 95 95 8 痰液 100 95 100 9 痰液 100 100 95 10 鼻咽拭子 100 95 95 11 鼻咽拭子 95 95 100 12 痰液 95 95 95 13 痰液 95 95 95 14 痰液 95 100 100 15 鼻咽拭子 95 95 95 16 口咽拭子 95 95 95 17 口咽拭子 100 95 95 18 口咽拭子 95 95 100 19 口咽拭子 100 95 95 20 口咽拭子 95 95 100 21 口咽拭子 95 95 100 22 口咽拭子 100 100 95 23 口咽拭子 100 95 95 24 口咽拭子 95 100 95 25 口咽拭子 100 100 100
3 讨 论
实时荧光定量PCR 具有较高的敏感性,是检测是否被2019-nCoV 感染或污染的有效手段[8-12]。目前我国批准的2019-nCoV 核酸检测试剂盒均为定性检测试剂[13]。目前尚无2019-nCoV 病毒核酸检测国际标准品,我国与WHO 对核酸试剂盒最低检测限研究方法相关要求基本一致,在试剂盒注册审评过程中,均要求采用科学的方法标定病毒滴度或病毒拷贝数,进行最低检出限相关的定量研究。虽然中国食品药品检定研究院建立了应急用国家参考品,用于评估所申报试剂的相对灵敏度,但并未对参考品进行定值。数字PCR 法可对起始核酸样本浓度进行定量,是目前核酸分子绝对定量最成熟的技术[14-15],但是昂贵的检测成本限制了其在临床上的广泛应用。本研究利用微滴式数字PCR 平台对临床核酸样本进行绝对定量用于试剂盒最低检测限的确立。准确的最低检测限的确立不仅是对方法及操作过程在低浓度水平检测能力的准确评估,对2019-nCoV 感染大规模筛查、流行病学调查及治疗效果评价均具有重要意义[16-19]。
上海捷诺生物科技有限公司研制生产的新型冠状病毒2019-nCoV 核酸检测试剂盒(荧光PCR 法),可定性检测2019-nCoV ORF1ab 和N 基因,用于2019-nCoV 疑似感染患者的鼻咽拭子、口咽拭子、痰液等多种采样途径样本病毒检测。在方法学验证过程中,本研究采用采集自不同地点、不同时间临床确诊2019-nCoV 患者的鼻咽拭子、口咽拭子及痰液样本,经数字PCR 法进行病毒核酸绝对定量,对定量核酸样本进行不同稀释度、多次重复以及应用多批次检测试剂盒进行检测,以确定其最低检测限。结果表明,在样本浓度≥500 copies / mL 时,阳性检出率均≥95%,而样本浓度 < 500 copies / mL 时,阳性检出率均<95%,按照《2019 新型冠状病毒核酸检测试剂注册技术审评要点》要求[4],将 500 copies / mL 作为试剂盒的最低检测限;经验证,在最低检测限水平上的鼻咽拭子、口咽拭子及痰液样本阳性检出率均可达95%以上,表明试剂盒适用于多种类型样本2019-nCoV核酸检测。最终确定的以500 copies / mL 作为本试剂盒最低检测限是有效的,符合我国药监部门对检测试剂盒最低检测限研究的要求。
因目前尚无可进行计量学溯源的2019-nCoV 国际标准品或国家标准品,因此无法将用于检测的样本进行精确的计量学溯源。本研究利用经数字PCR法绝对定量的特异性病毒阳性样本,作为标定试剂盒最低检测限的参考品,进行试剂盒最低检测限的确定和验证,对核酸定性检测试剂盒的检测能力进行了系统评价;期望能够对2019-nCoV 核酸检测试剂盒的临床应用及疾病诊断提供更加详细准确的参考和判定方法。

