短期高原抗阻练习对人骨骼肌的影响及基因芯片分析
王宁琦 包大鹏 龚丽景 晏冰 胡扬
1 北京体育大学(北京100084)
2 武汉体育学院健康科学学院,运动训练监控湖北省重点实验室(武汉430079)
肌肉萎缩是高原适应过程中常见的一种肌肉功能障碍。目前已知,缺氧是高原肌肉萎缩的主要诱导因素。低氧可以通过抑制蛋白合成、加强蛋白分解等方式对骨骼肌的体积产生负面的影响。早期研究发现,适当的体力活动可减缓高原暴露导致的肌肉萎缩[1,2]。近些年来有报道指出,在常压低氧环境下进行抗阻练习能提高肌肉力量和体积[3,4],但高原抗阻练习究竟通过怎样的途径对骨骼肌产生影响,尚未见相关人体实验报道。目前,基因芯片技术已经广泛应用于生物学和医学领域的研究中,利用该技术我们可以同时观测成千上万个基因的表达,将研究视角从某个靶基因,或某条靶通路延伸到全基因表达水平,从而更加全面地探索机体的生理和病理变化,为治疗和干预提供准确的靶目标。本研究采用基因芯片技术筛选高原抗阻训练前后骨骼肌差异基因,并通过生物信息学手段筛选关键调控通路,旨在探讨抗阻训练对高原肌肉萎缩的干预机理,为该训练手段在高原环境的应用提供理论基础。
1 研究方法
1.1 研究对象
12 名男性大学生分为训练组和对照组,每组各6人。受试者身体健康,无呼吸系统疾病及任何心肺功能疾病史,均为北方汉族平原居民,并在6个月内未到过高原或模拟高原环境中。受试者有抗阻练习经历,但在实验期间没有参与其他规律性抗阻练习。实验前受试者被详细告知实验流程并签署知情同意书。受试者基本情况见表1。

表1 受试者基本情况(x ± s)
1.2 实验设计
受试者暴露于海拔3700 米高原(拉萨)10 天。对照组每日进行基本的日常活动,而训练组除此之外隔天进行抗阻练习。两组的饮食和日常生活与平原保持一致。抗阻练习方案按照ACSM’S Guidelines for Exer⁃cise Testing and Prescription制定[5]。主要采用负重深蹲练习(75% 1RM)。辅助训练采用负重屈小腿练习和负重拉杠铃锻炼股后肌群。每种练习进行5 组,每组重复10 次,组间间歇1 分钟。整个训练在教练指导下完成。
1.3 测试指标与方法
1.3.1 形态学指标测试
两组受试者在高原暴露前后的常氧环境中进行测试。采用双能X 线法测试体成分、大腿脂肪、瘦体重(双能骨密度测试仪NOLAND)。采用Philips Achieva 3T 核磁共振成像系统(Philips Medical System)的SE(TR 500 ms,TE 20 ms )序列扫描,连续扫描24 张片,层厚5 mm;矩阵560 × 560。以股骨大转子为标志点向下20cm,选取大腿中部的一层进行分析。使用Matlab 图像处理软件(北京大学研发)对选取的图片进行分割,计算大腿肌肉横截面积(cross sectional area,CSA)。
1.3.2 取材
采用肌肉活检技术,分别在高原暴露前后常氧环境下提取两组受试者的股外侧肌中部肌肉。高原暴露前一周禁止剧烈运动,高原暴露后返回平原即刻进行取材。具体步骤:碘酊擦拭活检区域,然后用酒精擦拭活检区域周边;用铺巾盖住非手术区,暴露手术切口。注射利多卡因进行局部麻醉,待产生局麻效果后在手术区开1 cm小口,调试好活检针插入伤口进行肌肉采集。将采集到的肌肉迅速放入生理盐水中清洗,一部分放入RNA later 保存液而后置于4℃冰箱过夜后转置于-20℃冰箱保存,用于芯片测试;另一部分放入冻存管后投入液氮,而后置于-80℃冰箱保存,用于RTqPCR检测。
1.3.3 芯片分析
采用Agilent 全基因组表达谱芯片(SurePrint G3 Human Gene Expression)筛查高原暴露前后骨骼肌差异基因。由北京博奥晶典生物技术有限公司提供芯片杂交相关设备和技术支持。采用GeneSpring 软件进行数据归一化和差异表达分析筛出差异表达mRNA(Ab⁃solute Fold change≥1.5)。基于Gene ontology 数据库进行基因功能(Gene ontology,GO)注释,得到差异基因参与的所有生物学过程;基于KEGG数据库,对差异基因进行Pathway注释。
1.3.4 检验芯片
从差异基因所富集的显著性通路中筛选差异基因进行荧光实时定量PCR(RT-qPCR)验证。使用Prim⁃er5 软件进行引物设计,使用NCBI-Blast 进行引物检验,引物由生工生物(上海)股份有限公司合成。目的基因和内参基因(RPS18)引物见表2。
配置RT-qPCR体系(见表3)。使用两步法反应程序进行RT-qPCR反应(见表4)。

表2 RT-qPCR引物列表

表3 RT-qPCR体系

表4 RT-qPCR反应条件
1.3.5 所用数据库及分析平台
数 据 库:(1)GenBank: http://www.nvbi.nlm.nih.gov ;(2)Gene Ontology annotaition: http://www.geneon⁃tology.org;(3)KEGG: http://www.genome,jp/kegg/;(4)BLAST: http://www.ncbi.nlm.nih.gov
分析平台: (1)KOBAS(KEGG Orthology Based Annotation System);(2)DAVID Bioinformatics Re⁃sources: https://david.ncifcrf.gov/
1.4 数据统计方法
形态学各项指标的数据以平均值±标准差(x±s)表示,每组自身前后变化采用配对样本t检验。差异基因筛选采用独立样本t检验方法计算P值,采用Ben⁃jamini Hochberg FDR 方法对P值进行校正。RT-qP⁃CR数据分析采用△△Ct 值法。计算目标基因表达相较于相应对照组基因的改变倍数。使用独立样本t检验分析训练组的芯片中差异基因mRNA变化值与RTqPCR 检验的差异基因mRNA 变化值是否具有显著性差异,用于判断芯片的有效性。P<0.05 为差异具有统计学意义。
2 研究结果
2.1 实验前后体重、瘦体重以及CSA的变化
实验前后两组体重均无显著性变化。与实验前相比,对照组全身和腿部瘦体重分别显著下降1.86%和2.06%(P<0.05),训练组全身和腿部瘦体重均无明显变化。对照组CSA 显著降低了3.3%(P<0.05),训练组仅下降了2.46%,但未达到显著性。见表5、表6。
2.2 实验前后全身脂肪和下肢脂肪的变化
实验前后,两组的全身和下肢脂肪量无显著性改变,见表7。
2.3 差异表达基因分析
通过1.5倍的差异基因筛选(P<0.05),训练组差异基因共计432 个,其中上调192 个,下调240 个。对照组差异基因454个,其中上调199个,下调255个,聚类分析见图1。
2.4 差异基因显著性功能筛选和分析
GO注释包括生物过程、细胞组成和分子功能三个部分。受高原缺氧环境的影响,对照组差异基因主要涉及的生物学过程有(P<0.01,FDR<0.01):细胞周期、细胞生长、细胞增殖、激素反应、酶活性、氧化应激、蛋白质分解等。主要涉及的细胞组成包括纺锤体、无膜细胞器、细胞骨架、微管、收缩成分、肌原纤维等。分子功能主要涉及泛素蛋白酶活性、酶结合、泛素硫酯酶活性、蛋白激酶活性、胰岛素受体结合和肌肉结构成分等。

图1 两组高原暴露前后差异基因聚类分析

表5 实验前后体重和CSA的变化

表6 实验前后瘦体重的变化

表7 实验前后脂肪的变化
受高原缺氧和抗阻练习的双重影响,训练组差异基因主要涉及的生物过程有(P<0.01,FDR<0.01):细胞周期、激素反应、肌肉生长、氧化应激以及蛋白代谢等过程。主要涉及的细胞组成包括纺锤体、受体复合体、细胞骨架、微管和无膜细胞器等。分子功能主要涉及酶结合、蛋白激酶结合、蛋白激酶活性和泛素硫酯酶活性等。
2.5 差异基因涉及的信号通路分析
结果显示,对照组和训练组分别有4 条和10 条调控通路具有统计学意义(P<0.05,校正P<0.05),见表8、表9。在训练组中,与调控肌肉体积相关的通路有FOXO 信号通路(FOXO signaling pathway,hsa04068)、胰岛素通路(Insulin signaling pathway,hsa04910)和ErbB 信号通路(ErbB signaling pathway,hsa04012)(见图2、图3、图4)。此外,大多数通路与癌症相关,如结肠癌(Colorectal cancer,hsa05210)、膀胱癌(Bladder cancer,hsa05219)等。

表8 对照组信号通路分析结果

表9 训练组信号通路分析结果

(续表9)

图2 FOXO信号通路
2.6 差异基因RT-PCR结果及训练组芯片验证结果
按照公式△ct=cttargct-ctreference计算△ct。结果显示,训练组的MYC(v-myc avian myelocytomatosis viral oncogene homolog)、CUL5(cullin 5)、STAT1(signal transducer and activator of transcription 1)、Jak3(Ja⁃nus kinase 3)、UBE4A(ubiquitination factor E4A)、ErbB3以及IGF-1(insulin like growth factor 1)基因在高原抗阻训练后出现显著变化(P<0.05),见表10。芯片验证结果显示,基因芯片和RT-qPCR分析结果较为一致,说明芯片检测结果准确,见图5。

图3 胰岛素信号通路

图4 ErbB信号通路

表10 差异表达基因RT-qPCR结果
3 分析讨论
3.1 短期高原抗阻练习对体重、体成分以及骨骼肌形态学指标的影响
早期研究表明,长期高原暴露能引发较为明显的肌肉量丢失,并且伴随肌肉力量的下降[6-8]。但也有研究认为,全身蛋白合成速率在高原暴露初期已开始下降,同时蛋白分解速率持续增加[9]。近些年来有研究发现[10],7~9 天的高原暴露(4559 米)可导致蛋白分解增加并影响肌肉的蛋白调控过程。该研究认为低氧诱导mTOR(mechanistic target of rapamycin kinase)表达下降并抑制蛋白合成通路,导致肌肉量丢失。本研究发现,10天高原(海拔3700米)暴露可引起对照组体重和全身瘦体重的显著性下降,并且下肢瘦体重的丢失更为明显,同时伴有大腿肌肉横截面积的减小。这与Holm 等[11]的研究结果相一致,他认为短期高原暴露即可导致全身性的蛋白分解。然而本研究中的训练组在高原暴露前后未出现明显的肌肉丢失。研究发现,高原停留期间从事适当的体力活动(比如自行车,足球,篮球,攀岩等)可以维持肌肉体积[2]。Imoberdorf 等[1]等近一步证实了在高原上运动对蛋白合成的有利作用。运动对蛋白合成的刺激效应与肌肉收缩引发的促合成激素增加以及蛋白合成通路信号增强有关。抗阻练习作为一项辅助性治疗手段已广泛应用于多种肌肉萎缩的治疗[12,13],它对肌肉的机械性刺激较强,能有效促进骨骼肌肥大并提高肌肉力量。本研究为了控制日常体力活动和饮食对本实验的影响,对两组在高原暴露期间的饮食和出行进行了统一安排。因此,本研究推测,高原暴露前后,训练组的肌肉量及形态学指标未出现显著性变化,可能是由于抗阻训练激活了骨骼肌中蛋白质合成通路,从而削弱了缺氧对蛋白合成的抑制作用及促蛋白分解作用。这提示,高原暴露早期进行抗阻练习可在一定程度上减缓肌肉的丢失。
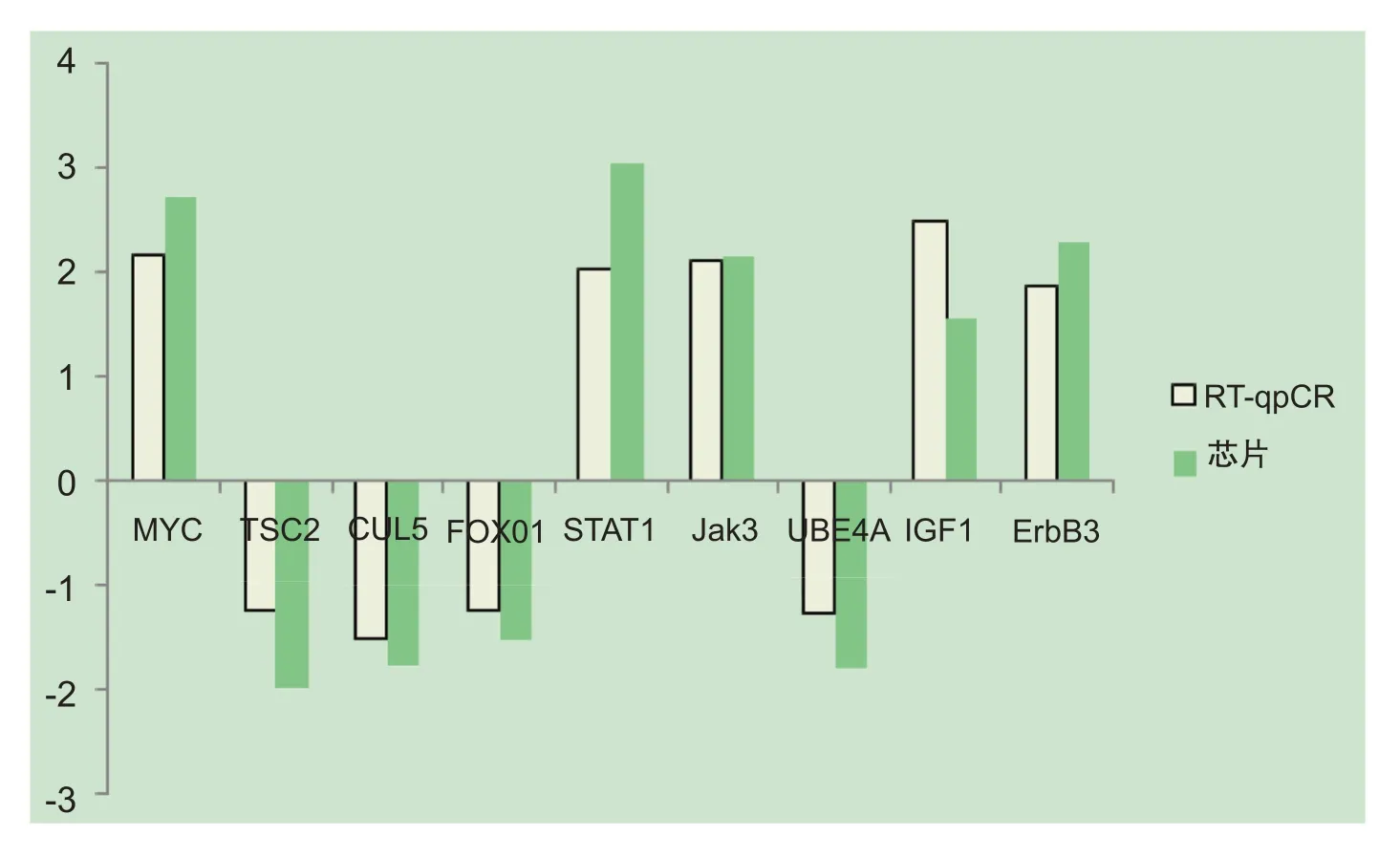
图5 芯片验证结果(以训练组训练后芯片结果为代表)
3.2 高原抗阻练习对骨骼肌基因表达的GO分析
为了进一步探究高原抗阻练习对骨骼肌作用的机理,本研究利用mRNA芯片扫描筛选差异基因,并采用GO 分析对差异基因的功能以及参与的生物学过程进行注解,结果显示,对照组和训练组的差异基因均参与了细胞周期、激素反应、细胞生长、氧化应激、磷酸化、泛素依赖性蛋白分解以及细胞内生物合成等相关过程。这说明高原缺氧对细胞的影响是广泛的,不仅抑制细胞生长,还能促使机体氧化应激升高,从而引发多种有害的细胞效应[14]。此外,高原缺氧对机体的代谢过程也会产生很大影响,低氧对肌肉蛋白代谢的影响尤为明显[15],本研究结果与此较为一致。本研究结果显示,对照组差异基因所富集的多个生物过程与蛋白分解相关,如GO:0030163 protein catabolic process、
GO:0051603 proteolysis involved in cellular protein catabolic process、GO:0044257 cellular protein catabol⁃ic process,说明高原暴露初期低氧诱导骨骼肌蛋白分解代谢加强可能是引发肌肉量丢失的主要原因。与对照组不同,在训练组的GO 分析结果主要涉及蛋白修饰、信号转导、胰岛素受体、大分子生物合成以及细胞运动等生物过程。可以推测,高原抗阻练习可能抑制了某些与分解代谢相关的基因,因而可能在一定程度上缓解了低氧诱导的肌肉丢失。
3.3 高原抗阻练习对骨骼肌基因表达的信号通路分析
信号通路分析是通过Pathway 的主要公共数据库KEGG 对差异基因进行分类。本研究将针对训练组差异基因富集的与骨骼肌蛋白调控相关的主要信号通路进行分析。
3.3.1 高原抗阻练习对FOXO信号通路的影响
FOXO 是O 型叉头转录因子家族,主要包括FOXO1、FOXO3、FOXO4 和FOXO6 等4 个转录因子[16]。FOXO家族主要参与多种重要的生物过程,如细胞周期停滞、DNA修复以及细胞凋亡[17]。其中FOXO1、FOXO3的表达与肌肉萎缩相关[18,19]。在FOXO 信号通路中,FOXO位于整个调控网络的核心位置。本研究发现,高原暴露后对照组FOXO1基因有上调趋势,而该基因在训练组呈下调趋势。FOXO1转录因子是胰岛素通路下游Akt 蛋白的作用靶点,在促肌肉萎缩中起重要作用。动物实验和细胞培养实验均已证实FOXO1 的表达增加能降低骨骼肌细胞体积,因为它可以使诱导蛋白分解的相关基因MAFbx/atrogin-1(F-box protein 32)上调[20,21]。有研究发现,长期离心运动可使小鼠肌肉中FOXO1 的mRNA 表达显著性下降,急性离心运动则上调该基因表达[22],认为氧化应激对FOXO1 的表达有重要作用。当机体在低氧环境下暴露时会增加氧化应激效应,促使FOXO1表达增加。训练组FOXO1基因表达下调可能与10天的抗阻练习有关,该训练模式可能有利于机体对低氧的适应,从而降低低氧引发的氧化应激效应。
本研究结果表明,高原抗阻练习可以通过下调FOXO通路中的核心转录因子FOXO1基因的表达减缓骨骼肌内的蛋白分解过程,从而对高原暴露诱导的骨骼肌萎缩有抵抗作用。
3.3.2 高原抗阻练习对胰岛素信号通路的影响
胰岛素通路涉及多条分支,其中包括了葡萄糖转运通路以及蛋白合成通路。低氧刺激对蛋白合成的负面影响已被大量报道证实[10],低氧能够从多个环节对蛋白合成通路产生抑制作用。一方面,在ATP 耗竭之后,低氧可以直接通过激活AMPK/PRKAA1(protein ki⁃nase AMP-activated catalytic subunit alpha 1)抑制mTOR 而不依赖于HIF-1α(hypoxia inducible factor 1 subunit alpha)[23];另一方面,低氧也可通过TSC1/TSC2(TSC complex subunit 1/2)抑制mTOR[24]。本研究结果显示,在胰岛素通路中,INSR(insulin receptor)、IRS(in⁃sulin receptor substrate)、PI3K(phosphoinositide 3-ki⁃nase)以及Akt基因均下调。IRS是IGF-1受体底物,此基因是蛋白合成通路上游的重要基因,其下调可导致细胞对IGF-1 的敏感性下降,直接影响蛋白合成过程。PI3K 和Akt 基因是PI3K/Akt/mTOR 通路的重要成员,其表达下调可能对于蛋白合成有不利影响。不过,在芯片结果中发现IGF-1 基因上调,同时经RT-qPCR验证也发现其显著性升高。因而可以推断,高原抗阻练习仍然可以有效增加IGF-1 的表达,但由于胰岛素受体受低氧的影响,IGF-1的增加不能有效与受体进行结合,因此不能增强蛋白合成通路。而本研究中,10天高原抗阻练习不能对蛋白合成通路中的基因起上调作用可能与低氧对该通路的抑制作用有关。有报道指出,低氧对小鼠负重训练后促肌肉肥大效应的影响是短暂的,只发生在低氧暴露的前12 天。之后,负重训练的促蛋白合成效应将逐渐恢复而不受低氧的影响[25]。本研究的高原暴露时间仅为10 天,也即高原适应的初期,机体对低氧的反应较为强烈,因而可能会对抗阻练习后的促蛋白合成效应产生一定影响。另外,本研究的训练强度是根据常氧环境下促肌肉肥大的训练负荷制定的,受低氧的影响,该负荷可能不足以激活蛋白合成通路的基因,因而提示,今后可以尝试通过增加训练强度来增加其对肌肉的刺激程度,从而更深入地探索高原抗阻练习对蛋白合成通路的影响。
3.3.3 高原抗阻练习对ErbB信号通路的影响
NRG(neuregulin)/ErbB 通路在调节骨骼肌代谢中起重要作用[26]。神经调节蛋白NRG通过激活Ⅰ型受体酪氨酸激酶(RTKs)亚家族的三个受体ErbB2、ErbB3和ErbB4 发挥其调控作用[27]。在骨骼肌中,NRG作为调控神经肌肉接头分化和生长的调节基因已被广泛研究。其中,神经性和肌源性NRG 家族成员对肌管形成、肌肉的生长和分化有重要作用[28,29]。有研究发现,通过电刺激模式的抗阻训练可激活NRG/ErbB通路,因而认为运动可通过NRG/ErbB 通路对骨骼肌代谢和增殖产生影响[30]。在本研究差异基因所富集的通路中也发现了ErbB通路,从该通路的调控图中可以看出NRG/ErbB 中的NRG 和ErbB3 基因显著性升高,而ErbB2 基因显著性下调。不过,ErbB2 的下游靶分子SHC3(SHC adaptor protein 3)的基因表达升高,因而本研究认为,在高原环境下进行抗阻训练同样可以激活NRG/ErbB通路。有研究在去除神经的肌肉中发现,NRG以及ErbB3 表达增加伴随葡萄糖转运载体的增强,认为NRG/ErbB 有利于提高肌肉对葡萄糖的摄取。因此推测,高原抗阻练习可以通过NRG/ErbB通路影响骨骼肌的代谢过程,但其对肌肉质量的调控还有待于进一步研究。
此外,本研究还发现,在ErbB 通路中,MAPK1/ERK2(mitogen-activated protein kinase 1)下游的靶基因MYC的表达也显著性升高。有研究证明,ERK1/2通路可以通过调控核糖体RNA 的基因表达促进蛋白质的合成[31],同时也受到IGF-1 的影响,对调控肌肉肥大效应有重要作用[32]。因而,MAPK1 的上调有利于促进肌肉的蛋白合成作用。MYC 是一种编码丝氨酸/苏氨酸的磷酸化蛋白质的原癌基因,不仅参与早期胚胎发生、细胞生长和分化过程,而且MYC 在细胞体积的调控中也发挥着重要作用[33,34]。研究发现,负重训练后骨骼肌中MYC 蛋白表达增加对于卫星细胞的增殖以及肌细胞的肥大性生长有重要作用[35]。抗阻练习所诱导的肌肉肥大常伴随较强的蛋白合成作用,满足这一过程不仅需要激活核糖体复合物,同时还要有较高的蛋白翻译水平,而提高蛋白翻译水平需要增强核糖体RNA 的合成。MYC 能诱导多种核糖体蛋白转录水平的增加并提高蛋白合成作用。有研究发现,抗阻练习24小时后MYC的表达增加伴有核糖体RNA的增多,该研究认为,核糖体合成增强是影响运动后肌肉肥大的重要因素之一[36]。有研究显示,小鼠在进行急性抗阻练习6 小时后MYC mRNA 水平显著升高,并认为MYC mRNA 表达增加是肌肉肥大的早期反应[37]。因而,本研究推测,高原抗阻练习后MYC mRNA 表达增加可能对于维持肌肉质量有重要作用。
4 总结
高原抗阻练习对骨骼肌基因转录水平的影响是复杂的,涉及FOXO、ErbB以及胰岛素等多条信号通路中相关基因的变化。一方面,低氧影响了抗阻练习对mTOR和MEK1/2/ERK等通路的激活作用,另一方面抗阻练习能削弱低氧对蛋白分解通路及相关基因如TSC2 和FOXO1 等的影响。本研究认为,高原暴露初期,虽然抗阻练习的促蛋白合成效应会受到低氧的影响,但仍然可以削弱低氧对肌肉蛋白的分解代谢作用,从而维持肌肉质量。不过,本研究仅从mRNA 转录水平上对该通路的差异基因进行分析,今后还应从蛋白水平上对以上所筛选出的通路进行深入研究。

